3D超声和计算机断层摄影结合用于引导介入医疗规程的制作方法
本发明整体涉及在医疗规程中跟踪或递送医疗器械,且具体地涉及跟踪和递送医疗器械以适应在医疗规程期间造成的患者解剖结构的变形的系统和方法。
背景技术:
图像引导手术是一种正在发展的技术,其允许外科医生在由图像引导的同时以微创方式执行介入或手术,所述图像可以是“真实”图像或虚拟图像。例如,在腹腔镜手术中,通过在患者皮肤中形成的小切口插入小型摄像机。该摄像机为操作员提供了解剖结构的“真实”图像。其他类型的图像引导手术(诸如血管内手术),其中利用通过导管插入的,导航到患者动脉中的设备来治疗病变,是“图像引导的”,因为使用低剂量x射线图像(也称为“荧光透视图像”)来引导导管和设备穿过患者解剖结构。荧光透视图像是“真实”图像,而不是虚拟图像,因为它是使用真实x射线获得的并显示了患者的真实解剖结构。然后,还存在使用了“虚拟”图像的情况,这是用于以已知方式形成解剖结构的虚拟图像的真实图像的组合。使用“真实”图像和“虚拟”图像两者进行的图像引导手术的一个示例是微创脊柱手术,其中使用在该手术期间获取的“真实”荧光透视图像来引导设备插入椎骨中,同时还使用术前ct或锥束ct(cbct)图像结合手术导航系统来使设备在患者的3d解剖结构中的位置可视化。由于设备在ct或cbct图像中的位置的显示并不是在手术期间执行直接图像采集的结果,因为手术室中无ct,而是由预先存在的真实图像和由手术导航系统提供的信息的组合引起的,因此将ct或cbct图像中的设备位置的显示描述为“虚拟”图像。
无论在其形成中利用了哪些特定图像,图像引导手术都允许外科医生减小进入患者体内的入口或切口的尺寸,这可以使患者的疼痛和创伤最小化并导致住院时间更短。图像引导规程的示例包括腹腔镜手术、胸腔镜手术、内窥镜手术等。医学成像系统的类型(例如,放射成像系统、计算机断层摄影(ct)、磁共振成像(mri)、正电子发射断层摄影(pet)、超声(us)、x射线血管造影机等)可用于为医疗规程提供静态图像引导辅助。上述成像系统可以提供二维或三维图像,该二维或三维图像可以被显示以向外科医生或临床医生提供说明性地图以引导工具(例如,导管)穿过患者身体的感兴趣区域。
在临床实践中,与传统的开放式手术规程相比,微创经皮心脏和血管介入正变得越来越普遍。此类微创经皮心脏和血管介入具有患者恢复时间短以及使规程更快且风险更低的优点。在此类微创心脏和血管介入中,将诸如支架或支架移植物的设备经由导管通过血管递送到患者体内。导管在患者的血管内的导航是具有挑战性的。为了辅助导航,通常使用x射线荧光透视来使导管在该规程期间可视化。然而,该成像模态不能很好地捕获患者的软组织结构。
具体地,在一种示例性类型的心脏和血管介入规程(即,血管内动脉瘤修复(evar)规程)期间,操作员在荧光透视引导下在主动脉中插入和部署内移植物。为了完成这项任务,操作员显然需要看到这些设备,这很容易使用荧光透视来实现,但他/她还需要了解设备相对血管解剖结构的位置,这更具挑战性。
由于在荧光透视下动脉不是自发可见的,因此必须获取注射造影剂后拍摄的x射线序列来使动脉可视化。然而,造影剂的使用具有多个显著缺点。首先,造影剂需要很长时间才能变得有效,而在患者体内具有有限的有效时间,然后才能要求额外的造影剂。其次,造影剂量较大时(诸如多个x射线序列所需)可能会给患者带来某些不利影响,包括由于造影剂注射的量而造成患者肾病潜在发展。第三,由于采取了多个x射线序列,x射线序列的数量增加必然导致对患者和工作人员的总x射线暴露增加。
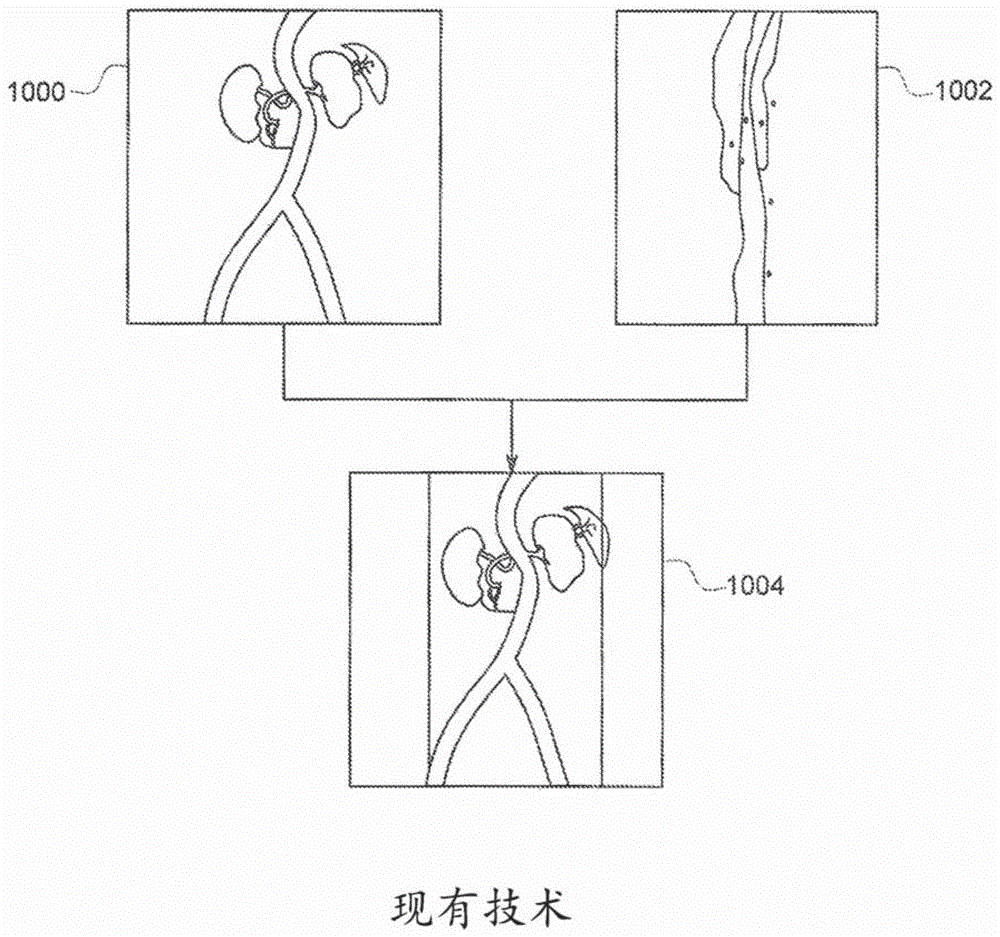
最近已经提出了基于术前3d计算机断层摄影血管造影术(cta)图像(其显示了介入工具将导航穿过其中的患者解剖结构)与荧光透视图像的融合的解决方案,以改进evar指导。在该规程中,如图1所示,获得术前cta图像1000,随后诸如通过将荧光图像叠加到cta图像上或反之亦然来将其与术中荧光或x射线图像1002对准或融合以示出融合图像1004,该融合图像示出了患者解剖结构以及介入工具(例如,导丝或导管)在解剖结构内的当前位置。这些融合图像解决方案可以更清楚地示出介入工具在患者解剖结构内的位置,并且已经显示为有助于使造影剂的注射量和对患者的x射线暴露两者都减少。
然而,用于介入规程(诸如evar规程)的融合图像解决方案的一个显著缺点是介入设备本身在介入规程期间的插入会使主动脉的解剖结构变形,具体地使主动脉变直,从而使内脏动脉口的位置相对于术前cta图像中所示的解剖结构移动。因此,在插入介入设备之后,由术前cta图像描绘的解剖结构不再与当前患者解剖结构匹配,并且不能提供精确路线图来将设备导航通过解剖结构。
为了解决这种解剖结构变形问题,操作员必须在插入设备后获取基于x射线的2d数字减影血管造影(dsa)系列,并使用该dsa系列手动校正主动脉的变形。由于以下两个原因,这种用于变形校正的解决方案是次优的。首先,它向患者注射造影剂,这与3d路线图/融合图像的目标之一直接矛盾,该目标是减少需要注射到患者体内的造影剂的量。其次,dsa校正提供的最终对准准确度可能仍然有限。由于解剖结构的变形以3d发生,因此从一个角度中获取的仅一个2ddsa不可能找到能够充分反映所有内脏动脉口的变形的校正。
一个附加解决方案是将ct图像与超声图像相结合用于识别患者解剖结构的图像中的基准和解剖界标的定位的变化。例如,在现有技术的组合式ct/超声成像方法中(诸如在kaspersen等人的three-dimensionalultrasound-basednavigationcombinedwithpreoperativectduringabdominalinterventions:afeasibilitystudy,cardiovascinterventradiol(2003)26:347-356(基于三维超声的导航结合术前ct在腹部介入治疗中的可行性研究,《心血管与介入放射学》,2003年,第26期,第347-356页)中所公开),将单独的术前ct图像与术中超声图像进行比较以比较基准和/或解剖界标的位置,以便通过并排地示出图像或通过将图像彼此叠加来确定ct图像中和超声图像中所示的解剖结构之间的差异。然后,医生利用这些差异来解释患者解剖结构的当前配置,以便执行介入规程。
然而,虽然该图像组合为医生提供了解释所显示的解剖结构中的差异的能力,但完全根据医生的经验和判断力来利用所显示的信息来在相应的ct图像和超声图像中的每一者中识别所显示的患者解剖结构中的任何变形的位置和范围。当在介入规程期间通过直接比较ct图像和超声图像来完成这一点时,这需要医生对可能不完整的信息做出决定并通过把注意力从正在执行的规程转移出来来做到这一点,这两者都是不期望的。
因此,期望开发成像系统和方法,其可以改进现有的用于校正介入规程(诸如evar规程)中的解剖结构变形的系统和方法。
技术实现要素:
在以下描述中通过本文描述的实施方案解决了上述缺点和需求。
根据本发明的示例性实施方案的一个方面,利用成像系统来获得患者解剖结构(例如,evar规程中的主动脉)的融合图像,以便提供导航路线图以将介入工具(例如,导丝或导管)插入解剖结构中。用于创建融合图像的技术以已知的方式且实时地融合放射图像(诸如在介入规程期间拍摄的荧光透视图像与术前cta图像),使得操作员可以在荧光透视图像中看到主动脉和内脏血管而无需注射造影剂。为了校正由在evar规程期间使用的血管内设备引起的血管解剖结构相对于术前cta图像的变形,在插入设备之后在evar规程期间另外获取主动脉的3d超声图像。可以利用位于患者体外的标准超声传感器或者利用直接插入主动脉内并称为“血管内超声”(ivus)的超声传感器来获取3d超声图像。然后利用3d超声图像来校正术前cta图像并提供患者的当前血管解剖结构。然后将该校正的cta图像与在该规程期间拍摄的术中荧光图像相结合或融合,以提供与主动脉的变形的解剖结构更好地匹配的精确的3d路线图图像,以用于正确地执行该规程。
根据本发明的一个示例性实施方案的又一方面,用于利用在介入医疗规程期间获得的患者解剖结构的术中图像来更新患者解剖结构的术前图像的方法包括以下步骤:利用第一成像系统模态获得患者解剖结构的术前第一图像体积;利用第二成像系统模态获得患者解剖结构的术中第二图像体积;在第一图像体积和第二图像体积中的每一者中标识多个界标;以及根据第一图像体积和第二图像体积之间的多个界标的位置差异修改第一图像体积,以形成更新的图像体积。
根据本发明的一个示例性实施方案的又一方面,用于更新术前cta图像以适应术中规程中的患者解剖结构变形以提供术中3d路线图的方法包括以下步骤:获得患者解剖结构的术前3dcta图像体积;获得患者解剖结构的术中3d超声图像体积;在3dcta体积和3d超声图像体积中每一者中标识多个界标;以及根据3dcta体积与3d超声图像体积之间的多个界标的位置差异来修改3dcta体积以形成更新的3dcta图像体积。
根据本发明的一个示例性实施方案的又一方面,用于针对介入医疗规程获得第一成像模态中的术前第一图像体积以及第二模态中的术中第二图像体积以便更新第一图像体积的成像系统包括:第一成像系统,该第一成像系统用于获得术前第一图像体积;第二成像系统,该第二成像系统用于获得术中第二图像体积;图像处理模块,该图像处理模块可操作地连接到第一成像系统和第二成像系统,该图像处理模块被配置为处理来自第一成像系统和第二成像系统的图像数据以更新第一图像体积并形成更新的图像体积;操作员界面,该操作员界面连接到图像处理模块;以及显示器,该显示器可操作地连接到图像处理模块,以显示第一图像体积、第二图像体积和更新的图像体积中的至少一者。
应当理解,提供上面的简要描述来以简化的形式介绍在具体实施方式中进一步描述的精选概念。这并不意味着识别所要求保护的主题的关键或必要特征,该主题范围由具体实施方式后的权利要求唯一地限定。此外,所要求保护的主题不限于解决上文或本公开的任何部分中提到的任何缺点的实施方式。
附图说明
附图示出目前设想的执行本公开的最佳模式。在附图中:
图1是现有技术的融合成像过程的图解表示。
图2是根据本发明的一个示例性实施方案的组合式成像系统的示意图。
图3是根据本发明的一个示例性实施方案的融合成像方法的图解表示。
具体实施方式
在以下详细描述中,参考形成其一部分的附图,并且其中通过图示的方式示出了可实践的具体实施方案。足够详细地描述了这些实施方案以使得本领域技术人员能够实践实施方案,并且应当理解,可以利用其他实施方案,并且可以在不脱离实施方案的范围的情况下进行逻辑、机械、电气和其他改变。因此,以下详细描述不应被视为具有限制意义。
以下描述呈现了用于在介入规程和/或外科规程期间对患者解剖结构实时成像的系统和方法的实施方案。具体地,某些实施方案描述了用于更新图像的成像过程的系统和方法,所述图像示出了在微创介入规程期间的患者解剖结构。例如,介入规程可以包括血管成形术、支架置入、血栓移除、局部溶栓药物给药、灌注研究、球囊隔膜造口术、经导管主动脉瓣植入术(tavi)、evar、肿瘤栓塞和/或电生理学研究。
可以注意到,在本发明的描述中,术语“动态过程”和“瞬态现象”可互换使用,以指代其中要成像的受试者的至少一部分表现出随时间推移的运动或其他动态过程的过程和事件,诸如介入设备移动穿过血管结构。作为示例,动态过程可包括通过通道的流体流动、设备振动、造影介质的吸收和冲洗、心脏运动、呼吸运动、蠕动和/或组织灌注参数变化,包括局部血容量、局部平均通过时间和/或局部血流量。
另外,以下描述呈现了诸如放射成像系统的成像系统以及使造影剂剂量、x射线辐射暴露和扫描持续时间最小化的方法的实施方案。除2d投影图像之外,本发明的系统和方法的某些实施方案还可以用于重建高质量的3d横截面图像,以用于允许诊断、治疗递送和/或功效评估。
出于讨论的目的,参考c形臂系统的使用描述本发明的系统的实施方案,该c形臂系统采用常规的和非常规的采集轨迹来对受试者的目标区域进行成像。在某些实施方案中,可以在介入规程或外科规程期间使用本发明的系统和方法。另外,本发明的系统和方法的实施方案还可以被实现用于在非医学成像环境中对各种瞬态现象成像,诸如制造的零件的安全筛查和/或工业无损评价。在以下部分参考图1描述了适合于实践本发明技术的各种实施方式的示例性系统。
图1示出了例如在介入医疗规程中使用的示例性放射成像系统200。在一个实施方案中,系统200可包括c形臂放射线照相系统102,该c形臂放射线照相系统被配置为从围绕受试者(诸如位于检查台105上的患者104)的一个或多个视角获取投影数据以供进一步分析和/或显示。为此,c形臂放射线照相系统102可包括机架106,该机架具有移动支撑件(诸如可移动c形臂107),该移动支撑件包括至少一个放射线源108(诸如x射线管)和位于c形臂107的相对端的检测器110。在示例性实施方案中,放射线照相系统102可以是x射线系统、正电子发射断层摄影(pet)系统、计算机化断层合成(ct)系统、血管造影或荧光透视系统等或它们的组合,其可操作以生成由静态成像检测器(例如,ct系统、mri系统等)在医疗规程之前采集的静态图像、或者利用实时成像检测器(例如,血管成形系统、腹腔镜式系统、内窥镜式系统等)在医疗规程期间采集的实时图像、或它们的组合。因此,所采集的图像的类型可以是诊断性的或介入性的。
在某些实施方案中,放射线源108可以包括多个发射设备(诸如布置在一维或多维场发射器阵列中的一个或多个可独立寻址的固态发射器),该多个发射设备被配置为朝向检测器110发射x射线束112。此外,检测器110可以包括多个检测器元件,该多个检测器元件在尺寸和/或能量灵敏度上可以相似或不同,用于以期望的分辨率对患者104的感兴趣区域(roi)成像。
在某些实施方案中,c形臂107可以被配置为沿着期望的扫描路径移动,用于将x射线源108和检测器110围绕患者104以不同的位置和角度取向,以用于采集用于动态过程的3d成像的信息。因此,在一个实施方案中,c形臂107可以被配置为围绕第一旋转轴线旋转。另外,c形臂107还可以被配置为围绕第二轴线以相对于参考位置约正或负60度的范围的角运动旋转。在某些实施方案中,c形臂107还可以被配置为沿着第一轴线和/或第二轴线向前和/或向后移动。
因此,在一个实施方案中,c形臂系统102可包括控制电路114,该控制电路被配置为基于用户输入和/或基于协议的指令控制c形臂107沿着不同轴线的移动。为此,在某些实施方案中,c形臂系统102可以包括诸如台侧控件116的电路,该电路可以被配置为使用各种输入机制向控制电路114提供信号,以对成像参数和/或处理参数进行自适应控制和/或交互式控制。例如,成像参数和/或处理参数可以包括显示特性、x射线技术和帧速率、扫描轨迹、台运动和/或位置、以及机架运动和/或位置。
在某些实施方案中,检测器110可包括多个检测器元件202,该多个检测器元件例如布置为2d检测器阵列,用于感测穿过患者104的投射的x射线束112。在一个实施方案中,检测器元件206产生代表照射的x射线束112的强度的电信号,该电信号继而可用于估计x射线束112在通过患者104时的衰减。在另一个实施方案中,检测器元件202确定x射线束112中的入射光子的计数和/或确定对应的能量。
具体地,在一个实施方案中,检测器元件202可以在围绕患者104的各种角位置处获取与所生成的x射线束112相对应的电信号,用于收集多个放射线照相投影视图用于构建x射线图像,诸如以形成荧光图像。为此,用于系统200的控制电路114可以包括控制机构204,该控制机构被配置为控制台105、机架106、c形臂107和/或安装在其上的部件的位置、取向和/或它们以某些特定采集轨迹的旋转。
例如,控制机构204可以包括台电机控制器206,该台电机控制器允许基于基于协议的指令和/或例如经由台侧控件(诸如操纵杆)从医生所接收的输入来控制台105的位置和/或取向。例如,在介入期间,医生可以通过使用台电机控制器206使台105移动来在系统102的视野中将介入设备尽量定位在患者104体中。一旦介入设备可以可视化,则医生可以将介入设备的位置推进到脉管系统内并执行诊断规程或治疗规程。
在某些实施方案中,可以使用控制机构204中的x射线控制器207来控制用于介入成像的x射线源108和检测器110,其中x射线控制器207被配置为向放射线源108提供功率信号和定时信号,用于在成像期间控制x射线暴露。此外,控制机构204还可以包括机架电机控制器208,该机架电机控制器可以被配置为控制机架106的旋转速度、倾斜度、视角和/或位置。在某些实施方案中,控制机构204还包括c形臂控制器210,该c形臂控制器与机架电机控制器208配合,可以被配置为移动c形臂107以用于动态过程的实时成像。
在一个实施方案中,控制机构204可以包括:数据采集系统(das)212,用于对来自检测器元件206的投影数据进行采样并将模拟数据转换为数字信号,以供由2d图像处理器220进行图像重建,实时重建高保真度2d图像以在介入规程期间使用;和/或3d图像处理器/重建器222,用于生成3d横截面图像(或3d体积)并随后在显示器218上示出图像。此外,在某些实施方案中,可以将由das212采样和数字化的数据输入到计算设备214。另选地,在某些实施方案中,计算设备214可以将投影数据存储在存储设备216中,诸如硬盘驱动器、软盘驱动器、光盘-读/写(cd-r/w)驱动器、数字通用光碟(dvd)驱动器、闪存驱动器,或者固态存储设备中以供进一步评价。
在一个实施方案中,系统200可以包括操作员控制台224,该操作员控制台可以被配置为允许选择和显示扫描模式、fov、先前检查数据和/或介入路径。操作员控制台224还可以允许例如基于操作员命令和/或系统命令即时访问2d和3d扫描参数以及选择roi以供后续成像。
此外,在某些实施方案中,系统200可以经由一个或多个可配置的有线和/或无线网络(诸如医院网络和虚拟专用网络)中的通信链路而耦接到例如在机构或医院内或者处于完全不同位置的本地或远程地定位的多个显示器、打印机、工作站、图像存档与通信系统(pacs)226和/或类似设备。
除c形臂系统102之外,成像系统200另外还包括超声成像系统230,该超声成像系统可操作地连接到计算设备214。超声成像系统230包括超声探头232,该超声探头连接到系统230并能够获得用于获取患者解剖结构的3d超声图像的图像。在特定示例性实施方案中,超声系统230可以利用3d超声探头或通过常规的2d超声探头产生3d超声图像,该3d超声探头可以是外部或内部(血管内)超声探头,该常规的2d超声探头被导航即配备有导航传感器,导航传感器实时提供探头232的位置和取向,以便使2d图像能够被处理成患者解剖结构的3d超声图像体积。
超声系统230还包括系统控制器234,该系统控制器包括多个模块。系统控制器234被配置为控制超声系统230的操作。例如,系统控制器234可以包括图像处理模块236,该图像处理模块接收超声信号(例如,rf信号数据或iq数据对)并处理超声信号以生成超声信息帧(例如,超声图像)以用于显示给操作员。图像处理模块236可以被配置为根据所获取的超声信息上的多个可选超声模态来执行一个或多个处理操作。仅以举例的方式,超声模态可以包括彩色流、声辐射力成像(arfi)、b模式、a模式、m模式、频谱多普勒、声流、组织多普勒模块、c扫描和弹性成像。所生成的超声图像可以是二维(2d)的、三维(3d)的或四维(4d)的。
随着接收到回波信号,可以在成像会话(或扫描会话)期间实时处理所获取的超声信息。除此之外或另选地,超声信息可以在成像会话期间临时存储在存储器238中,并且在实时或离线操作中以不太实时的方式处理。将图像存储器240包括在内,用于存储未被安排立即显示的所获取的超声信息的经过处理的帧。图像存储器240可以包括任何已知的数据存储介质,例如,永久存储介质、可移动存储介质等。
在操作中,超声系统230通过各种技术(例如,3d扫描、实时3d成像、体积扫描、利用具有定位传感器的换能器进行的2d扫描、使用voxel相关技术进行的自由扫描、使用2d或矩阵阵列换能器进行的扫描等)采集数据(例如,体积数据集)。超声图像在显示设备218上被显示给超声系统230的操作员或用户。
已经提供了系统200的一般构造的描述,以下是关于操作成像的患者解剖结构302的系统200的方法300(参见图3)的描述。尽管下面讨论了方法300的示例性实施方案,但应当理解,可以省略或添加包括方法300的一个或多个动作或步骤。还应当理解,动作中的一个或多个可以同时执行或至少基本上同时执行,并且动作的顺序可以改变。此外,可以体现的是,以下步骤或动作中的至少若干个可以表示为要存储在存储器216、238中的一系列计算机可读程序指令,以用于由控制电路/计算设备114、214针对放射线照相成像系统102和/或超声成像系统230中的一个或多个执行。
在方法300中,在步骤310中,初始获得患者解剖结构302的术前图像/体积312,诸如术前cta图像/体积。使用系统102以任何合适的成像方式获得cta图像/体积312。在步骤314中,在介入规程期间将介入器械316(例如,导丝)插入患者解剖结构302中。一旦介入设备316位于解剖结构302内,则在步骤320中,利用超声系统230获得解剖结构302(例如,evar规程期间的主动脉)的3d超声图像体积322。
一旦获得,则在本发明的示例性实施方案中,患者解剖结构302的3d超声图像体积322的利用可具有两个选项,这取决于图像322的质量。首先,如果3d图像具有高质量,并且清楚地显示患者解剖结构302(例如,主动脉以及周围组织和血管)的与规程相关的各种结构,包括由介入设备316的插入造成的患者解剖结构302的变形,则可以利用3d图像322代替术前cta图像312,以提供更新的3d图像体积312’以用于图像融合。在图像融合的初始步骤324中,使用c形臂系统102,获得患者解剖结构302的术中x射线图像(例如,荧光图像326),其中介入设备316在本文定位成以便获得介入设备316在解剖结构302内的位置的清晰图像。然后在步骤328中,将荧光图像326与3d超声图像322叠加或融合,以提供介入设备316在患者解剖结构302内的3d路线图图像,从而为医生提供设备316的位置以及由于介入设备316在解剖结构302内的放置而造成的解剖结构302的变形状态两者的清晰图像。3d超声图像322和荧光图像326的叠加或对准可以以任何合适且众所周知的方式执行。
如果在步骤320中获得的3d超声图像322的质量不足够高以代替术前cta图像/体积312来使用,则第二选项是将3d超声图像322与术前cta图像312融合,以测量和/或确定术前cts图像312中的解剖结构302的变形。该融合过程330在获得术中荧光图像326之前发生,并且作为框331中的第一步骤,涉及标识多个解剖界标332或者在术前cta图像312和3d超声图像322两者中都存在的患者解剖结构302的其他识别部分。这些界标332特定于正成像的特定患者解剖结构302并可以自动或手动选择。对于为evar规程提供引导和/或3d路线图的示例性实施方案,可以选择界标332作为主动脉血管解剖结构的位置,诸如例如内脏动脉口的3d位置,且具体地左肾动脉和右肾动脉、肠系膜上动脉和腹腔干、主动脉髂分叉、髂分叉、主动脉中心线和其他动脉的中心线等的位置。在步骤334中,以自动化或手动方式在术前cta图像312和3d超声图像322的每一者中确定这些点和/或界标332的位置。一旦在每个3d体积312、332中确定,则在步骤336中在每个体积312、322中使界标332匹配。在匹配之后,在步骤338中,执行合适的过程,诸如相应界标332之间的空间的非线性变换,以便基于每个体积312、322中的界标332之间的差异来计算或估计患者解剖结构302的变形。然后在步骤340中将该变形应用于术前cta图像体积312,以便提供由于介入设备316在解剖结构302内的放置而造成的当前变形的患者解剖结构302的清晰图像312′。
在术前图像312变形以获得更新的图像/体积312′之后,在步骤342中,可以将变形的或更新的图像/体积312′叠加到术中x射线图像(例如,在步骤328中获得的荧光图像326)上,以将当前变形的解剖结构302和介入设备316的3d路线图/融合图像344提供给医生。该过程可以以任何合适的方式执行,诸如通过将更新的图像体积312′与荧光图像326对齐地放置以提供3d路线图来执行。另外,方法300可以在该规程期间根据需要经常执行,以便连续地提供解剖结构302的更新的图像312′,用于与在整个规程期间拍摄的荧光图像326相结合。
以这种方式,系统200经由图像312′自动向医生提供更新的患者解剖结构3d路线图,该图像包括如由3d术前cta图像312和3d超声图像322中的界标332所确定的解剖结构302的变形,以用于彼此融合以自动识别和示出患者解剖结构302的变形并将更新的图像′312与术中荧光图像326相结合。
本书面描述使用示例来公开本发明,包括最佳模式,并且还使本领域技术人员能够实践本发明,包括制造和使用任何设备或系统以及执行任何包含的方法。本发明的专利范围由权利要求限定,并且可包括本领域技术人员想到的其他示例。如果此类其他示例具有与权利要求的字面语言没有区别的结构元素,或者如果它们包括与权利要求的字面语言具有微小差别的等效结构元素,则此类其他示例旨在落入权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!