MiR-22在制备抑制鼻咽癌的迁移的药物中的应用的制作方法
本发明涉及一种药物用途。
背景技术:
鼻咽癌(nasopharyngealcarcinoma,npc)是一种常见的头颈部肿瘤,来源于位于鼻咽部的上皮细胞。鼻咽癌作为一种多基因遗传疾病,主要发生在中国南部,东南亚和北非。鼻咽癌患者在疾病早期通过淋巴管和血管的转移潜能。随着精确成像和放疗的发展,鼻咽癌患者的预后更好。然而,远处转移仍然是鼻咽癌患者治疗不佳的主要原因。
微小rna(mirna)是内源性的〜22个核苷酸的rna,通过匹配蛋白质编码基因的mrna以指导它们的抑制[8]发挥重要作用,存在于许多有机体中。mirna涉及一些疾病和细胞功能,包含增殖和分化。据报道,在不同类型的癌症中mirna-22(mir-22)的表达水平不同。
技术实现要素:
本发明的目的在于提供一种mir-22的新药物用途。
本发明的技术解决方案是:
一种mir-22在制备抑制鼻咽癌的迁移的药物中的应用。
本发明提供了mir-22的新药物用途,用于制备抑制鼻咽癌的迁移的药物,mir-22/trpm7通路可成为针对鼻咽癌的新型治疗策略。
附图说明
下面结合附图和实施例对本发明作进一步说明。
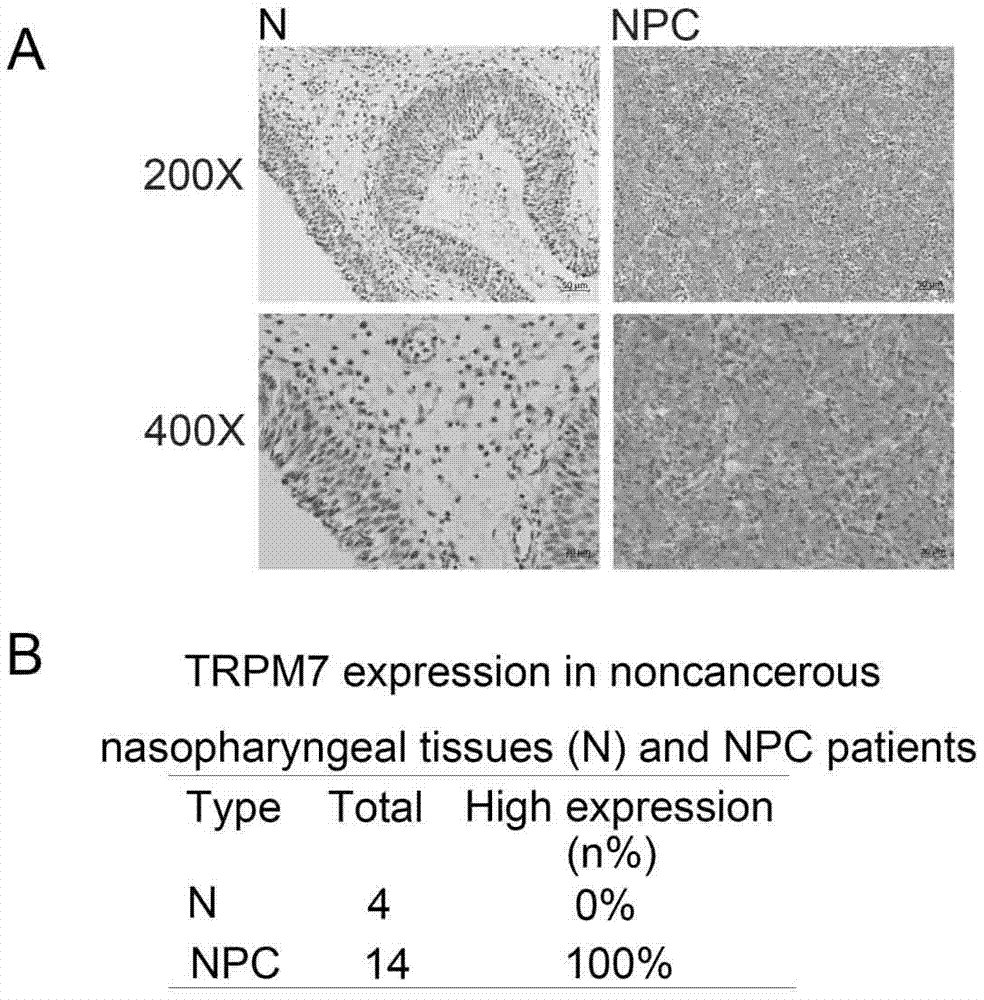
图1是trpm7在鼻咽癌组织中的表达及trpm7在非癌性组织中的表达鼻咽组织和npc组织示意图。
其中:(a)trpm7在鼻咽癌组织中的表达:trpm7在非癌性鼻咽组织中的低表达(n),trpm7在鼻咽癌组织中的高表达,(b)trpm7在非癌性组织中的表达鼻咽组织和npc组织。
图2是trpm7中预测的mir-22的3'utr区域及转染野生型(wt)或突变型(突变型)trpm73'-utr荧光素酶报告质粒mir-22或阴性对照mirna(nc)转染至hek293细胞,并检测相对荧光素酶活性示意图。
其中:(a)trpm7中预测的mir-22的3'utr区域(b)转染野生型(wt)或突变型(突变型)trpm73'-utr荧光素酶报告质粒mir-22或阴性对照mirna(nc)转染至hek293细胞,并检测相对荧光素酶活性*p<0.05。
图3是在用mir-22抑制剂(mo)和前体(pre)孵育的cne2细胞中trpm7的蛋白质印迹分析示意图。
其中所显示的数据经至少三次独立实验测试。数据通过t检验分析*p<0.05,**p<0.01。
图4是mir-22减少cne2细胞的迁移示意图。
其中(a)transwell实验用于测试mir-22对cne2细胞的迁移能力影响、(b)将迁移的细胞进行统计、(d)细胞的相对迁移距离被测量(p<0.001)、(c)收集已转染的细胞,并且通过划痕实验测量迁移率。在0h和48h显示划痕的代表性图像。数据为平均值±sem,*p<0.05。所有实验至少进行三次。
图5是使用流式细胞术分析具有mir-22敲低和过表达的cne2细胞示意图。
数据是平均值±sem.p>0.05。
具体实施方式
一种mir-22在制备抑制鼻咽癌的迁移的药物中的应用。
材料和方法:
细胞系和细胞培养:
将cne2细胞系维持在rpmi-1640(gibcobrl,grandisland,ny,usa)
用10%fbs(gibco)处理。所有细胞在含有5%co2的37℃的环境中温育。
免疫组化:
使用trpm7抗体(santa,1:100)孵育石蜡包埋的鼻咽癌组织切片。使用dab检测试剂盒(增强聚合物)(zsgb-bio,中国)进行ihc,使用dab试剂盒(zsgb-bio,中国)和苏木精复染。使用免疫反应评分(irs)根据染色强度和分布对trpm7表达水平进行评分。irs=si(染色强度)*pp(阳性细胞的百分比)。si被确定为0=负值;1=弱;2=中等;和3=强。pp被定义为0,<1%;1,1%-10%;2,11%-50%;3,51%-80%;和4个>80%的阳性细胞。每个肿瘤的10个不同的领域被用于irs评估。使用正常的鼻咽上皮作为对照。
荧光素酶报告基因测定:
将hek293细胞接种在24孔板的内孔中。当细胞汇合达到70%时,我们使用lipofectamine2000(invitrogen)与80ng含有trpm7的野生型或突变体3'-utr和4ngprl-tk的pgl3载体质粒共转染细胞.mir-22模拟物或模拟物nc(biomicsbiotechnologiesco.ltd。(南通,中国))以50pmol的终浓度共转染。转染后48小时,使用双荧光素酶报告基因测定系统(promega,southampton)连续测量荧光素酶活性,英国)基于制造商的说明书,发光信号用作记录器活性的量度,用于转染效率的归一化。
蛋白质印迹:
使用含有蛋白酶抑制剂pmsf的ripa裂解缓冲液在冰上裂解转染的细胞。将20微克总蛋白质样品在10%sds-page凝胶上分离并转移至pvdf膜(millipore,billerica,ma,usa)。并在tris缓冲盐水(tbst)中的5%脱脂奶粉中封闭膜,在室温下孵育1小时。然后,将膜与第一抗体在4℃孵育过夜,然后在室温下与hrp标记的第二抗体孵育1小时。通过增强的化学发光系统(ecl,cellsignalingtechnologies)检测免疫反应性。使用imagej软件获得数据,并使用gapdh作为上样对照。我们使用抗trpm7(1:500;santacruzbiotechnology,santacruz,ca,抗gapdh(1:5000;cusabio,武汉,中国),抗鼠igg(1:5000;sangonbioco.ltd,中国上海)。所有实验重复至少三次。
划痕实验:
在6孔板上用吗啉或前体和mir-22的对照转染cne2细胞。当细胞达到90%汇合时,用100μl移液管尖制备伤口。将平板在37℃温育。通过显微镜每12小时观察一次,通过伤口距离测量在0小时测量迁移距离。
transwell分析:
使用transwell细胞培养箱测定cne2细胞的迁移活性。用mo-mir22和pre-mir22处理细胞36小时后,将200ul细胞(30000细胞)添加到在顶部transwell小室中修饰的fbs游离rpmi培养基中(8ul,康宁,中国)。底室含有500ul完全培养基。迁移的细胞用无水甲醇固定,并在20小时后用结晶紫染色。在3个随机区域中计数细胞并通过olympus显微镜用数码相机捕获图像。
细胞周期分析:
我们用mir-22的抑制剂和前体转染cne2细胞,48h后收集细胞,然后将细胞置于70%乙醇中,-20℃过夜。然后,用含1%tritonx-100的细胞孵育10分钟,加入1mg/mlrna酶a20分钟并用pi/rnase染色缓冲液(bdbiosciences,sandiego,ca)染色。之后使用cellquest采集和分析程序。
统计分析:
使用graphpadprism5进行统计分析。所有相同的实验进行至少三次,数据通过学生测试分析并显示为平均值±sem。
结果:
trpm7在npc中的表达:
我们通过免疫组织化学方法检测了患者鼻咽癌组织中trpm7在鼻咽癌组织中的表达情况。如前述研究[5]所示,鼻咽癌组织中鼻咽癌组织中的表达水平高于非癌性鼻咽癌组织(n)(图1)。a)。此外,我们总结了鼻咽癌患者的百分比,发现trpm7在鼻咽癌患者和0%非癌性鼻咽患者中的高表达率为100%(图1.b)。总之,我们证实了trpm7在鼻咽癌中的过表达。
mir-22是trpm7的上游:
为了进一步探索功能,我们试图预测trpm7的上游.trpm7的3'utr通过预测软件microrna.org-targets和expression含有mir-22的预测结合位点(图2.a)。据报道trpm7是帕金森病中mir-22的靶基因[15]。我们通过荧光素酶报告基因分析证实了靶基因的作用,trpm7结合了mir-22的3'utr区(图2.b)。
mir-22减少cne2细胞的迁移:
为了研究mir-22在鼻咽癌细胞中的功能,我们利用transwell迁移实验和划痕实验研究了mir-22对细胞迁移的影响。我们将mir-22抑制剂(mo)和前体(pre)转染到cne2细胞。首先,我们通过蛋白质印迹分析检测了转染效率。由于mir-22的过表达和敲低是有效的(图3.ab),它们被用于后续研究。我们通过transwell迁移实验和划痕实验研究了mir-22对细胞迁移的影响。有趣的是,mir-22的敲低增加了transwell小室中的细胞数量,而mir-22的过表达显示出相反的现象,与模拟组相比(图4.ab)。划痕实验测定也显示了类似的结果(图4.cd)。以上数据支持mir-22可能会减少细胞迁移。
mir-22与cne2细胞增殖的关系:
为进一步探讨mir-22在npc中的潜在生物学作用,我们对细胞周期的细胞实验进行了研究。我们发现,与对照组相比,用mir-22抑制剂和前体处理过的cne2细胞的g1期,s期和g2期无明显差异(图5)。我们认为mir-22对cne2细胞增殖的影响不明显。
讨论:
尽管鼻咽癌放疗和化疗已被广泛应用于患者,且已显示出良好的治疗效果,但转移的比例仍然很高[16]。鼻咽癌是一个以迁移和增殖为特征的复杂生物过程[17]。因此,重要的是鉴别npc转移的机制,进展和预后,有助于早期诊断,支持预后预测。在这项研究中,我们证明了mir-22减少了cne2细胞的迁移,这受到trpm7的调控。
trpm7是一种非选择性阳离子通道,在许多恶性肿瘤中过表达[18]。trpm7ca2+和mg2+通道调节人类癌症的迁移[19],包括鼻咽癌[6]。研究报道trpm7在鼻咽癌发展过程中在增殖和迁移过程中发挥着多种功能作用[7]。但trpm7在npc中的作用机制有没有完全得到证明。
mirnas与治疗癌症的新型治疗药物有着密切的关系[20]。研究证实mir-22与癌症发展相关,如结直肠癌[21],肝癌[22],慢性心力衰竭[23]和非小细胞肺癌[24]。然而,在mir-22及其在npc中的靶标方面存在差异。
在目前的研究中,我们使用ihc来探索trpm7在npc样品中的表达,发现与非癌性鼻咽组织相比,trpm7在鼻咽癌组织中的过表达(图1)。通过激活,阻断和击穿离子通道,jianpengchen等发现trpm7通过介导ca2+内流来调节npc的转移过程[5,6]。而trpm7通道通过钙诱导钙释放(cicr)机制控制ca2+的释放[6]。但trpm7的上游调控尚不清楚。有趣的是,我们通过分析软件发现trpm7是mir-22的靶基因,我们的研究结果显示trpm7和mir-22的靶向结合(图2)。为了研究mir-22在体外的作用,我们转染mir-22的抑制剂和前体发现mir-22的敲低增加了cne2细胞的迁移,而mir-22的过表达降低了这一过程。但cne2细胞的增殖与mir-22关系不明显(图4)。未来还需要探索mir-22在鼻咽癌组织和细胞中的表达。
综上所述,我们发现mir-22抑制鼻咽癌细胞的迁移活性,证实trpm7作为mir-22的直接靶点在鼻咽癌组织中表达较高。结果表明mir-22/trpm7通路可能成为针对鼻咽癌的新型治疗策略。
- 还没有人留言评论。精彩留言会获得点赞!