3D打印PCL-Li骨组织工程支架及其制备方法与流程
本发明属于骨组织修复及重建领域,涉及3d打印pcl-li骨组织工程支架及其制备方法。
背景技术
临床上由于创伤、肿瘤、感染所造成的骨缺损很常见,每年我国有大量的骨组织缺损患者需要接受手术治疗。寻找具有良好生物特性的骨组织工程修复材料一直是骨科研究的热点,如何找到更多更好的骨组织再生修复材料,为人类修补生命再创健康,已成为全世界众多科学家共同的追求和孜孜不倦研究的动力。
尽管目前骨缺损修复已有多种疗法,但这些方法普遍存在着来源少、并发症多、免疫排斥和医源性感染等诸多问题,尤其对大范围骨缺损的医治至今仍未有效解决。包括:1.自体骨移植,这种方法受自身供体有限性的限制,不能反复大量使用;2.同种异体骨移植,主要存在免疫排斥、病原体传播、花费高昂等问题;3.各种以金属、陶瓷或高分子制造的人工骨替代材料,目前已应用于临床,但多数是作为永久植体使用,它们不能参与人体的新陈代谢,因而长期效果往往不尽人意。
随着骨组织工程技术的不断发展,人们已经开始通过运用组织工程的方法来解决骨缺损的修复问题。理想的骨组织工程材料应要求有:①良好的生物相容性;②良好的生物降解性;③具有三维立体多孔结构;④可塑性和一定的机械强度;⑤骨引导活性即骨诱导性和骨传导性;⑥易消毒性。
综上所述,开发出一种结构可靠,弹性和强度合适,手术植入方便,对人体具有良好相容性,创伤小,低成本、可诱导骨长入的组织工程化支架对骨伤、骨肿瘤、骨感染后骨缺损的修复治疗、以及对我国的卫生事业发展、对建设创新性国家都有重要的现实意义。
技术实现要素:
本发明的目的是针对现有技术的上述不足,提供3d打印pcl-li骨组织工程支架。
本发明的另一目的是提供该3d打印pcl-li骨组织工程支架的制备方法。
本发明的目的可通过以下技术方案实现:
一种3d打印pcl-li骨组织工程支架,以聚ε己内酯pcl与氯化锂为原料,通过3d打印技术制备而成。
本发明所述的3d打印pcl-li骨组织工程支架优选,pcl的用量为69.65重量份93.93重量份;氯化锂的用量为6.07重量份30.35重量份。
本发明所述的3d打印pcl-li骨组织工程支架,所述的pcl的分子量优选在10000-80000之间。
本发明所述的3d打印pcl-li骨组织工程支架优选通过以下方法制备得到:将配方量的pcl和氯化锂溶解于有机溶液配制成溶液后置于旋转蒸发仪中蒸发出溶剂,得到pcl-li颗粒,再通过3d打印技术将pcl挤压出成型纤维束、通过纤维束的不同层次与角度的拼接架构制备得到具有多孔隙结构的3d打印pcl-li骨修复组织工程支架。
本发明所述的3d打印pcl-li骨组织工程支架的外形依据不同的待修复区的骨缺损形态进行3d打印个性化制造,或通过3d打印制造为固定外形的支架。
本发明所述的3d打印pcl-li骨组织工程支架的制备方法,包括将配方量的pcl和氯化锂溶解于有机溶液配制成溶液后置于旋转蒸发仪中蒸发出溶剂,得到pcl-li颗粒,将pcl-li颗粒通过3d打印技术制备得到具有多孔隙结构的3d打印pcl-li骨修复组织工程支架。
其中,所述的有机溶液优选四氢呋喃、丙酮、二甲基亚砜。
所述得pcl在有机溶液中的浓度优选为13.93%~18.79%,氯化锂在在有机溶液中的浓度优选为1.21%~6.07%。
本发明制备方法优选将pcl-li颗粒通过熔融挤压成型式3d打印的加热系统升温到100℃变为液态,挤压出成型纤维束(直径范围500-800微米)、通过纤维束的不同层次与角度的拼接架构获得具有多孔隙结构的3d打印pcl-li骨修复组织工程支架。
本发明制备方法优选各层纤维在0-180°的范围内相交并累积形成包括0-90°正交行结构、0-45-90-135-180°菱形结构、0-60-120-180°三角形结构在内的规律性孔隙,或依据实际需要形成特殊的梯度化、层次化相交结构的孔隙。
有益效果:
(一)结构可控特性:通过3d打印技术构建,可以实现外形、内部孔隙结构的精细控制。本发明是以fdm3d打印的纤维通过不同层次与角度的逐层累积与拼接架构而成的多孔隙结构,孔隙是各层纤维在0-180°的范围内相交并累积而形成,每个纤维之间的距离也可以影响孔隙的大小,这样就最终可以形成包括0-90°正交行结构、0-45-90-135-180°菱形结构、0-60-120-180°三角形结构在内的规律性孔隙,亦可以依据实际需要形成特殊的梯度化、层次化相交结构。
(二)离子释放的可控性:本发明通过对3d打印微结构(包括支架的孔大小、孔形状、孔取向、孔隙率和连通性、及支架表面特性等)的精细控制以及锂离子反应那个条件的控制可以调控支架的力学性能、细胞粘附性能、以及锂离子的释放特性。同时,通过改变锂离子和pcl的混合比例,可调控支架内部li的负载量,进而调控li的释放特性。通过对锂的释放特性的调控,可以针对不同病情选择合理的强度。
(三)力学性能可调控特性与良好的骨长入特性:本发明的多孔微结构,pcl材料具有一定的弹性模量与拉伸强度,通过对孔隙微结构、pcl和氯化锂比例的调控,可以精准匹配待修复区的力学环境,依据骨生长的wolf定律,将有利于新骨的长入与塑形;而且pcl本身具有良好的具有亲水性、生物相容性、骨长入特性等理化特性可以提供有利于干细胞粘附、扩增、成骨分化及骨基质累积的局部微环境。同时,多孔结构有利于营养成分的交换,进而可促进新骨的长入。因此,随着支架基材pcl的不断降解、新生骨组织的形成与填充孔隙,就能够形成在宿主部位良好的骨整合性能,进而诱导、促进新骨组织形成。
(四)完全生物可降解性与良好的生物安全性:本发明采用的pcl及锂离子均为高生物相容性与生物安全性材料,其中pcl材料对生物体无毒,最终降解产物为co2和h2o,已被美国fda批准用于作为可临床使用的口服药基材、医用液态包装乃至组织工程支架基材等;锂是一种人体非必需微量元素,临床上口服锂治疗双向情感障碍已有超过50年的历史,具备良好的生物安全性,在体内外具有广谱抗肿瘤作用,体内应用氯化锂可以促进骨痂形成、骨折愈合及增加骨密度,已广泛应用于骨组织工程研究中。
附图说明
下面结合附图和实施例对本发明进一步说明。
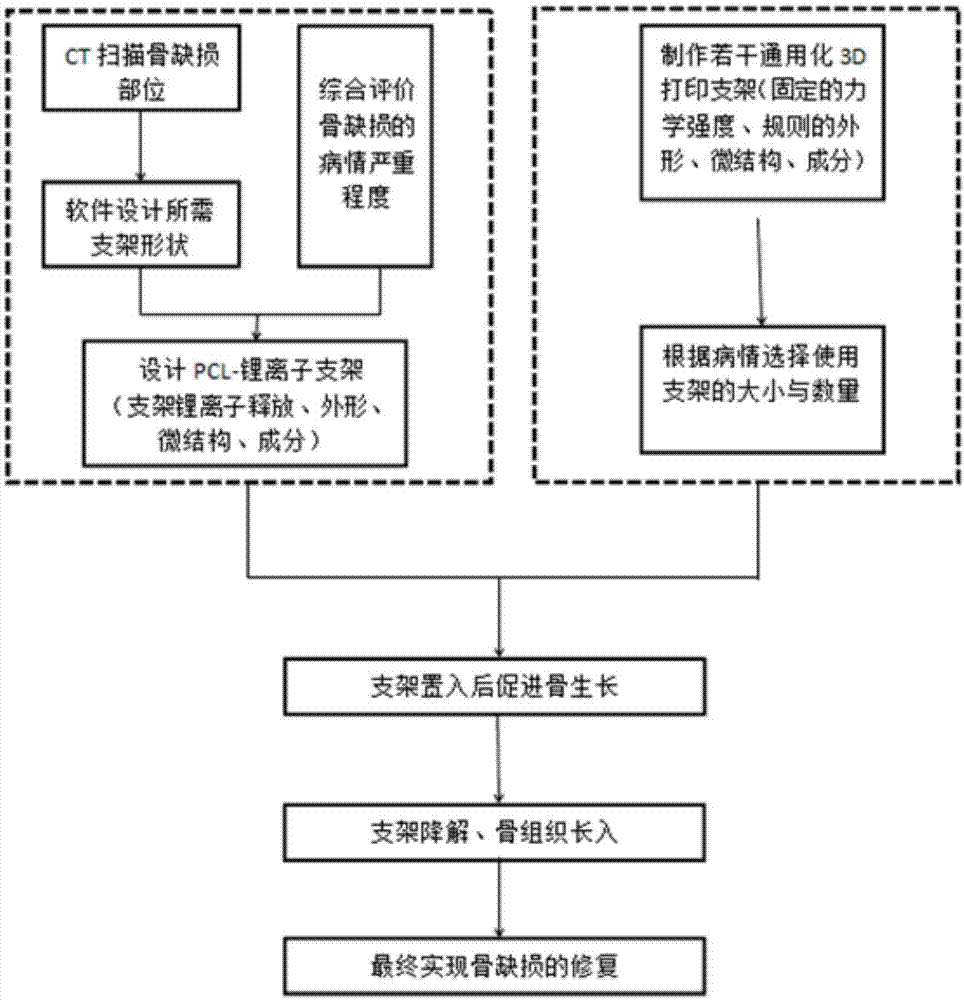
图1为pcl-li骨修复组织工程支架用于修复骨缺损的技术路线图。
如图1所示的技术路线,对于骨缺损患者,如果缺损区没有金属异物等可能影响ct扫描图像的干扰因素,可以通过ct扫描获得解剖数据,并结合骨缺损的病情严重程度,设计具备个性化外形与理化特性的3d打印支架并植入骨缺损区域。对于无法获取精确解剖数据的患者,使用预先准备好的pcl-li骨组织工程支架,依据实际缺损情况决定植入支架的数量。支架植入后,随着锂离子的释放逐步、持续促进骨生长。与此同时,随着pcl的降解,新生骨组织则不断长入,最终实现修复骨缺损修复的目标。
图2为本发明的纤维层叠排列、建立三维多孔结构的示意图。
纤维0-90°层叠排列的正方形孔隙支架的结构示意图,在实际工作中,亦可以依据不同待修复区力学环境、骨缺损程度等的实际要求,通过对支架纤维层叠的调控,进而制备个性化设计、具备特定孔隙微结构的支架。
图3为本发明锂离子负载于支架pcl纤维的示意图。
a为3d打印pcl-锂离子骨组织工程支架三维示意图;b为局部放大后单根支架纤维的示意图;c为支架的纤维内部示意图可以看到pcl高分子网状粘附li。
图4为本发明植入骨缺损区后发挥促进骨组织长入生物学作用的示意图。
a为支架植入骨缺损部位;b为支架植入时局部的放大图;c显示3d打印pcl支架的微观示意图;d为pcl支架局部放大后单根支架纤维的示意图;e为pcl支架纤维内部复合li;f为随着锂离子的释放及pcl的降解,支架逐渐被人体吸收,同时有骨组织长入,直到支架完全降解,骨缺损区域被新生骨组织替代。
图5为本发明采用不同孔隙微结构进行3d打印制备的通用型支架的实物图。其中纤维成0-90°层叠排列的具备正方形微结构的支架。
图6显示为3d打印pcl-li支架的细胞增殖结果和电镜下细胞粘附情况
图7为本发明体内骨修复实验的结果图。
其中a为骨缺损区域;b为将支架植入骨缺损区域,显示3d打印支架完全嵌入骨缺损区域;c为支架植入3月的。
具体实施方式
实施例1
1.制备pcl-li颗粒
将pcl和氯化锂按69.65:30.35的比例溶解于四氢呋喃中,配置成质量体积比20%的溶液。将pcl-li混合溶液置于旋蒸器中80℃水浴负压抽吸出溶剂四氢呋喃,得到pcl-li混合物,将其剪碎得到直径约为500微米的pcl-li颗粒。
2.制备3d打印pcl-li支架
将pcl-li颗粒通过熔融挤压成型式(fuseddepositionmodeling,fdm)3d打印的加热系统升温到100℃变为液态。挤压出成型纤维束、通过纤维束的不同层次与角度的拼接架构获得3d打印支架。纤维成0-90°层叠排列的具备正方形微结构的支架,支架孔径为500微米,正方形,空隙率为70%,支架的实物图如图5所示,为纤维成0-90°层叠排列的具备正方形微结构的支架。
3.检测3d打印pcl-li支架的生物学性质
将兔骨髓间充质干细胞负载于pcl-li支架,利用cck8试剂盒检测细胞的增殖,利用电镜观察细胞在支架上的粘附情况。图6显示为3d打印pcl-li支架的细胞增殖结果和电镜下细胞粘附情况
4.检测3d打印pcl-li支架的骨修复特性
于3月将兔直径4mm高度为4mm的pcl-li支架植入兔股骨髁骨缺损处,三月后取材检测其成骨效能。图7为本发明体内骨修复实验的结果图,显示新生骨软骨组织长入并替代支架材料。
- 还没有人留言评论。精彩留言会获得点赞!