一种IPMC医疗导管及其制备方法与流程
本发明涉及医疗器械领域,具体地涉及一种ipmc医疗导管及其制备方法。
背景技术:
医疗导管是一种有源、连续的手术工具,在手术过程中定位精确,受体内环境影响小并且稳定度高,因此,是心脑血管疾病诊疗手术中最重要的医疗工具之一。传统医疗导管一般是细长软管,由于人的心腔以及血管是弯曲多变的,存在很多分岔,外科医生很难精确地操控导管,以到达设定的目标病灶区域。导管在人体内血管穿梭时,在血管分叉处,无法识别方向,也不能及时转向避开障碍,极易刺穿组织,对血管内壁造成严重的损伤。
目前,国内外适用于外科手术的主流介入导管包括四类:绳索驱动导管、形状记忆合金导管、压电材料驱动导管和电磁场驱动导管。然而,这些导管也有各自的优缺点,绳索驱动导管可以提供较大的能量,但是结构复杂,尺寸较粗较大。绳索驱动导管操作方法也很复杂,非常依赖技术人员的操作水平,十分难以普及。目前研究最多的是形状记忆合金驱动导管,其主要问题是驱动响应较慢,严重影响外科手术时间;并且导管在弯曲变形时,会产生大量的热,容易给病人带来不适。压电驱动和电磁场驱动导管普遍缺乏具体的理论支持,弯曲刚度与导管导向机器人零件尺寸的关系计算十分复杂,难以用于实际手术。
ipmc(ion-exchangepolymermetalcomposite,离子交换聚合金属材料)驱动材料是近年发展起来的一类新型智能材料,在低电压下,依靠活性离子在电极材料中的可逆脱嵌,实现可逆的驱动响应形变。相比传统的智能材料包括压电陶瓷和记忆合金等,ipmc材料具有轻质、柔性、高应变、结构简单、生物相容性良好等特点,一直以来被认为是发展人工肌肉、轻质仿生系统理想的首选智能材料之一,被广泛研究开发用于生物医学领域。因此,将ipmc驱动技术与介入医学工程相结合,研发具有主动弯曲和导向能力并且生物相容性良好的ipmc活性医疗导管,以人体血管为运行通道,实现更精确、更高效的微创介入定位技术,具有很高的研究和实际应用价值。
技术实现要素:
为解决上述现有技术存在的问题,本发明提供了一种ipmc医疗导管及其制备方法,使该导管具有主动弯曲和导向特性,且结构简单,易操作。
为了达到上述发明目的,本发明采用了如下的技术方案:
在一个总体方面,本发明提供一种ipmc医疗导管的制备方法,包括步骤:
s1、取固态电解质管,对所述固态电解质管表面进行处理,获得处理后的固态电解质管;
s2、通过化学还原工艺或磁控溅射工艺,在处理后的固态电解质管表面形成偶数个沿所述固态电解质管的长度方向延伸的金属电极,其中,所述金属电极沿所述固态电解质管的周向间隔设置。
进一步地,所述步骤s1对所述固态电解质管表面进行处理包括步骤:
s11、取固态电解质管,对所述固态电解质管表面进行粗化,获得粗化的固态电解质管;
s12、利用无机洗液对粗化的固态电解质管表面的杂质进行处理,获得处理后的固态电解质管。
进一步地,所述无机洗液为去离子水、硫酸溶液、氢氧化钠溶液、氯化钠溶液及过氧化氢溶液中的一种或几种。
进一步地,所述步骤s2包括:
s21、通过化学还原工艺或磁控溅射工艺,在处理后的固态电解质管表面形成金属电极层;
s22、通过切割工艺沿所述固态电解质管的长度方向切割所述金属电极层,并在处理后的固态电解质管表面形成偶数个沿所述固态电解质管的长度方向延伸的金属电极。
进一步地,所述步骤s21包括:
s21a、将处理后的固态电解质管置于金属盐溶液中,8~24h后取出,并用去离子水对取出的固态电解质管进行冲洗,获得冲洗后的固态电解质管;
s21b、将所述冲洗后的固态电解质管置于150~350ml去离子水中,40~90℃水浴下加入质量分数为1~8%的还原性电解质溶液10~25ml;
依次重复所述步骤s21a和步骤s21b3~6次,在处理后的固态电解质管表面形成金属电极层。
在另一个总体方面,本发明还提供一种通过上述ipmc医疗导管的制备方法制备的ipmc医疗导管,所述ipmc医疗导管包括固态电解质管及设于所述固态电解质管表面、并与所述固态电解质管耦合的偶数个金属电极,所述偶数个金属电极沿所述固态电解质管的周向间隔设置,所述金属电极沿所述固态电解质管的长度方向延伸。
进一步地,所述固态电解质管材料为全氟磺酸或聚偏氟乙烯,所述固态电解质管的电解质层的电解质离子为水合氢离子或水合氢氧根离子;所述金属电极为金、银或铜的一种或几种组成的电极层。
进一步地,所述金属电极厚度为1~40μm,表面电阻为0.1~10ω,密度为7.2~20.4g/cm3。
进一步地,所述固态电解质管体颜色为透明或者淡黄色,密度为0.95~2.95g/cm3,摩尔质量为300~700g/mol,离子电导率为0.5×10-4~1.5×10-4s/cm。
进一步地,所述金属电极包括四个,四个所述金属电极的电极材料相同、且大小相等。
与现有技术相比,本发明的ipmc医疗导管及其制备方法,通过在固态电解质管表面设置偶数个金属电极,金属电极在外低电压作用下,依靠活性离子在电极材料中的可逆脱嵌,实现可逆的驱动响应形变,使ipmc医疗导管具有主动弯曲和导向特性,且其结构简单,便于操作;另外,由于多个金属电极均匀间隔设于固态电解质管表面,使得ipmc活性医疗导管表现出精确可控的多运动自由度弯曲导向特性,且其与生物相容性良好,因此在作为介入医疗器械时,以人体血管为运行通道,实现更精确、更高效的微创介入定位技术,在介入微创手术领域具有十分广阔的应用前景;同时由于制备工艺简单,成本低,有望实现产业化。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
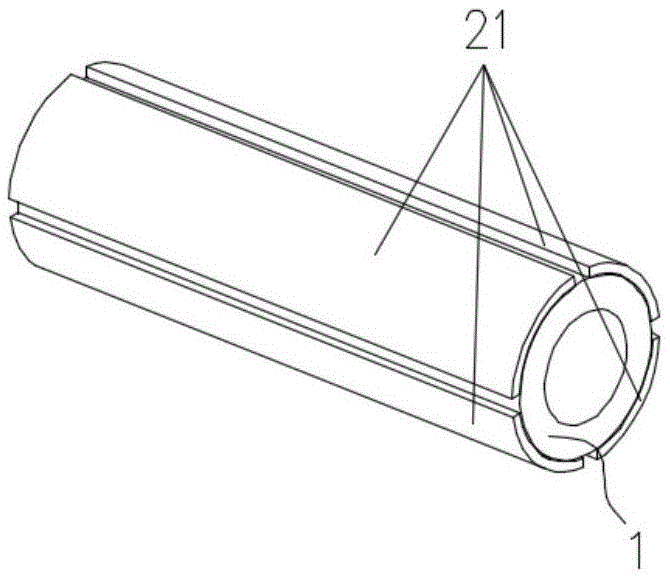
图1为本发明实施例的ipmc医疗导管的结构示意图;
图2为本发明实施例的ipmc医疗导管的一种制备方法的结构示意图;
图3为本发明实施例的ipmc医疗导管的制备方法的流程示意图;
图4为本发明实施例的ipmc医疗导管的另一种制备方法的结构示意图;
图5为本发明实施例1制备的ipmc医疗导管的局部截面sem照片;
图6为本发明实施例1的金电极层表面sem照片;
图7为本发明实施例1的电极分割线截面sem照片;
图8为本发明实施例1制备的ipmc医疗导管的交流阻抗谱;
图9为本发明实施例1制备的ipmc医疗导管的循环伏安曲线;
图10为本发明实施例1制备的ipmc医疗导管的电化学驱动变形性能随着电刺激频率的变化图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行详细地描述,显然,所描述的实施例仅仅是本发明一部分实例,而不是全部实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护范围。
如图1所示,为本发明实施例的一种ipmc医疗导管的结构示意图,所述ipmc医疗导管包括固态电解质管1及设于所述固态电解质管1表面、并与所述固态电解质管1耦合的偶数个金属电极21,所述偶数个金属电极21沿所述固态电解质管1的周向间隔设置,所述金属电极21沿所述固态电解质管1的长度方向延伸。
所述固态电解质管1材料为全氟磺酸或聚偏氟乙烯,所述固态电解质管1的电解质层的电解质离子为水合氢离子或水合氢氧根离子,固态电解质管可为固态电解质空心管,可通过溶液浇铸法或者螺杆挤出机成型制成;所述固态电解质管1颜色为透明或者淡黄色,对固态电解质管1而言,密度越大,模量越高,力学偏转挠度也越大,不利于ipmc医疗导管驱动,密度过小,又难以形成自支撑柔性结构,因此优选的,固态电解质管1密度为0.95~2.95g/cm3,密度不同,摩尔质量、离子电导率也随之变化。基于0.95~2.95g/cm3的密度范围,优选的,固态电解质管1摩尔质量为300~700g/mol,离子电导率为0.5×10-4~1.5×10-4s/cm。
所述金属电极21为金、银或铜的一种或几种组成的电极层。由于在实际应用过程中,若金属电极材料太薄则会影响电极导电性,而太厚,则ipmc医疗导管整体硬度和弯曲阻力会增加,不利于导管的低压驱动变形,因此申请人在经过大量实验探索与对比后,优选的,本实施例的金属电极厚度为1~40μm,同时表面电阻和密度等参数也随着镀层厚度变化而发生变化,基于1~40μm的厚度范围内,优选的,金属电极21表面电阻为0.1~10ω,密度为7.2~20.4g/cm3。
基于上述的固态电解质管1和金属电极21的优选范围,本实施例的ipmc医疗导管可实现0~150μm位移范围内可控的弯曲导向特性,满足医疗导管的实用需求。
为了进一步对ipmc医疗导管的弯曲导向特性进行精准控制,优选的,参见图1,本实施例的,偶数个金属电极21均匀的、间隔的附于固态电解质管1表面,优选的,每个金属电极21的组成材料相同,大小及厚度均相同,使得固态电解质管1的各个方位上的金属电极一致,使得施加于各个金属电极上的电压更便于控制,控制精准度更高;可理解的是,由于需施加于金属电极上的电压至少为一正一负,因此金属电极需为偶数个金属电极,且最少为2个金属电极,优选的,为了进一步实现对固态电解质管1多方位、多自由度的进行控制,金属电极数量为大于2的偶数个,优选的,所述金属电极21设有四个,且四个所述金属电极21的电极材料相同,且大小相等。对四个金属电极分别施加电压,通过控制电压大小及正负电性,从而实现多自由度驱动特性。
所述ipmc医疗导管长度范围在2~10cm,外径范围在2~5mm。
其中,对于设于固态电解质管1上的金属电极21的设置方式,可以有多种形式,参见图2,可以是在固态电解质管1上设置金属电解质层2,然后通过切割的方式,形成多个间隔的金属电极21;参见图4,也可以是将多个金属电极21分别独立的设于固态电解质管1上。
参见图3,本实施例还提供了一种制备上述的ipmc医疗导管的制备方法,其中,所述ipmc医疗导管包括固态电解质管及与所述固态电解质管耦合的偶数个金属电极,所述制备方法包括步骤:
s1、取固态电解质管,对所述固态电解质管表面进行处理,获得处理后的固态电解质管;
具体的,参照图3,步骤s1包括:
s11、取固态电解质管,对所述固态电解质管表面进行粗化,获得粗化的固态电解质管;其中,表面粗化可通过砂纸打磨或者等离子体刻蚀而实现;
s12、利用无机洗液对粗化的固态电解质管表面的杂质进行处理,获得处理后的固态电解质管。其中,所述的无机洗液为去离子水、硫酸溶液、氢氧化钠溶液、氯化钠溶液及过氧化氢溶液中的一种或几种。
s2、通过化学还原工艺或磁控溅射工艺,在处理后的固态电解质管表面形成偶数个沿所述固态电解质管的长度方向延伸的金属电极,其中,偶数个所述金属电极沿所述固态电解质管的轴向间隔设置。
具体的,结合图2和图3所示,步骤s2包括:
s21、通过化学还原工艺或磁控溅射工艺,在处理后的固态电解质管1表面形成金属电极层2;
s22、通过切割工艺沿所述固态电解质管1的长度方向切割所述金属电极层2,切割完成后,在处理后的固态电解质管表面形成偶数个沿所述固态电解质管的长度方向延伸的金属电极21。
其中,作为步骤s2中通过化学还原工艺或磁控溅射工艺,在处理后的固态电解质管表面形成偶数个沿所述固态电解质管的长度方向延伸的金属电极的另外一种实现方式,参见图4,可通过化学还原工艺或磁控溅射工艺,将多个金属电极21分别独立的设于固态电解质管1上,本方式与上述方式均可在固态电解质管1表面形成偶数个沿所述固态电解质管1的长度方向延伸的金属电21,且均通过化学还原工艺或者磁控溅射工艺而实现。
如图2所示,若采用形成金属电极层2然后通过切割的方式形成金属电极21,那么首先在固态电解质管1表面形成的是金属电极层2,在通过切割的方式形成间隔的金属电极21,其中,切割可通过车削加工或者激光进行切割。该方式利于保证多个金属电极之间电极材料的一致性,并且制备工艺简单,利于产业化生产,节省成本。
如图4所示,若采用的是将多个金属电极21分别独立的设于固态电解质管1上的设置方式,那么多个金属电极21可同时独立形成(对相邻金属电极21之间的间隔处进行遮掩),也可依次形成于固态电解质管1表面,那么通过该方式形成的多个金属电极21之间的电极材料可相同或者不同,大小及厚度可相同或者不同,比较有利的是,具有多样性、可选择性强。
其中,不论是那种方式形成,其均通过化学还原工艺或者磁控溅射工艺而实现,在上述步骤s21的基础上,通过化学还原工艺在处理后的固态电解质管表面形成金属电极层包括:
s21a、将处理后的固态电解质管置于金属盐溶液中,8~24h后取出,并用去离子水对取出的固态电解质管进行冲洗,获得冲洗后的固态电解质管;
s21b、将所述冲洗后的固态电解质管置于150~350ml去离子水中,40~90℃水浴下加入质量分数为1~8%的还原性电解质溶液10~25ml;
依次重复所述步骤s21a和步骤s21b3~6次,在处理后的固态电解质管表面形成金属电极层2。
当然,可理解的是,若采用的是将多个金属电极21分别独立的设于固态电解质管1上的设置方式,那么化学还原工艺在处理后的固态电解质管表面形成的就是金属电极21,而不是金属电极层2。
以下将通过多个试验实施例进行具体说明,由于考虑试验效率,下述的实施例均采用形成金属电极层然后通过切割的方式形成金属电极。
实施例1
本实施例的实施步骤如下:
11、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管为全氟磺酸管,由溶液浇铸法制成,颜色为透明,用1200目砂纸对全氟磺酸管打磨600次,进行表面粗化。
12、对粗化的固态电解质管表面的杂质进行处理;将打磨后的全氟磺酸管用稀硫酸和去离子水分别超声清洗3次(分别用稀硫酸和去离子水交错清洗),每次10min,目的是去除附着在材料表面的碎屑等易脱离杂质。在75℃的水浴下,将全氟磺酸管用过氧化氢溶液清洗3次,除去有机杂质。
13、通过化学还原工艺形成金属电极层;具体的包括:
131、将处理后的全氟磺酸管浸渍在金盐溶液(氯金酸、氰化金钾以及亚硫酸金钠等)中,24h后取出,用去离子水冲洗;
132、将上述全氟磺酸管放入270ml去离子水中,60℃水浴下(外部水浴加热),加入质量分数为5%的亚硫酸钠溶液16ml;
重复以上浸渍-还原过程5次(完成一次还原后再浸渍在金盐溶液中);用稀硫酸溶液和去离子水分别清洗1次,得到表面覆盖金属电极层的活性医疗导管。
14、切割金属电极层,形成金属电极;利用激光切割技术,在不损伤全氟磺酸电解质层的基础上,将电极层分割成四块间隔的独立的金电极。
其中,本实施例的固态电解质空心管半径约为3mm(外径),呈透明状,密度为1.64g/cm3,摩尔质量为419g/mol,离子电导率为0.8×10-4s/cm。制备好的ipmc医疗导管,其长为5cm,外径为3.2mm,导管表面镀层分布均匀,并且镀层质量较高,具有明显的金属光泽。
参见图5~10,本实施例所制备的ipmc医疗导管用扫描电子显微镜(sem)对导管表界面进行表征,采用电化学工作站(chi760d)对导管电化学性能进行表征,借助激光定位仪(keyencelk-g800)对导管电驱动变形性能进行表征。
图5为镀有金电极的固态电解质管的截面sem照片,其中金电极层厚度约19μm,经测定表面电阻为3.7ω,密度为9.4g/cm3。(固态电解质管外面包覆一层金电极层,电镜拍摄的是下边缘,因此,下层是金电极层,上层是固态电解质管层)。
图6为金属电极表面sem照片,可以看出金属镀层分布均匀,意味着电极表面导电性较好。
图7为金电极分割线截面sem照片,可看出金电极分割的同时,固态电解质层保持完整,没有损坏。(缺口是激光切割留下的,为电极分隔处,上面是金电极,下面是固态电解质管)。
图8为导管交流阻抗谱,反映导管器件各耦合单元之间的界面阻抗特性,横坐标是实部阻抗,纵坐标是虚部阻抗,通过该图可看出器件等效串联电阻较低,只有190ω,进一步验证了电极具有较小的内阻。
图9为本实施例的循环伏安曲线,曲线形状是个标准的矩形,证明其内部离子迁移过程为双电层机制,横坐标是电化学窗口,即扫描测试电压范围,纵坐标是器件对瞬时电压的电流密度响应,曲线呈矩形,则离子富集机制是双电层效应,比电容计算公式如下:
其中,sarea为曲线积分面积,v是电压扫速,δv是电化学窗口,m是金电极质量)比电容为57f/g(其中sarea/m=9.12v·a·g-1,v=0.1v·s-1,δv=0.8v)。
图10为ipmc医疗导管电化学驱动变形性能随着电刺激频率的变化图,横坐标是多步阶跃电位的频率,电压大小为1v,纵坐标是对应刺激频率下,导管的驱动位移大小。随着电压频率增加,导管位移逐渐减小,因此,可以通过控制频率大小,来控制驱动位移的大小,精度可达微米级别,最高驱动位移为20μm,证明了其精确可控的弯曲导向特性。
实施例2
本实施例的实施步骤如下:
21、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管为全氟磺酸管,由溶液浇铸法制成,颜色为透明,密度为1.27g/cm3,摩尔质量为356g/mol,离子电导率为1.2×10-4s/cm,采用等离子体刻蚀工艺对全氟磺酸管进行表面粗化。
22、对粗化的固态电解质管表面的杂质进行处理;将打磨后的全氟磺酸管用氢氧化钠溶液、氯化钠溶液和去离子水分别超声清洗1次,每次10min,目的是去除附着在材料表面的碎屑等易脱离杂质。在65℃的水浴下,将全氟磺酸管用过氧化氢溶液清洗3次,除去有机杂质。
23、通过化学还原工艺形成金属电极层;具体的包括:
231、将处理后的全氟磺酸管浸渍在银盐溶液中,24h后取出,用去离子水冲洗;
232、将上述全氟磺酸管放入300ml去离子水中,80℃水浴下,加入质量分数为5%的氯化亚铁溶液20ml;
重复以上浸渍-还原过程3次,用稀硫酸溶液和去离子水分别清洗1次,得到表面覆盖银电极的活性医疗导管。
24、切割金属电极层,形成金属电极;利用激光切割技术,在不损伤全氟磺酸电解质层的基础上,将电极分割成四块独立的银电极。
经测定,所制备的ipmc医疗导管长度为5cm,外径为3.5mm。银电极厚度为15μm,表面电阻为1.6ω,密度为7.2g/cm3,等效串联电阻为170ω,质量比电容为43f/g,驱动应变最高为52μm。
实施例3
本实施例的实施步骤如下:
31、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管是由螺杆挤出法制成的,颜色为透明,密度为1.34g/cm3,摩尔质量为407g/mol,离子电导率为1.1×10-4s/cm,用600目砂纸对聚偏氟乙烯管打磨300次,进行表面粗化。
32、对粗化的固态电解质管表面的杂质进行处理;将打磨后的聚偏氟乙烯管用氯化钠和去离子水分别超声清洗3次,每次5min,目的是去除附着在材料表面的碎屑等易脱离杂质。在75℃的水浴下,将全氟磺酸管用去离子水和过氧化氢溶液分别清洗1次,除去有机杂质。
33、通过磁控溅射工艺形成金属电极层;采用磁控溅射工艺镀金电极,镀金完毕,用稀硫酸溶液和去离子水分别清洗3次,得到表面覆盖金电极的活性医疗导管。
34、切割金属电极层,形成金属电极;利用激光切割技术,在不损伤全氟磺酸电解质层的基础上,将电极分割成四块独立的电极。
经测定,所制备的ipmc活性医疗导管长度为6cm,外径为4.5mm。电极厚度为25μm,表面电阻为0.4ω,密度为10.7g/cm3,等效串联电阻为120ω,质量比电容为84f/g,驱动应变最高为94μm。
实施例4
本实施例的实施步骤如下:
41、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管是由螺杆挤出法制成的,颜色为淡黄色,密度为1.82g/cm3,摩尔质量为426g/mol,离子电导率为1.5×10-4s/cm,用1200目砂纸对聚偏氟乙烯管打磨600次,进行表面粗化。
42、对粗化的固态电解质管表面的杂质进行处理;将打磨后的全氟磺酸管用稀硫酸和氯化钠溶液分别超声清洗3次,每次10min,目的是去除附着在材料表面的碎屑等易脱离杂质。在95℃的水浴下,将聚偏氟乙烯管用过氧化氢溶液清洗3次,除去有机杂质。
43、通过化学还原工艺形成金属电极层;具体的包括:
431、将处理后的聚偏氟乙烯管浸渍在金盐溶液中,24h后取出,用去离子水冲洗;
432、将上述聚偏氟乙烯管放入270ml去离子水中,60℃水浴下,加入质量分数为5%的亚硫酸钠溶液16ml。
重复以上浸渍-还原过程5次。用稀硫酸溶液和去离子水分别清洗1次,得到表面覆盖金电极的活性医疗导管。
44、切割金属电极层,形成金属电极;利用车削工艺,在不损伤电解质层的基础上,将电极分割成四块独立的电极。
经测定,所制备的ipmc活性医疗导管长度为7cm,外径为5mm。电极厚度为32μm,表面电阻为1.2ω,密度为11.7g/cm3,等效串联电阻为130ω,质量比电容为76f/g,驱动应变最高为87μm。
实施例5
本实施例的实施步骤如下:
51、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管是由螺杆挤出法制成的,颜色为淡黄色,密度为2.92g/cm3,摩尔质量为554g/mol,离子电导率为0.9×10-4s/cm,采用等离子体刻蚀工艺对聚偏氟乙烯管进行表面粗化。
52、对粗化的固态电解质管表面的杂质进行处理;将打磨后的聚偏氟乙烯管用氢氧化钠和去离子水分别超声清洗3次,每次5min,目的是去除附着在材料表面的碎屑等易脱离杂质。在75℃的水浴下,将聚偏氟乙烯管用过氧化氢溶液清洗3次,除去有机杂质。
53、通过化学还原工艺形成金属电极层;具体的包括:
531、将处理后的全氟磺酸管浸渍在铜盐溶液中,24h后取出,用去离子水冲洗;
532、将上述聚偏氟乙烯管放入270ml去离子水中,60℃水浴下,加入质量分数为5%的亚硫酸铁溶液16ml;
重复以上浸渍-还原过程6次;用氢氧化钠溶液和去离子水分别清洗1次,得到表面覆盖铜电极的活性医疗导管。
54、切割金属电极层,形成金属电极;利用车削技术,在不损伤固态电解质层的基础上,将电极分割成四块独立的电极。
经测定,所制备的ipmc活性医疗导管长度为4cm,外径为3.5mm。电极厚度为20μm,表面电阻为3.8ω,密度为7.3g/cm3,等效串联电阻为200ω,质量比电容为60f/g,驱动应变最高为39μm。
实施例6
本实施例的实施步骤如下:
61、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管是由溶液浇铸法制成的,颜色为透明,密度为1.89g/cm3,摩尔质量为443g/mol,离子电导率为1.09×10-4s/cm,采用等离子体刻蚀工艺对全氟磺酸管进行表面粗化。
62、对粗化的固态电解质管表面的杂质进行处理;将打磨后的全氟磺酸管用稀硫酸、氯化钠溶液和去离子水分别超声清洗1次,每次10min,目的是去除附着在材料表面的碎屑等易脱离杂质。在95℃的水浴下,将全氟磺酸管用过氧化氢溶液以及去离子水分别清洗3次,除去有机杂质。
63、通过磁控溅射工艺形成金属电极层;采用磁控溅射工艺镀铜电极,镀铜完毕,用过氧化氢溶液、稀硫酸溶液和去离子水分别清洗2次,得到表面覆盖铜电极的活性医疗导管。
64、切割金属电极层,形成金属电极;利用激光切割技术,在不损伤全氟磺酸电解质层的基础上,将电极分割成四块独立的电极。
经测定,所制备的ipmc活性医疗导管长度为6cm,外径为3mm。电极厚度为26μm,表面电阻为1.2ω,密度为8.9g/cm3,等效串联电阻为130ω,质量比电容为79f/g,驱动应变最高为97μm。
实施例7
本实施例的实施步骤如下:
71、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管是由螺杆挤出法制成的,颜色为透明,密度为1.84g/cm3,摩尔质量为433g/mol,离子电导率为1.21×10-4s/cm,采用等离子体刻蚀工艺对全氟磺酸管进行表面粗化。
72、对粗化的固态电解质管表面的杂质进行处理;打磨后的全氟磺酸管用稀硫酸、氯化钠溶液和去离子水分别超声清洗1次,每次10min,目的是去除附着在材料表面的碎屑等易脱离杂质。在95℃的水浴下,将全氟磺酸管用过氧化氢溶液以及去离子水分别清洗3次,除去有机杂质。
73、通过磁控溅射工艺形成金属电极层;采用磁控溅射工艺镀铜电极,镀铜完毕,用过氧化氢溶液、稀硫酸溶液和去离子水分别清洗2次,得到表面覆盖铜电极的活性医疗导管。
74、切割金属电极层,形成金属电极;利用激光切割技术,在不损伤全氟磺酸电解质层的基础上,将电极分割成四块独立的电极。
经测定,所制备的ipmc活性医疗导管长度为6cm,外径为3mm。电极厚度为0.8μm,表面电阻为2kω,密度为5.3g/cm3,等效串联电阻为1.4kω,质量比电容为8.4f/g,驱动应变最高为4μm。
实施例8
本实施例的实施步骤如下:
81、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管是由螺杆挤出法制成的,颜色为透明,密度为1.71g/cm3,摩尔质量为421g/mol,离子电导率为1.15×10-4s/cm,采用等离子体刻蚀工艺对全氟磺酸管进行表面粗化。
82、对粗化的固态电解质管表面的杂质进行处理;将打磨后的全氟磺酸管用稀硫酸、氯化钠溶液和去离子水分别超声清洗1次,每次10min,目的是去除附着在材料表面的碎屑等易脱离杂质。在95℃的水浴下,将全氟磺酸管用过氧化氢溶液以及去离子水分别清洗3次,除去有机杂质。
83、通过磁控溅射工艺形成金属电极层;采用磁控溅射工艺镀铜电极,镀铜完毕,用过氧化氢溶液、稀硫酸溶液和去离子水分别清洗2次,得到表面覆盖铜电极的活性医疗导管。
84、切割金属电极层,形成金属电极;利用激光切割技术,在不损伤全氟磺酸电解质层的基础上,将电极分割成四块独立的电极。
经测定,所制备的ipmc活性医疗导管长度为5cm,外径为3mm。电极厚度为60μm,表面电阻为0.1ω,密度为38.9g/cm3,等效串联电阻为30ω,质量比电容为92f/g,驱动应变最高为2μm。
实施例9
本实施例的实施步骤如下:
91、取固态电解质并对其表面进行粗化;其中本实施例的固态电解质管是由溶液浇铸法制成的,颜色为透明,密度为4.27g/cm3,摩尔质量为963g/mol,离子电导率为1.33×10-4s/cm,采用等离子体刻蚀工艺对全氟磺酸管进行表面粗化。
92、对粗化的固态电解质管表面的杂质进行处理;将打磨后的全氟磺酸管用稀硫酸、氯化钠溶液和去离子水分别超声清洗3次,每次10min,目的是去除附着在材料表面的碎屑等易脱离杂质。在95℃的水浴下,将全氟磺酸管用过氧化氢溶液以及去离子水分别清洗2次,除去有机杂质。
93、通过磁控溅射工艺形成金属电极层;采用磁控溅射工艺镀金电极,镀金完毕,用过氧化氢溶液、稀硫酸溶液和去离子水分别清洗3次,得到表面覆盖金电极的活性医疗导管。
94、切割金属电极层,形成金属电极;利用激光切割技术,在不损伤全氟磺酸电解质层的基础上,将电极分割成四块独立的电极。
经测定,所制备的ipmc活性医疗导管长度为6cm,外径为3mm。电极厚度为18μm,表面电阻为4ω,密度为5.3g/cm3,等效串联电阻为80ω,质量比电容为87f/g,驱动应变最高为6μm。
本发明的ipmc医疗导管及其制备方法,通过在固态电解质管表面设置偶数个金属电极,金属电极在外低电压作用下,依靠活性离子在电极材料中的可逆脱嵌,实现可逆的驱动响应形变,使ipmc医疗导管具有主动弯曲和导向特性,且其结构简单,便于操作;另外,由于多个金属电极均匀间隔设于固态电解质管表面,使得ipmc活性医疗导管表现出精确可控的多运动自由度弯曲导向特性,且其与生物相容性良好,因此在作为介入医疗器械时,以人体血管为运行通道,实现更精确、更高效的微创介入定位技术,在介入微创手术领域具有十分广阔的应用前景;同时由于制备工艺简单,成本低,有望实现产业化。
虽然已经参照特定实施例示出并描述了本发明,但是本领域的技术人员将理解,在不脱离由权利要求及其等同物限定的本发明的精神和范围的情况下,可在此进行形式和细节上的各种变化。
- 还没有人留言评论。精彩留言会获得点赞!