用于上调抗原表达的方法与流程
本发明的技术领域
本发明涉及放射免疫偶联物,其能够上调一种或多种抗原的表达。该上调的抗原可以是由所述放射免疫偶联物靶向的抗原或者是在相同的细胞上表达的不同抗原。
本发明的背景
单克隆抗体治疗(mat)的使用已是引起极大的兴趣和较强的科研努力的领域。为了有效,mat取决于每个细胞的足够数目的抗原,细胞的抗原可以结合用于触发响应(sugimoto等人,2009,czuczman等人,2008)。
放射免疫治疗(rit)的使用已被批准为癌症治疗中的治疗选择(stevens等人,2012)。如今放射免疫治疗主要用于经历从化疗和/或mat复发的那些患者(stevens等人,2012)。
从文献中已知,高剂量率外束照射可导致b细胞中cd20的增加,而且该响应受到如抗坏血酸、peg-过氧化氢酶等等的抗氧化剂的抑制并且通过例如h2o2和丁硫氨酸亚砜胺的氧化剂增强(kunala等人,2001;gupta等人,2008)。值得注意的是,在外束曝光后该效果仅持续约48h。
但是,未知的是低剂量率放射免疫治疗是否可上调抗原表达。事实上,
此外,单克隆抗体治疗可引起肿瘤细胞上的抗原表达减少(musto等人,2011)以及与化疗联合的抗体减少(hiraga等人,2009)。
因此,在该领域已知的是外束高剂量率照射可引起抗原表达增加以及放射免疫治疗和单克隆抗体治疗可引起癌细胞中抗原表达减少。
施用放射免疫治疗作为还原治疗(例如,利妥昔单抗(抗体))的目前标准是作为调理治疗在zevalin(放射免疫偶联物)之前给予。
这种方法的一个问题是实验工作和临床数据已经表明,抗体治疗可引起抗原漂移,即朝向具有低抗原表达的细胞的选择压力,这成为治疗抗性(musto和d’auria,2011)。这也已在实验rit中表明(
因此,可导致相反效应,即,经处理的细胞上的抗原增加的针对性的治疗选择将是一种非常有价值的治疗工具。
发明概述
本发明涉及放射免疫偶联物,其能够上调一种或多种抗原的表达。上调的抗原可以是由放射免疫偶联物靶向的抗原,在相同的细胞上表达的不同抗原,或二者的组合。
该表达允许靶向和特异性抑制癌细胞和免疫系统的细胞。
因此,本发明的一个方面涉及包含单克隆抗体,可选的连接子和放射性核素的放射免疫偶联物,所述放射免疫偶联物用于上调一种或多种抗原的抗原表达。
本发明的一个实施方案中,被上调的所述一种或多种抗原是在b细胞癌细胞的表面上表达的抗原。
本发明的另一个实施方案中,在患有癌症的患者中在免疫治疗或免疫偶联物治疗之前进行上调。
本发明的另一个实施方案中,患者患有b细胞恶性肿瘤,其选自非霍奇金淋巴瘤和慢性淋巴细胞白血病。
本发明的又一个实施方案中,放射性标记的是单克隆抗体hh1。
本发明的一个实施方案中,连接子是选自p-scn-bn-dota、dota-nhs-酯、p-scn-bn-dtpa和chx-a”-dtpa的螯合连接子。
本发明的另一个实施方案中,放射性核素选自47sc、67cu、90y、105rh、117msn、131i、149tb、153sm、161tb、165dy、177lu、186re、188re、211at、212pb、212bi、213bi、223ra、224ra、225ac和227th。
本发明的进一步实施方案中,上调的抗原选自cd37,cd19,cd20,cd21,cd22,hla-dr,cd23,cd39,cd52,cdw75和cd80。
本发明的又一个实施方案中,所述放射免疫偶联物被配制成药物组合物。
本发明的另一个实施方案中,所述药物组合物包括一种或多种药学上可接受的载体或佐剂。
本发明的进一步的实施方案中,用途是组合治疗,其中在放射免疫偶联物之后是用抗体治疗、免疫偶联物治疗或它们的组合的同时或后处理。
本发明的另一个实施方案中,上调的抗原是cd20,以及上调之后是以单次施用或重复施用模式使用利妥昔单抗的抗cd20抗体治疗。
本发明的又一个实施方案中,所述同时或后处理是靶向不同于放射免疫偶联物的抗原。
本发明的另一个方面涉及上调抗原表达的方法,其包括对其中上调抗原表达将是有利的患者施用放射免疫偶联物。
本发明的一个实施方案中,患者患有b细胞恶性肿瘤。
本发明的另一个实施方案中,用途是组合治疗,其中在放射免疫偶联物之后是用抗体治疗、免疫偶联物治疗或它们的组合的同时或后处理。
在另一个实施方案中,重复进行放射免疫治疗和免疫治疗或免疫偶联物治疗几个周期。
在另一个实施方案中,以低剂量给予放射免疫治疗,这本身在肿瘤中具有低细胞杀伤效果,但具有显著的抗原上调。
附图的简要说明
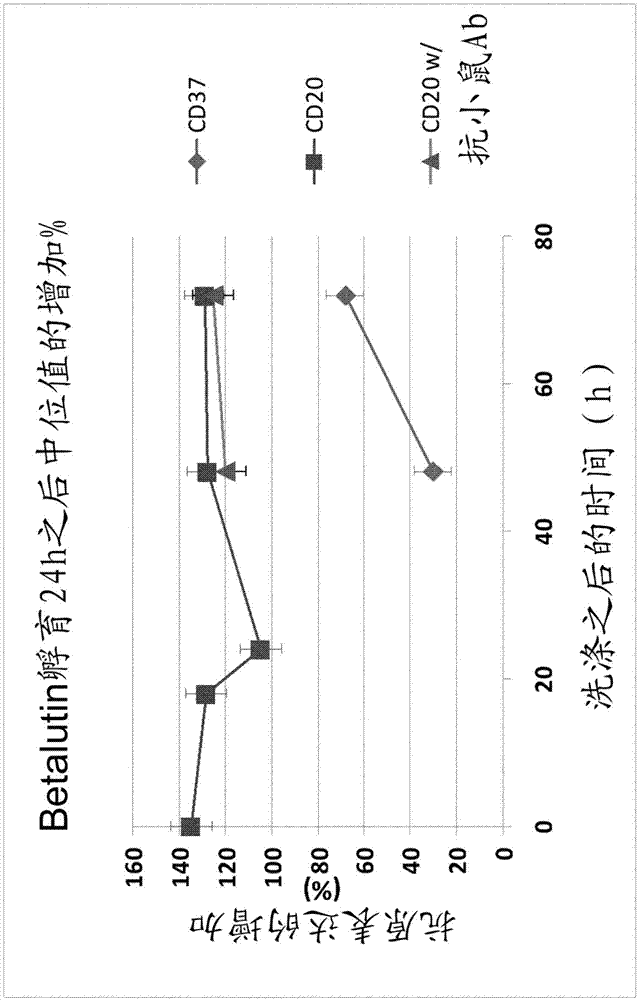
图1显示如通过流式细胞术所测定的用betalutin孵育24h后daudi细胞的cd20和cd37表达增加(t=0表示在去除betalutin之后加入新鲜培养基时)。
图2显示如通过流式细胞术所测定的用177lu-tetulomab(betalutin)孵育daudi细胞1h和24h期间cd37和cd20的上调。
图3(表1)显示如通过流式细胞术所测定的用177lu-tetulomab(betalutin)孵育1h之后抗原表达增加。
图4(表2)显示如通过流式细胞术所测定的对于用177lu-利妥昔单抗(betalutin)处理的细胞,cd20和cd37的上调。
图5(表3)显示如通过细胞结合测定法所测定的在加入betalutin或对照之后4天/8天/11天/15天,125i-利妥昔单抗与放射免疫治疗之后的肿瘤细胞的结合相对于对照的%增加。
图6示出注射125i-利妥昔单抗3天后125i-利妥昔单抗的生物分布。用350mbq/kgbetalutin(处理)或冷hh1(对照)提早5天注射老鼠。
本发明现在将更加详细地描述如下。
本发明的详细描述
本发明人惊讶地发现,当用低剂量率β发射177lu标记hh1抗体(也称为177lu-tetulomab或betalutin)对b细胞相关的抗原cd37进行实验时,由此处理的细胞将上调cd37和cd20(另一个b细胞相关的抗原)的表达。
因此,它表明用177lu-hh1治疗可以改善mat在如癌症和自身免疫性疾病的b细胞疾病中的情况。
这也是意外的发现,对cd37抗原阳性细胞使用177lu-hh-1的低剂量率放射免疫治疗不仅造成癌细胞中抗原表达的增加,并且与外束曝光的公开数据相比也造成了延长效应。
放射免疫治疗导致cd37和cd20抗原的表达增加。这暗示,使用例如177lu-hh-1的放射免疫治疗可以用作对抗体治疗的引导治疗,由于抗体治疗在很大程度上取决于抗原的良好表达。
另一个值得注意的发现是,对比于在外束曝光后上调抗原表达将持续仅约两天,在暴露于放射免疫治疗后上调抗原表达将持续一周到两周之间。
可以设想使用有针对性的抗体治疗的新方法,即,使用放射免疫治疗的诱导治疗,之后是在接下来的几天和几周内的抗体或抗体偶联物治疗以利用增加的抗原表达。
因此,本发明涉及放射免疫偶联物,其能够上调一种或多种抗原的表达。上调的抗原可以是由放射免疫偶联物靶向的抗原,在相同的细胞上表达的不同抗原,或二者的组合。
该表达允许靶向和特异性抑制癌细胞和免疫系统的细胞。
放射免疫偶联物的用途
本发明的一个方面涉及包含单克隆抗体,可选的连接子和放射性核素的放射免疫偶联物,所述放射免疫偶联物用于上调一种或多种抗原的抗原表达。
本发明的一个实施方案中,被上调的所述一种或多种抗原是在b细胞癌细胞的表面上表达的抗原。
本发明的另一个实施方案中,本发明的放射免疫偶联物将下调免疫系统的细胞。
免疫系统的这种细胞可能患病,例如患有自身免疫性疾病。
本发明的另一实施方案中,在患有癌症或疾病的患者中在免疫治疗或免疫偶联物治疗之前进行上调。
本发明的另一个实施方案中,所述患者患有b细胞恶性肿瘤,其选自非霍奇金淋巴瘤、急性淋巴细胞白血病和慢性淋巴细胞白血病。
本发明的一个实施方案中,所述患者患有非霍奇金淋巴瘤的b细胞恶性肿瘤。
本发明的一个实施方案中,所述患者患有急性淋巴细胞白血病的b细胞恶性肿瘤。
本发明的一个实施方案中,所述患者患有慢性淋巴细胞白血病的b细胞恶性肿瘤。
在另一个实施方案中,以低剂量给予放射免疫治疗,这本身对肿瘤具有低细胞杀伤效果,但具有显著的抗原上调。
在本文中,术语“上调”定义为抗原在蛋白质水平或mrna水平的显著更高的表达。
本发明人已经令人惊奇地表明,使用177lu标记的hh1抗体的b细胞恶性肿瘤的预处理能够上调利妥昔单抗靶标cd20。
因此,本发明的一个方面涉及使用177lu标记的hh1抗体,之后使用利妥昔单抗组合治疗b细胞恶性肿瘤的用途。
本发明的优选实施方案涉及177lu标记的hh1抗体然后是利妥昔单抗在治疗b细胞恶性肿瘤中的用途。
可以优化施用177lu标记的hh1抗体和利妥昔单抗之间的该窗口以产生对cd20的最大上调。所述窗口典型地为至少一天,3-5天或3-10天。
该窗口也可以是施用放射免疫治疗之后的0-30天,更优选3-15天。在长时间循环抗体的情况下,甚至可以考虑共同或预先处理,只要当抗原上调发生时抗体以大量浓度存在于血液中。
在本发明的范围内,所述放射免疫治疗与针对cd37或与血液癌症相关的其他抗原的的其他放射标记抗体,例如,放射性标记的抗cd20抗体,包括替伊莫单抗,托西莫单抗,利妥昔单抗,奥法木单抗,维妥珠单抗和帕考珠单抗(ocrelizumab),或放射性标记的cd19,cd21,cd22,hla-dr,cd23,cd39,cd52,cdw75或cd80抗体,包括博纳吐单抗(blinatumomab)和依帕珠单抗,一起使用。
所使用的放射性核素的实例可以是47sc、67cu、90y、105rh、117msn、131i、149tb、153sm、161tb、165dy、177lu、186re、188re、211at、212pb、212bi、213bi、223ra、224ra、225ac和227th,其可以用螯合连接子偶联到抗体或通过与蛋白中的基团的亲电或亲核反应偶联到抗体。
放射免疫偶联物
放射免疫偶联物可以是能够结合到或靶向感兴趣的抗原的任何物质。
放射免疫偶联物包括但不限于泽娃灵(zevalin),百克沙(bexxar)和betalutin。
在本文中,betalutin也称为177lu-hh1,177lu-hh-1,177lu-tetulomab或177lu-tetraxetan-tetulomab。
本发明的另一个实施方案中,所述一种或多种抗体或放射免疫偶联物将靶向cd20。
抗体包括但不限于利妥昔单抗,维妥珠单抗,奥法木单抗,阿夫土珠(afutuzumab),托西莫单抗,reditux和替伊莫单抗。
本发明的另一个实施方案中,所述一种或多种抗体或放射免疫偶联物将靶向cd37。
本发明的一个优选的实施方案中,cd37放射免疫偶联物为betalutin。
抗体
本发明的抗体可以是能够靶向任何下面讨论的抗原的任何单克隆抗体。
抗体包括但不限于利妥昔单抗,依帕珠单抗,l19,f8,f16,galiximab,托利珠单抗,阿仑单抗,奥法木单抗,维妥珠单抗,阿夫土珠,托西莫单抗,reditux,替伊莫单抗,k7153a,37.1和hh1。
本发明的一个实施方案中,单克隆抗体是hh1(即tetulomab)。
本发明的一个实施方案中,单克隆抗体是利妥昔单抗。
hh1的特定变体在pct/ib2012/057230和pct/ep2011/051231中公开,其在此通过引用并入并公开为包括在本发明中的具体实施方案。
因此,将有可能基于上述公开内容调整包括在本发明的放射免疫偶联物中的hh1变体。
这样的变体包括嵌合变体或与hh1的链具有一定的序列同一性的变体。
本发明的优选实施方案中,所述变体是嵌合hh1或人源化hh1。
本发明的另一个实施方案中,hh1的嵌合变体是chhh1.1,其是嵌合的hh1同种型igg1,或chhh1.3h,其是具有r435h突变的嵌合的hh1同种型igg3。
本发明的另一个实施方案中,所述单克隆抗体是利妥昔单抗。
连接子
放射性核素可以通过可选的连接子连接到抗体。
例如,带碘的放射免疫偶联物不需要连接子。这意味着,125i-hh1不需要包含连接子。
放射性核素可以通过以下连接至抗体:首先使双功能螯合剂,例如,p-scn-bn-dota(macrocyclics,tx,美国)与抗体反应,然后纯化以除去未偶联的螯合剂,然后使螯合剂抗体偶联物与放射性核素反应,接着纯化以除去任何未偶联的放射性核素。
可替代地,螯合剂和放射性核素可以先组合,并随后与抗体偶联。
螯合连接子,例如,p-scn-bn-dota可用于以对于177lu说明的类似方式将其他金属放射性核素偶联至hh1。
也可以使用具有足够的络合能力和允许直接或间接偶联到蛋白质或肽的官能团的任何类型的连接子。
这些连接子的实例描述在文献中(例如brechbiel,2008;liu,2008)。一些有用的实例是双功能环状螯合剂,如p-scn-bn-dota,dota-nhs-酯;双功能线性螯合剂,如p-scn-bn-dtpa和chx-a”-dtpa。
本发明中的放射性核素将优选通过使用双功能螯合剂偶联至靶分子。
这些可以是环状,线性或支链的螯合剂。可以特别提及聚氨基聚酸螯合剂,其包含线性,环状或支链聚氮杂烷主链,其具有连接在主链氮上的酸性(如羧基烷基)基团。
合适的螯合剂的实例包括dota衍生物,如对异硫氰酸苄基-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(p-scn-bz-dota)和dtpa衍生物,如对异硫氰酸基苄基-二乙烯三胺五乙酸(p-scn-bz-dtpa),第一个是环状螯合剂,后者是线性螯合剂。
可以在络合部分偶联到目标部分之前或之后实施络合部分的金属化。
如果在放射性标记发生之前将螯合剂偶联到抗体,就所使用的时间等而言放射性标记过程一般将更便捷。
使用与抗体附接的鳌合剂来制备经过放射性标记的偶联物的原理在(例如)liu,2008中有更为全面的描述。
因此,可以使用hh1来制备各种放射免疫偶联物,这些放射免疫偶联物具有不同的辐射特性和有效半衰期。
因此,本发明的一个实施方案中,所述连接子是选自p-scn-bn-dota,dota-nhs-酯,p-scn-bn-dtpa和chx-a”-dtpa的螯合连接子。
具有金属特性的发射β和/或α粒子的放射性核素允许络合至双功能螯合连接子,以下通过举例说明所述双功能螯合连接子但不限于此:bn-tcmc、dota、bn-dota、bn-nota、bn-oxo-do3a、dtpa、chx-a-dtpa、bn-dtpa、bn-pcta,以及来自杯芳烃、穴状化合物和穴状配体等类别的分子。
因此,该连接子可以是双功能鳌合连接子。
在本发明的一个实施方案中,连接子是螯合连接子。
放射性核素
如上所述,可能构建具有不同的辐射特性和有效半衰期的放射免疫偶联物。
构建这样的放射免疫偶联物的自然部分是放射性核素的选择。
在本发明的一个优选实施方案中,放射性核素是金属放射性核素。
在本发明的进一步的实施方案中,放射性核素是α粒子发射体。
α粒子发射体可以选自212bi、213bi、225ac、227th。
在本发明的进一步实施方案中,放射性核素是β粒子发射体。
所述β粒子发射体可以选自90y、153sm、161tb、177lu。
在本发明的另一个实施方案中,放射性核素选自47sc、67cu、90y、105rh、117msn、131i、149tb、153sm、161tb、165dy、177lu、186re、188re、211at、212pb、212bi、213bi、223ra、224ra、225ac和227th。
在本发明的又一个实施方案中,放射性核素的半衰期小于24h且放射性核素选自211at、212pb、212bi、213bi。
本发明的另一个实施方案中,放射性核素的半衰期超过24h且放射性核素选自47sc、67cu、90y、105rh、117msn、131i、149tb、153sm、161tb、165dy、177lu、186re、188re、223ra、224ra、225ac和227th。
抗原
本发明的抗原是可以由本发明的放射免疫偶联物上调的抗原。
这种上调也可以看作是该抗原的表达的增加或诱导。上调或增加可由本领域技术人员通过包括蛋白质印迹和facs的已知的常规技术测定。
上调的抗原可能是单个但它也可以是几个。
例如能够通过本发明的放射免疫偶联物上调cd20和cd37两者。
因此,在本发明的一个实施方案中,上调的抗原选自cd37,cd19,cd20,cd21,cd22,hla-dr,cd23,cd39,cd52,cdw75和cd80。
本发明的进一步的实施方案中,上调的抗原是cd37。
本发明的又一个实施方案中,上调的抗原是cd20。
本发明的另一个实施方案中,上调的抗原是cd22。
由放射免疫治疗上调或可以潜在地上调的b细胞抗原包括cd19,cd20,cd22,cd37和cd52。
因此,本发明的进一步的实施方案中,所述抗原选自cd19,cd20,cd22,cd37和cd52。
本发明的又一个实施方案中,b细胞特异性抗原选自cd19,cd20,cd22,cd37。
本发明的进一步的实施方案中,cd20和cd37两者均由本发明的放射免疫偶联物上调。
本发明的另一个实施方案中,cd22和cd37两者均由本发明的放射免疫偶联物上调。
本发明的另一个实施方案中,cd52和cd37两者均由本发明的放射免疫偶联物上调。
本发明的另一个实施方案中,cd19和cd37均由本发明的放射免疫偶联物上调。
所述抗原还可以是特异于自身免疫性疾病或病症的抗原。
当抗原特异于自身免疫性疾病时,所述抗原被下调,因此具有治疗例如炎症的潜能。
这种抗原的实例是tnf-α,il-2或免疫球蛋白e。
本发明的另一个实施方案中,所述疾病是多发性骨髓瘤,并且抗原选自cd38、cd138、bcma、cd317、cs1、cd40、blys、cd56、cd52、kma、grp78、baff、cxcr4和lma。
参与多发性骨髓瘤治疗或正在开发用于多发性骨髓瘤治疗的抗体可以选自地诺单抗(denosumab)、埃罗妥珠单抗(elotuzumab)、daratumumab、milatuzumab、鲁卡木单抗(lucatumumab)、mdx-1097、pat-sm6、tabalumab、ulocuplumab和mdx-1458。
用于治疗多发性骨髓瘤的抗体药物偶联物可以选自bt062、milatuzumab-dox、lorvotuzumab-美登素(mertansine)。
参与多发性骨髓瘤患者的溶骨性骨疾病的抗体可以选自抗-dkk-1抗体bhq-880,其促进形成骨的成骨细胞的活性。
抗rankl抗体地诺单抗减少分解骨组织的破骨细胞的活性。
因此,本发明的一个实施方案中,抗体是地诺单抗且疾病是骨质疏松症。
血管生成抗原vegf可以是抗vegf抗体贝伐单抗(bevacizumab),其防止癌细胞中的新血管生长。
因此,本发明的一个实施方案针对癌细胞中的血管生成,抗原是vegf且抗体是贝伐单抗。
在本发明的范围内,使用针对抗上述骨髓瘤抗原之一的放射性标记的抗体以诱导抗原上调。
药物组合物
抗体通常配制在药物组合物中应用于治疗疾病。
优化此类组合物的参数诸如生理耐受性和保质期。
因此,本发明的一个实施方案中,所述放射免疫偶联物被配制成药物组合物。
本发明的一个实施方案涉及如上所述的一种药物组合物,其还包含一种或多种另外的治疗剂。
本发明的另一个实施方案中,所述一种或多种另外的治疗剂选自诱导细胞凋亡的试剂。
缓冲液通常是药物组合物的重要部分,其在相当大的程度上保持放射免疫偶联物的化学完整性且对于输注入患者而言是生理上可接受的。
在本发明一个实施方案中,药物组合物包含一种或多种药学上可接受的载体和/或佐剂。
可接受的药物载体包括但不限于无毒缓冲剂,填充剂,等渗溶液等。更具体地,所述药物载体可以是但不限于生理盐水(0.9%),半生理盐水,林格氏乳酸盐,5%葡萄糖,3.3%葡萄糖/0.3%盐水。生理学上可接受的载体可含有辐射分解的稳定剂,例如抗坏血酸,其在储存和运输过程中保护该放射性药物的完整性。
本发明的一个实施方案包括本发明的药物组合物和一种或多种另外的抗体或放射免疫偶联物。
治疗方法
根据本发明的放射免疫偶联物的治疗用途可以是如本文所述的针对表达抗原的恶性细胞的治疗,包括但不限于从b细胞非霍奇金淋巴瘤、b细胞慢性淋巴细胞白血病,毛细胞白血病,淋巴浆细胞淋巴瘤,急性淋巴细胞白血病和多发性骨髓瘤选择的b细胞恶性肿瘤。
其它用途可能是治疗自身免疫性疾病和治疗移植相关效应。
因此,本发明的一个方面涉及上调抗原表达的方法,其包括对其中上调抗原表达将是有利的患者施用放射免疫偶联物。
本发明的一个实施方案涉及治疗b细胞恶性肿瘤或免疫系统的病症或疾病的方法,所述疾病或病症中cd20是靶标且放射免疫偶联物能够上调cd20抗原表达。
本发明的一个优选的实施方案中,所述放射免疫偶联物是betalutin,能够上调cd20抗原表达且cd20由利妥昔单抗或其变体靶向。
本发明的一个方面涉及使用betalutin,接着使用利妥昔单抗,obinutuzumab或类似的cd20治疗性抗体对b细胞恶性肿瘤或免疫系统的疾病或病症进行组合治疗。
在本发明的一个实施方案中,患者患有b细胞恶性肿瘤或免疫系统的疾病或病症。
本发明的另一个实施方案中,使用组合治疗,其中放射免疫偶联物之后是抗体治疗,免疫偶联物治疗或它们的组合的同时或后处理。
所述治疗可以作为单一治疗或与其他治疗组合施用,所述其他治疗优选标准治疗。这种其他治疗可以是预处理、外科手术、化疗(包括阿霉素、长春碱和吉西他滨)、免疫治疗、抗体治疗、光动力治疗、蛋白酶体抑制剂(包括硼替佐米)、组蛋白脱乙酰酶抑制剂(包括伏立诺他和辛二酰苯胺异羟肟酸)、维生素d3和维生素d3类似物、细胞周期检查点抑制剂(包括ucn-01和2-(4-(4-氯苯氧基)苯基)-1h-苯并咪唑-5-甲酰胺)、低氧细胞放射增敏剂(包括甲硝唑和米索硝唑)、细胞凋亡诱导剂(包括醉茄素a)放射增敏剂、放射免疫治疗或这些的两种或更多种的组合。
施用是指静脉内输注或静脉内注射。更具体地,本发明的放射免疫偶联物可通过与防止空气栓塞和允许估计的流量进入患者的滴注器连接的外围插管在静脉中直接施用。
在一个实施方案中,放射免疫偶联物可以以重复的方式施用。
在另一个实施方案中,放射免疫偶联物,接着是单克隆抗体(或免疫偶联物)都可以以重复的方式施用。
在本发明的另一个实施方案中,放射免疫偶联物可以以重复的方式但与不同的放射性核素一起施用,例如,β-放射免疫治疗之后可以是α-放射免疫治疗,反之亦然。
本发明的一个方面涉及使用本发明的放射免疫偶联物治疗b-细胞恶性肿瘤。
本发明的一个实施方案涉及与其他治疗组合或者除了其他治疗之外施用的本发明的放射免疫偶联物的用途。
在本发明一个实施方案中,其它治疗选自预处理、化学治疗、单克隆抗体治疗、外科手术、放射治疗和/或光动力治疗。
在本发明的另一个实施方案中,其它治疗是骨髓移植或干细胞移植和/或治疗。
在本发明的一个实施方案中,抗体剂量是每名患者1-1000mg,更优选每名患者5-50mg,以及177lu达1-200mbq/kg,更优选10-100mbq/kg体重。
组合治疗
如上所述,放射免疫偶联物可以与其它类型的治疗组合使用。
因此,本发明的进一步的实施方案中,使用组合治疗,其中放射免疫偶联物之后是抗体治疗,免疫偶联物治疗或它们的组合的同时或后处理。
本发明的另一个实施方案中,上调的抗原是cd20,以及上调之后是以单次施用或重复施用模式使用利妥昔单抗的抗cd20抗体治疗。
因此,有可能使用本发明的放射免疫偶联物上调除了放射免疫偶联物靶向的抗原之外的其他抗原。
因此,在本发明的又一个实施方案中,同时或后处理针对与放射免疫偶联物不同的抗原。
施用模式可以是单次施用,其中放射免疫偶联物上调一种或多种抗原的表达,然后单个剂量或几个剂量的抗原特异性治疗靶向所述一种或多种抗原。
取决于针对的抗原,这种治疗可以是单克隆抗体,如利妥昔单抗或hh1。
该治疗可以以循环模式重复,其中放射免疫偶联物和单克隆抗体的施用重复一次,两次或多次。
这种施用的一个优点是,靶细胞可以在每个周期中被相同或不同的抗体处理,以确保聚焦具有最高表达的抗原。
其中聚焦多种抗原的策略限制了在靶细胞的表面上表达的抗原的表达漂移的风险。
应当指出的是,在本发明的一个方面的上下文中描述的实施方案和特征也适用于本发明的其他方面。
在本申请中引用的所有专利和非专利参考文献,在此通过引用整体并入本文。
现在将在以下非限制性实施例中进一步详细地说明本发明。
实施例
实施例1-用betalutin(177lu-tetraxetan-tetulomab或177lu-hh1)处理以及对抗原表达的影响
材料与方法:
标记抗体
根据dahle等人(2013)和repetto-llamazares等人(2013)中描述的标准程序实施用p-scn-bn-dota和177lu标记抗体hh-1。使用瞬时薄层色谱法评价放射免疫偶联物(ric)的放射化学纯度(rcp)。如果rcp低于95%,则使用econo-pac10dg柱(bio-rad实验室,加利福尼亚州,美国)纯化偶联物。实验中使用的所有ric的rcp均高于97%。betalutin的比活度是92mbq/kg并且抗体浓度是178μg/ml。用ramos和daudi淋巴瘤细胞和单点法估计ric的免疫反应性部分(irf)。使用7500万个细胞/ml的细胞浓度。用冷tetulomab孵育的细胞被用来评估非特异性结合。用40ng/ml的放射免疫偶联物孵育封闭和未封闭的细胞1.5h。使用校准的伽马射线探测器(cobraii自动伽马探测器,帕卡德仪器公司,梅里登,ct,usa)测定所增加的活性。随后,用pbs以及0.5%bsa洗涤细胞三次并在γ计数器中测定结合活性。通过从非封闭样品的结合活性减去使用封闭样品测定的非特异性结合来估计irf。在daudi细胞中irf为52+/-3而在ramos细胞中为75+/-1。
根据制造商提供的程序使用相应的alexafluor蛋白标记试剂盒(molecularprobes,lifetechnologies)用alexa647标记利妥昔单抗。
处理细胞
在第0天,使用补充有10%fbs的rpmi1640将daudi细胞稀释至100万个细胞/ml。然后将细胞等分到两个细胞培养瓶中,每个含有6ml。其中一个培养瓶接收大约4.6mbq的177lu-tetraxetan-tetulomab(10μg/ml)而另一个未接受任何处理。将两个培养瓶都孵育24h,洗涤,再悬浮于新鲜培养基中成0.5百万个细胞/ml的浓度。处理过的细胞的培养基所吸收的辐射剂量为约1.1gy。然后将处理过的细胞和对照细胞等分在细胞培养瓶中,其对应于待测定的每个时间点。每个细胞瓶含有约5ml的细胞悬液。不给予所述细胞新鲜培养基直至处理后的72h实验结束。
流式细胞仪测量
在每个时间点,将对照细胞在37℃下用0,4μg/ml的dna染色剂hoechst33342(h33342)染色20分钟。接着,对照和处理的细胞洗涤并混合。用冷tetulomab孵育细胞20分钟以饱和所有cd37位点。接着细胞用pbs洗涤并向溶液中加入偶联到alexa647的抗cd20抗体利妥昔单抗和二级兔抗小鼠抗体(偶联到藻红蛋白(pe)(dakocytomation)。在冰中孵育30分钟之后,洗涤样品并使用流式细胞术测定。可以将抗原表达的增加(cd37或cd20)计算为对照和处理的细胞之间的强度测量的差别(以%表示)。通过对来自对照细胞的dna中的h3342染料的蓝色荧光进行圈门来区分对照和处理的细胞。对0,18,24,48和72h评价cd20上调。在24和48h评价cd37。为了控制该兔抗小鼠ab不影响cd20测定,在24h和48h使用和不使用抗小鼠ab进行染色。
结果:
对于大多数的时间点,相对于未经处理的对照,cd20表达增加大约130%(图1)。cd37表达增加大约60%(图1)。由于使用和不使用兔抗体的样品的cd20表达增加相似,因此,在利妥昔单抗和兔抗小鼠抗体之间没有相互作用。
结论:
在用177lu-tetraxetan-tetulomab处理细胞之后,cd20和cd37抗原上调。对于cd20,在所有的时间点增加大致恒定且为大约130%,而对于cd37,在处理后48和72h之间增加是从30到60%。
实施例2
前言
为了评价177lu-tetulomab的效果是否是由于细胞特异性辐射,用betalutin孵育daudi细胞1h。
材料和方法
标记抗体
先前已经在实施例1中讨论过用于标记抗体和计算irf的程序。177lu-tetulomab的比活度为212mbq/mg且ab浓度为0.5mg/ml。irf为72+/-2%,且在ramos细胞中测定。
处理细胞
处理细胞所遵循的程序类似于实施例1中描述的程序。在本实施例中,评价两种不同的治疗方法。一个治疗方法涉及在24h期间孵育细胞,与实施例1所进行的类似。另一个治疗方法涉及在1小时期间孵育细胞。如实施例1中所描述的,对每个治疗方法制备对照细胞。向两个治疗方法中加入相同量的活度(4.6mbq,与实施例1中所给出的相同的活度)。每2至5天分离细胞并加入新鲜培养基以使在稀释之后细胞浓度在0.5至1百万细胞/ml之间。
流式细胞仪测量
使用与实施例1所描述的相同的程序染色细胞并测定所处理的细胞相对于对照细胞的抗原上调。在0和14天之间的时间点进行测定。
结果
对于培养1h的细胞的培养基,剂量是大约0.05gy,而对于在24h期间孵育的细胞,剂量是大约1.1gy。对于孵育1h的细胞,在暴露后48h,cd20增加45.5%且cd37增加3.8%,以及在暴露后144h分别为48.8%和15.1%,指示来自放射免疫偶联物的细胞特异性辐射是效果的重要组成部分,特别是对于cd20抗原(图2)。14天后抗原的上调似乎朝着0下降。
实施例3
前言
为研究抗原的上调是否是淋巴瘤的一般特征而不是细胞系特异性效果,daudi细胞与三个其他淋巴瘤细胞系,raji、ramos和rec-1一起测试。
材料和方法
标记抗体
先前已经在实施例1中讨论过用于标记抗体和计算irf的程序。177lu-tetulomab的比活度为212mbq/mg且ab浓度为0.5mg/ml。irf为72+/-2%,且在ramos细胞中测定。
处理细胞
处理细胞所遵循的程序类似于实施例1中描述的程序。在1小时期间孵育细胞。对实施例1中描述的每种细胞系制备对照细胞。向细胞系中加入相同量的活度(4.6mbq,与实施例1中所给出的相同的活度)。对于细胞的培养基,剂量是大约0.05gy。每2至5天分离细胞并加入新鲜培养基以使在稀释之后细胞浓度在0.5至1百万细胞/ml之间。
流式细胞仪测量
使用与实施例1所描述的相同的程序染色细胞并测定相对于对照细胞,所处理的细胞中的抗原上调。在0和7天之间的时间点进行测定。
结果
对于非霍奇金淋巴瘤细胞,抗原的上调似乎是普遍的。在所有的细胞系上均观察到cd20的增加,而在4种细胞系中的3种上观察到cd37表达的增加(表1)。总之,暴露于177lu-tetulomab放射免疫偶联物导致cd20和cd37的增加,而且这似乎是b细胞淋巴瘤的一般特征。
实施例4.用177lu-利妥昔单抗靶向cd20对抗原表达的效果
前言
为了研究效果是否为放射免疫偶联物的一般特征,而不是betalutin(即,177lu-hh-1或177lu-tetulomab)的特异性效果,用177lu-利妥昔单抗处理daudi和raji细胞。
材料和方法
标记抗体
先前已经在实施例1中讨论过用于标记利妥昔单抗和计算irf的程序。177lu-利妥昔单抗的比活度为165mbq/mg且ab浓度为0.2mg/ml。irf为60+/-2%,且在ramos细胞中测定。
根据制造商提供的程序使用相应的alexafluor蛋白标记试剂盒(molecularprobes,lifetechnologies)用alexa488标记tetulomab。
处理细胞
处理细胞所遵循的程序类似于实施例1中描述的程序。在1小时或24小时期间孵育细胞。使用daudi和raji淋巴瘤细胞。对实施例1中描述的每种细胞系制备对照细胞。向细胞系中加入相同量的活度(4.6mbq,与实施例1中所给出的相同的活度)。对于细胞的培养基,剂量是大约0.05gy。每2至5天分离细胞并加入新鲜培养基以使在稀释之后细胞浓度在0.5至1百万细胞/ml之间。
流式细胞仪测量
使用与实施例1所描述的相同的程序染色细胞并测定相对于对照细胞,所处理的细胞中的抗原上调。在0和7天之间的时间点进行测定。鉴于177lu-利妥昔单抗结合cd20且该同一抗体用于测定荧光的强度,所得结果给出cd20上调的最小值。通过使用二级(兔抗小鼠)和直接ab(结合到alexa488的tetulomab)来评价cd37的上调。
结果
当用177lu-利妥昔单抗处理细胞时也观察到cd20和cd37的上调(表2)。因此,抗原的上调不是177lu-tetulomab的特异性效果。
实施例5。
前言
为了确认在不同的测定中放射免疫治疗会增加抗体到细胞的结合,用177lu-hh-1(抗cd37)处理两个细胞系daudi(非霍奇金淋巴瘤)和jmv-3(b细胞白血病),随后测定125i-标记的利妥昔单抗(抗cd20)的结合。
方法:
使用氯甘脲(iodogen)管(pierce)制备125i-利妥昔单抗。用1mltris缓冲剂洗涤氯甘脲管并随后加入100μl的tris缓冲剂(ph7.5),并添加125i碘。在向通常具有100μltris以及50-200μgoi-3抗体的瓶中加入一些或者所有的125i溶液之后,在6分钟期间内在管中轻轻回旋该溶液几次。
偶尔回旋小瓶,反应继续进行7分钟。在这之后,在使用sephadexg-25pd-10(gehealth)凝胶过滤柱纯化溶液之前,加入50μl在tris中的l-酪氨酸(饱和的)并反应至少5分钟。
约70%的活性会在高分子量级分中洗脱,被收集并在细胞结合实验中使用。
首先用溶于0.005mhcl中的p-scn-bn-dota标记抗体hh-1。p-scn-bn-dota与抗体的摩尔比为6:1。使用碳酸盐缓冲液将反应ph调节为8.5±0.2。在37℃下孵育45分钟后,通过加入50μl0.2m甘氨酸溶液/mg抗体停止反应。为了去除游离螯合剂,通过用0.9%nacl、1:10稀释抗体偶联物洗涤偶联的抗体并通过用amicon-30离心管(millipore,科克,爱尔兰)离心进行上浓缩(up-concentrate)。重复该程序4-5次。用220mbq177lu(perkinelmer,波士顿,ma,usa)标记之前,使用0.25m醋酸铵缓冲液将1mg抗体偶联物的ph调节至5.3±0.3。在37℃下将反应孵育15分钟。
使用瞬时薄层色谱法(itlc)评估放射免疫偶联物(ric)的放射化学纯度(rcp)。rcp为95.5%。用ramos(177lu-hh1)或daudi(125i-利妥昔单抗)淋巴瘤细胞和单点法测定ric的免疫反应部分(irf)。使用大约50百万个细胞/ml的细胞浓度。两个管不封闭且用10μghh-1预处理2个管,此后它们被添加2ng的177lu-hh1并振摇1.5h。此后在γ计数器上计数管以确定所施加的活性,在对管计数细胞结合活性之前,用0.5mldpbs/bsa洗涤并离心三次。通过减去封闭的管的计数来校正细胞结合活性的非特异性结合。irf,即特异性结合vs.应用总量,为78%(177lu-hh1)和71%(125i-利妥昔单抗)。向含有5ml的rpmi1640(补给有10%fbs)与1百万细胞/ml的细胞培养瓶(25cm2,corning)中加入2.5mbq177lu-bn-dota-hh-1(177lu-hh-1),bn-dota-hh-1(dota-hh-1,对照组1)或制剂缓冲液,即,除了ric或抗体偶联物外与其他两个处理相同的溶液(对照组2)16.7微升。一天后抽出2ml并加入3ml新鲜培养基(1.7倍稀释),三天后加入3ml培养基(1.5倍稀释),五天后抽出4ml和加入3ml新鲜培养基(1.8倍稀释),在第8天,抽出6ml并加入5ml新鲜培养基(2.7倍稀释),在第11天,抽出7ml并加入4ml新鲜培养基(5倍稀释)。这样做是为了再补给生长培养基并模拟浓度随时间的降低,如在体内关于ric所观察到的。
3.5天后,抽出细胞悬浮液并用countess自动细胞计数器(invitrogen)测定细胞浓度和存活率,并将0.5ml加入到反应管中离心,并将细胞沉淀再悬浮于具有0.5%bsa(vwr)的200μldpbs(gibco)中。向177lu-hh-1组中的两个管添加0.8μg,即在10μldpbs/bsa中的约1.6μg/ml125i-利妥昔单抗,且两个管中只加入dpbs(在125i窗口中校正来自177lu的计数干扰)。向对照组1和2中的两个管添加0.8μg,即在10μldpbs/bsa中的约1.6μg/ml125i-利妥昔单抗和10μldpbs/bsa缓冲液。将管孵育1.5h,然后在cobraiiautogamma(packard)γ计数器的125i窗口中计数之前,洗涤和离心分离两次。通过使用来自未添加125i-利妥昔单抗的两个管的测量值为177lu-hh-1组中的计数校正从177lu至125i窗口中的交叉计数。
结果
关于细胞数量和125i窗口中的177lu干扰调节细胞结合活性,且ric处理过的和未处理过的对照1(除了177lu之外的抗体偶联物)和2(ric的缓冲溶液)之间的比较示于表3中。其显示,在开始用177lu-hh1治疗之后直到和包括15天的所有时间点,用ric处理过的细胞具有增加的125i-利妥昔单抗的结合。
结论
如表3所示,在177lu-hh1暴露后,b细胞淋巴瘤和b细胞白血病细胞显示125i-利妥昔单抗的结合增加。这表明,放射免疫治疗在正接受针对淋巴瘤和白血病的单克隆抗体治疗例如利妥昔单抗治疗的患者中作为诱导治疗可能是有益的。
实施例6评价非特异性结合。
背景:
为了验证抗原特异性抗体与暴露于放射免疫治疗的细胞结合的增加不是由对细胞的非特异性结合增加引起的,实施利用抗原封闭的实验。
实验:
使daudi细胞,大约100万个/ml在25cm2培养瓶中,暴露于未标记的hh1抗体(对照1),制剂缓冲液(对照)或0.1mbq/ml或0.5mbq/ml177lu-hh-1三天。一天后通过加入新鲜培养基将浓度降低到50%。在第三天,抽出细胞悬浮液并用于如实施例4的结合测定和处理,所述结合测定和处理利用来自接收125i-利妥昔单抗的三个组的平行双管。此外,用未标记的利妥昔单抗(100μg/ml)处理每个组的重复半小时以封闭cd20抗原。为了校正125i窗口中的177lu,使用来自两个放射性组的重复而不加入125i-利妥昔单抗,并按照与加了125i-利妥昔单抗的测试管相同的方式处理和洗涤。加入125i-利妥昔单抗后,将测试管孵育2h并计数所施加的活性。使用cobraii自动伽马计数器(packardinstrumentscompanyinc,downersgrove,il,usa)。此后,用dpbs/0.5%bsa洗涤测试管两次并离心两次,并计数细胞结合活性。对数据校正从经处理的细胞中的177lu到125i窗口内的伽马溢出。
结果:
当相对于未封闭的管比较封闭的管中的每个细胞的净活性计数时,结果如下:0.1和0.5mbq/ml组,0.8%和1.1%的非特异性结合;对照1和对照2,1.3%和1.1%非特异性结合。
结论:
抗原封闭对于处理过的和没处理的细胞同样有效。因此,与放射免疫偶联物处理过的细胞的结合增加不是由非特异性结合引起的,因此,一定是由抗原表达增加引起的。
实施例7:用betalutin(177lu-tetraxetan-tetulomab或177lu-hh1)处理以及对体内cd20抗原表达的影响
这个实施例验证了在体内也观察到177lu-hh1的抗原上调效果。在用betalutin或冷hh1的对照注射处理之后3天,测定具有皮下ramos移植瘤的裸鼠中的生物分布和肿瘤摄取。
方法:
用177lu标记tetulomab
将螯合剂p-scn-bn-dota(dota)溶解在0.005mhcl中,以6:1比例加入到抗体中,并使用碳酸盐缓冲液将ph调节至约8.5。在37℃下孵育45分钟后,通过加入每mgab50μl的0.2m甘氨酸溶液终止反应。为了去除游离的dota,使用amicon-30离心管(millipore,cork,爱尔兰)用nacl0.9%洗涤偶联的抗体4-5次。用177lu标记之前,使用0.25m的乙酸铵缓冲液将ph调节到5.3±0.3。将大约150mbq的177lu(perkinelmer,波士顿,ma,usa)加入到0.5mg的dota-ab中,并在37℃下在20分钟内孵育。比活度为250mbq/mg。使用瞬时薄层色谱法评价偶联物的放射化学纯度(rcp)。如果rcp低于95%,则使用econo-pac10dg柱(bio-rad实验室,加利福尼亚州,美国)纯化偶联物。
用125i标记利妥昔单抗
根据制造商的说明使用氯甘脲预涂覆的碘化管(pierce,rockford,il)通过间接碘化用125i标记利妥昔单抗。终止与l-酪氨酸的反应后,将反应混合物通过sephadexg-25pd-10柱洗脱以除去低分子量化合物。最终产物的比活度为12mbq/mg。
177lu-hh1和125i-利妥昔单抗的免疫反应部分
在具有95%空气/5%co2的潮湿气氛中,在补充有10%热灭活的fcs(paa),1%l-谷氨酰胺(paa)和1%青霉素-链霉素(paa)的rpmi1640培养基(paa,linz,奥地利)中生长ramos淋巴瘤细胞的单细胞悬浮液。使用单点改性的lindmo方法测定放射免疫偶联物的免疫反应性。所用的细胞浓度为75百万细胞/ml。偶联物的免疫反应性介于60%至82%之间。
动物
使用在实验的开始大约8-9周龄并且体重约22克的惯常培育的雌性无胸腺裸鼠foxn1nu。将动物保持在无病原体的条件下,随意供给食物和水。在本研究中涉及动物的所有程序和实验均由国家动物研究权威机构批准并根据用于科学目的的保护脊椎动物欧洲公约而进行。在两个侧面用50μl的ramos淋巴瘤肿瘤组织的糊状溶液皮下注射小鼠,每ml的肿瘤糊状溶液用大约300μlnacl稍微稀释。
生物分布摄取实验
在实验的开始具有直径为5至14mm的ramos移植瘤的裸鼠foxn1nu中确定125i-利妥昔单抗和177lu-hh1的生物分布。对每只动物通过尾静脉注射100μl溶液施用制剂。对5只小鼠(经处理的小鼠)施用大约350mbq/kg的betalutin的剂量,相当于2,3mg/kg的蛋白剂量(在使用之前已经储存177lu-hh-1,因此,降低了比活度)。对照组包括被注射相同的蛋白剂量(2.3mg/kg)的冷hh1的7只小鼠作为经处理的小鼠。注射betalutin或冷hh1两天后,所有小鼠注射3mg/kg的125i-利妥昔单抗。注射125i-利妥昔单抗后三天,通过颈脱位处死小鼠并进行尸体解剖。测定每个组织样品的重量,以及通过校准的伽马探测器(cobraii自动伽马探测器,帕卡德仪器公司,梅里登,ct,usa)测定177lu和125i的量。注射物(injectate)的样品用作测量程序中的参照。计算各时间点的每克组织的注射剂量的衰变校正百分比(%id/g)。通过使用双窗口设置测定器官中的活性同时测定177lu和125i活性。仅具有177lu或125i的空管用于评估从窗口的交叉。从125i窗口到177lu窗口的交叉约为0.006%且被认为是可以忽略不计。另一方面,从177lu窗口到125i窗口的交叉约为10%并且相应地校正所有的数据。此外,放任样品衰减10周(约10个177lu半衰期)并再次计数,以证实校正的效果。
结果:
图6示出注射125i-利妥昔单抗后3天的125i-利妥昔单抗的生物分布。用350mbq/kgbetalutin(处理的)或冷hh1(对照)提早5天注射小鼠。在两组中正常器官中的摄取类似(p>0.05),而经处理的小鼠中的肿瘤中的摄取高出约3倍(p=3,1910-10)。对照小鼠中的肿瘤中的平均%id/g为1.3+/-0.2,而在处理的小鼠中是3.6+/-0.7。
结论:
与用冷hh1处理的小鼠相比,用betalutin处理增加肿瘤摄取3倍,同时保持正常器官中的摄取恒定。这些结果连同在前面的实施例中示出的数据表明,用betalutin处理在体内上调cd20抗原并且这转化为显著增加的肿瘤摄取。
- 还没有人留言评论。精彩留言会获得点赞!