lncRNAH19的靶miRNAmiR19a-3p及其应用的制作方法
本发明涉及恶性肿瘤的治疗方法,尤其是lncrnah19的靶mirnamir19a-3p及其应用。
背景技术
慢性粒细胞白血病(chronicmyelocyticleukemia,cml)是一种发生在多能造血干细胞上的恶性骨髓增殖性肿瘤。cml患者往往会出现特征性的染色体异位t(9:22)(q34:q11)(即ph染色体),其9号染色体2上c-abl原癌基因易位至22号染色体长臂的断裂点簇集区(bcr),形成bcr-abl融合基因,异常表达bcr-abl蛋白,导致络氨酸激酶的持续激活,并且导致下游的信号转导通路被活化,从而调节细胞因子的表达,最终导致骨髓干祖细胞大量增生、凋亡减少和骨髓基质细胞的粘附性下降,致使大量尚未成熟的髓细胞释放到外周血,导致cml发生。依据疾病的整体发展过程,在临床上其发展进程被分为三个时期,分别为慢性期(chronicphase,cp)、加速期(acceleratedphase,ap)和急变期(blasticphase,bp)。慢性期疾病症状轻微无特异性,主要表现为腹胀、腹部肿块、乏力、低热、脾大,见于90%患者,病症程度不一。
随着基因组测序技术的迅速发展,人们发现rna可以由60%~70%的基因组序列转录而成,但是其中只有不到2%的编码蛋白质的序列,其余被称为非编码rna。事实上,很多年前,许多非编码rna就被发现对生命活动有重要影响,例如涉及蛋白质合成的核糖体rna(rrnas)、转运rna(trna)和小核rna(snrna),并且这些非编码rna通常被称为持家非编码rna。近年来非编码rna引起广泛关注,这些rna主要是指具有生命调节作用的非编码rna,包括microrna和本文研究的rna(lncrna)。研究已经发现lncrna是指长度大于200个核苷酸并且由rna聚合酶ⅱ转录且缺少或无开放阅读框架的rna,它可来源于基因间、增强子原件、基因的反义链、内含子区基因组的其他位置。
随着对长链非编码rna研究的不断深入,发现lncrna具有很多重要的功能,参与了机体重要的生物学过程,包括细胞分化、衰老、增值、凋亡和肿瘤的发生发展等。多种lncrna如h19、x染色体特异性性失活转录物(xist)等参与基因印记。
pachnis等在1984年发现h19基因尽管可被rna聚合酶ⅱ转录,可以被剪切并加尾,但其转录出来的产物却无法翻译成有生物学功能的蛋白质,而是以非编码rna的形式来发挥作用。由于h19产物长度超过了200nt,故将其定义为lncrna。在小鼠体内h19与igf2存在于第七号染色体,在人体则位于11p15.5,两者相距90kb,这属于第一对被证实为具有印记特性的基因。h19体现为父系印记和母系表达,而igf2则体现为父系表达和母系印记。二者的印记特性都受到h19启动子上游4kb的甲基化差异修饰区(dmr)或印记调控区域(icr)的调控。在物种进化上,h19具有高度保守的特征,在三个时期内高表达,分别是胚胎发育时的内胚层、中胚层及其分化而来的组织内,但是出生后,除了心脏和骨骼肌外,其他组织内几乎不表达,除非在三种情况下会重新激活表达:组织损伤修复和应激状态以及肿瘤发生时。
h19全长2.3kb,由35个小的开放阅读框,且具有类似mrna的5′端帽子结构和3′端多聚腺苷酸尾巴结构,理论上可编码一种包含256个氨基酸分子的蛋白质,但是lncrna仅仅在mrna水平发挥作用,并无法编码任何蛋白质分子。h19第一个启动子中的高度保守区域编码的mirna-675分子,可在妊娠后期通过调节igflr基因的表达控制胎盘的生长。研究发现,h19在人体胎盘素和一些胚胎组织中大量聚集,表示h19可能在胚胎形成和生长发育期起很重要的作用。胎儿出生后,h19表达下调,但在乳腺、肾上腺和子宫组织中扔维持基础表达量。目前有报道表明,在肾母细胞瘤、胚胎横纹肌肉瘤中,h19起抑癌基因的作用,然而许多实体瘤(包括乳腺癌、肝癌、膀胱癌等)中,h19是一个致癌基因。这表明,人体内h19通过不同的机制参与机体肿瘤的形成和进展。这些不同的机制中还有许多未知环节有待进一步的研究发现。
技术实现要素:
基于上述问题,本申请的发明人在研究h19参与机体肿瘤的形成和进展的具体机制的过程中,意外地发现通过提升lncrnah19的表达水平或抑制lncrnah19的靶mirnamir-19a-3p(其碱基序列如seqidno.6所示),能有效地抑制肿瘤细胞的增殖。具体地,本发明的技术方案包括以下几个方面:
在第一个方面,本发明提供了lncrnah19的靶mirnamir-19a-3p在制备和/或筛选治疗肿瘤的药物中的应用。
优选地,所述肿瘤为白血病。
在第二个方面,本发明提供了lncrnah19和mir-19a-3p的联合使用在制备和/或筛选治疗肿瘤的药物中的应用。其中,lncrnah19的过表达可以抑制肿瘤细胞的增殖,靶向抑制mir-19a-3p可以抑制肿瘤细胞的集落形成能力(colony)以及肿瘤细胞的增殖。
优选地,所述肿瘤为恶性肿瘤。
在第三个方面,本发明提供了一种治疗肿瘤的药物,所述药物中含有mir-19a-3p的抑制剂。
优选地,所述抑制剂为mir-19a-3p的反义核酸。
优选地,所述药物中还含有能促进lncrnah19表达水平的试剂或载体。
优选地,所述mir-19a-3p的反义核酸的碱基序列如t-anti-mir-19a-3p(即seqidno.7)所示。
更优选地,所述肿瘤为血癌。
综上所述,本发明的有益效果为:
本发明中提出lncrnah19的过表达抑制了肿瘤的生长以及延长了小鼠的存活;同时,本发明还通过软件预测lncrnah19的靶mirna有mir-19a-3p,并通过实验进行了验证;最后,发明人发现靶向抑制mir-19a-3p,抑制了k562细胞的增殖,减弱了k562细胞的colony形成能力。
附图说明
图1为慢病毒载体结构图;
图2为正常对照组与k562和kcl-22细胞h19的表达水平的检测结果图;
图3为real-timepcr对h19-sirna有效序列的筛选结果图;
图4为k562-h19lentiv和k562emptylentiv中的h19的表达水平的检测结果图;
图5为k562-h19lenti和k562-emptylentiv组的colony数目检测结果图,其中a为集落图(40×);b为相对集落数;
图6为h19过表达对balb/cnude小鼠的影响结果图;其中,
a显示了注射过表达h19的p210细胞后,小鼠肿瘤的大小;
b显示了注射过表达h19的p210细胞后对小鼠存活的影响;
c显示了注射过表达h19的p210细胞后,小鼠肿瘤体积的统计结果;
图7为nod/scid小鼠尾静脉移植k562-neg-lentiv和k562-h19lentiv,活体成像观察小鼠发病率,记录小鼠存活率的结果图;
图8是小rna样品处理步骤的流程图;
图9是小rna数据分析步骤的流程图;
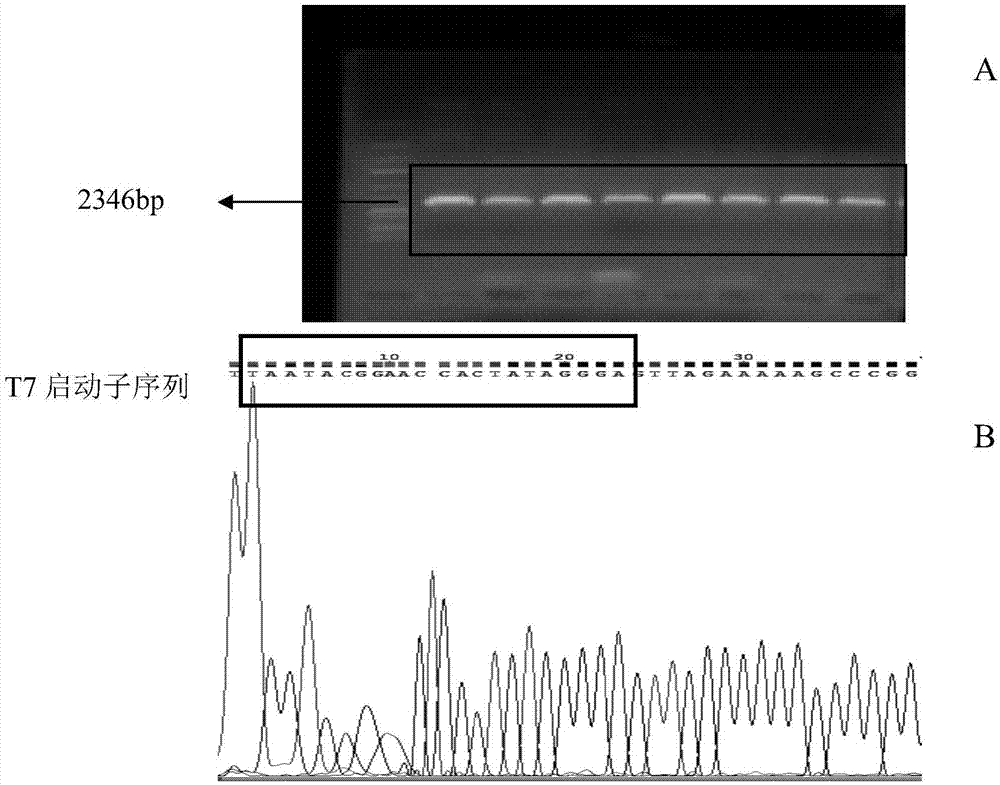
图10为pcr产物的鉴定结果图;其中,a为pcr产物后的琼脂糖凝胶电泳图,b为pcr产物测序(序列已经带上t7启动子)结果图;
图11为体外转录后的lncrnah19琼脂糖凝胶电泳图;
图12starbasev2.0软件预测的结果示意图,其中显示与lncrnah19相互作用的microrna和rna-seq检测到的microrna中,有5个是共同的,它们分别是:hsa-mir-19a-3p、hsa-mir-106b-5p、hsa-mir-148a-3p、hsa-mir-148b-3p、hsa-mir-454-3p;
图13为实时定量pcr的结果图;其验证了rnapull-down产物中mir-19a-3p和mir-106b-5p;
图14为lncrna-mirna相互作用模型;
图15为转染t-antimir-19a-3p后对k562细胞活性的影响结果图,其中,**p<0.01,*p<0.05,t-antimir-19a-3p与空白组和scr组相比;
图16为k562,scr和t-antimir-19a-3p组的colony结果图,其中,a为集落图(40×),b为相对集落数,*p<0.05,t-antimir-19a-3p组与k562、scr组相比。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。本发明的实施例主要包括三大部分,其中涉及的试剂、耗材、以及其它试验用品均可从市场或其它公众渠道获得。
第一部分:lncrnah19的功能鉴定
1.h19-sirna序列和h19慢病毒表达载体
1.1h19sirna序列
1.2h19慢病毒表达载体
h19慢病毒表达载体构建于广州复能基因有限公司。
h19慢病毒表达载体:cs-gs3160-lv201;
空慢病毒表达载体:cs-neg-lv-201
2.细胞株
k562细胞株,人慢性粒细胞白血病系,购于中国科学院上海细胞库
3.主要试剂配制
3.1含10%血清的细胞培养基
将澳洲胎牛血清置于高压灭菌锅内56℃、30min灭火后分装于10ml的康宁离心管,分装后的血清于-20℃冰箱中保存。rpmi-1640培养基分装于200ml广口瓶,每瓶180ml,放于4℃冰箱中保存。每180ml培养基中加入澳洲胎牛血清20ml,配制使得rpmi-1640培养基中血清的含量为10%。
3.2ph7.2磷酸缓冲液(pbs)
分别称取上述组分,使用双蒸水溶解上述称好的组分并且定容至1000ml,高压蒸汽灭菌30min,取出,4℃保存。
3.3配制2.7%的甲基纤维素半固体培养基
称取2.7g甲基纤维素粉末于广口瓶中,加入50ml沸水,边搅拌边溶解,30min,取出,待其冷却,在超净工作台中加入50ml的无菌2×1640培养基,搅拌直至溶解,保存于4℃冰箱待用。
实施例1k562细胞培养
将cml细胞k562接种于rpmi-1640培养基,rpmi-1640中血清的含量为10%,将接种好的k562细胞置于温度为37℃、co2体积分数为5%的细胞培养箱中进行培养。
实施例2h19-sirna有效序列的筛选
2.2.1h19-sirna转染k562细胞
(1)实验分组为:空白对照组(blank)、scr、h19-sirna-01、h19-sirna-02、h19-sirna-03组,scr、h19-sirna-01、h19-sirna-02、h19-sirna-03的浓度为100nm。
(2)取对数生长期细胞,用无血清、无抗生素的rpmi-1640培养基将细胞悬液浓度调整为30×104/ml,每孔1.5ml的细胞悬液接种于6孔板中。
(3)配制lipofectaminetm2000与rna的复合物:根据lipofectaminetm2000说明书,各取所需的sirna量和lipofectaminetm2000量,分别用优化培养基opti-mem稀释。
(4)lipofectaminetm2000稀释完成后,室温静置5min。
(5)稀释且静置5min的lipofectaminetm2000与稀释好sirna按照1:1的比例混合,室温静置20min后,即得到lipofectaminetm2000-rna复合物。
(6)将各组所需的lipofectaminetm2000-rna复合物慢慢滴加到孔板中的细胞悬液中,使得每孔的终体积为2ml。将6孔板置于37℃、co2体积分数为5%的细胞培养箱中。
2.2.2real-timepcr检测各组细胞内h19mrna的相对表达水平
2.2.2.1总rna提取
实验分组:空白对照组(blank)、scr、h19-sirna-01、h19-sirna-02、h19-sirna-03
(1)取对数生长期的各组细胞,1500rpm离心5min,弃上清。
(2)pbs将细胞沉淀洗一遍,1500rpm离心5min,弃上清。
(3)往细胞沉淀中加入1ml的trizol,冰上裂解5min。
(4)往细胞裂解液中加入200μl的氯仿,振荡45s,冰上静置10min。
(5)12000rpm,4℃,离心15min。小心吸取上清于一个干净的ep管,负20℃放置20min。
(6)12000rpm,4℃,离心10min。小心弃掉上清。
(7)70%的酒精洗rna沉淀,12000rpm,4℃,离心5min,重复三次。
(8)通风橱中将沉淀晾干,2-3min。沉淀中加入30μl的rna无酶水。将rna置于负80℃保存。
2.2.2.2逆转录反应(rt)
(1)取a260/a280在1.8-2.0之间的rna样品1μg与无核酸酶污染的pcr管,各组rna置于冰上备用。
(2)按照bimake公司的all-in-onecdnasynthesissupermix的说明书,在核酸无酶管中,加入以下组分进行逆转录反应(冰上操作):
(3)按照上述组分加好后,瞬时离心10s。
(4)将pcr管放入pcr仪中,按照试剂盒提供的标准反应程序进行逆转录反应:42℃15min;85℃2min。
2.2.2.3real-timepcr
(1)根据bimake公司的2×sybrgreenqpcrmastermix试剂盒来检测各组h19mrna的相对表达水平,gapdh为内参,取1μlcdna进行real-timepcr扩增。
(2)反应体系如下:
h19和gapdh的相对表达水平用2-△△ct计算。
实施例3建立稳定表达h19的k562细胞株
3.3.1h19慢病毒表达载体和空慢病毒表达载体转染k562细胞
(1)取对数生长期细胞,用无血清、无抗生素的rpmi-1640培养基将细胞悬液浓度调整为30×104/ml,每孔1.75ml细胞悬液接种于6孔板中。
(2)配制lipofectaminetm3000于dna的复合物:根据lipofectaminetm3000说明书配制,每孔取2.5μg的dna量以及3.75μl的lipofectaminetm3000量,分别用250μl的opti-mem稀释。
(3)dna与lipofectaminetm3000稀释完成,将稀释液按照1:1的比例混合均匀,室温静置5min后,得到lipofectaminetm3000-dna复合物。
(4)将lipofectaminetm3000-dna复合物缓慢滴加到孔板中的细胞悬液中,每孔最终体积为2ml。将六孔板置于温度为37℃、co2体积分数为5%的细胞培养箱中培养,6h后,加入2ml含血清为20%的rpmi-1640培养基。
3.3.2嘌呤霉素筛选稳定表达h19的k562细胞株
h19慢病毒载体转染k562细胞后,在培养体系中加入嘌呤霉素,使嘌呤霉素的终浓度为1mg/ml,每隔2天更换培养液。
实施例4real-timepcr检测细胞内h19mrna的相对表达水平
4.4.1总rna提取,
按照2.2.2.1
4.4.2逆转录反应(rt)
按照2.2.2.2
4.4.3real-timepcr
按照2.2.2.3
实施例5h19对k562细胞colony形成的影响
5.5.1实验分组
1.k562空白对照组
2.k562-h19lentiv组(稳定表达h19的k562细胞)
3.k562-emptylentiv组(含有空慢病毒载体的k562细胞)
5.5.2colony实验
实验分为两组:稳定表达h19的k562细胞和已转染空慢病毒表达载体的k562细胞。取对数生长期的各个实验组的细胞,用无血清培养基稀释k562细胞,使得其密度为1×103/ml,取450μl的k562细胞悬液,加入到550μl含20%胎牛血清、5μmol/lβ-巯基乙醇、2mmol/l的l-谷氨酰胺和0.9%的甲基纤维素半固体培养基中,将细胞悬液与半固体培养基充分混匀后,每孔1ml接种于24孔板中,每个实验重复三个复孔,将24孔板置于温度为37℃、co2体积分数为5%的细胞培养箱中培养7-14天。置于倒置显微镜下观察colony大小以及形态,以大约大于40个细胞的细胞团为1个colony,拍照保存,实验重复三次。
实施例6h19在cml小鼠模型中的功能研究
6.6.1balb/c裸鼠皮下成瘤实验
在p210细胞中转染h19慢病毒载体和空慢病毒载体,构建稳定过表达h19的p210细胞,将密度为1×107/ml的p210-h19和p210-neg细胞接种200μl到balb/cnude小鼠左下肢腋下,观察其成瘤情况,在小鼠成瘤后,每日测量小鼠肿瘤大小的变化。
6.6.2nod/scid小鼠尾静脉实验
在k562细胞中转染h19慢病毒载体和空慢病毒载体,构建稳定过表达h19的k562细胞,将密度为1×107/ml的k562-h19和k562-neg细胞移植200μl,尾静脉注射k562-h19细胞和k562-neg细胞,活体成像观察并记录小鼠的发病以及存活情况。
实验结果:
1.h19对k562细胞进展的影响
1.1h19表达量检测
取正常人的血,提取rna,同时对k562细胞、kcl-22细胞、293t细胞提取rna,荧光定量pcr检测各组h19的表达量,结果如图2所示,与正常对照组相比,k562、kcl-22中h19的表达量较低。
1.2h19-sirna有效序列的筛选
浓度为100nm的scr(血肌酐)、h19-sirna转染k562细胞,正常培养48h后,提取各组细胞的总rna,real-timepcr检测各组h19mrna的相对表达水平,mtt检测转染h19-sirna后,各组k562细胞的细胞活力。结果如图3所示。
1.3h19慢病毒载体转染k562细胞的效率检测
所用的h19慢病毒载体(cs-gs3160-lv201)和空慢病毒载体(cs-neg-lv-201)是由广州复能基因有限公司所提供的。h19慢病毒载体在转染k562细胞后,经嘌呤霉素筛选,得到稳定表达h19的k562细胞。收集对数生长期的各组k562细胞,提取总rna检测h19mrna的相对表达水平。各组k562细胞内h19的相对表达水平如图4所示,相对于空慢病毒载体(emptylentiv),h19慢病毒载体组(h19lentiv)的h19mrna的表达水平明显升高。
1.4h19过表达对k562细胞colony形成的影响
以甲基纤维素为载体的colony形成法可以用来检测单个肿瘤细胞的增值能力。取对数生长期的k562、k562-emptylentiv和k562-h19lentiv进行colony实验,结果如图5所示,相对于k562组和k562-emptylentiv组,k562-h19lentiv组的colony数目和大小减少(p<0.05)。
2.过表达h19对cml模型鼠balb/c裸鼠的影响
裸鼠皮下成瘤探究h19过表达对balb/cnude小鼠肿瘤大小的影响,对balb/cnude小鼠存活的影响,为了探究h19对balb/cnude小鼠p210肿瘤大小的影响,在p210细胞中转染h19慢病毒载体和空慢病毒载体,构建稳定过表达h19的p210细胞,将密度为1×107/ml的p210-h19和p210-neg细胞接种200μl到balb/cnude小鼠左下肢腋下,观察其成瘤情况,在小鼠成瘤后,每日测量小鼠肿瘤大小的变化。从图6中可以看出h19过表达组的肿瘤比对照组的小。
3.过表达h19对cml模型小鼠nod/scid的影响
小鼠尾静脉注射k562-h19细胞和k562-empty细胞,活体成像观察记录小鼠的发病以及存活情况。结果如图7所示。
结果分析:
本发明首先对h19的表达量进行了检测,取正常人的血与k562细胞和kcl-22细胞,提取rna,进行h19表达量进行检测。如图2,可以看出,与正常对照组相比,k562和kcl-22中h19的表达量相对较低。其次,对h19的sirna进行了有效序列的筛选,h19-sirna和scr合成于广州锐博生物有限公司。经real-timepcr筛选,h19-sirna-02和h19-sirna-03两条序列有效,如图3,但靶向抑制h19后,对k562细胞的活力影响不明显。因此,发明人利用h19慢病毒载体转染k562细胞,嘌呤霉素筛选阳性细胞,使得h19过量表达,稳定株命名为k562-h19lentiv,研究h19过表达对k562细胞恶性进展的作用,如图4,h19过表达抑制了k562细胞的克隆形成。慢病毒表达载体cs-gs3160-lv201和cs-neg-lv-201构建和技术支持由广州复能基因公司提供。cs-gs3160-lv201含有h19和egfp目的基因片段,而cs-neg-lv-201只含有egfp,所以在转染完成以后观察gfp蛋白的阳性细胞,可以初步判断转染效率,根据载体上具有的抗性标记基因使用嘌呤霉素进行初步筛选。对转染慢病毒后的k562稳定株提取rna,real-timepcr检测h19的相对表达水平。图5表明,与k562-emptylentiv细胞组相比,k562-h19lentiv细胞内的h19mrna的表达水平明显升高,以上结果表明,稳定表达h19的k562细胞建立成功,这为研究h19在cml中的功能提供了实验模型。
克隆性增生是cmlk562细胞株一个很重要的特征,因此,对k562细胞克隆形成能力进行研究可以证明h19对cml细胞进展的影响。colony形成实验是指单个细胞尤其是肿瘤细胞在甲基纤维素半固体培养基培养条件下的生长状况,通过倒置显微镜观察细胞数目以及colony形态,可以用来评价单个细胞的增殖能力。通过colony形成实验得知,过表达h19后k562细胞的colony大小和数目减少,h19的表达水平与k562细胞的增殖能力紧密相关。
慢性粒细胞白血病具有特征性的bcr/abl融合基因及其产物bcr/abl融合蛋白(p210),该蛋白具有强烈的络氨酸激酶活性,能够异常激活多种信号通路,导致血细胞恶性转化。baf-p210细胞,简称p210,是稳定表达bcr/abl的细胞株。因此,这一部分是在动物水平探了h19过表达对balb/cnude小鼠成瘤的影响以及存活的影响。发明人在构建了稳定过表达h19的p210细胞,将密度为1×107/ml的p210-h19和p210-neg细胞接种200μl到balb/cnude小鼠左下肢腋下注射之日起,观察小鼠的成瘤情况以及存活情况。图6可以看出,与对照组相比,h19的过表达抑制了肿瘤的生长以及延长了小鼠的存活。同时,发明人在构建了稳定过表达h19的k562细胞,将密度为1×107/ml的k562-h19和k562-neg细胞通过尾静脉注射,将细胞移植200μl到nod/scid小鼠体内,活体成像观察小鼠的发病情况以及存活情况,从图7可以看出,与对照组相比,h19的过表达抑制了肿瘤的生长以及延长了小鼠的存活。
第二部分:lncrnah19靶mirna的鉴定
1.带有t7启动子序列的h19基因的引物序列(如下表所示),由生工生物工程(上海)股份有限公司设计并合成。
2.k562细胞株,人慢性粒细胞白血病系,购于中国科学院上海细胞库。
3.主要试剂配制
3.1配制10×tae电泳缓冲液
称取上述组分于烧杯中,向烧杯中加入800ml双蒸水,搅拌,使得其充分溶解;加入11.4ml冰醋酸,充分搅拌;用双蒸水定容至1l,室温保存,待用。
3.2配制0.8%的琼脂糖胶
称取0.4g琼脂糖溶解于50ml双蒸水,搅拌均匀,并微波炉加热,直至沸腾,取出,待温度降到60℃左右,加入3μl的genered,充分搅拌,倒入配胶槽中,插入梳子,待其凝固,备用。
3.3lb培养基配制
称取上述各组分于烧杯中,加蒸馏水搅拌并定容至1l,置于高压蒸汽灭菌锅灭菌,备用。
3.4lb固体培养基配制
除了上述液体培养基中各成分外,再加15g琼脂,同样加双蒸水定容到1l,灭菌大约30min后,取出,待温度降到60℃左右,将其倒入已经加了抗生素的培养皿中,摇匀,待凝固后,4℃保存,备用。
3.5配制5m的氯化钠
称取292.5g氯化钠,加双蒸水搅拌,直到溶解,并且定容至1l。备用。
3.610×tbs缓冲液配制(ph=7.6)
称取上述组分,适量双蒸水溶解,用hcl调节至ph为7.6,加双蒸水定容至1l,室温保存。使用时将10×tbs稀释成1×tbs。
3.7配制1×tbst缓冲液
量取100ml1×tbs溶液,加入1mltween-20,加入适量双蒸水定容至1l,即为1×tbst缓冲液。
3.8配制1×转膜缓冲液(ph=8.5)
称取上述组分,加入适量双蒸水溶解,用hcl调整ph为8.5,用双蒸水定容至1l,室温保存。
3.9配制封闭液
称取5g脱脂奶粉,溶于100mltbst中,现用现配。
3.10配制抗体稀释液
将5g脱脂牛奶溶于50mltbst中,配成5%的脱脂牛奶,先用现配。
3.115×sds-page电泳缓冲液
加适量双蒸水,搅拌溶解,加双蒸水定容至1l。室温保存。使用时加双蒸水稀释到1×sds-page。
3.121.5mol/lph=8.8tris-hcl缓冲液
加适量双蒸水溶解,并定容至100ml。4℃保存。
3.1330%丙烯酰胺
称取上述组分,双蒸水溶解并定容值100ml。4℃保存。
3.1410%的分离胶
3.155%浓缩胶
实施例7获得体外转录的模板
1)感受态大肠杆菌的制备
(1)取一支负70℃冻存的保种菌液大肠杆菌dh5α,吸取5μl菌液与5mllb液体培养基中,37℃,250rpm摇床活化过夜。
(2)从步骤(1)的菌液中取50μl,接种到5ml新鲜的lb液体培养基中,37℃,250rpm摇床培养3h,取适量菌液与1.5ml的ep管中测od值(0.3-0.4od值即可进行实验)。
(3)在超净台中取1ml的菌液于1.5ml的无菌ep管,5000rpm离心5min,去上清。加入1ml预冷的0.1mol/l的cacl2重悬菌液,冰上放置30min。
(4)5000rpm,4℃,离心5min,去上清。
(5)加入50μl预冷的0.1mol/l的cacl2重悬菌液,即为感受态细胞(置于负80℃冰箱保存)
2)h19慢病毒表达载体转化大肠杆菌
(1)将感受态细胞置于冰上融化,待其融化后,向感受态细胞悬液中加入h19慢病毒过表达载体dna1μl,用移液器轻轻吹打混匀,冰浴30min。
(2)42℃热击45s,迅速将离心管转移到冰浴中,冰上静置3min。
(3)向离心管中加入450μl无菌不含抗生素的lb培养基,混匀,置于37℃摇床,150rpm振荡培养45min,使得菌体复苏。
(4)取100μl菌液,涂布于含有氨苄青霉素的lb平板上,使用无菌涂布棒将均匀涂开,将平板置于37℃待液体被吸收,倒置培养,37℃培养过夜。
(5)次日早晨,准备一个10ml的离心管,加5mllb培养液,再加2.5μl的浓度为氨苄青霉素,挑取单个菌落接种于已经加了氨苄青霉素的lb培养基中,37℃振荡培养,10个h左右。
3)质粒dna的提取
提取使用的试剂见下表:
(1)取5ml过夜培养的菌液,加入离心管中,13000rpm离心1min收集菌体沉淀,小心吸去上清。
(2)向含有沉淀的离心管中加入250μlbufferp1,使用移液器充分混匀,悬浮沉淀。
(3)向离心管中加入250μlbufferp2,温和上下颠倒混匀10次,使菌体充分裂解,室温放置5min。此时溶液应变得清亮粘稠。
(4)向离心管中加入250μlbuffere3,立即上下颠倒混匀10次,此时出现白色絮状沉淀,室温放置5min,13000rpm离心5min,吸取上清,将上清加入过滤注(endo-removerfm)中,13000rpm离心1min过滤,滤液收集在离心管中。
(5)向滤液中加入225μl异丙醇,上下颠倒混匀。
(6)柱平衡:向已装入收集管的吸附柱(spincolμmnsdm)中加入200μlbufferps,13000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(7)将步骤(5)中的滤液与异丙醇的混合液转移到平衡好的吸附柱(已装入收集管)中。
(8)13000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(吸附柱的最大容积为750μl,如果样品体积大于750μl可分批加入。)
(9)向吸附柱中加入750μl事先已经加入无水乙醇的bufferpw,13000rpm离心min,倒掉收集管中的废液。
(10)将吸附柱重新放回收集管中,13000rpm离心1min。(注意:这一步的目的是将吸附柱中残余的乙醇除去,乙醇残留会影响后续的酶促反应。)
(11)将吸附柱置于一个新的收集管中,向吸附膜的中间部位加入50-100μledno-freebuffereb,室温放置5min,13000rpm离心2min,将质粒溶液收集到离心管中。负20℃保存质粒。
4)质粒dna定量
质粒dna定量:使用核酸定量仪进行定量,三次定量取平均值。
5)pcr扩增
根据thermoscientific公司的thermoscientificphusionhigh-fidelitydnapolymerase进行pcr扩增
(1)取一200μl的exygen的ep管。
(2)扩增体系见下表:
(3)充分混匀后,上机进行pcr扩增。
(4)按照以下程序进行扩增
6)琼脂糖凝胶电泳进行pcr扩增产物的鉴定
(1)取10μl的pcr产物于一个新的200μl的ep管。
(2)向ep管中加入2μl的5×loadingbuffer,用微量加样器混匀。
(3)向电泳槽中加入1×tae新鲜电泳缓冲液,拔掉梳子,使得电泳液没过凝胶。
(4)依次上样:5μl的dnaladder、pcr产物与loadingbuffer的混合液。目的pcr产物上14个复孔,使得回收的dna量足够后续实验。
(5)设置条件,调节电压为110伏,时间为30min。进行琼脂糖凝胶电泳。
(6)电泳结束紫外灯下观察条带位置是否正确,拍照保存。
6.1.7纯化回收凝胶dna
回收dna使用的试剂以及其他成分见下表:
(1)将单一目的dna条带从琼脂糖凝胶切下(尽量切除多余部分)放入干净的离心管中,称取重量。
(2)加入3倍体积的buffernj:如凝胶重量为0.1g,则其体积为0.1ml于55-65℃水浴中至凝胶完全融化。(注意:在凝胶完全溶解之后,观察混合物颜色,如果是粉红色,则要加入5μl浓度为3m,ph为5.2的醋酸钠,以调低其ph值。经过调节,混合物的颜色应为浅黄色。)
(3)将上一步所得的溶液加入到gbc吸附柱上(注意:吸附柱容积为800μl,若样品体积大于800μl。可分批离心后加入)。室温下放置2min后,1000×g离心60s。弃收集管中滤液,将柱子套回2ml收集管。
(4)弃收集管中滤液,将柱子套回2ml收集管。加入600μldnawashbuffer至柱子中。室温下10000×g离心30-60s。
(5)重复用dnawashbuffer洗涤柱子。室温下10000×g离心30-60s。
(6)弃收集管中滤液,柱子套回2ml收集管。室温下,13000×g离心2min以甩干柱子基质残余液体。
(7)把柱子装在一个干净的1.5ml的离心管上,加入15-25μl(具体取决于终产物浓度)elutionbuffer到柱基质上,室温放置1min,12000×g离心1min以洗脱dna。
实施例8获得脱硫生物素标记的lncrnah19
1)纯化回收的pcr产物作为模板进行体外转录
(1)解冻各试剂:将rnapolymeraseenzymemix置于冰上;
(2)将10×reactionbuffer和4种ribonucleotidesolutions(atp,ctp,gtpandutp)旋涡轻轻振荡,直到溶解。溶解后,将10×reactionbuffer置于常温,将四种ribonucleotidesolutions置于冰上。
(3)转录反应在室温进行。
①取一个200μl的无rna酶的ep管
使用微量加样器依次加入2μlatpsolution、2μlctpsolution、2μlgtpsolution、2μlutpsolution、2μl10×reactionbuffer、模板dna1μg,再加入2μl的enzymemix,最后使用核酸无酶水补齐20μl。
②使用微量加样器上下轻轻混匀。
③37℃孵育过夜。
④孵育完成,取出,在反应体系里面加1μl的dnase,混匀,37℃孵育15min。dnase的目的是去除体系里面的模板dna。
⑤终止反应,沉淀rna。在反应体系中加30μl的nuclease-freewater和30μl的氯化锂沉淀剂。
⑥彻底混匀,-20℃沉淀30min以及30min以上。
⑦4℃,最大转速离心15min来沉淀rna。
⑧小心去除上清。用1ml70%的乙醇洗沉淀一次。目的是最大程度地去除杂质。4℃,最大转速离心15min。
⑨小心去除70%的乙醇,用核酸无酶水重悬rna,对rna进行定量,负70℃保存。
2)体外转录完成的rna进行脱硫生物素标记
(1)将dmso置于冰上解冻;将30%的peg(聚乙二醇)在37℃加热直到其变成可流动液体。其余试剂于冰上解冻。
(2)准备加热器,将其调节为85℃。
(3)取一个200μl的ep管,加入5μl的未标记rna(50pmol),再加入1.25μl的dmso。dmso的作用是:
(4)按照下表加反应体系:
(5)16℃孵育过夜,过夜孵育可以增加反应效率。
(6)反应结束,在反应体系中加70μl的核酸无酶水。充分混匀。
(7)在反应体系中加100μl的chloroform:alcohol(24:1)(除去其中的rnaligase),轻轻混匀,最大转速离心3min。小心吸取上清,转移到一个新的无核酸酶的ep管中。
(8)向第七步中的上清中分别加入10μl的浓度为5m的nacl、1μl的glycogen和300μl的100%的冷乙醇。负20℃放置至少1hour。
(9)4℃,13000×g离心15min,小心去除上清,注意不要丢弃沉淀。
(10)加入300μl70%的冷乙醇枪头上下轻轻混匀,洗沉淀。4℃,13000×g离心15min,小心除去上清,将沉淀晾干(不能超过5min)。
(11)用20μl的(核酸无酶水)nuclease-freewater重悬沉淀,负80℃保存。
实施例9标记好的长链非编码rnah19与rna的结合
1)rna的制备:
(1)取一定量对数生长期的k562细胞于15ml离心管,1500rpm离心5min。
(2)弃上清,用2ml的pbs洗细胞一遍,1500rpm,离心5min。
(3)弃上清,吸掉多余上清,往离心管中加1ml的trizol,轻轻吹打混匀,冰上放置5min。
(4)将已经加了trizol的细胞裂解液吸入一个干净的且无rna酶的1.5ml的ep管,并加入200μl的氯仿,振荡30s,冰上静置10min。
(5)12000rpm,4℃,离心15min。
(6)小心吸取上清于一个新的无rna酶的ep管,加入等体积的异丙醇,负20℃放置至少20min。
(7)12000rpm,4℃,离心10min。
(8)小心除去上清,用75%的乙醇洗涤沉淀。向ep管中加入1ml75%的乙醇,吹打混匀,12000rpm,4℃离心5min。
(9)小心除去上清,重复⑧两遍。小心除去上清,将沉淀倒置于通风橱中,干2min。
(10)向沉淀中加入60μl的rna无酶水。负80℃保存。
2)按照实施例8的步骤标记rna
3)将标记好的rna与链霉亲和素磁珠结合,其中,
结合的rna量为50pmol,结合步骤如下:
(一)取一个1.5ml的ep管,加入50μl的链霉亲和素磁珠。
(二)将ep管置于磁力架,收集磁珠于ep管的一端,去除上清。
(三)加入等体积(50μl)的20mm的tris(ph7.5)进行洗涤,使用枪头重悬磁珠。
(四)重复步骤二和三。
(五)将ep管置于磁力架,收集磁珠于ep管的另一端,去除上清。
(六)加入等体积(50μl)的1×rnacapturebuffer,使用枪头重悬磁珠。
(七)加入50pmol已经标记的rna于磁珠中,轻轻混匀。
(八)室温旋转混匀,孵育30min。
然后:
(1)将结合了rna的磁珠与上述制备好的rna进行孵育,体系中加入10μl的rna酶抑制剂,4℃孵育60min。
(2)洗脱rna-rna结合复合物,具体的洗脱步骤为:
一)将ep管置于磁力架,收集磁珠于ep管的另一端,去除上清。
二)用等体积(100μl)的1×washbuffer进行复合物洗涤。
三)重复步骤一)、二)两次。
四)将ep管置于磁力架,收集磁珠于ep管的另一端,去除上清。
五)加50μl的elutionbuffer于磁珠中,混匀,37℃孵育30min。
六)将ep管置于磁力架,收集磁珠于ep管的另一端,收集上清。用于后续分析。
七)加1×上样缓冲液于复合物中。沸水中煮10min,负20℃保存。
最后,洗脱下来的复合物置于负80℃保存。
实施例10rna-rna结合复合物进行小rna测序
1)小rna样品处理的步骤如图8所示。
2)小rna数据分析步骤如图9所示。
实施例11lncrnah19靶mirna验证
使用takakra-clontech的mirna逆转录试剂盒和实时定量pcr试剂盒,对pull-down产物中的mir-19a-3p和mir-106b-5p进行检测。
实验结果:
1.以h19慢病毒载体为模板扩增带有t7启动子的体外转录的模板,结果如图10所示。
2.体外转录产物lncrnah19的鉴定:
以带有t7启动子的dna为模板,按照试剂盒说明书进行体外转录,对转录后的rna进行琼脂糖凝胶电泳,根据相对分子质量和marker的大小进行比对,结果如图11所示。
3.rna-seq检测长链非编码rnah19的靶mirna
发明人对长链非编码rnah19拉下来的rna复合物进行rna-seq测序,同时使用starbaev2.0软件预测能够与长链非编码rnah19相互作用的microrna,发现预测到的microrna中有5个与rna-seq检测到的microrna是共同的,它们分别是:hsa-mir-19a-3p、hsa-mir-106b-5p、hsa-mir-148a-3p、hsa-mir-148b-3p、hsa-mir-454-3p,结果如图12所示。
4.real-timepcr验证lncrnah19的靶mirna
发明人对rnapull-down的产物进行mirna逆转录和real-timepcr验证,发现产物中存在mir-19a-3p和mir-106b-5p,结果如图13所示。
结果分析:
lncrna与mirna相互作用类型包括:第一,mirna介导lncrna降解。incrna与细胞的增殖、分化、衰老、程序性死亡等有很紧密的联系。正因为lncrna分子链长度的特殊,才使得其链上存在许多mirna的识别位点,这些位点能够特异性地与mirna结合,介导lncrna的的降解,调控细胞的生物学功能(图14a)。例如,let-7降解lincrna-p21、let-7降解h19、mir-9降解malati等。第二:lncrna作为mirna的诱饵分子调控基因表达。lncrna可充当mirna的诱饵分子,通过靶标模仿(targetmimicry)的方式吸附mirna,抑制mirna对靶标的作用(图14b)。第三:lncrna作为mirna竞争性内源分子与mrna互作。incrna可以竞争性与mirna结合mrna,直接对靶基因进行调控(图14c)。第四:许多lncrna是mirna的前体。例如,mir-206andmir-133b是由linc-md1产生的,mir-675是由h19产生的。
在这部分实验中,发明人采用体外转录的方法,在体外获得lncrnah19(图11),然后利用生物素标记rna,采用rnapull-down技术获得lncrnah19与其结合蛋白的复合物,同时获得lncrnah19与rna结合的复合物。starbasev2.0软件可以预测mirna-lncrnainteractions、mirna-circrnainteractions、mirna-sncrnainteractions、mirna-mrnainteractions、protein-lncrnainteractins、protein-mrnainteractions、protein-pseudogeneinteractions、protein-sncrnainteractions。rna-seq检测到有1134个小rna分子,starbasev2.0软件预测到与lncrnah19互作的mirna有40个,两者共同的mirna分子有5个(图12),它们分别是:hsa-mir-19a-3p、hsa-mir-106b-5p、hsa-mir-148a-3p、hsa-mir-148b-3p、hsa-mir-454-3p。经过验证得出,lncrnah19的靶mirna有mir-19a-3p和mir-106b-5p(图13)。
第三部分lncrnah19靶mirnamir-19a-3p的功能研究
1、mir-19a-3p反义核酸的序列由生工生物工程(上海)股份有限公司合成
2.细胞株
k562细胞株,人慢性粒细胞白血病系,购于中国科学院上海细胞库。
3.mtt溶液
将100mg的mtt粉末溶于20ml的ph7.2的pbs中,配制成浓度为5mg/ml的溶液,0.22μm滤膜过滤除菌,4℃避光保存。
实施例12靶向抑制mir19a-3p对k562细胞活力的影响
实验方法:
(1)实验分为空白组(blank)、随机对照组(scr)、mir19a-3p反义核酸组,每组设置5个复孔。
(2)取对数生长的细胞,用无血清、无抗生素的rpmi-1640培养基将细胞悬液浓度调整为10×104/ml,每孔50μl的细胞悬液接种于96孔板中,每个实验组重复5个复孔。
(3)稀释lipofectaminetm2000:根据lipofectaminetm2000说明书配制,取所需的lipofectaminetm2000的量,使用opti-mem优化培养基稀释。室温静置5min。
(4)稀释反义核酸:根据lipofectaminetm2000说明书对转染反义核酸的要求配制反义核酸。取所需的反义核酸,使用opti-mem优化培养基稀释
(5)将上述稀释好的lipofectaminetm2000与反义核酸稀释液按照1:1的比例混合,室温静置20min。
(6)每组各取50μl缓慢滴加于细胞悬液中,空白组加50μl的opti-mem优化培养基,每组5个复孔,每孔终体积为100μl。将96孔板置于37℃、co2体积分数为5%的细胞培养箱中,饱和湿度下培养6h后,每孔加100μl的含20%血清的rpmi-1640培养基,使得细胞培养基中血清含量为10%。
(7)培养48h后,每孔加入mtt溶液20μl,置于培养箱培养4h,1000rpm,离心20min,离心后用移液枪小心将上清吸出,每孔再加入150μl的dmso,振荡10min,溶解结晶。
(8)在多功能酶标仪上测定吸光度a570。实验重复3次,计算增殖抑制率。增殖抑制率(%)=(1-a实验组/a对照组)×100%。
实施例13靶向抑制mir19a-3p对k562细胞colony形成的影响
具体方法参见实施例12。
本部分的数据处理使用spss统计软件,数据以均数±标准差表示,采用单因素方差分析法,(one-wayanova)分析各组数据间差异的显著性,以p﹤0.05为有显著性差异。
实验结果:
1、靶向抑制mir-19a-3p后对k562细胞增殖能力的影响
如图15所示,在k562细胞中转染浓度为100nm的scr、mir-19a-3p反义核酸,48h后检测细胞活力,发现mir-19a-3p反义核酸转染组的细胞活力明显减弱,具有统计学意义(p<0.05)。
2、靶向抑制mir-19a-3p后对k562细胞colony形成的影响
如图16所示,在k562细胞中转染浓度为100nm的scr、mir-19a-3p反义核酸后进行colony形成实验,与空白组和scr组相比,发现mir-19a-3p反义核酸转染组细胞的colony形成能力减弱,具有统计学意义(p<0.05)。
本部分实验主要研究了lncrnah19的靶mirna的功能,发明人合成了mir-19a-3p反义核酸,使其抑制后,研究mir-19a-3p对k562细胞的影响,发现靶向抑制mir-19a-3p,抑制了k562细胞的增殖(图15),减弱了k562细胞的colony形成能力(图16)。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!