三维结构可控的多层功能性支架的制备方法及应用与流程
本发明属于医用材料技术领域,具体涉及三维可控结构的多层功能性支架的制备方法及应用。
背景技术
自然界的生物已经逐步进化出了各种精妙的结构,以至于在许多情况下具有非凡的功能。作为最具代表性和最吸引人的例子之一,生物多层体系结构在生物体中表现出各种各样的形式(如骨骼、血管和皮肤等)。这样的结构起着支撑生物体,避免渗血和屏障的功能。一般来说,生物多层体系结构由两部分组成,即微层的宏观组装和微尺度上的单个微层。在宏观尺度上(从几百微米到毫米),具有三维结构的支架不仅可以模拟自然组织结构,还可以使细胞生长到最佳的组织。在微观尺度上,支架的局部形貌可以为细胞提供关键的微环境从而来控制细胞的各种行为(如增殖,分化等等)。因此,将不同尺度的结构整合到一个支架上是一件很重要的事情。
受大自然生物结构功能特性的启发,研究人员已经投入了大量的精力来制备具有多层结构的功能性支架。许多种技术,包括电纺、溶剂铸造、相分离微加工、层层自组装、冷冻干燥等已经用于制造这种支架。然而,上述方法中仍然存有许多问题,如使用有毒溶剂、支架内部的有机溶剂残渣、难以大规模生产等等。因此,人们非常希望以一种大规模和环保的方式来制造多层结构的功能性支架。另一方面,由于难以将准备好的预成型材料转换成新的具有不同结构的支架而受阻,并大大缩小了多层支架的应用范围。因此,为了满足各种应用的不同需求,灵活的变换支架的三维结构是另一件极其重要的事情。
技术实现要素:
本发明的目的在于提供一种三维结构可控的多层功能性支架的制备方法,适用性广,成本低廉,环境友好,生产效率高。
本发明的另一目的在于提供上述制备方法制备的支架三维结构可控的多层功能性支架的应用。
为实现上述目的,本发明采用以下技术方案:
三维结构可控的多层功能性支架的制备方法,包括以下步骤:
步骤1:将医用级左旋聚乳酸粒料与聚环氧乙烷粒料置于烘箱中烘干水分,然后置于单螺杆挤出机中进行熔融共混,挤出料条;
步骤2:将步骤1中所得的料条利用三辊压光机进行无拉伸冷却,然后剪切成长度为40~60cm的料条,得到具有交替多层同心圆柱结构的聚乳酸/聚环氧乙烷挤出物;
步骤3:将步骤2中得到的聚乳酸/聚环氧乙烷挤出物再次剪切成长度为5~20mm的料条,经热压工艺、打孔工艺或缠绕工艺得到支架预制品;
步骤4:将步骤3中所得的支架预制品放置于去离子水中去除聚环氧乙烷层,沥滤,得到三维结构可控的多层功能性支架。
进一步地,步骤1中所述烘箱的温度为30~45℃,烘干时间为12~24h。
进一步地,步骤1中所述医用级左旋聚乳酸粒料与聚环氧乙烷粒料的质量比为1:(0.6~1.5)。
进一步地,步骤1中所述单螺杆挤出机的转速为10~60rpm/min、挤出温度为170℃。
进一步地,步骤3中所述热压工艺是在热压温度为80~130℃下将所述料条压制出不同的宏观形状。
进一步地,步骤3中所述打孔工艺是在所述料条的横切面上钻出不同形状的内部通道。
进一步地,步骤3中所述缠绕工艺是将漆包线或纱布缠绕至所述料条的外表面形成不同的表面形貌。
进一步地,步骤4中所述支架预制品放置于去离子水中的时间为15天。
本发明还提供上述制备方法制备的三维结构可控的多层功能性支架在药物输送中的应用。
本发明还提供上述制备方法制备的三维结构可控的多层功能性支架在培养自接种细胞中的应用。
相比现有技术,本发明的有益效果在于:
1.本发明通过熔融挤出加工来制备具有交替多层同心圆柱结构的聚乳酸/聚环氧乙烷挤出物,其层与层间界限分明,无连接,经热压、打孔或缠绕处理改变其宏观形状、内部结构以及表面形貌,并且在去除peo后,得到三维结构可控的多层功能性支架,支架中的微层和间隙是交替排列的,支架孔隙率高达69%。
2.本发明制备的三维结构可控的多层功能性支架同时具有宏观尺度、微观尺度和纳米尺度的结构,这种结构导致了支架具有强劲的毛细管力,有助于亲水性和亲脂性药物的吸附,以及细胞的自接种,而使支架应用范围更广,可以满足不同领域的使用要求。
3.本发明制备方法采用了简单通用的材料及加工设备,在加工过程中没有添加任何有毒有害溶剂,环境友好,工艺简单,成本低廉,易于控制,生产效率高,解决了现有制备方法中难以规模化、低成本生产结构可控的多层功能性支架的问题。
附图说明
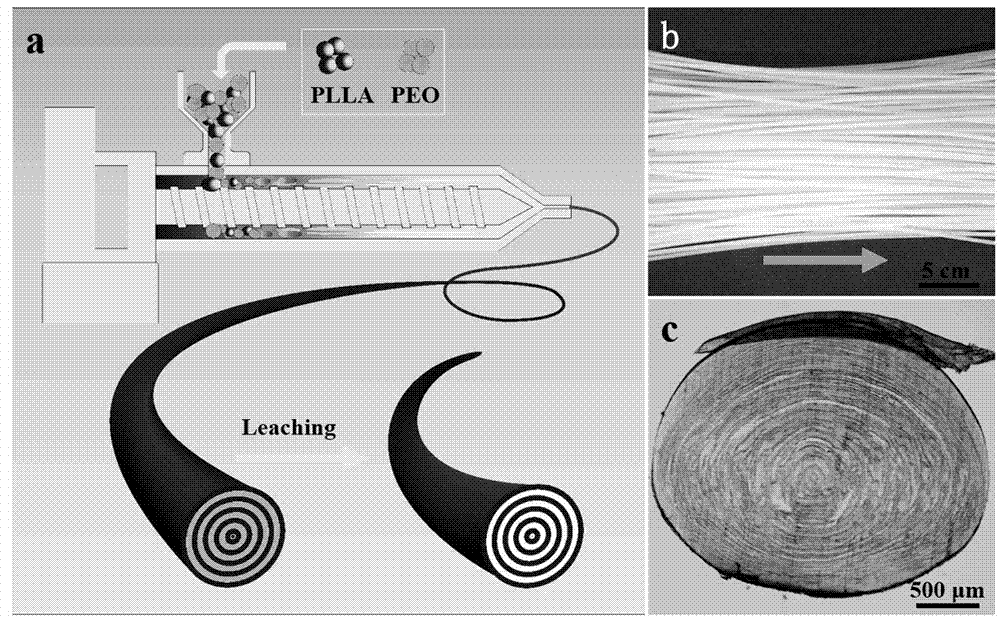
图1为本发明聚乳酸/聚环氧乙烷挤出物的制备过程示意图。
图2为本发明聚乳酸/聚环氧乙烷挤出物放置于去离子水中去除聚环氧乙烷相后的扫描电子显微镜照片。
图3为本发明聚乳酸/聚环氧乙烷挤出物内部微层厚度以及微层之间的间隙距离统计直方图。
图4为实施例1中具有不同宏观形状的多层功能性支架的扫描电子显微镜照片。
图5为实施例2中具有不同内部通道的多层功能性支架的扫描电子显微镜照片。
图6为实施例3中具有不同表面形貌的多层功能性支架的照片。
图7为本发明多层功能性支架的油/水润湿性检测图。
图8为本发明多层功能性支架的药物负载分布图。
图9为本发明多层功能性支架吸附两种药物后的体外释放曲线。
图10为本发明多层功能性支架自接种细胞的细胞分布图。
具体实施方式
以下实施例用于说明本发明,但不用来限定本发明的保护范围。若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段。下述实施例中的试验方法,如无特别说明,均为常规方法。
下述实施例中烘箱型号为zksfb-1,购自上海树立仪器仪表有限公司;单螺杆挤出机的型号为cjs-20,购自上海昌凯机电科技有限公司;真空压膜机的型号为y002,购自郑州工匠机械设备有限公司;医用级左旋聚乳酸粒料(plla,1.97×105g/mol)购自美国natureworks;聚环氧乙烷(peo,1×105g/mol)购自陶氏化学。
实施例1
三维结构可控的多层功能性支架的制备方法,包括以下步骤:
步骤1:将800gplla粒料与1200gpeo粒料置于烘箱中在40℃下,烘干12h,烘干水分,放入超大号自封袋混合均匀,然后置于单螺杆挤出机中进行熔融共混,在挤出温度为170℃、螺杆转速为20rpm/min下挤出料条。
步骤2:将步骤1中所得的料条利用三辊压光机进行无拉伸冷却,然后剪切成长度为40cm的料条,得到具有交替多层同心圆柱结构的聚乳酸/聚环氧乙烷挤出物。
步骤3:将步骤2中得到的聚乳酸/聚环氧乙烷挤出物再次剪切成长度为10mm的料条,然后固定于定制的三角形、长方形及椭圆形模具中,将真空压膜机升温至100℃,并将料条放置真空压膜机中保温10分钟,再将料条取出手动加压1分钟,分别得到具有三角形截面、长方形截面及椭圆形截面的支架预制品,如图4-a~4-c所示。
本发明不对模具的形状进行具体限定,模具的形状还可以是其他多边形、圆台形等。
步骤4:将步骤3中所得的三种支架预制品放置于去离子水中15天去除peo相,沥滤,得到三种具有不同宏观形状的多层功能性支架,如图4-d~4-f所示。
参考图1,图1示出了本发明步骤2中聚乳酸/聚环氧乙烷挤出物的制备过程示意图,其中1-a为挤出成型过程示意图;1-b为挤出后剪断的料条;1-c为料条的偏光图片。将步骤2制备的交替多层同心圆柱结构的聚乳酸/聚环氧乙烷挤出物沿横截面方向于超薄切片机上,切取厚度为20μm的超薄切片,然后置于载玻片上在放大倍数为50倍的偏光显微镜(olympusbx51型)下观察微观结构,其中横截面为垂直于挤出方向,结果如图1-c所示。由图1-c可以看出,偏光图片中有很多规则有序的同心环微层,这种同心环微层由plla层和peo层交替组成,层与层之间没有连接。
参考图2,图2示出了本发明聚乳酸/聚环氧乙烷挤出物(未进行热压工艺处理)放置于去离子水中去除聚环氧乙烷相后的扫描电子显微镜照片,其中2-a~2-c为支架的横截面图片;2-d~2-f为支架的纵截面图片;2-g~2-i为支架的内部微层表面。由图2可以看出,这种方法制备出的支架具有多层同心圆柱结构,并且层与层之间没有连接,微层与间隙高度有序交替排列,形成了完善的多层结构。这一有趣的形态学演化应该主要归因于熔体挤压过程中的剪切流场,在单螺杆挤出机形成的弱剪切流场下,离散的plla液滴和peo液滴更有可能合并而不是分裂。随后,单独聚结的plla液滴和peo液滴可以形成完整的微层,并由于剪切流场而进一步组合成一个交替的多层结构。微层在流场的作用下形成了平行于挤出方向的沟槽,由于plla结晶还形成了纳米尺度的晶片,这种微纳结构有助于细胞的生长。
参考图3,图3示出了本发明聚乳酸/聚环氧乙烷挤出物放置于去离子水中去除聚环氧乙烷相后的内部微层厚度以及微层之间的间隙宽度统计直方图,其中3-a为微层厚度统计图,3-b为间隙宽度统计图。对挤出物的横截面进行了分析,并用imagej软件对图像进行了分析,以测量相邻微层之间的微层厚度和间隙宽度。对每个样本进行了30次测量,共测量了10个样本。从图3可以看出,微层厚度和间隙宽度均符合正态分布,其平均值分别为10μm和20μm,这种同心圆柱形的结构可保证挤出物的高孔隙率。
参考图4,图4为示出了本实施例中具有不同宏观形状的多层功能性支架的扫描电子显微镜图片,其中4-a~4-c为经热压工艺处理得到的具有不同宏观形状的支架预制品;4-d~4-f为去除peo层的不同宏观形状的三维结构可控的多层功能性支架;4-g~4-i分别是图4-d~4-f中微层的放大图片。从图4-g~4-i可以看出,经热压工艺处理后,多层功能性支架的微层没有被破坏。
实施例2
三维结构可控的多层功能性支架的制备方法,包括以下步骤:
步骤1:将800gplla粒料与1200gpeo粒料置于烘箱中在30℃下,烘干24h,烘干水分,放入超大号自封袋混合均匀,然后置于单螺杆挤出机中进行熔融共混,在挤出温度为170℃、螺杆转速为40rpm/min下挤出料条。
步骤2:将步骤1中所得的料条利用三辊压光机进行无拉伸冷却,然后剪切成长度为60cm的料条,得到具有交替多层同心圆柱结构的聚乳酸/聚环氧乙烷挤出物。
步骤3:将步骤2中得到的聚乳酸/聚环氧乙烷挤出物再次剪切成长度为10mm的料条,然后固定于三爪卡盘并放于微型电钻下面,将直径为1mm、0.6mm及0.35mm的钻头固定于微型电钻,启动微型电钻进行钻孔,分别得到孔径为1mm的单通道、孔径为0.6mm的三通道及孔径为0.35mm的六通道的支架预制品,如图5-a~5-c所示。
步骤4:将步骤3中所得的三种支架预制品放置于去离子水中15天去除peo相,沥滤,得到三种具有不同内部通道的多层功能性支架,如图5-d~5-f所示。
请参照图5,图5示出了本实施例中具有不同内部通道的多层功能性支架的扫描电子显微镜图片,其中5-a~5-c为经打孔工艺处理得到的具有不同内部通道的支架预制品;5-d~5-f为去除peo层的不同内部通道的三维结构可控的多层功能性支架;5-g~5-i分别是图5-d~5-f中微层的放大图片。从图5-g~5-i可以看出,经打孔工艺处理后,多层功能性支架的微层没有被破坏。
实施例3
三维结构可控的多层功能性支架的制备方法,包括以下步骤:
步骤1:将800gplla粒料与1200gpeo粒料置于烘箱中在40℃下,烘干24h,烘干水分,放入超大号自封袋混合均匀,然后置于单螺杆挤出机中进行熔融共混,在挤出温度为170℃、螺杆转速为30rpm/min下挤出料条。
步骤2:将步骤1中所得的料条利用三辊压光机进行无拉伸冷却,然后剪切成长度为40cm的料条,得到具有交替多层同心圆柱结构的聚乳酸/聚环氧乙烷挤出物。
步骤3:将步骤2中得到的聚乳酸/聚环氧乙烷挤出物再次剪切成长度为20mm的料条,将直径为0.1mm的漆包线以螺旋线的方式缠绕至料条表面,线与线之间不留缝隙,得到表面具有螺旋沟槽的支架预制品,如图6-a所示;将直径为0.1mm的漆包线缠绕至一块边长为10mm的正方形铁皮上,缠绕线之间不留缝隙,缠绕线长度为8mm,然后用胶带将一面粘上并用手术刀将两边隔断得到均匀平行排列的漆包线,将平行排列的漆包线放置至料条表面并用漆包线裹紧得到表面具有平行沟槽的支架预制品,如图6-b所示;用500目的纱布缠绕至料条表面并用胶带将接口粘住,可得到表面具有凹陷的支架预制品,如图6-c所示。
本发明不对漆包线的直径进行具体限定,直径可以为0.1mm、0.05mm及0.2mm;本发明对纱布规格不进行具体限定,纱布可以为500目、400目及300目。
步骤4:将步骤3中所得的三种支架预制品放置于去离子水中15天去除peo相,沥滤,得到三种具有不同表面形貌的多层功能性支架,如图6-d~6-f所示。
请参照图6,图6示出了本实施例中具有不同表面形貌的多层功能性支架的图片,其中6-a~6-c为经缠绕工艺处理得到的支架预制品的超景深显微镜图片;6-d~6-f为支架的扫描电子显微镜图片;6-g~6-i为支架的三维共聚焦显微镜图片;6-j-~6-l分别是6-g~6-i中虚线对应的z轴深度图片。从图6可以看出,经缠绕工艺处理后,多层功能性支架的微层没有被破坏。
实施例4
本实施例与实施例1基本相同,不同之处在于:步骤1中将800gplla粒料与800gpeo粒料置于烘箱中在45℃下,烘干24h,烘干水分,放入超大号自封袋混合均匀,然后置于单螺杆挤出机中进行熔融共混,在挤出温度为170℃、螺杆转速为60rpm/min下挤出料条。步骤3中将聚乳酸/聚环氧乙烷挤出物再次剪切成长度为5mm的料条,真空压膜机升温至80℃。
实施例5
本实施例与实施例1基本相同,不同之处在于:步骤1:将800gplla粒料与480gpeo粒料置于烘箱中在30℃下,烘干24h,烘干水分,放入超大号自封袋混合均匀,然后置于单螺杆挤出机中进行熔融共混,在挤出温度为170℃、螺杆转速为10rpm/min下挤出料条。步骤3中将聚乳酸/聚环氧乙烷挤出物再次剪切成长度为15mm的料条,真空压膜机升温至130℃。
实施例6
取实施例1中得到的多层功能性支架进行应用表征:
(1)采用液体置换法来测量多层功能性支架的孔隙率。首先记录支架的重量和体积(分别为w0和v0),然后将支架浸泡至乙醇溶液中至饱和状态,此时重量记为w1,则孔隙率计算为:(w1-w0)/(v0×ρ)×100%,其中ρ为乙醇的密度。十个样品被测量然后求平均值,得出其孔隙率为69%。
(2)采用高速摄像机来观察多层功能性支架的油/水润湿性。将一滴油或水垂直滴落至支架横截面,结果如图7所示,其中7-a为油,7-b为水。由图7可以看出,油和水可以在非常短的时间内被吸入支架内部,表明了支架具有优异的双亲性,可以很好的吸附和负载亲水性和亲脂性药物。
(3)采用荧光显微镜来观察多层功能性支架吸附不同药物的分布图片。将多层功能性支架分别浸泡至10ml香豆素乙醇溶液和罗丹明水溶液,时间为12h,然后取出干燥后切片观看药物分布情况,结果如图8所示,其中8-a为切片示意图,8-b、8-c为亲脂性药物香豆素负载分布图,8-d、8-e为亲水性药物罗丹明负载分布图。由图8可以看出,药物可以均匀分布在支架中间和端部;图8-b和8-d中,同心圆的中心和边部同样没有颜色差异,可以说明了药物负载的均一性。由此可以看出,本发明制备的多层功能性支架可以有效地负载亲水性亲脂性药物。
(4)将上述负载药物的多层功能性支架进行模拟体外释放实验,并用分光光度计进行定量统计计算,结果如图9所示,其中9-a为香豆素,9-b为罗丹明。从图9中可以看出,两种药物的释放均具有明显的缓释特征。
(5)将本发明制备的多层功能性支架进行自接种细胞实验,为了证明毛细管力的作用,设置两种支架:预先浸湿细胞培养基的支架和干燥的支架。将支架一端接触100微升的细胞悬浮液,等待几秒钟,液体可以被吸附进入支架内部,然后进行切片观察,结果如图10所示,其中10-a为接种实验及切片观察示意图,10-b为预先浸湿细胞培养基的多层功能性支架自接种细胞实验荧光图片,10-c~10-f为干燥的多层功能性支架自接种细胞实验荧光图片。由图10-b、10-c可以看出,由于支架本身具有的毛细管力,细胞可以被均匀的吸附到支架内部,提高了细胞的接种效率,有助于组织再生和简化临床应用。
以上所述之实施例,只是本发明的较佳实施例而已,仅仅用以解释本发明,并非限制本发明实施范围,对于本技术领域的技术人员来说,当然可根据本说明书中所公开的技术内容,通过置换或改变的方式轻易做出其它的实施方式,故凡在本发明的原理上所作的变化和改进等,均应包括于本发明申请专利范围内。
- 还没有人留言评论。精彩留言会获得点赞!