一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法与流程
本发明涉及一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法。
背景技术:
维生素是人体必需的营养素之一,根据它们在水溶液中的溶解性可分为水溶性维生素和脂溶性维生素。水溶性维生素主要有:硫胺素(维生素b1)、核黄素(维生素b2)、尼克酸(维生素pp、烟酸、烟酰胺)、砒哆醇(维生素b6)、氰钴素(维生素b12)、叶酸、泛酸、生物素、抗坏血酸(维生素c)等,易溶于水,在体内几乎不能储备。脂溶性维生素主要有维生素a、d、e与k。作为人体必须的营养素之一,所有的维生素在体内含量都很少,但在机体的代谢、生长、发育等过程中起着重要作用。脂溶性维生素和水溶性维生素的共同特点有:1、一般不能在体内合成,或即使在体内合成(如维生素d),其合成的量也很少,必须由食物提供或外界补充;2、不是人体的构成成分,也不提供能量,但具有特殊功能;3、人体需要量很小,但绝对不能缺少,如果某种维生素的缺乏达到一定程度,就会引起相应的维生素缺乏症。不同维生素有着不同的功能,人体缺乏维生素将出现不同症状。正常人维生素的供应主要来源于食物,而对于特殊营养需求者或者老年营养性疾病患者、慢性充血性心力衰竭和同时存在的食欲减退和肝功能紊乱的患者、慢性充血性心力衰竭患者、肿瘤尤其是进展期恶性肿瘤患者、外科手术患者等,注射途径补充多种维生素作为一种全胃肠外营养制剂,有利于促进和平衡人体组织的新陈代谢,有利于提高治愈率,是药物治疗的很好辅助。根据我国营养学会及美国医学会营养指导小组推荐,静脉营养时需补充13种维生素,包括4种脂溶性维生素和9种水溶性维生素。注射用12种复合维生素(施尼维他)是目前我国唯一上市的同时含有水溶性和脂溶性维生素的注射用复合维生素品种,含有12种维生素(不含维生素k),尚不能完全满足患者对4种脂溶性维生素的需要。极为重要的是,注射用12种复合维生素在美国已撤市,理由是处方配比不合理。注射用12种复合维生素(施尼维他)是采用大豆磷脂和甘氨胆酸混合胶束増溶,该技术増溶体系具有不稳定性,当被稀释或与其他营养液混合时,易出现浑浊或沉淀现象。在美国上市的13种维生素注射液(infuviteadult),2瓶装形式。其中,瓶1含有4种维生素(a、d、e、k)和5种水溶性维生素(维生素b1、b2、b6、维生素c、烟酰胺、右泛醇),采用吐温80増溶。瓶2含有3种水溶性维生素(维生素b12、生物素、叶酸),采用30%的丙二醇作为溶剂。长期应用中发现,吐温80具有一定的药理作用和毒性,最突出的是溶血作用,另外对心脏有抑制作用,能引起血压轻度下降。因此,吐温类不适合作为静脉给药制剂增溶剂,尤其是营养类制剂。该品种采用2瓶分装,在临床使用时需要反复抽取混合,给临床应用造成不便,增加了污染的可能,并且采用2瓶分装,生产成本增加。该品种储存条件为冷藏(2-8℃条件),储存条件苛刻,不利于运输。专利cn101181289提供了一种13种复合维生素注射剂及其生产工艺,该专利中采用了抗氧剂和络合剂,采用了吐温类混合助溶剂,并且是2支装。其中注射剂中加入抗氧剂、络合剂均增加安全性风险,不利于产品的安全性;吐温类80具有一定毒性,如溶血作用,对心脏有抑制作用;另外,两瓶装,虽然能解决了共溶性问题,但是增加了生产成本,同时临床配制使用造成二次污染的风险。专利cn102018720提供了一种复合维生素冻干粉针剂的制备方法,该专利的目的是提供制备一种低成本、工艺简单、稳定的12种复合维生素冻干粉针剂,该制备方法的主要创新点是通过增加适当的吐温80溶解脂溶性维生素和水溶性维生素,使2类维生素共溶一起,然后进行冻干。这种方法虽然能够使两类维生素共溶一起,但是吐温80的处方量大,吐温类80具有一定毒性,易造成溶血;该处方工艺没有赋形剂,冻干品外观、渗透压、复溶速度、澄清度均难以保证;另外,该处方为12种维生素,缺维生素k1,不能满足肠外营养要求。专利cn102652744和专利cn104415041提供了一种的13种复合维生素注射液及其制备方法,该两份专利旨在克服溶解性和稳定性。该两利的不足有:①吐温80助溶剂有一定毒性,影响注射的安全性;②处方中添加抗氧剂,不利于注射的安全性;③2支装,生产成本高,临床配制使用易造成二次污染。④注射液,运输保存不便利。专利cn104337829提供了一瓶装脂微乳复合维生素冻干制剂,该专利采用微乳工艺解决脂溶性维生素和水溶性维生素共溶一起问题,但是生产工艺复杂,工业化难,且冻干复溶后易破乳,造成分层或不溶物等问题。另外,该专利的制备方法采用的辅料种类多,不利于注射安全性。总体而言,目前13种复合维生素注射液制剂存在的如下缺陷:1.脂溶性维生素不溶于水,难以和水溶性维生素共溶;2.所得产品稳定性差;3.制备13种复合维生素的传统方法采用吐温类增溶剂,毒性大,同时用到的抗氧剂和防腐剂也有一定毒副作用;4.现有13种复合维生素的注射剂渗透压不等渗,易引起溶血;5.已上市的13种复合维生素的注射剂为2瓶装,临床配制易造成再次污染风险;6.目前的13种复合维生素制剂需要冷冻贮藏,不利于储存和运输。维生素化学性质极不稳定,对光、热和氧不稳定,很容易降解。13种维生素成分中,4种为脂溶性维生素,9种水溶性维生素,将13种维生素制备成共溶的水溶液一直为本
技术领域:
的技术难题。13种维生素注射剂
技术领域:
中,一般采用吐温类助溶剂的技术或普通乳剂的技术解决13种维生素共溶问题。但是,吐温类助溶剂具有一定的毒副作用,其为提高维生素稳定性,通常加入抗氧剂,但是抗氧剂也具有一定的毒副作用。在公开的关于13种维生素注射剂的微球专利技术方案中,均属于亚微乳或微乳技术,属于普通乳剂范畴,其乳剂处方油相基本采用包括大豆油等长链甘油三酸酯,乳化剂使用磷脂为主的乳化剂,最终得到的乳剂粒径一般在150nm以上,通常在200-500nm范围,因无菌过滤滤膜孔径为0.22μm,不能符合注射剂无菌过滤的要求。技术实现要素:本发明的目的在于提供一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法。本发明所采取的技术方案是:一种多种维生素肠外营养剂毫微球冻干注射剂,该冻干注射剂由以下配方制成,每4000mg冻干前药液中,含有维生素a2300~3300iu、维生素d3150~200iu、维生素e7~10iu、维生素k1150~200mcg、维生素c200~400mg、维生素b11~6mg、核黄素磷酸钠1.4~4.9mg、烟酰胺17~40mg、维生素b61~6mg、维生素b121~5mcg、右泛醇5~15mg、叶酸140~600mcg、生物素20~60mcg、中链甘油三酸酯10~50mg、大豆卵磷脂3~20mg、15-羟基硬脂酸聚乙二醇10~50mg、甘油22~28mg、甘露醇340~360mg,余量为水;其中,大豆卵磷脂与15~羟基硬脂酸聚乙二醇的质量比为1:1.4~4;中链甘油三酸酯与大豆卵磷脂和15~羟基硬脂酸聚乙二醇总重量的质量比为1:1~4。进一步的,所述甘油的含量为25mg。进一步的,所述甘露醇的含量为350mg。多种维生素肠外营养剂毫微球冻干注射的制备方法,包括以下步骤:1)脂质毫微球溶液的制备:在惰性气体或氮气的保护下,将维生素a、维生素e、维生素d3、维生素k1与中链甘油三酸酯混合,再加入15-羟基硬脂酸聚乙二醇酯和大豆卵磷脂,于50~70℃加热搅拌至溶解澄清形成油相混合物;在惰性气体或氮气的保护下,往油相混合物中加入50~70℃的甘油和适量水,搅拌冷却至30℃以下,得到脂质毫微球溶液;水溶性溶液的制备:在惰性气体或氮气的保护下,将维生素c、维生素b1、维生素b2、维生素b6、维生素b12、烟酰胺、右泛醇、生物素、叶酸、甘露醇溶解于适量水中,调节ph值至5.0~7.0,得到水溶性溶液;整个操作过程中的温度不超过30℃;2)在惰性气体或氮气的保护下,将上述脂质毫微球溶液缓慢加入到水溶性溶液中,加水至全量,搅拌至澄清,调节ph值至5.0~7.0,滤膜除菌过滤,得混合药液;整个操作过程中的温度不超过30℃;3)将上述混合药液灌装于瓶中,冻干;各原料的用量如上述任一项所述。进一步的,上述方法整个操作过程中的光强均不超过100lx。进一步的,所述滤膜为孔径为0.22μm的滤膜。进一步的,所述冻干的具体操作过程为:将温度降至-40℃~-50℃,然后将温度升至-10℃~-20℃,维持1~2小时,再将稳定将至-40℃~-50℃,维持2~5小时;在真空度为5~20pa,将温度升至-5℃~-15℃,维持20±3小时;再将温度升至-1~1℃,维持1~2小时;再升温至20℃~30℃,维持3~10小时。进一步的,步骤3)中,将混合药液灌装于棕色西林瓶中,半压塞,然后进行冻干。进一步的,冻干后对棕色西林瓶进行真空压塞,扎盖。本发明的有益效果是:1、本发明将脂溶性维生素制成脂质毫微球溶液,可以与水溶性维生素溶液共溶,巧妙的办法解决了脂溶性维生素和水溶性维生素共溶问题。本发明的脂溶性维生素制成脂质毫微球溶液,为澄清透明液体,可以无限的水溶液稀释。2、采用毫微球冻干注射剂的制备工艺,有效解决脂溶性和水溶性维生素共溶1瓶的难题。单瓶装,复溶快,临床应用便捷,不易受污染。3、本发明将脂溶性维生素制成脂质毫微球溶液,粒径小,可满足0.22μm滤膜无菌过滤要求。4、安全性高:本
技术领域:
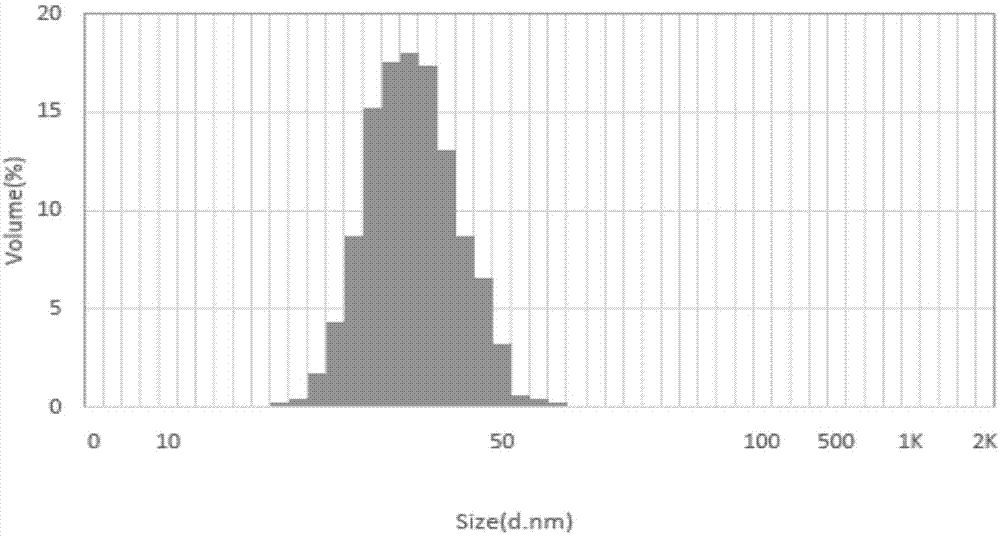
的人员均知,吐温80、抗氧剂和防腐剂具有一定的毒性。本品不含有具有一定毒性的吐温80,不含有任何抗氧剂和防腐剂,本品采用的均为可注射用辅料。5、质量高、稳定性好:水分低(≤2.0%),包括整个生产过程控制,成品质量高,稳定性好,可常温储存。6、生产工艺易操作,生产成本低:在gmp生产线条件即可实现,单瓶装,辅料少,冻干时间短,制备工艺易简单、生产成本低。附图说明图1实施例1冻干前药液的粒度分布图;图2实施例1冻干注射剂样品复溶后药液的粒度分布图;图3实施例2冻干前药液的粒度分布图;图4实施例2冻干注射剂样品复溶后药液的粒度分布图。具体实施方式下面结合具体实施例对本发明作进一步的说明。实施例1一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法一种多种维生素肠外营养剂冻干制剂的配方为表1所示。表1多种维生素肠外营养剂冻干制剂的配方制备方法:整个操作过程避光操作,照度≤100lx。步骤1,在氮气保护下,将处方量的维生素a、维生素e、维生素d3、维生素k1加到处方量的中链甘油三酸酯中混合,再加入处方量的15-羟基硬脂酸聚乙二醇酯和大豆卵磷脂,加热至60±10℃,继续搅拌至溶解澄清形成油相混合物。整个过程避光操作,照度≤100lx。步骤2,在氮气保护下,缓慢搅拌,加入60±10℃的处方量甘油和适量注射用水混合溶液,搅拌冷却至≤30℃得到透明澄清的脂质毫微球溶液。整个过程避光操作,照度≤100lx。步骤3,在氮气保护下,将维生素c、维生素b1、维生素b2、维生素b6、维生素b12、烟酰胺、右泛醇、生物素、叶酸、甘露醇溶解于适量的注射用水中,用hcl或naoh溶液调节ph值至5.0~7.0,得到水溶性溶液。整个过程控制药液温度不超过30℃,避光操作,照度≤100lx;步骤4,在氮气保护下,缓慢搅拌,将步骤2的脂溶性维生素毫微球溶液缓慢加入到步骤3的水溶性溶液中,加注射用水至全量,搅拌至澄清,调节ph值至5.0~7.0,用0.22μm微孔滤膜除菌过滤,得透明澄清的液体。整个过程控制药液温度不超过30℃,避光操作,照度≤100lx;步骤5,灌装于棕色西林瓶中,半压塞,避光操作,照度≤100lx;步骤6,将灌装好的药液进行冻干:1)预冻:将温度降至-40℃~-50℃,然后将温度升至-10℃~-20℃,维持1~2小时,再将稳定将至-40℃~-50℃,维持2~5小时;2)升华干燥:在真空度为5~20pa,将温度升至-5℃~-15℃,维持20±3小时;3)解析干燥:将温度升至0℃,维持1~2小时;再升温至20℃~30℃,维持3~10小时。4)真空压塞,扎盖,得多种维生素肠外营养剂毫微球冻干注射剂。本实施例制得的产品外形饱满,橙黄色疏松块状物,水分为1.5%,复溶性好、快,渗透压为298mosmol/kg,稳定性好,可常温储存,每瓶用5ml注射用水复溶后等渗,安全性高。将本实施例冻干前的药液外观透明,无乳光,不分层,对其粒径进行检测,测定结果如图1所示,其平均粒径为42.35nm,pdi为0.105,90%体积的粒径积累在49.5nm。将本实施例制得的多种维生素肠外营养剂毫微球冻干注射剂进行复溶后,复溶后药液外观透明,无乳光,不分层,对其粒径测定的结果如图2所示。复溶后的平均粒径为55.48nm,pdi为0.204,90%体积的粒径积累在60.7nm。在本发明特定配方情况下,脂溶性维生素可以被制备出粒径小达42.35nm的脂质毫微球液体,同时所得脂质毫微球液体可以加水无限稀释,并且稀释后的液体仍为澄清透明脂质毫微球液体,且粒径不会发生明显变化,该液体属于热力学稳定体系。且本发明冻干注射剂在冻干前或加水复溶后,均为透明澄清的脂质毫微球。实施例2一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法一种多种维生素肠外营养剂冻干制剂的配方为表2所示。表多种维生素肠外营养剂冻干制剂的配方制备方法:整个操作过程避光操作,照度≤100lx。步骤1,在氮气保护下,将处方量的维生素a、维生素e、维生素d3、维生素k1加到处方量的中链甘油三酸酯中混合,再加入处方量的15-羟基硬脂酸聚乙二醇酯和大豆卵磷脂,加热至60±10℃,继续搅拌至溶解澄清形成油相混合物。整个过程避光操作,照度≤100lx。步骤2,在氮气保护下,缓慢搅拌,加入60±10℃的处方量甘油和适量注射用水混合溶液,搅拌冷却至≤30℃得到透明澄清的脂质毫微球溶液。整个过程避光操作,照度≤100lx。步骤3,在氮气保护下,将维生素c、维生素b1、维生素b2、维生素b6、维生素b12、烟酰胺、右泛醇、生物素、叶酸、甘露醇溶解于适量的注射用水中,用hcl或naoh溶液调节ph值至5.0~7.0,得到水溶性溶液。整个过程控制药液温度不超过30℃,避光操作,照度≤100lx;步骤4,在氮气保护下,缓慢搅拌,将步骤2的脂质毫微球溶液缓慢加入到步骤3的水溶性溶液中,加注射用水至全量,搅拌至澄清,调节ph值至5.0~7.0,用0.22μm微孔滤膜除菌过滤,得透明澄清的液体。整个过程控制药液温度不超过30℃,避光操作,照度≤100lx;步骤5,灌装于棕色西林瓶中,半压塞,避光操作,照度≤100lx;步骤6,将灌装好的药液进行冻干:1)预冻:将温度降至-40℃~-50℃,然后将温度升至-10℃~-20℃,维持1~2小时,再将稳定将至-40℃~-50℃,维持2~5小时;2)升华干燥:在真空度为5~20pa,将温度升至-5℃~-15℃,维持20±3小时;3)解析干燥:将温度升至0℃,维持1~2小时;再升温至20℃~30℃,维持3~10小时。4)真空压塞,扎盖。本实施例制得的产品外形饱满,外形饱满,橙黄色疏松块状物,水分为1.4%,复溶性好、快,渗透压为301mosmol/kg,稳定性好,可常温储存,每瓶用5ml注射用水复溶后等渗,安全性高。将本实施例冻干前的药液外观透明,无乳光,不分层,对其粒径进行检测,测定结果如图3所示,其平均粒径为45.55nm,pdi为0.205,90%体积的粒径积累在55.3nm。将本实施例制得的多种维生素肠外营养剂毫微球冻干注射剂进行复溶后,复溶后药液外观透明,无乳光,不分层,对其粒径测定的结果如图4所示。复溶后的平均粒径为57.48nm,pdi为0.108,90%体积的粒径积累在68.6nm。在本发明特定配方情况下,脂溶性维生素可以被制备出粒径小达45.55nm的脂质毫微球液体,同时所得脂质毫微球液体可以加水无限稀释,并且稀释后的液体仍为澄清透明脂质毫微球液体,且粒径不会发生明显变化,该液体属于热力学稳定体系。且本发明冻干注射剂在冻干前或加水复溶后,均为透明澄清的脂质毫微球。实施例3一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法一种多种维生素肠外营养剂冻干制剂的配方为表3所示。表3多种维生素肠外营养剂冻干制剂的配方制备方法同实施例1。本实施例制得的产品外形饱满,外形饱满,橙黄色疏松块状物,水分低,复溶性好、快,渗透压为295mosmol/kg,稳定性好,可常温储存,每瓶用5ml注射用水复溶后等渗,安全性高。将本实施例冻干前的药液外观透明,无乳光,不分层,对其粒径进行检测,其平均粒径为46nm。将本实施例制得的多种维生素肠外营养剂毫微球冻干注射剂进行复溶后,复溶后药液外观透明,无乳光,不分层。复溶后的平均粒径为56nm(见表6)。在本发明特定配方情况下,脂溶性维生素可以被制备出粒径小达46~56nm的脂质毫微球液体,同时所得脂质毫微球液体可以加水无限稀释,并且稀释后的液体仍为澄清透明脂质毫微球液体,且粒径不会发生明显变化,该液体属于热力学稳定体系。且本发明冻干注射剂在冻干前或加水复溶后,均为透明澄清的脂质毫微球。实施例4一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法本对比例中大豆卵磷脂和15-羟基硬脂酸聚乙二醇的用量分别为12mg、30mg,二者的用量比为4:10,其他成分均与实施例3相同,制备工艺均与实施例3相同。本实施例制得的产品外形饱满,外形饱满,橙黄色疏松块状物,水分低,复溶性好、快,渗透压为297mosmol/kg,稳定性好,可常温储存,每瓶用5ml注射用水复溶后等渗,安全性高。将本实施例冻干前的药液外观透明,无乳光,不分层,对其粒径进行检测,其平均粒径为42nm。将本实施例制得的多种维生素肠外营养剂毫微球冻干注射剂进行复溶后,复溶后药液外观透明,无乳光,不分层。复溶后的平均粒径为51nm(见表6)。在本发明特定配方情况下,脂溶性维生素可以被制备出粒径小达42~51nm的脂质毫微球液体,同时所得脂质毫微球液体可以加水无限稀释,并且稀释后的液体仍为澄清透明脂质毫微球液体,且粒径不会发生明显变化,该液体属于热力学稳定体系。且本发明冻干注射剂在冻干前或加水复溶后,均为透明澄清的脂质毫微球。实施例5一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法本对比例中大豆卵磷脂和15-羟基硬脂酸聚乙二醇的用量分别为9mg、36mg,二者的用量比为2:8,其他成分均与实施例3相同,制备工艺均与实施例3相同。本实施例制得的产品外形饱满,外形饱满,橙黄色疏松块状物,水分低,复溶性好、快,渗透压为303mosmol/kg,稳定性好,可常温储存,每瓶用5ml注射用水复溶后等渗,安全性高。将本实施例冻干前的药液外观透明,无乳光,不分层,对其粒径进行检测,其平均粒径为52nm。将本实施例制得的多种维生素肠外营养剂毫微球冻干注射剂进行复溶后,复溶后药液外观透明,无乳光,不分层。复溶后的平均粒径为63nm(见表6)。在本发明特定配方情况下,脂溶性维生素可以被制备出粒径小达52~63nm的脂质毫微球液体,同时所得脂质毫微球液体可以加水无限稀释,并且稀释后的液体仍为澄清透明脂质毫微球液体,且粒径不会发生明显变化,该液体属于热力学稳定体系。且本发明冻干注射剂在冻干前或加水复溶后,均为透明澄清的脂质毫微球。实施例6一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法一种多种维生素肠外营养剂冻干制剂的配方为表4所示。表4多种维生素肠外营养剂冻干制剂的配方制备方法同实施例1。实施例7一种多种维生素肠外营养剂毫微球冻干注射剂及其制备方法一种多种维生素肠外营养剂冻干制剂的配方为表5所示。表5多种维生素肠外营养剂冻干制剂的配方制备方法同实施例1。对比例1大豆油替代中链甘油三酸酯本对比例用大豆油替代中链甘油三酸酯,其他成分均与实施例1相同,制备工艺均与实施例1相同。对比例1制备的冻干前药液不透明,有明显的乳光,平均粒径为186nm,显著大于实施例1(42.35nm)。且对比例1冻干注射剂样品复溶后不透明,乳白浑浊,平均粒径为272nm,显著大于实施例1(55.48nm)。对比例2吐温80替代15-羟基硬脂酸聚乙二醇本对比例用吐温80替代15-羟基硬脂酸聚乙二醇,其他成分均与实施例1相同,制备工艺均与实施例1相同。对比例2制备的冻干前药液不透明,略有乳光,平均粒径为102nm,显著大于实施例1(42.35nm)。且对比例2冻干注射剂样品复溶后不透明,略有白色乳光,平均粒径为123nm,显著大于实施例1(55.48nm)。对比例3本对比例中大豆卵磷脂和15-羟基硬脂酸聚乙二醇的用量分别为3mg、30mg,二者的用量比为1:10,其他成分均与实施例3相同,制备工艺均与实施例3相同。对比例3制备的冻干前药液分层,不能形成微乳(见表6)。对比例4本对比例中大豆卵磷脂和15-羟基硬脂酸聚乙二醇的用量分别为6mg、30mg,二者的用量比为2:10,其他成分均与实施例3相同,制备工艺均与实施例3相同。对比例4制备的冻干前药液不透明,有白色乳光,平均粒径为143nm,显著大于实施例3(46nm)。且对比例4冻干注射剂样品复溶后不透明,也有白色乳光,平均粒径为183nm,显著大于实施例3(56nm),见表6。对比例5本对比例中链甘油三酸酯用量为9mg其他成分均与实施例3相同,制备工艺均与实施例3相同。本对比例中,中链甘油三酸酯与大豆卵磷脂和15-羟基硬脂酸聚乙二醇总和之比为9mg:(9+30)mg,二者的用量比为1:4.33(比例在1:1~4范围之外)。对比例5制备的冻干前药液液面可见油滴,未形成微乳,见表6。对比例6本对比例中链甘油三酸酯用量为45mg其他成分均与实施例3相同,制备工艺均与实施例3相同。本对比例中,中链甘油三酸酯与大豆卵磷脂和15-羟基硬脂酸聚乙二醇总和之比为45mg:(9+30)mg,二者的用量比为1:0.87(比例在1:1~4范围之外)。对比例5制备的冻干前药液分层,乳化不完全,未形成微乳,见表6。表6各组制备的多种维生素肠外营养剂毫微球冻干注射剂的效果比较上述检测结果说明,只有当大豆卵磷脂和15-羟基硬脂酸聚乙二醇的用量比为1:1.4~4,且中链甘油三酸酯:(大豆卵磷脂+15-羟基硬脂酸聚乙二醇)的用量比为1:1~4时,才能使制得的多种维生素肠外营养剂毫微球冻干注射剂在冻干前、复溶后均呈无乳光、不分层的透明澄清液体,且可以加水无限稀释仍保持透明澄清状态;同时只有在上述条件下,才能使制备出的脂质毫微球的粒径在63nm以下。在本发明体系中,如果用大豆油,制备的脂质毫微球粒径偏大或者冻干后复溶不能得到小于l00nm的毫微球。下面对本发明制备的多种维生素肠外营养剂毫微球冻干注射剂作进一步的效果检测。一、含量检测方法:采用高效液相色谱法测定1)水溶性维生素有关物质高效液相色谱条件:色谱柱:c18色谱柱(150×4.6mm,3μm)流速:1ml/min检测波长:210nm检测器:紫外检测器流动相:以0.01mol/l己烷磺酸钠的0.2%磷酸溶液为流动相a,以乙腈为流动相b,按下列程序进行梯度洗脱,见表7。表7梯度洗脱程序时间(min)流动相a%流动相b%090.010.0590.010.02080.020.02580.020.03090.010.02)脂溶性维生素有关物质高效液相色谱条件:色谱柱:inertsilods-2色谱柱(150×4.6mm,5μm)流速:1.5ml/min检测波长:265nm检测器:紫外检测器流动相:以甲醇为流动相a,以乙腈为流动相b,以乙醇为流动相c,以水为流动相d,按下列程序进行梯度洗脱,见表8。表8梯度洗脱程序时间(min)流动相a%流动相b%流动相c%流动相d%05502520105502520201550250301550250355502520405502520测定方法:按外标法测定,检测结果见下表9。表9按外标法测定检测本发明产品中13种维生素主药成分的含量上述检测结果说明了本发明制备的毫微球冻干注射剂中13种维生素主药成分含量均符合质量标准规定。二、稳定性检测将实施实例1和实施实例2制得的产品,按中国药典2010年版附录的药物稳定性试验指导原则进行了长期稳定性试验,结果均符合质量标准规定,详见表10。表10长期稳定性试验(25℃)含量考察结果(标示量%)三、过敏性、溶血性和局部刺激性等特殊安全性试验对本发明多种维生素肠外营养剂毫微球冻干注射剂加入注射用水,然后进行安全性进行试验评价,分别进行了主动全身敏试验、被动皮肤过敏试验、体外溶血试验、血管刺激性试验和肌肉刺激试验等5个特殊安全性试验。试验结果见下表11。表11刺激性、过敏性、溶血性研究结果综上所述,本发明通过研究发现,只有本发明配方在一定的比例范围内进行工艺配比,可以令人意外形成完全透明的毫微球液体,这种毫微球液体完全符合微乳特征,可以任意得到粒径在63nm以下的脂质毫微球液体。另外还发现在这个组成中只有采用中链甘油三酸酯,才可以得到可以复溶为透明液体的冻干脂质毫微球。如用大豆油,制备的脂质毫微球粒径偏大或者冻干后复溶不能得到小于l00nm的毫微球。另外,在本发明配方中还发现如果加入经过筛选得出等渗调节剂甘油的用量,即22~28mg/4000mg,才可以得到令人惊奇的冻干后可迅速复溶成透明澄清的脂质毫微球,且在有效期内粒径不会发生变化。如果甘油量低于15mg/4000mg,这种脂质毫微球冻干剂复溶后溶液粒径明显变大,粒径就超过200nm以上,溶液变成白色乳状液,体系将变成热力学不稳定状态。研究证明,本发明技术方案中采用22~28mg/4000mg的甘油,通过对分散油滴,防止油滴聚集,从而达到保持冻干前小粒径的效果,才可以达到这种粒径小于63nm的透明效果。且本发明可以使每支冻干剂用5ml注射用水复溶后与人体血浆渗透压等渗,渗透压在280-310mmol/l,从而避免了给药的刺激性和发生溶血。本发明多种维生素脂质毫微球冻干注射剂加水可迅速复溶,呈透明溶液,平均粒径在63nm以内,可无限加水稀释,该液体属于热力学稳定体系,制备工艺不需要高压均质等提供额外能量,可以采用无菌过滤的方式灭菌,工艺简单,溶液物理稳定性比大粒径的乳剂更为稳定,本发明冻干剂比液体毫微球具有更好的稳定性和运输便捷性,1瓶装临床应用更便捷且减少配制污染。稳定性试验结果显示,本品可常温贮存2年,稳定性良好。所用辅料均为注射用级别,不含具有一定毒性吐温类助溶剂和抗氧剂,安全性高。安全性刺激溶血试验结果显示,本品给药基本无刺激,没有发生溶血现象,安全性高。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1