基于骨的DXATOMO的有限元分析的系统和方法与流程
背景技术:
骨密度或骨矿物质密度(bmd)是骨组织中骨矿物质的数量。此概念是每骨骼体积的矿物质的质量(在物理意义上与密度有关),不过,在临床上,它是根据被成像的骨表面的每平方厘米的光密度由代理测量的。骨密度测量用在临床医学中,作为骨质疏松症和骨折风险的间接指示。它由称作密度测定的过程测量,通常是在医院或诊所的放射或核医学部进行的。测量是无痛、非侵入性的,涉及低辐射暴露。测量最常见是在腰脊柱上和在髋的上部上进行的。如果髋和腰脊柱不可接近,则可扫描前臂。
身体组成由组成软(非矿物质)组织的脂肪组织的部分表示。身体组成用在临床医学中,作为健康状况或疾病(肌少症、糖尿病、肥胖症等)的间接指示和/或风险因子。密度测定也用来评估身体组成。最常见的在整个身体或除了头部外的整个身体上进行测量。
由于跌倒造成的腿和骨盆骨折是重大的公共健康问题,特别是在年长的女性中,导致更多的医疗成本,不能独立生活甚至是死亡的风险。使用骨密度测量来筛选有骨质疏松症风险的人,并且识别可能得益于测量以改进骨强度的那些人。
尽管有许多不同类型的bmd测试,但全部是非侵入性的。大多数测试根据测量哪些骨骼来确定bmd结果而不同。这些测试包括:
·双能量x射线吸收测定(dxa或dexa)
·双x射线吸收测定和激光(dxl)
·定量计算的断层摄影(qct)
·定量超声(qus)
·单光子吸收测定(spa)
·双光子吸收测定(dpa)
·数字x射线放射照相测定(dxr)
·单能量x射线吸收测定(sexa)
dxa目前被广泛使用,并通过测量特定的一块骨骼或若干骨骼,通常是脊骨、髋和腕来工作。接着将这些骨骼的密度与基于年龄、性别和体型的平均指标进行比较。所产生的比较结果用来确定个体中骨折的风险和骨质疏松症(如果存在)的阶段。
如图1中的示范性实施例中图示的,dxa扫描器100包括用于支撑患者101的工作台102,x射线源104(典型地由x射线发生器、x射线管、x射线滤波器和x射线准直器组成)位于工作台102中,并可相对于工作台102在患者101下方移动。在dxa系统/扫描器100的大多数实施方式中,检测器106设置在与检测器106相对的臂108内,使得检测器106和源104定位在患者101的相对侧上。检测器106主要是一维的,但可以是二维或者其它适当维数的配置,且将被移动以捕获由x射线源104发射并通过患者身体101的x射线光子。臂108移动检测器106,并与x射线源104关联,x射线源104与检测器106同步地在臂108上移动。臂108在与dxa工作台102的更长维度对应的方向上移动检测器106和x射线源104两者。在实施光栅扫描(笔形光束或扇形光束)的dxa扫描器中,检测器106和x射线源104两者可在与dxa工作台102的较长维度垂直的方向上移动,以便沿其宽度扫描工作台102/身体101。
在替代性实施例中,例如图1中所示,工作台102包括设置在臂108内、在工作台102上方间隔开、可相对于工作台102移动的x射线检测器106。工作台102连同检测器106和x射线源104及臂108可操作连接至计算机系统110,计算机系统110可控制x射线源104和/或臂108的操作,且可从检测器106接收由来自x射线源104的通过患者101并撞击检测器106的x射线产生的成像数据。
在dxa成像过程中,扫描器100沿要被成像的患者101的身体部分移动臂108和x射线源104,以便获得患者的特定部分的多对(高能量和低能量)二维(2d)dxa图像。dxa扫描器100可沿患者101的身体从头到脚或者沿着身体101的任何部分移动检测器106/x射线源104/臂108,以便获得期望的dxa图像。取决于由x射线源104生成的束的类型,例如,笔形、扇形或窄扇形(图2a-2c),x射线源104和/或检测器106和/或臂108可直接沿患者身体的主轴线或者以光栅扫描模式移动,以便使得x射线源104和检测器106能够对患者101的整个身体或身体的特定部分成像。
在执行dxa成像时,x射线检测器106通过检测具有由x射线源104生成的不同的能量谱的两个不同的x射线束,或者通过检测从x射线源104生成的一个x射线束并鉴别两个不同的能量箱(binsofenergy),产生身体的特定部分的双能量(高能量(he)和低能量(le))图像。有3种主要方式来实现dxa:
-不同能量谱的两个x射线束和检测器,检测器整合由发射的x射线光子(通过身体的光子)沉积的能量。
-具有特定能量谱的一个x射线束和检测器,检测器鉴别发射的x射线光子中的至少两个能量束。
-具有特定能量谱的一个x射线束和由至少两层检测器元件组成的检测器,例如上层将优先检测低能量光子,下层将优先检测高能量光子。
一个图像是高能量,另一个图像是低能量。x射线束通过被扫描的患者101,接触到位于与x射线源104相对的扫描器100上的检测器106。检测器106被通过患者101但不被患者组织(骨和软组织)吸收的那些x射线接触,因此测量从每个光束通过组织的x射线的量。这将根据组织的组成和厚度而变化。基于组织对两个光束的x射线吸收的差异,可以测量骨密度和/或身体组成。
在骨密度测定中,扫描结果被分析,并以平均面积骨矿物质密度bmda=bmc/a[kg/m2]报告,其中,bmc是骨矿物质含量[kg],a是包含骨矿物质为其部分的混合物的体积的投影面积[m2]。结果通常由t评分和z评分两种测量进行评分。z评分表示个体受试者中测量值bmda和由总体方差的年龄匹配的标准偏差标准化的年龄匹配的平均参考值之间的差异。t评分被类似地定义,但是代替年龄匹配值,使用来自青年参照人群的数据。基于由who工作组开发的t评分,骨质疏松症的操作定义已经提供唯一基于bmd的具体的诊断标准。who(1994)定义使用由dxa测量的面积bmda将受试者分成四组中的一组:正常(bmdat评分≥-1.0);低骨量或骨质减少(-1.0>bmdat评分>-2.5);骨质疏松症(-2.5≥bmdat评分);确定性骨质疏松症(-2.5≥bmdat评分)和至少一个骨质疏松性骨折。
对于bmd,使用dxa具有几个限制。例如,由于骨密度的计算只是基于计算的骨的矿物质密度的骨强度的近似,所以期望有在骨上的任何位置骨上的应力和/或应变的指示,以便提供在这些位置的骨强度的更加直接的指示。提供此骨强度分析的一种方法是将dxa图像与有限元分析相结合以提供患者的骨密度的更详细的表示。
为了辅助在确定bmd时的dxa图像/过程,在dxa中,通常产生2个图像,即高能量(he)图像和低能量(le)图像。he&le图像可以由软件组合,以生成骨等效厚度的一个图像和软组织等效厚度的一个图像。可以从he&le图像推导其它各对组织等效图像,提供对在由足够的材料制成的物理或仿真人体模型上采集的数据推导的材料校准。另外,也可以只使用2个图像中的一个(he或le,骨或软组织)。在图3的图示示范性实施例中,一旦获得至少一个2ddxa图像,使用适当的计算机系统110/50,可以将至少一个dxa图像10与可操作地连接至计算机系统50或者包含在计算机系统50上的存储的2ddxa图像14的参考数据库12进行比较,以便定位最近似或最类似于至少一个获得的2ddxa图像10的至少一个存储的2ddxa图像14。系统50和此类型的数据库12的一个实例在可从西班牙巴塞罗那的galgomedicalsl获得的3d-dxa软件包中找到,其中,系统50从2ddxa图像重建3d形式的骨结构,以根据humbertl,martelliy,fonollar等人2017年发表在ieeetransmedimaging36:27–39的3d-dxa:assessingthefemoralshape,thetrabecularmacrostructureandthecortexin3dfromdxaimages(3d-dxa:评估来自dxa图像的3d形式的股骨形状、小梁的宏观结构和皮质)中公开的过程,来评估dxa图像10中的骨的皮质骨和骨小梁宏观结构。出于所有目的,上述文章通过引用被明确地全部并入本发明中。在此过程中,参考数据库12包括存储的dxa图像14和存储的以前从其它患者获得的并与dxa图像14对应的ct扫描图像集18。存储的dxa图像14和对应存储的ct图像集18由系统50使用,以构造一组3d有限元分析(fea)模型20,所述fea模型20也存储在数据库12中,每个fea模型与每个对应的dxa图像14和推导模型20的ct扫描图像集18的关联。当给系统50提供至少一个获得的dxa图像10时,系统50定位最近似至少一个获得的2ddxa图像10的2ddxa图像14。系统50接着定位与选择为最靠近至少一个获得的dxa图像10的特定存储的dxa图像14关联的fea模型20。系统50接着基于来自至少一个获得2ddxa图像10的参数修改fea模型20,以便得到修改的fea模型20’,修改的fea模型20’在模型20’上图示与用提供至少一个dxa图像10的dxa扫描器成像的骨有关的不同参数的不同颜色图,所述不同参数包括但不限于皮质厚度、皮质体积密度和小梁体积密度及其它。
替代性地,如图4中所示,可以操作系统50以计算与直接来自ct扫描图像集18的特定ct扫描图像集18关联的存储的2ddxa图像16。接着以前面描述的方式将这些计算出的2ddxa图像16与至少一个获得的2ddxa图像10进行比较,以得到修改的fea模型20’。
然而,尽管获得修改的fea模型20’的过程提供关于至少一个获得的2ddxa图像10中的骨结构的额外信息,但用于构造修改的fea模型20’的过程仍具有明显不足,原因是至少一个获得的2ddxa图像10包含可用来修改fea模型20、并提供患者的骨结构的准确表示的信息量有限。
因此,期望提供用于确定骨密度和具有给操作者提供增强的体积成像能力的其它关联参数的成像系统和方法,从而提高扫描结果,并提供对骨密度和强度的更好测量。
技术实现要素:
需要或期望有这样的成像系统和关联方法,其能够获得患者的骨骼的x射线图像以便使得成像系统能够给系统的操作者提供除了关于骨骼的其它信息(例如bmd)之外,还提供关于患者的骨中存在的应力和/或应变的信息。成像系统使用在断层摄影成像过程或者模式中获得的2d双能量dxa图像,以便给患者的骨结构的操作者提供更详细的信息。成像系统在单次通过或多次通过患者的身体时,在关于患者的不同角度获得多个2ddxa图像。接着可以在通常平行于检测器平面的平面内,使用这些2ddxa图像重建患者身体的至少一组2d切片(通常是一个(骨厚度)或两个(he/le、骨/软组织))。由断层摄影重建提供的信息的技术效果提供对确定参照数据库中的对应存储的dxa图像的增强,以及提供对与至少一个选择存储的2ddxa图像对应的3dfea模型的修改,以用于分析患者/个体的骨/骨组织的结构。以此方式,所述系统和方法提供所产生的修改的3dfea模型中误差的明显减小,以供查看和分析。
根据本发明的另一方面,一种用于分析患者内的骨组织的方法,所述方法包括步骤:提供扫描装置,所述扫描装置包括至少一个x射线源、至少一个x射线检测器和控制器,所述控制器用于控制所述至少一个x射线源的运动并从所述至少一个检测器接收图像数据;相对于患者沿着至少一个平面操作所述至少一个x射线源,以获得与许多点对应的多个双能量x射线图像,每个点相对于与所述至少一个检测器的检测表面垂直的轴线定位在不同角度;使用所述多个双能量x射线图像重建患者的骨组织的至少一个二维(2d)平面切片图像;以及用由所述至少一个2d平面切片图像提供的信息修改有限元分析(fea)模型。
根据本发明的又一方面,一种确定患者的身体内的骨骼的各种参数的方法,所述方法包括步骤:提供扫描装置,所述扫描装置包括至少一个x射线源、至少一个x射线检测器和控制器,所述控制器用于控制所述至少一个x射线源的运动并从所述至少一个检测器接收图像数据;相对于患者沿着至少一个平面在许多点处操作所述至少一个x射线源,以获得与所述许多点对应的多个双能量x射线图像,每个点相对于与所述至少一个检测器的检测表面垂直的轴线定位在不同角度;使用所述多个双能量x射线图像重建患者的至少一个二维(2d)平面切片图像;将所述至少一个2d平面切片图像与能够操作连接至所述控制器的图像数据库进行比较;以及用由所述至少一个2d平面切片图像提供的信息修改有限元分析(fea)模型。
根据本发明的再一方面,一种确定患者的各种参数的方法,所述方法包括步骤:提供扫描装置,所述扫描装置包括至少一个x射线源、至少一个x射线检测器和控制器,所述控制器用于控制所述至少一个x射线源的运动并从所述至少一个检测器接收图像数据;相对于患者沿着至少一个平面操作所述至少一个x射线源,以获得与许多点对应的多个双能量x射线图像,每个点相对于与所述至少一个检测器的检测表面垂直的轴线定位在不同角度;使用所述多个双能量x射线图像重建患者的至少一个二维(2d)平面切片图像;将所述至少一个2d切片图像分割成骨像素和组织像素;以及测量组织像素中的组织质量和骨像素中的组织质量和骨质量。
应当理解,提供以上简要描述是为了以简化形式介绍在详细描述中进一步描述的一系列概念。而不意图识别要求保护的主题的关键或必要特征,该主题的范围唯一地由详细描述之后的权利要求限定。此外,要求保护的主题并不限于解决上文或本公开的任何部分中指出的任何缺点的实施。
附图说明
附图示出了设想到的实现本发明的最佳方式。在附图中:
图1是根据本发明的示范性实施例的dxa成像系统的示意表示。
图2a-2c是图1的dxa成像系统的扫描几何图形的示意图。
图3是与图1中图示的dxa成像系统结合使用的现有技术的图像分析系统的示意框图。
图4是与图1中图示的dxa成像系统结合使用的现有技术的图像分析系统的示意框图。
图5是根据本发明的一个实施例使用图1的dxa成像系统的扫描方法的示意图。
图6是与图5的扫描方法结合使用的图像分析系统的一个实施例的示意框图。
图7是与图5的扫描方法结合使用的图像分析系统的一个实施例的示意框图。
图8是与图5的扫描方法结合使用的图像分析系统的一个实施例的示意框图。
图9a-9b是现有技术的身体组成图像分析系统和与图5的扫描方法结合用来确定身体组成图像分析系统的一个实施例的示意框图。
具体实施方式
在以下详细描述中,参考形成本文一部分的附图,且在附图中,以说明方式来展示可实践的特定实施例。对这些实施例进行了足够详细的描述,以使所属领域的技术人员能够实践实施例,并且应了解,可以利用其它实施例,并且可以在不脱离实施例的范围的情况下进行逻辑、机械、电气和其它变化。因此,不应按限制性意义来看待以下详细描述。
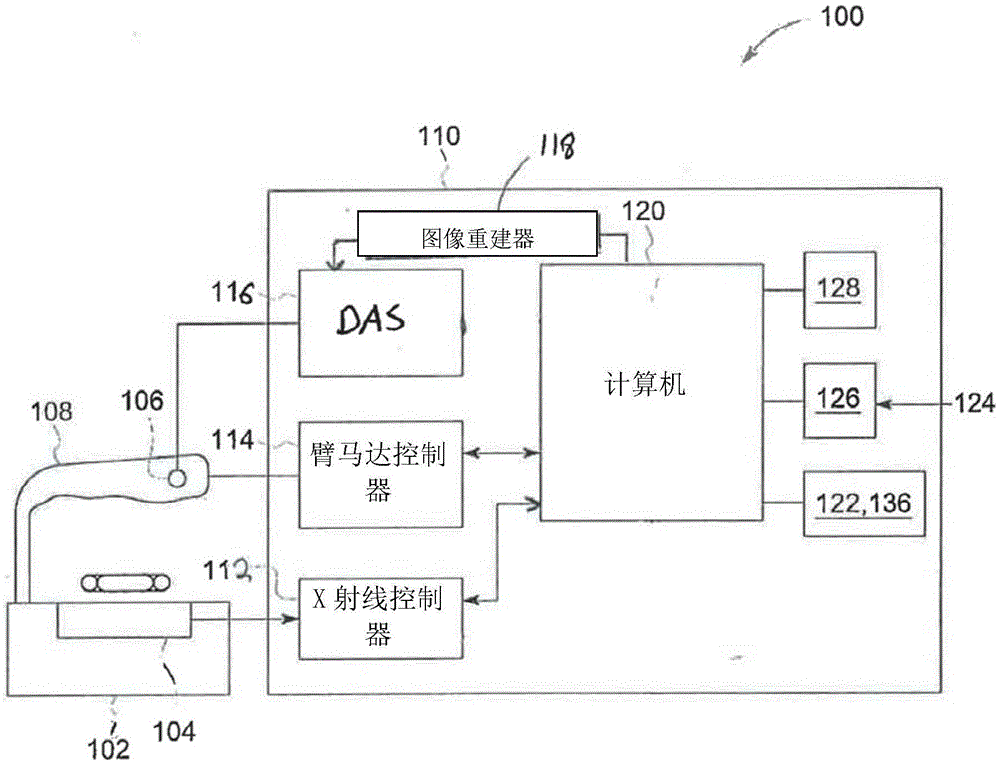
现在参照图1,图示根据本发明的一个示范性实施例的双能量x射线吸收测定(dxa)成像系统和/或扫描器100。如前面描述的,dxa扫描器100包括用于支撑患者101的工作台102,x射线源104位于工作台102中患者101下方。工作台102还包括设置在臂108内、在工作台102上方间隔开、可关于工作台102移动的x射线检测器106。需要时,x射线源104和检测器106的位置还可以颠倒。工作台102连同检测器106和x射线源104及臂108可操作连接至计算机系统110,计算机系统110可控制x射线源104和/或臂108的操作,且可从检测器106接收由来自x射线源104的通过患者101并撞击检测器106的x射线产生的成像数据。
来看图1和图5,在执行扫描以采集x射线投影数据时,臂108的运动和x射线源104和/或检测器106的操作由dxa扫描器100的控制机构/计算机系统110管理。控制机构110包括x射线控制器112和臂马达控制器114,x射线控制器112向x射线源106提供功率和时序信号,臂马达控制器114控制臂108的速度和位置。在控制机构110中的数据采集系统(das)116对来自检测器106的模拟数据取样,在检测器不传送直接数字信号时,将数据转换成数字信号以在随后进行处理。图像重建器118从das116接收采样的和数字化的x射线数据,并执行高速重建。重建的图像作为输入应用到计算机120,计算机120将图像存储在数据库/大容量存储设备122中。
而且,计算机120也可以经由可具有例如键盘126的输入设备的操作者控制台124从操作者接收命令和扫描参数。相关联的显示器128允许操作者观察重建的图像和来自计算机120的其他数据。操作者提供的命令和参数由计算机120使用以向das116、x射线控制器112和臂马达控制器114提供控制信号和信息。
现在具体看图5,在本发明的一个示范性实施例中,示意性示出在对患者101的头到脚的扫描期间x射线源104相对于患者101和检测器106的运动。与图2a-2c中图示的现有技术的扫描路径相反,可以不同的断层摄影成像扫描模式操作扫描器100,例如在光栅扫描中,x射线源104至少部分地沿着垂直于检测器106的平面移动;在x射线源104正在至少部分地以连续的运动移动的扫描中,其中,在时间上有限的x射线暴露会产生被成像的对象的不同的双能量投影,和/或x射线源104至少部分地垂直于平面p移动,但以除了只是平面运动之外的更加复杂的运动模式,且可选地以与检测器106的变化的距离移动,以便能够在从不同角度获得的一组投影重建断层摄影数据时,优化图像质量。在图5的图示的示范性实施例中,x射线源104沿与检测器106的入口或检测表面105平行定向的患者101的平面或截面w移动,并停下来,在通过x射线源104和检测器106的中心的轴线和轴线p之间,以变化的角度在多个位置处操作,轴线p处于至少一个检测器106的检测表面105的中心且与所述检测表面105垂直。一旦在患者101的该特定截面w处已经获得期望数目的图像129,则臂108将源104和/或检测器106移动到不同和可能重叠的截面w,以便获得额外的图像129。此过程重复多次,直到在整个身体或身体的特定部分上已经对患者101进行充分的扫描。对于x射线源104的多个成像位置使得x射线源104能够在相对于平面p的不同角度在检测器106上产生或获得患者101体内的同一对象(例如骨)的多个图像129,其中,图像129可以是双能量图像,即在操作x射线源104所在的每个定位处从患者101获得的低能量图像和高能量图像。在das116和图像重建器118中,这些图像129可用断层摄影重建,以形成与检测器106平行或者相对于检测器106在其它期望定向的在患者101体内的不同高度的至少一组2d图像130,132。
在替代性示范性实施例中,扫描器100可包括沿臂108相互间隔开的多个x射线源104。操作中,各个x射线源104被顺序操作以便生成双能量图像129,用于断层摄影重建成2d平面图像130,132的集合133,无需移动正在垂直于检测器106的入口表面的给定平面内操作的x射线源104。因此,多个源104的存在和操作可消除在源104之间获得的双能量图像129中的机械引起的变化,原因是源104在获得双能量图像129的每一个的过程中保持静止。
现在参照图6中图示的示范性实施例,在完成平面图像130,132的至少一个集合133的重建之后,这些图像130,132可个别地或者共同与从其它患者的dxa扫描获得的保留在可操作地连接至控制机构110的数据库122,136内的2d断层摄影扫描图像134的一个或多个存储集合进行比较。当得出比较结果接近或者在集合133中的一个或多个获得的2d断层摄影图像130和132与在tomo图像134的dxa扫描集中的一个或多个存储的2d断层摄影图像之间发现相似时,控制机构110可访问与特定存储的断层摄影图像134的dxa扫描集关联地存储在数据库122,136中的ct扫描图像集137,以便生成或定位与所选择的图像134和137的存储集有关的存储的3d有限元分析(fea)模型138。在生成模型138时或者作为对模型138的修改,来自获得的dxa断层摄影图像130,132的集合133的信息包括在fea模型138中,以构造模型138’,模型138’随后可以在显示器128或可操作地连接至扫描器100的其它类似的装置上图示。以此方式,由至少一个dxa断层摄影图像集133提供的额外信息大大地降低在构造模型138时和在表示在模型138’上显示的不同参数(例如皮质厚度、皮质体积密度和骨小梁体积密度等等)的颜色图时和/或在评估在模型138上提供或由模型138提供的骨折的风险时的误差。
现在看图7,在本发明的替代性实施例中,将获得的dxa断层摄影图像130,132的至少一个集合133与位于数据库122,136中的计算得出的dxa断层摄影图像142的存储集比较。计算的dxa断层摄影图像142的这些集合是从存储在数据库136中的现有患者的ct扫描图像144的集合重建的,以用于与获得的dxa断层摄影图像130,132的至少一个集合133比较,并用于以存储的ct扫描图像144的集合和来自获得的dxa扫描断层摄影图像130,132的信息形成fea模型138。在此示范性实施例中,先前没有对其它患者执行dxa扫描,因为与获得的dxa扫描断层摄影图像130,132的集合133比较的dxa图像142是直接从患者的ct扫描图像144重建的,患者的ct扫描图像144用来构造模型138。
在图8中图示的本发明的另一示范性实施例中,获得的dxa扫描断层摄影图像130,132的至少一个集合133与ct扫描图像146的重新格式化的集合比较,ct扫描图像146的重新格式化的集合从对现有患者获得的并存储在数据库122,136中的ct扫描图像148的集合重建。ct扫描图像146的重新格式化的集合是从ct扫描图像148的集合重建的图像,ct扫描图像148的集合对应于至少一个获得的dxa扫描断层摄影图像130,132的图像平面,例如,沿着患者的各冠状面。接着与ct扫描图像148和来自获得的dxa扫描断层摄影图像130,132的至少一个集合133的信息结合使用所选择的重新格式化的图像146,以生成fea模型138。
现在参照图9a,dxa扫描图像150图示为使用dxa扫描器10和图2a-2c的一个中图示的扫描方法获得。在图像150中,基于像素152是骨像素154还是软组织像素156,是否由脂肪组织158和/或瘦肉组织160(肌肉、非脂肪和非矿物质组织)组成,对每个像素152进行分析。在软组织像素156中,所述分析从低能量dxa图像和高能量dxa图像的组合测量脂肪组织部分158和瘦肉组织部分160。然而,在骨像素154中,由于只从以两个不同的能量获得的两个图像不能推导三个不同的材料(脂肪、瘦肉和骨)的部分,所以假设骨像素154内的软组织组成与相邻软组织像素156中的软组织组成相似,骨、脂肪和瘦肉组织部分被相应地导出。一旦完成分析,在被扫描的个体的全身上以及在感兴趣区域上将骨组织部分、脂肪组织部分158和瘦肉组织部分160的值相加。
现在来看图9b,在本发明的另一示范性实施例中,使用dxa扫描器100和如图5中示意性图示的关联的断层摄影扫描方法执行身体组成测量,以获得身体或身体内的感兴趣区域的多个2d断层摄影切片161。结果,尽管在断层摄影图像/切片161的每一个中的个别像素162类似地被分割成骨像素164和软组织像素166,但由于可以在每个切片160中执行脂肪组织部分168和瘦肉组织部分170的体积评估,所以脂肪组织部分168和瘦肉组织部分170的量化更加准确,结果,从每个切片161的结果的组合获得更准确的结果。
本书面描述用实例来公开包括最佳模式的本发明,并且还使本领域技术人员能实施本发明,包括制造和使用任何装置或系统以及执行任何包括在内的方法。本发明的可获专利的范围由权利要求书限定,且可包括所属领域的技术人员所想到的其它实例。如果此类其他实例具有与权利要求书的字面语言相同的结构元件,或者如果它们包括与权利要求书的字面语言无实质差别的等效结构元件,那么此类其他实例希望在权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!