一种茶多酚溶致液晶分散体及制备方法与流程
本发明涉及医药领域,具体涉及一种茶多酚溶致液晶分散体及其制备方法。
背景技术:
茶多酚又称茶鞣质,是茶叶中多酚类物质的总称,也是茶叶中有药理和保健功能的主要成分之一。研究发现茶多酚具有抗氧化、抗炎、抗肿瘤、抗辐射、抗高血脂、延缓衰老等药理和保健作用,有关茶多酚的研究目前已成为药学领域的研究热点。但茶多酚的口服生物利用度很低,一般不到2-5%。因此,为了更好的应用茶多酚,制备一种载体来对茶多酚包封,可以保持其良好稳定性,进一步提高其生物利用度。
溶致液晶作为一种两亲分子在水中形成的自组装体,已被广泛作为药物载体。溶致液晶通常由两亲分子和溶剂组成,可分为层状、立方、六角形中间相。溶致液晶存在于我们身体的许多部位,如大脑、肌肉、视网膜等。它们的特殊结构在我们的重要活动中起着重要作用。在溶致液晶的内部结构中,亲水和疏水部分分别可以包含水溶性药物和油溶性药物。近年来,溶致液晶因其出色的载药和释药性能受到广泛关注。
技术实现要素:
本申请提供了一种茶多酚溶致液晶分散体及制备方法。茶多酚被包封在了由卵磷脂、油酸、peg400和水形成的溶致液晶中,以吐温80为稳定剂,将溶致液晶超声分散为纳米颗粒。本发明通过实验发现,包封在溶致液晶分散体中的茶多酚的抗氧化性增强了,本发明的茶多酚溶致液晶分散体清除abts自由基的ic50值都小于3.778μg/ml,3.778μg/ml是茶多酚水溶液清除abts自由基的ic50值。本发明的茶多酚溶致液晶分散体清除dpph自由基ic50值都小于4.657μg/ml,4.657μg/ml是茶多酚水溶液清除dpph自由基的ic50值。并且,本发明的茶多酚溶致液晶分散体能减慢茶多酚的释放速率,使得茶多酚释放平衡时间明显延长。
此外,本发明的茶多酚溶致液晶分散体具有164-190nm的粒径,相比于单纯的溶致液晶载体,本发明既可用作口服制剂,也可用作静脉注射制剂,而且具有更好的稳定性,本发明的茶多酚溶致液晶分散体缓释时间可长达80小时以上,相比于单纯的溶致液晶载体缓释效果具有显著提升。
具体地,本发明是通过如下所述的技术方案实现的:
在本发明的第一方面,本发明提供了一种液晶分散体,其为包含药物活性成分、药物载体和稳定剂的乳状纳米颗粒分散体,分散介质为水;所述药物活性成分为茶多酚,所述药物载体为溶致液晶,所述溶致液晶由卵磷脂、油酸、peg400和水组成。
优选地,所述溶致液晶中,油酸与peg400的质量比为1:1;
优选地,所述水为二次蒸馏水;
优选地,所述稳定剂为吐温,优选为吐温80。
优选地,所述液晶分散体包含或由以下组分组成:57-73wt%卵磷脂、2-10wt%油酸、2-10wt%peg400、8-25wt%水、6wt%吐温、1wt%茶多酚。
优选地,所述液晶分散体包含或由以下组分组成:57.66-72.54wt%卵磷脂、2.325-9.765wt%油酸、2.325-9.765wt%peg400、8.37-23.25wt%水、6wt%吐温、1wt%茶多酚。
优选地,所述液晶分散体包含或由以下组分组成:65.1wt%卵磷脂、2.325-6.045wt%油酸、2.325-6.045wt%peg400、15.81-23.25wt%水、6wt%吐温、1wt%茶多酚。
优选地,所述分散体中纳米颗粒的粒径为160-200nm,优选为164-190nm;所述纳米颗粒的pdi为0.3-0.55,优选为0.388-0.521;所述纳米颗粒的zeta电位为-2~-18mv,优选为-2.57~-17.2mv。
在本发明的第二方面,本发明提供了一种制备上述液晶分散体的方法,其包括以下步骤:将卵磷脂、油酸和peg400在水浴中充分搅拌混匀;然后向该混合物中先后加入茶多酚和二次蒸馏水,搅拌混匀并反复离心以赶走气泡;将该混合物在恒温水浴中静置平衡;加入吐温与之完全混合后,取该混合物置于水中,进行超声分散,得到乳状纳米分散体。
优选地,所述卵磷脂、油酸和peg400的加入量质量比为(5.766~7.254):(0.2325~0.9765):(0.2325~0.9765)。
水、油及表面活性剂间的比例关系会影响本发明液晶分散体的释放率,经本发明的实验验证,当卵磷脂、油酸和peg400按照本发明的配比添加时容易获得更为满意的释放率和缓释效果。优选地,所述卵磷脂、油酸和peg400混合时的水浴温度为60-70℃。
优选地,所述茶多酚和二次蒸馏水的用量质量比为0.1:(0.837~2.325)。
优选地,离心后在37℃下的恒温水浴中静置平衡,平衡时间为7天。
优选地,所述超声分散的条件为脉冲模式,每工作时间10s,间歇时间5s,超声功率400w,超声总时间18min。
在本发明的第三方面,本发明还提供了一种药物制剂,其包含上述液晶分散体。
在本发明的第四方面,本发明还提供了上述液晶分散体在制备药物制剂中的应用;优选地,所述药物制剂具有抗氧化和/或清除abts自由基的作用。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:
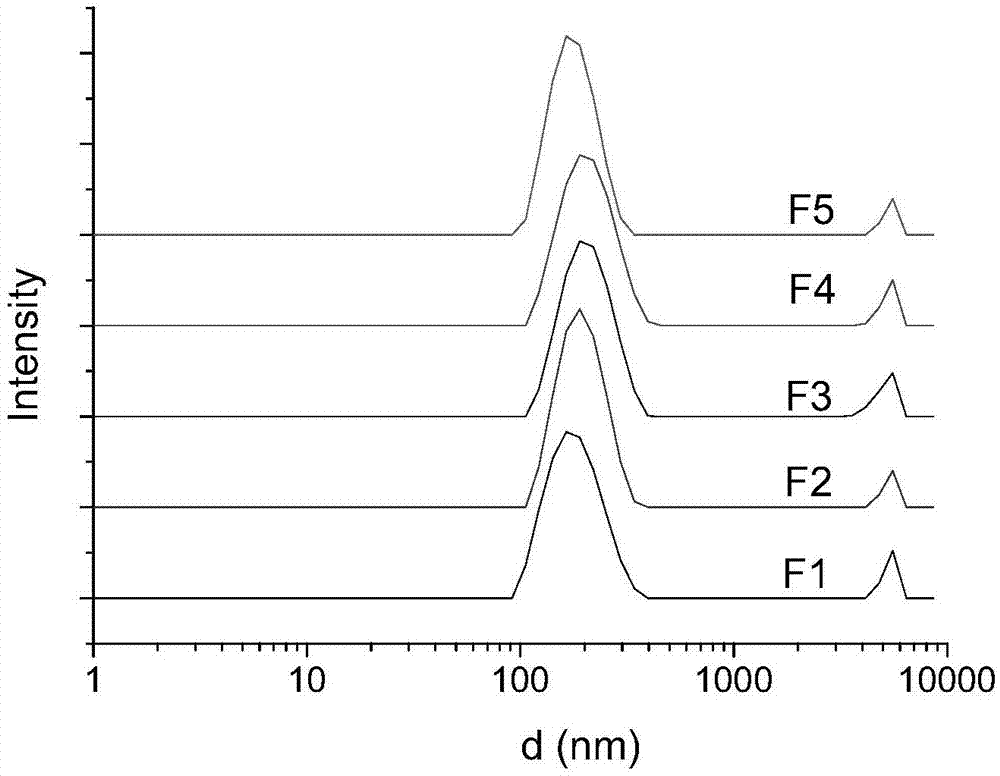
图1为本发明的茶多酚溶致液晶分散体的粒径分布。
图2为茶多酚水溶液在273nm下的吸光度绘制的标准曲线。
图3为37℃下茶多酚在本发明的液晶分散颗粒中的释放行为。
图4为清除abts自由基活性与茶多酚浓度的关系。
图5为清除dpph自由基活性与茶多酚浓度的关系。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
卵磷脂(sl,精制)买自alfaaesarcompany;聚乙二醇400(peg400,分析纯),吐温80(tween80,化学纯),油酸(oa,分析纯)和乙醇(分析纯)均从中国国药化学试剂有限公司购得;茶多酚(tp,纯度95%)买自宣城百草植物工贸有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(abts,纯度98%)和1,1-二苯基-2-三硝基苯肼(dpph,纯度96%)均买自上海麦克林生化科技有限公司,水为二次蒸馏过的去离子水。
实施例1
将6.51g卵磷脂,0.2325g油酸和0.2325gpeg400置于带塞子的比色管中,在60-70℃的水浴中充分搅拌混匀。然后向该混合物中先后加入0.1g茶多酚和2.325g二次蒸馏水,搅拌混匀并反复离心以赶走气泡。将该比色管在37℃下的恒温水浴中静置平衡一周。将0.6g吐温(tween80)与之完全混合后,取1g混合物置于25ml水中,在超声波细胞破碎仪上进行分散,最终得到乳状分散体。超声波细胞破碎仪参数设置为:功率400w,超声总时间18min,脉冲模式(工作时间10s,间歇时间5s)。将此乳状分散体记为f1,该分散体的组成如表1所示。
实施例2
将6.51g卵磷脂,0.6045g油酸和0.6045gpeg400置于带塞子的比色管中,在60-70℃的水浴中充分搅拌混匀。然后向该混合物中先后加入0.1g茶多酚和1.581g二次蒸馏水,搅拌混匀并反复离心以赶走气泡。将该比色管在37℃下的恒温水浴中静置平衡一周。将0.6g吐温(tween80)与之完全混合后,取1g混合物置于25ml水中,在超声波细胞破碎仪上进行分散,最终得到乳状分散体。超声波细胞破碎仪参数设置为:功率400w,超声总时间18min,脉冲模式(工作时间10s,间歇时间5s)。将此乳状分散体记为f2,该分散体的组成如表1所示。
实施例3
将6.51g卵磷脂,0.9765g油酸和0.9765gpeg400置于带塞子的比色管中,在60-70℃的水浴中充分搅拌混匀。然后向该混合物中先后加入0.1g茶多酚和0.837g二次蒸馏水,搅拌混匀并反复离心以赶走气泡。将该比色管在37℃下的恒温水浴中静置平衡一周。将0.6g吐温(tween80)与之完全混合后,取1g混合物置于25ml水中,在超声波细胞破碎仪上进行分散,最终得到乳状分散体。超声波细胞破碎仪参数设置为:功率400w,超声总时间18min,脉冲模式(工作时间10s,间歇时间5s)。将此乳状分散体记为f3,该分散体的组成如表1所示。
实施例4
将5.766g卵磷脂,0.9765g油酸和0.9765gpeg400置于带塞子的比色管中,在60-70℃的水浴中充分搅拌混匀。然后向该混合物中先后加入0.1g茶多酚和1.581g二次蒸馏水,搅拌混匀并反复离心以赶走气泡。将该比色管在37℃下的恒温水浴中静置平衡一周。将0.6g吐温(tween80)与之完全混合后,取1g混合物置于25ml水中,在超声波细胞破碎仪上进行分散,最终得到乳状分散体。超声波细胞破碎仪参数设置为:功率400w,超声总时间18min,脉冲模式(工作时间10s,间歇时间5s)。将此乳状分散体记为f4,该分散体的组成如表1所示。
实施例5
将7.254g卵磷脂,0.2325g油酸和0.2325gpeg400置于带塞子的比色管中,在60-70℃的水浴中充分搅拌混匀。然后向该混合物中先后加入0.1g茶多酚和1.581g二次蒸馏水,搅拌混匀并反复离心以赶走气泡。将该比色管在37℃下的恒温水浴中静置平衡一周。将0.6g吐温(tween80)与之完全混合后,取1g混合物置于25ml水中,在超声波细胞破碎仪上进行分散,最终得到乳状分散体。超声波细胞破碎仪参数设置为:功率400w,超声总时间18min,脉冲模式(工作时间10s,间歇时间5s)。将此乳状分散体记为f5,该分散体的组成如表1所示。
表1茶多酚溶致液晶分散体的组成
实验例
液晶分散体中颗粒尺寸的测量
液晶分散颗粒的粒径,多分散指数(pdi)和zeta电位由马尔文激光粒度仪在25℃下进行了测定。仪器参数中溶剂选为水,平衡时间120s,测定角度90°。样品(f1、f2、f3、f4、f5)用双蒸水稀释20倍后再盛入样品池中进行测定。粒径结果选用的强度平均粒径。
体外释放
1.茶多酚标准曲线的绘制
配制一定浓度的茶多酚水溶液,用紫外可见分光光度计在500-200nm范围内进行光谱扫描,得到吸光度-波长曲线,确定了茶多酚的最大吸收峰为273nm。配制一系列浓度梯度的茶多酚水溶液,在定波长273nm下测其吸光度,绘制标准曲线。
2.茶多酚的体外释放
采用透析的方法研究茶多酚在溶致液晶中的体外释放行为,体外释放在磷酸二氢钠与磷酸氢二钠的ph6.8的缓冲溶液中进行。准确移取2ml样品(f1、f2、f3、f4、f5)于透析袋中,透析袋置于40ml缓冲介质中,使用磁子在一定转速条件下37℃恒温释放。每隔一段时间取3ml释放液,并补充3ml缓冲液。通过用紫外可见分光光度计测量吸光度的方法计算释放到缓冲溶液中的茶多酚量,计算茶多酚的累计释放率(cr)。
cr=取样时间内累计茶多酚释放量/溶致液晶中茶多酚总量×100%
mt/m∞表示在时间t时药物释放的百分数,k是释放的比例系数,n是释放的指数。n值不同表明药物从溶致液晶中释放时扩散机制不同。
abts自由基清除实验
配制0.14mol/l的过硫酸钾溶液50ml和0.007mol/l的abts溶液5ml,在abts溶液中加入88μl配制好的过硫酸钾溶液,避光反应16个小时。将样品(f1、f2、f3、f4、f5)稀释为一系列浓度梯度的溶液,以空白作为对照。将abts溶液用二次蒸馏水稀释到吸光度为0.7±0.02。1ml稀释后的样品溶液加入3ml吸光度为0.7±0.02的abts溶液,用漩涡混匀器将溶液混合均匀,避光反应30min,在定波长730nm下测其吸光度a。空白用1ml二次蒸馏水,该吸光度记录为a0。
清除率=(1-a/a0)×100%
dpph自由基清除实验
dpph乙醇溶液的浓度配制成6×10-5mol/l。将样品(f1、f2、f3、f4、f5)稀释为一系列浓度梯度的溶液,以空白作为对照。1ml稀释后的样品中加入3mldpph溶液,混匀后避光静置反应60分钟,在定波长517nm下测其吸光度a。空白用1ml二次蒸馏水,该吸光度记录为a0。测试之前所有样品(f1、f2、f3、f4、f5)先在离心机3000转以上离心5分钟。离心后的样品直接倒入比色皿测量,注意试管从离心机拿出时一定要轻轻的,避免振动又让离下来的东西重新悬浮造成样品浑浊。测试之前,用3ml乙醇和1ml水的混合液置零。
清除率=(1-a/a0)×100%
实验结果
茶多酚溶致液晶的dls表征
图1为本发明实施例1-5的茶多酚溶致液晶分散体的粒径分布图,载药液晶分散颗粒粒径、pdi和zeta电位值展示在表2中。由表中数据可发现,样品的粒径值都在160-200nm之间,较小的pdi值表示茶多酚溶致液晶具有良好的一致性。其中f2和f4样品zeta电位的绝对值最大,说明这两个样品的稳定性最好。
表2茶多酚溶致液晶分散体的粒径、pdi、zeta值
茶多酚体外释放研究
1.茶多酚标准曲线的建立
如图2是通过测定一系列浓度的茶多酚水溶液在273nm下的吸光度绘制的标准曲线,经线性拟合得到吸光度与浓度的关系符合以下方程:abs=21.1229c+0.00736。在273nm处测得茶多酚的吸光度后,可以由方程计算出茶多酚的浓度,进而计算出茶多酚在不同时间点的累计释放率,绘制样品的释放曲线。
2.茶多酚的体外释放
如图3所示,f1、f2、f3是固定表面活性剂含量改变水油比时的体外释放曲线。对于f1、f2、f3来说释放前期释放速率比较快,2500min后,释放速率变得缓慢。在释放初期(1000min之前),f1、f2、f3的释放速率相当,1000min后f3的释放速率开始变得比f1、f2的释放速率慢,f1、f2的释放速率仍然相当。最终f3的累计释放率低于f1、f2的累计释放率,而f1、f2的累计释放率相当。总的来说,固定表面活性剂含量改变水油比对体外释放行为有影响但不明显。
f2、f4、f5是固定水含量改变油和表面活性剂比时的体外释放曲线。对于f2、f4、f5来说释放前期释放速率比较快,但f5前期释放最快。1000min后释放速率开始出现明显差异,f5释放速率仍然最快,f2的释放速率较快,f4的释放速率开始减慢并与f2出现差异。在3000min后,f5释放速率变得极其缓慢,接近于零。在3500min后,f2释放速率变得极其缓慢,接近于零。在4500min后,f4释放速率变得极其缓慢,接近于零。总的来说,固定水含量改变油和表面活性剂比对体外释放行为有明显影响。表面活性剂占比越大,体外释放越快,且累计释放率越高。
f1、f5和f3、f4是固定油含量改变水和表面活性剂比时的释放曲线。f5与f1相比,表面活性剂占比大,f5释放速率比f1释放速率快且累计释放率高。f3与f4相比,表面活性剂占比大,但f3与f4的释放速率相当且累计释放率相当。
整体来说,固定水含量改变油和表面活性剂比对体外释放的影响最大,且具有良好的缓释效果,如图3所示,本发明的茶多酚溶致液晶分散体的缓释时间可长达80小时以上。
抗氧化活性
1.清除abts自由基活性
以清除率为纵坐标,样品浓度为横坐标,每个样品(f1、f2、f3、f4、f5)的实验数据都用logistic模型拟合,在拟合的曲线上找到ic50,ic50是清除率为50%时的浓度。ic50值越低表示抗氧化活性越好。如图4所示,f2具有最好的抗氧化活性。从图4中可以看出,茶多酚水溶液的ic50值为3.778μg/ml。所有样品的ic50值都小于茶多酚的ic50值,这说明本发明的茶多酚的液晶分散体具有更好的抗氧化活性。由图4可知,样品对abts自由基的清除活性随其质量浓度增大而提高。
s(cs,rs)为清除曲线变平滑的临界点。参数cs代表清除效率,参数rs代表清除过程的有效性,最大自由基清除效力对应最小清除效率。f4具有最大清除效率,最小清除效力。f2和f3具有最小清除效率,最大清除效力。
2.清除dpph自由基活性
每个样品(f1、f2、f3、f4、f5)的实验数据同样用logistic模型拟合,在拟合的曲线上找到ic50。如图4所示,样品1具有最好的抗氧化活性。从图5中可以看出,茶多酚的ic50值为4.657μg/ml。所有样品(f1、f2、f3、f4、f5)的ic50值都小于茶多酚的ic50值,这说明包载茶多酚的溶致液晶具有更好的抗氧化活性。由图5可知,样品对dpph自由基的清除活性随其质量浓度增大而提高。f5具有最大清除效率,最小清除效力。f1具有最小清除效率,最大清除效力。
结论
我们由sl/oa/peg400/h2o体系构筑的溶致液晶成功制备了粒径均一的液晶分散颗粒。体外释放实验表明,当茶多酚包封在溶致液晶中,其释放平衡时间明显延长。而且固定水含量改变油和表面活性剂比对体外释放的影响最大,表面活性剂占比越大,体外释放越快,且累计释放率越高。包载茶多酚的液晶分散颗粒的抗氧化性实验表明,茶多酚液晶分散颗粒对abts自由基和dpph自由基有良好的清除作用。在abts自由基清除实验中,f2的抗氧化活性最好,ic50=0.950μg/ml。在dpph自由基清除实验中,f1的抗氧化活性最好,ic50=0.957μg/ml。
- 还没有人留言评论。精彩留言会获得点赞!