用于确定血管容量和冠状血流量的方法、装置及系统与流程
本申请要求于2017年11月28日提交的美国临时申请第62/591,437号的优先权,其全部内容通过引用并入本文。
本公开总体上涉及图像处理和分析。更具体地,本公开涉及用于确定目标血管的容量和冠状血流量的计算机实现的方法、装置及系统。
背景技术:
血液循环是生物体内最重要的功能之一,其将氧气提供给身体的器官。例如,冠脉循环是血液在心脏肌肉(也称为心肌)的血管内的循环。冠状动脉将富氧血液输送到心肌。严重的冠状动脉狭窄可限制心肌血流量,导致心肌缺血。然而,心脏病专家在单独基于冠脉造影来区别可导致心肌缺血的病变和生理上微不足道的病变方面的能力是有限的。作为时间的函数而被评估的容积冠脉血流会是对动脉阻塞的功能重要性的分析的有价值的帮助。例如,当使用血流储备分数(ffr)评估心外膜狭窄的生理重要性时,血流量可以用作一个或多个边界条件来计算定量ffr。诊断和了解微血管疾病可以使用绝对血流量来更好地了解许多病理生理状况,如心脏移植、干细胞治疗和大面积心肌梗塞。
现有的评估冠脉血流量的血管造影方法基于通过循环系统注射造影剂之后对造影剂传播的分析。然后,使用在心外膜动脉或心肌灌注床中测量的造影剂通过曲线数据来确定流量信息。从而,绝对均值和瞬时冠脉血流量可以通过首过分析(first-passanalysis)来确定。这些技术通过对填充选定的关注区域(roi)的造影剂的量进行量化并测量连续图像中视频密度信号的变化来确定冠脉血流量。另外,数字血管造影技术已经被开发出来以高精度量化冠状动脉管腔容量。该技术使用背景去除图像和围绕冠状动脉仔细绘制的roi以根据roi内的积分视频密度信号和系统校准因子来量化管腔容量。这些技术通常假设造影剂浓度和x射线束能量已知,并且与校准条件相匹配或者从校准表插值得到。通常需要进行外部校准,伴随对放大倍数进行额外校准,以执行该方法。roi区域通常也是手动选择的。背景移除通常依赖于由外部ecg信号引导的相位匹配。
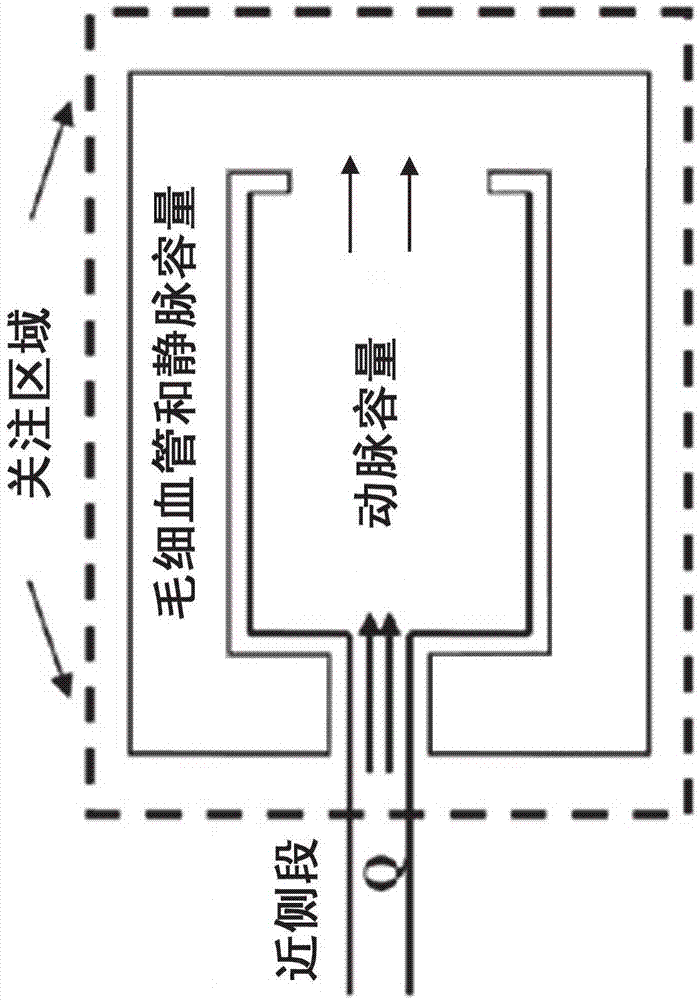
下面,说明使用传统方法中的首过分析(fpa)方法来确定血管的血流量的过程。在fpa方法中,由主要冠状动脉供应的血管床的容量被建模为具有单一输入的储库。如图1所示,可以根据一个心动周期内的容量变化确定冠脉血流量。
首过分析将冠状动脉系统简化为接收具有流率q的单个输入的汇集容量(vp),而不需要系统中动脉结构或出口路径的知识。此外,存在进入的造影剂在vp内部汇集时没有任何造影剂离开的短暂期间。然后,在任何造影剂离开选定的灌注容积之前,q可以根据造影剂容积(v)随时间(t)变化的变化来确定:q=△v/△t。首过分析的应用通常涉及在流入毛细血管和静脉系统之前识别其中冠状动脉血流将被测量的近侧动脉段和其中将收集注射的造影剂的血管的远侧网络。然后可以用所获取的图像,诸如空间上变化的视频密度碘信号,来监测通过动脉网络的造影剂传播。对于造影剂中碘的已知浓度(ci),视频密度测定法可基于碘信号来定量冠状动脉系统中造影剂的容积。造影剂的浓度通常通过以比冠状动脉血流更快的速度注入造影剂使得造影剂的注射团块完全取代血液来获知。在这种情况下,造影剂容积(v)等于检测到的碘质量(mi)除以其浓度:v=mi/ci。然后可以根据在填充毛细血管和静脉系统之前测量的造影剂容积来确定总冠状动脉容积。
在一个例子中,造影剂在时间段△t内的平均流量可写成公式(1)。
其中△di是在图像中的关注区域中的积分视频密度碘信号的变化。碘的质量衰减系数
为了考虑到x射线束能量和x射线摆位几何变化,可选地,获取定位在心脏上方的校准体模的图像以确定图像灰度水平和碘质量之间的相关性。放大倍数的变化可能需要额外的修正。
然而,这些传统方法依赖于实际注入的造影剂浓度与校准过程中使用的造影剂的浓度相同的假设。此外,这些方法还要求若干外部校正,导致不确定性的增加。
本公开实施例通过用于确定目标血管的容量和冠状血流量的计算机实现方法和装置解决了上述问题。
技术实现要素:
本公开提出了一种用于确定目标血管的容量和/或流量的计算机实现方法、装置和系统,来解决现有技术中存在的上述问题。本公开的方法、装置和系统不依赖诸如校准体模和二维查找表的外部校准就能够计算出目标血管的容量和/或流量,即实现了完全自动的自校准,减少了血管容量和/或流量的计算过程的不确定性,增加了血管容量和/或流量的计算结果的准确度,并且由于不需要进行外部校准,简化并加快了确定目标血管的容量和/或流量的过程。
在一个方案中,本公开涉及一种用于确定目标血管的容量的计算机实现的方法。该方法包括获取步骤:在造影剂注入到所述目标血管中之后,获取所述目标血管的时域上的造影图像序列。并且,该方法进一步包括由处理器,在所述时域上的造影图像序列中的各个造影图像中,识别包含所述目标血管的关注区域。并且,该方法进一步包括由处理器,对所述关注区域内的各像素值进行积分。所述方法还包括由所述处理器,基于各个关注区域的积分值以及所述积分值与造影剂容积之间的预定关系,确定所述目标血管的容量。
又一方案中,本公开还涉及一种用于确定目标血管的容量的装置,所述装置包括处理器、存储器及其上存储的计算机可执行指令,所述处理器执行所述计算机可执行指令时,实现上述用于确定目标血管的容量的计算机实现的方法。
还一个方案中,本公开涉及一种计算机可读存储介质,其上存储有计算机可执行代码,所述计算机可执行代码在由处理器执行时实现上述的用于确定目标血管的容量的计算机实现的方法。
在另外还一个方案中,本公开涉及一种用于确定目标血管的容量的系统。该系统包括:接口,其被配置为接收由血管造影装置所采集的目标血管的时域上的造影图像序列;处理器,其被配置为:执行时实现根据上述的用于确定目标血管的容量的计算机实现的方法。
本公开的方法、装置和系统,基于为各个关注区域的积分值以及积分值与造影剂容积之间的预定关系,能够在不依赖于外部校准并且无需关于已知的碘浓度和x射线束能量的假设,就可以确定所述目标血管的容量。由此可见,本公开的方法、装置和系统从图像本身提取了丰富的信息,实现了在无需外部校准和假设的情况下,目标血管的容量的快速且现场的计算。
附图说明
在不一定按线性绘制的附图中,相同的附图标记可以在不同的视图中描述相似的部件。附图大体上通过举例而不是限制的方式示出各种实施例,并且与说明书以及权利要求书一起用于对所公开的实施例进行说明。在适当的时候,在所有附图中使用相同的附图标记指代同一或相似的部分。这样的实施例是例证性的,而并非旨在作为本方法、装置、系统或其上存储有指令用于实现所述方法的非易失性计算机可读存储介质的穷尽或排他实施例。
图1示出首过分析的简化模型图;
图2示出根据本公开实施例的用于确定目标血管的容量的方法的示例性过程的流程图;
图3(a)和图3(b)示出了根据本公开实施例的造影图像序列的示例并且框示出了在造影图像序列之中对roi的跟踪;
图4(a)~图4(c)示出了根据本公开实施例的获得造影图像的为关注区域去除背景且进行对数处理后的第一处理图像的过程;
图5示出了根据本公开实施例的积分信号与造影剂容积之间的关系;
图6示意性示出了根据本公开实施例的计算光程的图示;
图7示出根据本公开实施例的用于确定目标血管的平均流量的方法的示例性过程的流程图;
图8示出根据本公开实施例的所确定的造影剂容积随时间变化的时域分布图;
图9示出根据本公开实施例的用于确定目标血管的容量和/或流量的装置的示意图;以及
图10示出根据本公开实施例的用于确定目标血管的容量和冠状血流量的系统的框图。
具体实施方式
此处参考附图描述本公开的各种方案以及特征。通过下面参照附图对给定为非限制性实例的实施例的优选形式的描述,本发明的这些和其它特性将会变得显而易见。
本说明书可使用词组“在一种实施例中”、“在另一个实施例中”、“在又一实施例中”以及“在其他实施例中”,其均可指代根据本公开的相同或不同实施例中的一个或多个。注意的是,在说明书全文中,相同的附图标记指代相同或相似的元件,并省略不必要的重复描述。此外,具体实施例中,以单数形式出现的元件并不排除可以以多个(复数个)形式出现。本文中使用的技术术语“光程”表示射线在被摄体(并非真空)内传播的几何路程,技术术语“光程的长度”表示射线在被摄体内传播的几何路程的长度,技术术语“模拟光程长度”旨在表示利用模型模拟得到的光程长度。“血管的图像”旨在表示该图像中包含有血管,而非限定该图像中只有血管。本文中使用的技术术语“血管的流量”可以表示血管内的流体的流率,诸如其中注入的造影剂的扩散流率。在造影剂注射操作完成后,造影剂在血管内的扩散流率可接近血管中的血液流率。
图2示出根据本公开实施例的用于确定目标血管的容量的方法的示例性过程200的流程图,其始于步骤202:获取目标血管的时域上的造影图像序列。在一些实施例中,目标血管可以是由用户选择或由机器判别的病变血管。例如,目标血管的时域上的造影图像序列可以通过对目标血管使用造影剂进行灌注,并通过成像装置对目标血管连续成像而获得。在一些实施例中,可以按时间顺序获取血管造影图像序列。然而,序列不一定包括所获取的每个帧,而是仅包括所选择的图像帧。
造影图像的示例性序列例如由图3(a)和图3(b)所例示,从图3(a)到图3(b),造影剂在血管中逐渐扩散。虽然仅示出了图3(a)和图3(b)作为造影图像序列,但是可以理解,该造影图像序列可以包括两幅以上的(例如三幅或更多幅的)目标血管的造影图像。在步骤204中:在时域上的造影图像序列中的各个造影图像中,识别包含目标血管的关注区域。在一些实施例中,各个关注区域(roi)可沿着各个相应造影图像的血管中心线截取得到。
在一些实施例中,包含所述目标血管的关注区域可利用光流算法在所述多个造影图像中跟踪得到。在一个例子中,使用了farneback光流算法,该算法提供了质量和速度之间的良好折衷。图3(a)和图3(b)示出了对关注区域(roi)的跟踪。在血管的造影图像序列中,血管和其他组织在各帧间发生移动。在一些实施例中,为了准确地计算不同帧的对应的关注区域内的造影剂容积,可以使用光流算法来追踪roi区域。在一个实施例中,使用光流跟踪roi的包络边界,从图3(a)和图3(b)中可以看到,roi的包络边界被标示出来。由于血管的对比度相对较强,所跟踪的包络边界将关注的血管保持在该区域内。
在步骤206中,可以通过对造影图像的roi内的像素的强度值进行处理并对处理后像素值进行积分来对各个造影图像进行积分值计算。在一些实施例中,该处理可以包括无处理。在一些实施例中,该处理可以包括对像素值进行对数处理。在一些实施例中,该处理可以包括去除背景像素并对像素值进行对数处理。在一些实施例中,可以通过对所处理图像的roi中的像素的强度值求和来计算积分值。与本公开一致地,积分值可以称为“积分信号”。
图4(a)~图4(c)例示了根据本公开的实施例的处理后造影图像。
图4(a)是目标血管的二维图像it(例如造影图像)。关注区域可以仅为4(a)例示的区域中的一部分,可能仅包括其中一段或一部分血管。在一些实施例中,关注区域可以由用户(例如医生)根据需要而设定。图4(b)是二维图像it的背景图像ib,其为该二维图像it在没有注入造影剂的情况下会呈现的图像。在本公开的一些实施例中,例如可以使用图像修补方法来估计背景图像。使用图像修补方法来估计背景图像例如通过以下方式进行:首先将血管从图像中分割并提取出来,然后基于血管周围区域的信息替换血管区域。在一些实施例中,可以采用各种图像修补方法,着重于图像中待保留的不同方面的结构,包括几何结构、纹理等。在一个实施例中,可以选择匹配修补区域的边界处的梯度矢量并具有质量和速度之间的良好平衡的图像修补方法。图4(b)例示了通过匹配背景强度图案(诸如明亮的伪影区域)来填充血管区域的图像修补。
在一些扩展的实施例中,可以在视频序列中进行上述修补以更好地保持时域一致性。
虽然例示了用图像修补的手段来估计背景图像并将其去除,但是本发明不限于此,可以使用任何已知的背景图像估计方法来估计背景图像。
在一些实施例中,所述第一处理图像ln(it)-ln(ib)可以通过如下步骤得到:首先,对所述二维图像it(例如,图4(a))的各个像素的强度值求对数,得到第二对数处理图像ln(it);然后对血管部分基于其周边的背景像素的强度值进行修补得到估计背景图像ib(例如,图4(b)),然后对估计背景图像ib的各个像素的强度值求对数,得到第三对数处理图像ln(ib);之后,从第二对数处理图像ln(it)减去第三对数处理图像ln(ib),得到第一处理图像ln(it)-ln(ib)。
图4(c)示出了得到的第一处理图像ln(it)-ln(ib)。
然后,对第一处理图像ln(it)-ln(ib)(也就是图4(c))中关注区域内的各像素的强度值进行求和运算可以得到上述的积分值。
回到图2,过程200可以进行到步骤208以确定目标血管的容量。在一些实施例中,可以基于步骤206算出的积分值以及积分值与造影剂容积之间的预定关系,确定目标血管的容量。所述预定关系应步骤206中对像素值的处理方式的不同而不同。
对包括目标血管的关注区域算出的积分值与目标血管内灌注的造影剂的容积之间存在预定关系。如图5所示,以造影剂容积为横轴并以积分信号为纵轴绘制了相应各点,可以看到,图中积分信号(即,积分值)与造影剂容积之间的预定关系可以拟合为线性关系。因此,积分信号(即,积分值)与造影剂容积之间的预定关系可以预先确定,通过预先确定的关系以及当前造影图像中针对目标血管所在的关注区域计算出的积分值,可以很快地计算出当前造影图像中关注区域内的造影剂容积。可以计算出不同时刻采集的造影图像中的目标血管中所充盈的造影剂容积。
在一些实施例中,步骤208可以通过以下方式实现:基于步骤206算出的积分值以及预定关系,计算多个造影图像中对应的关注区域内的造影剂容积,并将计算出的造影剂容积中最大的一个确定为所述目标血管的容量。
在另一些实施例中,步骤208可以由以下方式实现:在为多个造影图像算出的积分值中选择最大积分值,基于所述最大积分值和所述预定关系(例如图5所示的线性关系),计算所述最大积分值对应的造影剂容积作为所述目标血管的容量。
观察到的是,在灌注造影剂的一定时间段内,造影剂容积逐渐递增(此时,造影剂仅流入目标血管而未流出该目标血管),直到达到最大值之后,随着时间经过,造影剂逐渐流出目标血管,造影剂容积将逐渐减小。因此,造影剂容积的最大值可近似目标血管的容量。
上述预定关系(例如线性关系)还可以数学上被支持。具体说来,造影剂的x射线衰减和造影剂中的光程可以用下面的公式(2)定义。
其中ii是入射射束强度,it是透射射束强度,μ/ρ是质量衰减系数,x是光程。本文中的技术术语“光程”表示x射线在被摄体(并非真空)内传播的几何路程。另外,下标c和o分别代表造影剂和器官(即,血管)。在没有造影剂的情况下,由于器官单独引起的x射线吸收,可以由公式(3)表示。
其中ib是仅具有背景的透射射束强度。
将公式(3)代入公式(2),并且可以得到血管各处的透射光强度与对应位置处的光程长度xc之间的关系,参见公式(4)。
血管各处的透射光经由平板探测器捕获灰度二维图像,并由此将血管各处的透射光的强度转换为二维图像上血管各处的强度值(例如灰度值),灰度转换并未破坏上述预定(固有)关系。于是,上述血管各处的透射光强度与对应位置处的光程长度xc之间的固有关系在二维图像上血管各处的强度值与对应位置处的光程长度xc之间得以保留。在下文中,为了便利描述,忽略血管各处的透射光强度与二维图像中相应血管各处的强度值之间的转换,其中it表示二维图像中血管各处的强度值,ib表示二维图像中血管对应各处的背景强度值。
进一步地,可将造影剂采样容积v0视为一个长方体,其容积是像素面积a和光程xc的乘积,如公式(5)所示。
可以看出,造影剂采样容积v0与采样点的去除背景且对数处理后的强度处理值[ln(it)-ln(ib)]成线性关系。将公式(5)两边在目标血管所在的关注区域进行积分,并且血管容量(对应造影剂容积)v与{ln(it)-ln(ib)]的积分值同样保持这种线性关系。
在一些实施例中,预定关系可以在同个患者的相同造影剂注射条件下的之前的血管造影中预先建立。在一些实施例中,预定关系可以在同次血管造影中针对部分血管预先建立。这是因为同一个患者的生理特征(如血液粘度、呼吸运动、心脏运动等)和/或造影剂参数(如注射时间和注射量)等差异可能较小。因此,在之前的血管造影中预先建立的该关系或者在同次血管造影中针对部分血管预先建立该关系对于同一个患者是能够连续适用的,由此可以快速获取积分值与造影剂容积之间的预定关系,从而针对同个患者,快速确定目标血管的血管容量。
在下面的示例中,说明了如何得到这种预定关系。
通过从原始x射线血管造影图像(可选地计入三维与二维的投影关系)进行半径估计来获得一个像素处的实际光程xc,如公式(6)并如图6所示。
xc=d/sinθ公式(6)
其中d为对应像素处的血管直径,θ为血管上该像素处的中心线与x射线投射方向的夹角。通过图像分析可以得到d和θ,从而计算出某一采样点处(例如,沿着目标血管中心线设定采样点)的光程。
例如,如图5所示,将各采样点的去除背景后且对数处理后的强度值ln(it)-ln(ib)视为在各采样点处的积分信号,可以绘制出各采样点处的积分信号相对于造影剂采样容积v0。图5建立了积分信号(即,积分值)与造影剂容积v之间的相关性。与传统方法相比,本公开实施例的方法可基于图像获得积分信号与血管容量的相关性,而不依赖于外部校准。
在一些实施例中,多个造影图像选自从灌注开始时间点起经过第一预定时间之后所采集的造影图像的序列。
例如,在开始灌注造影剂的第一预定时间,例如(在开始灌注的前10秒),造影剂还未流入roi中。于是,无需计算造影剂容积,直到第一预定时间结束,并且加速处理速度。
在一些实施例中,第一预定时间可以被设定得较大,理论上来说,只要第一预定时间被设定在目标血管中造影剂开始流出的时刻之前,都能够满足要求。因此,第一预定时间可以根据先验知识来设定,而不限于在此给出的具体时间。
如图7所示,提供了一种用于确定目标血管的流量的方法的示例性过程700。示例性过程700始于获取步骤702。在步骤702中,可以获取对目标血管使用造影剂进行灌注的时域上的造影图像序列。
在步骤704,可以为造影图像序列中的顺序的多个造影图像的每个造影图像,识别对应的包含目标血管的关注区域。在步骤706中,可以对关注区域的各像素的去除背景且对数处理后的强度值进行积分。步骤702-706与示例性过程200中的对应步骤(步骤202-206)相同或相似,故在此不再赘述。
然后,过程700进入步骤708。在步骤708中,可以基于积分值计算步骤706计算出的多个造影图像的对应的关注区域内的积分值的变化情况以及积分值与造影剂容积之间的预定关系,确定目标血管的流量。
同样,可以参照前文方法来预先确定积分值与造影剂容积之间的这种预定关系。
由此,本实施例通过利用积分值与造影剂容积之间的预定关系,在无需进行外部校准的前提下确定了目标血管的流量。
在一些实施例中,步骤708可以包括计算造影剂容积并确定平均流量。在一些实施例中,可以基于积分值以及所述预定关系,计算所述多个造影图像上所述关注区域内的造影剂容积。可以计算在所述多个造影图像上所述关注区域内的造影剂容积的时域分布的上升段中所述造影剂容积相对于时间的变化率,作为所述目标血管的平均流量。
在一些实施例中,步骤708不必先计算造影剂容积就可确定平均流量。具体而言,在步骤708,可以计算在所述多个造影图像上所述关注区域内的积分值的上升段中所述积分值相对于时间的变化率,并基于积分值与造影剂容积之间的预定关系将其转换为所述造影剂容积相对于时间的变化率,作为所述目标血管的平均流量。
在一个实施例中,平均流量可以如下地确定。
在坐标系上绘制造影剂容积随时间变化的曲线,如图8中实线所示,例如在约前10秒造影剂还未流入roi中,而在约45秒-60秒左右造影剂灌注进入了平台期(即输入与输出基本相等),之后造影剂持续流出roi。
然后,将随时间变化的曲线拟合为多项式曲线,如图8中虚线所示;
然后,计算多项式曲线中上升部分的斜率作为变化率
在一些实施例中,多个造影图像选自从灌注开始时间点起经过第一预定时间(例如,如图8所示,可以设定为第10s或接近的数值)之后第二预定时间(例如,如图8所示,可以设定为第40s或接近的数值)之前所采集的造影图像。由此,排除了灌注开始时间段的造影图像和平台期以及之后的造影图像,由于减少了用于计算的造影图像的量,能够提升处理速度。
此外,在一些实施例中,可以从获得的多个造影图像序列中顺序选取一部分造影图像进行上述确定血管容量和/或平均流量的处理,以进一步提高处理速度。在一些实施例中,可以计算上述多项式曲线中的任何一段的斜率作为目标血管在对应时刻的实时流量。
图9示出了根据实施例的一种用于确定目标血管的容量和/或流量的装置900的示意图。
装置900可以包括:获取单元902,配置为获取目标血管的时域上的造影图像序列;积分值计算单元904,配置为在造影图像序列的每个造影图像中,识别对应的包含所述目标血管的关注区域,并在所述关注区域内对各像素的去除背景后的对数处理值进行积分;以及血管容量确定单元906,配置为基于所述积分值计算单元904为多个造影图像算出的积分值以及积分值与造影剂容积之间的预定关系,确定所述目标血管的容量。
在一些实施例中,血管容量确定单元906可以包括造影剂容积计算单元9062,造影剂容积计算单元9062用于计算多个造影图像中对应的关注区域内的造影剂容积。
在一些实施例中,获取单元902可以从医学图像数据库935获取目标血管的造影图像序列。
在另一些实施例中,获取单元902可以从诸如医学图像采集装置(未示出)的外部装置直接获取目标血管的造影图像序列。
在还一些实施例中,获取单元902可以从图像数据存储装置(未示出)获取上述图像。在一个变型实施例中,获取单元902可以从上述来源中的至少两个来获取所需的模型和图像。
获取单元902将获取到的对目标血管使用造影剂进行灌注的造影图像序列传输到积分值计算单元904。
积分值计算单元904将计算出的积分值传输到血管容量确定单元906,其配置为基于积分值以及积分值与造影剂容积之间的预定关系,确定目标血管的容量。积分值与造影剂容积之间的预定关系可以从例如存储装置中调取,也可以通过预定关系计算单元910实时计算得到。
例如,预定关系计算单元910可利用前述的方法,针对某一造影图像,对目标血管设定采样点(例如沿目标血管的中心线,但不限于此),如图5所示,绘制各采样点的积分信号相对于造影采样容积的值,并拟合出一条直线,求得直线的斜率,从而确定积分信号与造影剂容积之间的预定关系。此外,基于公式(4)和公式(6),可以仅通过单个采样点的积分信号与造影采样容积的比值,确定所述预定关系。但是,通过多个采样点,能够使获得的预定关系更精确。
在一些实施例中,血管容量确定单元906可以输出所确定的目标血管的容量。
在一些实施例中,装置900还可以包括流量确定单元912。造影剂容积计算单元9062将计算出的多个造影图像中的每一个造影图像上的关注区域所对应的造影剂容积传输至流量确定单元912,从而流量确定单元912基于造影剂容积计算单元9062计算出的多个造影图像的对应的关注区域内的造影剂容积的变化情况,确定目标血管的流量。
在一些实施例中,装置900被配置为仅实现确定目标血管的容量和流量这两个功能中的任一个。装置900的各单元可以执行本公开中描述的相应步骤和方法,在此不再赘述。
图10例示了一种用于确定目标血管的容量和平均流量的医学图像处理系统1000的框图。医学图像处理系统1000可以包括网络接口1001,借助于网络接口1001,系统1000可以连接到网络(未示出),例如但不限于医院中的局域网或互联网。网络可以将系统1000与诸如图像采集装置(未示出)的外部装置、医学图像数据库2000、图像数据存储装置3000连接。
可以构想的是,实施例中公开的装置和方法可使用计算机装置来实现。在一些实施例中,医学图像处理系统1000可以是专用智能装置或通用智能装置。例如,医学图像处理系统1000可以是为图像数据采集和图像数据处理任务定制的计算机,或者置于云中的服务器。例如,系统1000可以被集成到图像采集装置中。
医学图像处理系统1000可以包括图像处理器1002和存储器1003,并且可以额外包括输入/输出1004和图像显示器1005中的至少一个。
图像处理器1002可以是包括一个或多个通用处理设备(诸如微处理器,中央处理单元(cpu),图形处理单元(gpu)等)的处理设备。更具体地说,图像处理器1002可以是复杂指令集计算(cisc)微处理器、精简指令集计算(risc)微处理器、超长指令字(vliw)微处理器、运行其他指令集的处理器或运行指令集的组合的处理器。图像处理器1002也可以是一个或多个专用处理设备,例如专用集成电路(asic)、现场可编程门阵列(fpga)、数字信号处理器(dsp)、片上系统(soc)等等。如本领域技术人员将理解的,在一些实施例中,图像处理器1002可以是专用处理器,而不是通用处理器。图像处理器1002可以包括一个或多个已知处理设备,诸如由英特尔公司制造的pentiumtm、coretm、xeontm或itaniumtm系列的微处理器,由amd公司制造的turiontm、athlontm、semprontm、opterontm、fxtm、phenomtm系列的微处理器或太阳微系统(sunmicrosystems)制造的各种处理器的任一种。图像处理器1002还可以包括图形处理单元,诸如来自nvidia公司制造的
图像处理器1002可以通信地耦合到存储器1003并且被配置为执行存储在其中的计算机可执行指令。存储器1003可以包括只读存储器(rom),闪存,随机存取存储器(ram),静态存储器,易失性或非易失性、磁性、半导体、带、光学、可移动、不可移动或其他类型存储设备或有形(例如,非暂时性)计算机可读介质。在一些实施例中,存储器1003可以存储一个或多个图像处理程序923的计算机可执行指令以及当图像处理程序被执行时生成的数据。计算机程序指令可以被图像处理器1002访问,从rom或者任何其他合适的存储位置读取,并加载到ram中供图像处理器1002执行,以实现上述方法的每个步骤。图像处理器1002还可以向/从存储器1003发送/接收医学图像数据。例如,存储器1003可以存储一个或多个软件应用程序。存储在存储器1003中的软件应用程序可以包括例如用于通用计算机系统的操作系统(未示出)以及软控制设备。此外,存储器1003可以存储整个软件应用程序或仅存储软件应用程序的一部分(例如图像处理程序923)以能够由图像处理器1002执行。在一些实施例中,图像处理程序923可以包括图9中所示的积分值计算单元904和血管容量确定单元906作为软件单元,用于实现与本公开一致的确定目标血管的容量的方法或过程的各个步骤。在一些实施例中,图像处理程序923还可以由图9中所示的造影剂容积计算单元9062和流量确定单元912执行,用于实现与本公开一致的确定目标血管的平均流量的方法或过程的各个步骤。此外,存储器1003可以存储在执行计算机程序时生成/缓存的数据,例如医学图像数据1006,其包括从图像采集装置、医学图像数据库2000、图像数据存储装置3000等发送的医学图像。此外,医学图像数据1006还可以包括对目标血管的检测结果(血管容量和/或平均流量)。
图像处理器1002可以执行图像处理程序923以实现用于确定目标血管的容量和/或平均流量的方法。
在一些实施例中,当执行图像处理程序923时,图像处理器1002可以将所获取的造影图像序列与确定出的目标血管的容量和/或流量相关联,并将它们存储到存储器1003中。可选地,图像处理器1002可以将所获取的造影图像序列与确定出的目标血管的容量和/或流量相关联,并经由网络接口1001将它们发送给医学图像数据库2000。
可以想到的是,该装置可以包括一个或多个处理器和一个或多个存储设备。(一个或多个)处理器和(一个或多个)存储设备可以以集中式或分布式的方式来配置。
该系统1000还可以包括一个或多个数字和/或模拟通信设备(输入/输出1004)。例如,输入/输出设备1004可以包括允许用户提供输入的键盘和鼠标。
系统1000可以通过网络接口1001连接到网络。网络接口1001可以包括网络适配器、电缆连接器、串行连接器、usb连接器、并行连接器、诸如光纤的高速数据传输适配器、usb3.0、闪电、无线网络适配器如wifi适配器、电信(3g、4g/lte等)适配器。网络可以提供局域网(lan)、无线网络、云计算环境(例如,作为服务的软件、作为服务的平台、作为服务的基础设施等)、客户端服务器、广域网(wan)等的功能。
该系统1000可以进一步包括图像显示器1005。在一些实施例中,图像显示器1005可以是适合于显示血管造影图像及其检测结果的任何显示设备。例如,图像显示器1005可以是lcd、crt或led显示器。
这里描述了各种操作或功能,其可以被实现为软件代码或指令或被定义为软件代码或指令。这样的内容可以是可直接执行的源代码或差异代码(“增量”或“块”代码)(“对象”或“可执行”形式)。软件代码或指令可以存储在计算机可读存储介质中,并且当被执行时,可以使机器执行所描述的功能或操作,并且包括用于以机器可访问的形式存储信息的任何机构(例如,计算设备,电子系统等),诸如可记录或不可记录介质(例如,只读存储器(rom)、随机存取存储器(ram)、磁盘存储介质、光存储介质,闪存设备等)。
所公开的实施例的装置和方法可以应用于像素强度随成像微粒行进的距离改变的各种成像模态,诸如ct、锥形束计算机断层摄影(cbct)、螺旋ct、正电子发射断层扫描(pet)、单光子发射计算机断层扫描(spect)、x射线扫描、光学断层扫描、放射射野成像等。
以上实施例仅为本发明的示例性实施例,不用于限制本发明,本发明的保护范围由权利要求书限定。本领域技术人员可以在本发明的实质和保护范围内,对本发明做出各种修改或等同替换,这种修改或等同替换也应视为落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!