一种肿瘤放射治疗中生物效应剂量确定方法及系统与流程
本发明涉及医学领域,特别是涉及一种肿瘤放射治疗中生物效应剂量确定方法及系统。
背景技术:
放射治疗过程中的“生物剂量”和“物理剂量”是两个不同的概念。根据国际原子能委员会iaea第30号报告定义,“生物剂量”是指生物体辐射响应程度的测量。描述细胞生存曲线模型描述了肿瘤细胞和正常组织细胞放射治疗过程中细胞的存活状况,普遍用于拟合克隆形成细胞的体外和体内存活实验获得的生存曲线。由细胞生存曲线模型推导出的生物效应剂量(biologicaleffectdose,bed)模型普遍适用于计算不同分次方案的等效剂量、正常组织并发症(normaltissuecomplicationprobability,ntcp)的预测和肿瘤局部控制率(tumorcontrolprobability,tcp)的计算。
随着放疗设备、技术的发展,单次大剂量放疗——包括寡分割、体部立体定向放疗(stereotacticbodyradiotherapy,sbrt)的治疗模式逐渐得到重视,单次大剂量放疗是在放疗时通过单次照射大于常规治疗的单次剂量的放疗方式,不仅将肿瘤细胞再增殖概率降到最低,提高肿瘤控制率,而且能够缩短放疗疗程、降低治疗成本。原发性和转移性肺、肝脏、前列腺等恶性肿瘤的临床研究结果显示,大分割放疗效果显著。单次大剂量和常规放疗两种放疗模式都是由于射线照射引起的dna双链的断裂导致细胞的损伤,从而控制肿瘤和引起正常组织损伤。不同之处是在实施常规放疗时,由于单次剂量小、分次次数多和治疗疗程长的原因,会提高分次间细胞的修复、细胞周期的再分布和增殖,这不利于肿瘤的控制但可以减少正常组织的损伤。单次大剂量放疗由于单次治疗剂量大、分次次数少和治疗疗程短的原因,治疗中会减少细胞的修复、细胞周期再分布和增殖,这有利于肿瘤的控制但同时增加了正常组织的损伤。
在现有的将物理剂量转换为生物剂量的换算模型中,线性-二次(linear-quadratic,lq)模型是一种广泛应用于放射生物学研究和临床放射治疗的数学模型,它是从细胞的存活曲线直接推导而得出。由lq模型推导衍生出的生物效应剂量,是一种根据剂量分割模式不同而将物理剂量转化为生物剂量的方法。
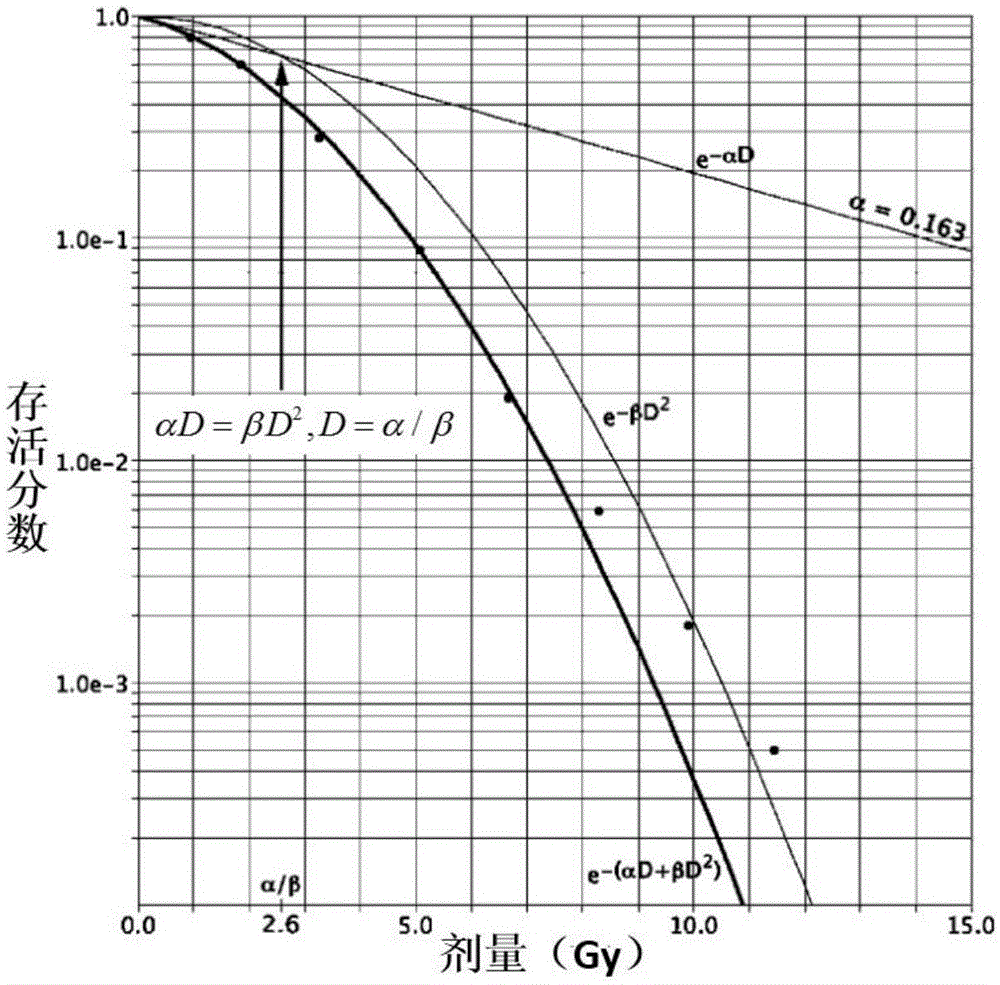
lq模型是一个通过拟合细胞接受不同持续剂量照射后数据变化曲线得到的经验公式。如图1所示,在对数线性图中,lq曲线非常符合培养中中国仓鼠细胞的这些实验结果,最高剂量为6gy,但随后继续弯曲,观察到实验结果在高剂量下变为线性,模型认为放射会导致致死性损伤和亚致死性损伤。细胞dna双链断裂是导致细胞失活的致死性损伤事件,双链断裂可以是单个粒子能量沉积导致双链破坏,称为α损伤,与放射剂量呈正比;或者2个粒子协同作用导致双链破坏,称为β损伤,与放射剂量的平方呈正比。亚致死性损伤是由于放射粒子导致细胞dna单链断裂,如果没有进一步的照射,则细胞可以被修复。细胞受照射后,其总体损伤必定是α损伤和β损伤的综合效应,可描述为:
s=exp(-αd-βd2)(1)
其中,s表示的是细胞的存活分数,d为施照剂量,α表示单位剂量的单个粒子使细胞杀灭的平均概率;β表示单位剂量的两个粒子使细胞杀灭的平均概率。当α损伤和β损伤概率相同时,αd=βd2,d=α/β,此处得到的α/β是该受照射组织的生物特征剂量(单位:gy)。每种组织都有其对应的生物特征剂量,α/β越大,该组织对射线越敏感,体现为早反应组织,如多数的肿瘤组织、上皮细胞;α/β越小,该组织对射线越抗拒,体现为晚反应组织,如前列腺肿瘤(α/β小于2gy)、肺、脊髓。
lq模型推导出的生物效应剂量,是指分次数无穷多、分次剂量无穷小时产生相等生物效应所需的理论总剂量。bed推动了肿瘤放射治疗生物剂量向基于实验的定量评估方向发展。bed是细胞存活分数s取对数后的(-1/α)倍,即:
n表示照射次数,d表示分次剂量,α/β表示待等效组织的生物特征剂量。动物实验表明,在小鼠小肠隐窝细胞不同剂量率照射生物效应研究中,lq模型可以很好的拟合不同剂量率下细胞的生存曲线。同时临床上已经证明,当皮肤分割1~64次照射时,lq模型能恰当的定量描述它们修复中的生物效应剂量;在对157例鼻咽癌患者常规分割放疗研究中发现,鼻咽癌分割放疗中有明显的bed关系,剂量越低,局控和生存率越低,但一定剂量所产生的bed随疗程时间而变化,疗程越长,局控和生存率越低。
近十年来,随着设备及技术水平的提高,放疗能够将x射线剂量以高度适形的方式准确投射到身体的任何部位,治疗过程可以在短暂的数天内完成,提高生物效应的同时降低医疗成本,这使得放疗医生对大分割技术重新燃起了兴趣,相关临床队列实验也给出了令人鼓舞的结果。
但是,lq模型中认为分次之间的时间间隔可以使细胞的亚致死性损伤得到完全的修复,但是随着单次方式治疗剂量不断增加,单次剂量提升带来的生物效应却被忽略。细胞在放射过程中会形成两种类别的损伤:第一类是致死性损伤,第二类是亚致死性损伤。致死和亚致死可以利用把理论进行解释,把理论中认为细胞中存在关键的靶,只有射线粒子击中所有的靶,细胞才会死亡。细胞中的致死性损伤可以认为是所有靶都被击中,亚致死性损伤是细胞中部分靶被击中但未全部击中。lq模型中的理论认为亚致死性损伤会自我修复,但是随着放射治疗中单次剂量的提升,细胞会在短时间内产生大量的亚致死性损伤,这就导致:1.细胞在进行dna自我修复时,由于亚致死性损伤的基数变多,使得细胞错误修复的数量变多;2.细胞在进行自我修复可用来进行修复的生物酶和蛋白质在短时间内是有限的,这就使得细胞的亚致死性损伤得不到修复而进一步转化为致死性损伤;3.在放射治疗时随着剂量的不断提升,一些亚致死性损伤受到进一步的照射直接变为致死性损伤导致细胞凋亡。这就导致了在高剂量区传统lq模型的不能正确细胞的存活状况。由于lq模型是在单次低剂量照射推导得到模型,而lq模型中没有考虑到随着单次照射剂量的增加,因此,无法准确计算出生物效应剂量;此外,lq模型中的参数都有其相应对生物学意义,但在拟合中发现模型在拟合一些对射线相对不敏感的细胞系时所得到的生物学参数不能准确地表示其真正的生物敏感性。
技术实现要素:
本发明的目的是提供一种肿瘤放射治疗中生物效应剂量确定方法及系统,以解决传统的lq模型中由于没有考虑到随着单次照射剂量的增加,而导致无法准确评估出放射治疗过程中的生物效应剂量的问题。
为实现上述目的,本发明提供了如下方案:
一种肿瘤放射治疗中生物效应剂量确定方法,包括:
获取修正参数;所述修正参数包括单次照射剂量、亚致死损伤向致死性损伤转化的转化函数以及修正函数;
根据所述修正参数建立细胞生存曲线描述模型;
根据所述细胞生存曲线描述模型建立生物效应剂量模型;
根据所述生物效应剂量模型确定生物效应剂量。
可选的,所述根据所述修正参数建立细胞生存曲线描述模型,具体包括:
根据公式s=exp((-αd-βd2)/(1+dγ))建立细胞生存曲线描述模型;其中,s为细胞存活分数;为d为单次照射剂量;α为放射过程中由单个粒子造成的致死性损伤的平均概率;β为两个粒子造成致死性损伤的平均概率;γ为由于亚致死性损伤转换而导致的二次项不断减小的模型参数。
可选的,所述根据所述细胞生存曲线描述模型建立生物效应剂量模型,具体包括:
采用最小二乘法对所述细胞生存曲线描述模型进行拟合,确定拟合后的细胞生存曲线描述模型;
根据所述拟合后的细胞生存曲线描述模型建立生物效应剂量模型。
可选的,所述根据所述生物效应剂量模型确定生物效应剂量之后,还包括:
根据所述生物效应剂量模型将分次剂量等价到无限分次照射条件下的照射等价剂量,并根据公式n1d1(1+βd1/α)/(1+d1γ)=n2d2(1+βd2/α)/(1+d2γ)转化不同放射治疗方案;n1为第一治疗方案的分次数;d1为第一治疗方案的单次照射剂量,n2为第二治疗方案的分次数;d2为第二治疗方案的单次照射剂量。
一种肿瘤放射治疗中生物效应剂量确定系统,包括:
修正参数获取模块,用于获取修正参数;所述修正参数包括单次照射剂量、亚致死损伤向致死性损伤转化的转化函数以及修正函数;
细胞曲线描述模型建立模块,用于根据所述修正参数建立细胞生存曲线描述模型;
生物效应剂量模型建立模块,用于根据所述细胞生存曲线描述模型建立生物效应剂量模型;
生物效应剂量确定模块,用于根据所述生物效应剂量模型确定生物效应剂量。
可选的,所述细胞曲线描述模型建立模块具体包括:
细胞曲线描述模型建立单元,用于根据公式s=exp((-αd-βd2)/(1+dγ))建立细胞生存曲线描述模型;其中,s为细胞存活分数;为d为单次照射剂量;α为放射过程中由单个粒子造成的致死性损伤的平均概率;β为两个粒子造成致死性损伤的平均概率;γ为由于亚致死性损伤转换而导致的二次项不断减小的模型参数。
可选的,所述生物效应剂量模型建立模块具体包括:
拟合单元,用于采用最小二乘法对所述细胞生存曲线描述模型进行拟合,确定拟合后的细胞生存曲线描述模型;
生物效应剂量模型建立单元,用于根据所述拟合后的细胞生存曲线描述模型建立生物效应剂量模型。
可选的,还包括:
转化模块,用于根据所述生物效应剂量模型将分次剂量等价到无限分次照射条件下的照射等价剂量,并根据公式n1d1(1+βd1/α)/(1+d1γ)=n2d2(1+βd2/α)/(1+d2γ)转化不同放射治疗方案;其中,n1为第一治疗方案的分次数;d1为第一治疗方案的单次照射剂量,n2为第二治疗方案的分次数;d2为第二治疗方案的单次照射剂量。
根据本发明提供的具体实施例,本发明公开了以下技术效果:本发明提供了一种肿瘤放射治疗中生物效应剂量确定方法及系统,通过引进单次照射剂量,即:引进了随单次照射剂量增加而引起的细胞自我修复变化,将lq模型中忽略的亚致死损伤向致死性损伤转化的因素量化后添加到lq模型中,从而确定了新的细胞生存曲线描述模型,在高剂量区改善了模型的梯度,使得模型曲线更加符合实验观察数据,改善了以前细胞生存曲线描述模型在高剂量区持续弯曲下降,不能准确描述细胞的存活状况的缺点;同时,通过新的细胞生存曲线描述模型推导出的生物效应剂量模型能够更加准确地描述放射治疗中的生物效应剂量,改善了以往模型在高剂量区高估或低估生物杀伤效应的缺点,可以准确的计算生物效应剂量,从而更准确地进行不同放射治疗方案之间的转换;模型所拟合得到的参数都有其对应的生物学意义,同时细胞生存曲线描述模型简单,易于临床推广。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明所提供的对数线性图;
图2为本发明所提供的肿瘤放射治疗中生物效应剂量确定方法流程图;
图3为本发明所提供的二次项由于亚致死向致死性损伤的转化而导致的概率减小曲线图;
图4为本发明所提供的基于动物细胞存活数据的拟合曲线图;
图5为本发明所提供的基于人体细胞存活数据的拟合曲线图
图6为本发明所提供的肿瘤放射治疗中生物效应剂量确定系统框图;
图7为本发明所提供的肿瘤放射治疗中生物效应剂量确定系统结构图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明的目的是提供一种肿瘤放射治疗中生物效应剂量确定方法及系统,能够准确评估出放射治疗过程中的生物效应剂量。
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
图2为本发明所提供的肿瘤放射治疗中生物效应剂量确定方法流程图,如图2所示,一种肿瘤放射治疗中生物效应剂量确定方法,包括:
步骤201:获取修正参数;所述修正参数包括单次照射剂量、亚致死损伤向致死性损伤转化的转化函数以及修正函数。
步骤202:根据所述修正参数建立细胞生存曲线描述模型。
在以往研究报道中,发现单次剂量超过(5~6gy)时,部分细胞的存活曲线会变成较强的线性关系。所以,亚致死的转换应该是在小于(5~6gy)显著地变化,在大于(5~6gy)后变得平稳。所以,剂量对亚致死转换的关系假设为幂指函数关系,即f{dγ},其中d为单次照射剂量,γ为模型参数。在lq模型中与亚致死相关的是模型的二次项。由于亚致死的转换,使得二次项-βd2不断减小。假设二次项为-p·βd2,p可以理解为二次项的概率。在未考虑剂量因素前p(d)=1,在考虑单次剂量增加后p(d)=f{dγ}。由于p随着剂量的增加不断减小,所以p(d)=p/f{dγ},即p(d)=1/f{dγ}。可以直接用简单形式f{dγ}=dγ来表示它们之间的关系,所以p(d)=1/dγ,为保证p在[0,1]之间小于1,所以将底数改为(1+dγ),最终结果为r=p=1/(1+dγ)。
如图3所示,在相同的时间间隔下,随着单次剂量的增加细胞对亚致死的修复能立刻用模型1/(1+dγ)来表示。将修复函数r与lq模型结合便可得到新的细胞生存曲线描述模型:
s=exp(-αd-βd2·1/(1+dγ))(3)
其中α代表放射过程中由单个粒子造成的致死性损伤的平均概率,β代表有两个粒子造成致死性损伤的平均概率。其中γ表示由于亚致死向致死性损伤转换,而导致的二次项不断减小的模型参数。在大量的细胞实验基础上发现,在拟合的数据效果上将一次项同样也乘以修正函数r会有更好的效果。原因是修正函数描述了一次项的随剂量增加由快速变化到平稳的函数特性,为了新模型的简洁所以公式为:
s=exp((-αd-βd2)/(1+dγ))(4)
其中α、β和γ(参数的决定是根据不同的细胞系进行拟合确定,或者通过临床数据进行整合和预处理,然后对参数进行拟合估计)为模型的特征参数,d为单次照射剂量。
α代表放射过程中由单个粒子造成的致死性损伤的平均概率,β代表有两个粒子造成致死性损伤的平均概率。其中γ表示由于亚致死向致死性损伤转换,而导致的二次项不断减小的模型参数。
获取细胞存活数据;所述细胞存活数据包括动物细胞存活数据以及人体细胞存活数据。通过细胞存活数据验证模型的准确性和适用性;在具体的系统实现中,可以应用人体细胞存活数据进行拟合。
回顾分析现有的细胞存活数据,在里面选了一组动物细胞辐射存活实验数据和一组人体细胞辐射存活实验数据,来对新的模型进行拟合精度检验和模型参数拟合。在动物细胞里面挑选了中国仓鼠纤维瘤细胞系(choaa8)和小鼠乳腺肉瘤细胞系(emt6);在人体细胞中挑选了两种前列腺癌细胞系(cp3和du145)。在两组数据集的基础上使用最小二乘法对细胞存活数据进行拟合,拟合结果如图4和图5所示,同时,表1为本发明所提供的四种不同细胞系所对应的拟合参数以及其拟合精度对比表,如表1所示。
动物细胞存活数据为中国仓鼠纤维瘤细胞系(chaoo8,○)和小鼠乳腺肉瘤细胞系(emt6,△),实线为choaa8的拟合曲线,虚线为emt6的拟合曲线。
人体细胞存活数据为前列腺癌细胞系(du145和cp3,分别为□和☆),实线为du145的拟合曲线,虚线为cp3的拟合曲线。
步骤203:根据所述细胞生存曲线描述模型建立生物效应剂量模型。
根据所得到的细胞存活曲线描述模型建立生物效应剂量计算模型,式(5)为生物效应剂量模型。将生物效应剂量模型在等式两边取自然对数,然后乘以-1/α,这样就可以将新模型转化为生物效应剂量计算模型。
bed=d(1+βd/α)/(1+dγ)(5)
其中,α为放射过程中由单个粒子造成的致死性损伤的平均概率;β为两个粒子造成致死性损伤的平均概率;γ为由于亚致死性损伤转换而导致的二次项不断减小的模型参数,d为单次照射剂量。
步骤204:根据所述生物效应剂量模型确定生物效应剂量。
如图6所示,其中,
n1d1(1+βd1/α)/(1+d1γ)=n2d2(1+βd2/α)/(1+d2γ)(6)
其中,α为放射过程中由单个粒子造成的致死性损伤的平均概率;β为两个粒子造成致死性损伤的平均概率;γ为由于亚致死性损伤转换而导致的二次项不断减小的模型参数,n1为第一治疗方案的分次数;d1为第一治疗方案的单次照射剂量,n2为第二治疗方案的分次数;d2为第二治疗方案的单次照射剂量。
图7为本发明所提供的肿瘤放射治疗中生物效应剂量确定系统结构图,如图7所示,一种肿瘤放射治疗中生物效应剂量确定系统,包括:
修正参数获取模块701,用于获取修正参数;所述修正参数包括单次照射剂量、亚致死损伤向致死性损伤转化的转化函数以及修正函数;
细胞曲线描述模型建立模块702,用于根据所述修正参数建立细胞生存曲线描述模型。
所述细胞曲线描述模型建立模块702具体包括:细胞曲线描述模型建立单元,用于根据公式s=exp((-αd-βd2)/(1+dγ))建立细胞生存曲线描述模型;其中,s为细胞存活分数;为d为单次照射剂量;α为放射过程中由单个粒子造成的致死性损伤的平均概率;β为两个粒子造成致死性损伤的平均概率;γ为由于亚致死性损伤转换而导致的二次项不断减小的模型参数。
生物效应剂量模型建立模块703,用于根据所述细胞生存曲线描述模型建立生物效应剂量模型。
所述生物效应剂量模型建立模块703具体包括:拟合单元,用于采用最小二乘法对所述细胞生存曲线描述模型进行拟合,确定拟合后的细胞生存曲线描述模型;生物效应剂量模型建立单元,用于根据所述拟合后的细胞生存曲线描述模型建立生物效应剂量模型。
生物效应剂量确定模块704,用于根据所述生物效应剂量模型确定生物效应剂量。
本发明还包括转化模块,用于根据所述生物效应剂量模型将分次剂量等价到无限分次照射条件下的照射等价剂量,并根据公式n1d1(1+βd1/α)/(1+d1γ)=n2d2(1+βd2/α)/(1+d2γ)转化不同放射治疗方案;其中,n1为第一治疗方案的分次数;d1为第一治疗方案的单次照射剂量,n2为第二治疗方案的分次数;d2为第二治疗方案的单次照射剂量。
针对描述放射治疗过程中细胞存活状况模型,还能够推导出一系列的生物效应剂量的计算方法。
其中,主要包括两类模型,第一类为连续型模型,其中包括线性-二次(linear-quadratic,lq)模型和广义线性二次模型(linear-quadratic,lq);第二类为分段型模型,其中包括通用生存曲线(universalsurvivalcurve,usc)模型和线性-二次-线性(linear-quadratic-linear;lql)模型。
glq模型认为lq模型没有充分考虑随着时间的推移亚致死损伤的变化,lq模型中仅考虑了亚致死损伤的修复过程,而亚致死损伤由于进一步辐射转换为致死性损伤的情况被忽略。在低剂量照射和低剂量率照射时是可以接受的,而在单次大剂量照射和高剂量率照射时就会造成较大的差异。glq模型最主要的改进就是增加了亚致死损伤向致死性损伤转化指数项β2,表达式为:
其中,d为在时间t内照射总剂量,i(t)为照射时的剂量率,μ为修复率,β1表示亚致死损伤比率,β2表示亚致死损伤转化为致死性损伤的比率。
usc模型是由lq模型和多靶单击模型组合而成,将前者精确拟合低剂量区细胞存活曲线和后者在高剂量区能更加准确拟合实验数据的特点相结合。为了使模型更加简单易用,usc采用多靶单击模型的渐近线来代替该模型。模型设置转换剂量dt,当d≤dt时,采用lq模型;当d≥dt时,应用多靶单击模型,使得lq模型可在dt处平滑过渡,表达式为:
dt为转换剂量,d0为确定曲线最终斜率的参数,dq为多靶单击模型渐近线的延长线与x轴的截距。usc模型计算生物效应剂量的计算公式:
d为照射的总剂量,d为单次剂量,n为照射次数。
lql模型通过使用转换剂量dt将剂量区域分了为两个部分,在高剂量区通过引进一个简单模型来拟合细胞生存曲线的线性部分。lql模型的表达式为:
公式中γ表示在细胞存活曲线高剂量区的线性部分,每单位剂量细胞的对数杀伤。当假设两个模型紧密匹配并平滑的过渡到线性部分时,可以将γ近似为用lq模型拟合的细胞生存曲线在转换剂量dt处的切线斜率。lq-l模型可用来计算生物等效剂量,计算公式为:
本发明在传统的计算模型的基础上,将被忽略的随着单次剂量的不断提升生物效应改变的因素添加到模型中,解决了传统的生物效应剂量计算模型随着单次剂量的提升,过高的估计放射治疗中生物效应剂量的问题。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的系统而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处。综上所述,本说明书内容不应理解为对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!