患者胸腹部肿瘤呼吸运动预测跟踪方法与流程
本发明属于医学信号处理领域,特别是涉及一种应用于放射治疗过程的,患者胸腹部肿瘤呼吸运动的预测跟踪方法。
背景技术:
在恶性肿瘤中发病率最高的肺部肿瘤和其它胸部、腹部肿瘤,会发生由病人呼吸引起的术中移位。随着技术的发展,采用x射线立体平面成像和光学实时跟踪相结合的跟踪技术,使对患者体内肿瘤呼吸运动的实时跟踪成为可能;且高精度的呼吸预测算法,能补偿数据处理和设备电气机械动作等引入的时间延迟。由此,放射治疗设备可在放射治疗过程中,对运动肿瘤进行跟踪和补偿,实施更精准的放射治疗,可极大地减少放疗射线对肿瘤周边正常组织和关键器官的损伤,改善治疗效果,降低放疗副作用。
其他研究主要关注于下一时刻呼吸位置的预测算法,效果较好的有神经网络(nn)、支持向量机(svm)、自适应神经模糊推理系统(anfis)等。
其他研究的呼吸预测算法,nn算法容易陷入局部最小化或者产生过拟合问题。svm算法复杂度高,预测结果依赖参数选择。anfis算法采用呼吸运动的位置作为模型的输入参数构造模糊集进行预测,预测能力较强,但对不规则信号特别是当呼吸信号的振幅发生突变时,预测误差过大。
技术实现要素:
本发明的目的在于克服现有技术中存在的不足,提供一种患者胸腹部肿瘤呼吸运动预测跟踪方法,能够实时跟踪、预测患者体内肿瘤呼吸运动;(1)为放射治疗门控方法提供输入数据;(2)与实时跟踪放射治疗设备进行通信,引导其实施精确的跟踪放射治疗。本发明采用的技术方案是:
本发明提出一种患者胸腹部肿瘤呼吸运动预测跟踪方法,包括以下步骤:
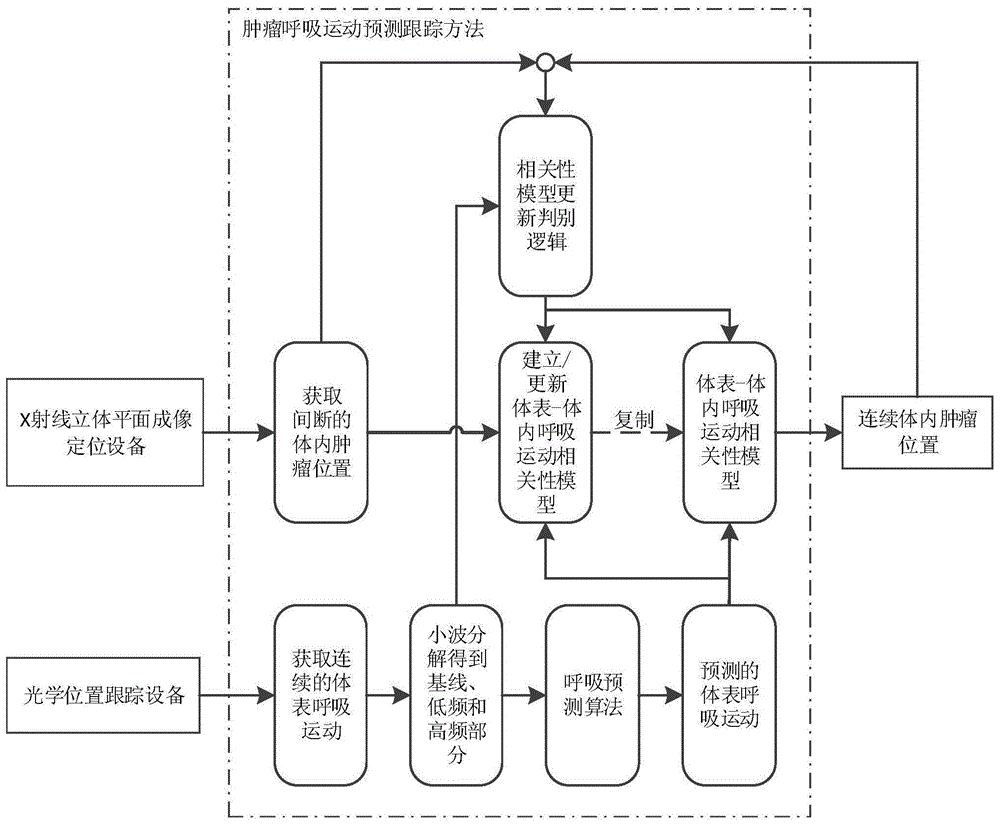
步骤1,数据采集:采用光学位置跟踪设备,连续地获取体表呼吸运动;采用x射线立体平面成像定位设备,间断地获取体内肿瘤位置;
步骤2,数据预处理:对体表呼吸运动进行小波分解,得到基线、代表主要呼吸信号的低频部分、以及代表噪声的高频部分;
进行小波分解的具体步骤为:
步骤2.1,利用小波函数进行分解和重构的mallat算法,选取小波基,确定分解层数;同时,为了消除边界效应,在利用小波分解得到基线部分时,边界延拓采用0阶平滑延拓;在利用小波分解得到低频部分和高频部分时,边界延拓采用1阶平滑延拓;
步骤2.2,先对体表呼吸运动的原始信号进行第一次多层分解,将低频分量作为基线部分;
步骤2.3,然后将原信号去除基线的其余部分,再进行一次小波分解,分解得到的低频分量作为低频部分,高频分量作为高频部分。
步骤3,通过呼吸预测算法得到体表呼吸运动的预测结果;经过小波分解后,基线部分较平滑,采用线性算法(lf)进行预测;低频部分是呼吸信号去除基线后的呼吸振幅部分,采用改进的自适应神经模糊推理系统(anfis)进行预测;高频部分主要是噪声,采用简单移动平均法进行预测;最后综合三部分预测值作为体表呼吸运动的预测结果;
具体地,采用改进的自适应神经模糊推理系统(anfis)进行预测,步骤如下:
步骤3.1,进行低频信号预测的自适应神经模糊推理系统anfis采用一种新的预测模型结构,不仅仅采用呼吸运动的位置作为输入参数,而且通过位置信息得到速度(通过邻近的位置信息求得),将呼吸运动的位置和速度作为预测模型的输入参数;
步骤3.2,呼吸运动的位置和速度可以作为预测模型构造中模糊划分的特征,预测模型将位置按大小分成小、中、大三个模糊集;同时又按速度大小分为负的大速度、小速度、正的大速度三个模糊集;从而构造一个结合位置和速度的3×3模糊集;
步骤3.3,依据预测模型输入输出参数构造训练集,应用训练集训练预测模型;采用混合学习算法训练anfis的参数,在每一次迭代中,输入信号首先沿网络正向传递到倒数第二层,此时固定前提参数,利用最小二乘调整结论参数,然后信号继续沿网络正向传递,将获得的误差信号沿网络反向传播,利用梯度下降法调节前提参数;
步骤3.4,进行预测时,将最新位置和速度数据输入已训练好的预测模型,得到输入数据对应时间τs个采样点以后的位置预测值;
步骤3.5,在应用anfis已训练好的预测模型进行预测时,若当前时刻的呼吸位置或速度超出历史数据位置的幅度范围,首先执行幅度调整,将位置或速度调整到历史数据的幅度范围内,得到幅度调整后的位置或速度;然后将经过幅度调整后的最新输入信号输入已训练好的预测模型,得到输出值;再进行幅度反调整,得到呼吸运动的位置预测值。呼吸信号的位置和速度并不一定同时超出历史数据范围,该anfis模型根据信号的不规则情况具体选择需要调整的内容。
步骤4:以获取的体内肿瘤位置和对应时间点的体表呼吸运动作为输入,采用线性和非线性混合多项式模型,建立体表-体内呼吸运动相关性模型;并优化该相关性模型;具体地,
步骤4.1,先采用线性多项式模型,以最小二乘法拟合出多项式最优参数;
步骤4.2,统计相关性模型输出的肿瘤位置与原始体内肿瘤位置之间的偏差;
步骤4.3,若该偏差在阈值内则采用此线性多项式模型;
步骤4.4,否则,更换二阶非线性多项式模型,通过梯度下降法迭代优化获得多项式最优参数。
步骤5:复制体表-体内呼吸运动相关性模型,以预测的连续的体表呼吸运动作为输入,计算连续的体内肿瘤位置;
步骤6:进入相关性模型更新判别逻辑,以小波分解后的体表呼吸运动和相关性模型输出与原始体内肿瘤位置之间的偏差作为输入;进行逻辑判别,并根据判别结果,决定沿用原相关性模型,或者继续获取体内肿瘤位置,更新相关性模型。
具体地,采用的相关性模型更新判别逻辑描述如下:
步骤6.1,通过小波分解后的体表呼吸运动,根据低频部分统计呼吸运动的周期、振幅变化情况,结合呼吸基线变化情况,评估体表呼吸模型变化情况;
步骤6.2,若有一定时间内获取的原始体内肿瘤位置,则计算相关性模型输出与原始体内肿瘤位置之间的偏差;
步骤6.3,进行更新逻辑判别,条件为上述体表呼吸模型变化情况和位置偏差,若满足模型更新条件,则获取体内肿瘤位置,更新相关性模型;否则继续使用原相关性模型。
本发明的优点在于:
(1)通过小波分解将呼吸信号的基线、低频和高频分离出来,用于模型更新和信号预测。
(2)评估呼吸运动的基线、振幅和周期变化情况,结合相关性模型输出与实际肿瘤位置之间的偏差,建立一种合理的运动相关性模型更新逻辑。
(3)采用此相关性模型更新逻辑,及时发现并应对患者呼吸模型的变化,及时曝光采图获取体内肿瘤实际位置,验证并更新运动相关性模型,提高体内肿瘤跟踪精度。
(4)采用此相关性模型更新逻辑,根据呼吸模型变化情况,不断调整更新相关性模型,减少相关性模型输出与实际肿瘤位置之间的偏差过大的情况,可降低重建相关性模型的概率。
(5)采用此相关性模型更新逻辑,且对于平稳呼吸过程,可进一步减少验证采图次数,降低患者所受剂量。
(3)从呼吸信号中提取出相对规则的低频信号成分采用anfis进行预测,减小了基线漂移对预测精度的影响,使预测结果更加准确。
(4)在呼吸运动位置的基础上,引入速度作为anfis模型结构的输入参数,构造一个结合位置和速度的3×3模糊集,能有效捕获呼吸运动的变化,提升模型对非规则呼吸运动的预测能力。
(5)当信号发生不规则(甚至异常)变化时,对超出历史数据幅度范围的最新输入信号的位置或速度进行相应的幅度调整可提高预测准确度,从而使预测模型对非规则呼吸运动或者随机性异常呼吸的预测能力更强。
(6)将呼吸信号高频部分分离出来通过简单移动平均进行预测,相当于对呼吸信号滤波去噪,减小了噪声对呼吸预测的影响,使预测的呼吸曲线更加平滑。降低高频成分引起放疗呼吸运动补偿中导致机器颤动的概率。
(7)采用小波分解和改进型自适应神经模糊推理相结合的呼吸预测算法,提升呼吸预测进度,对规则和不规则呼吸都有很强的鲁棒性;当呼吸特征改变时能迅速调整适应为新的呼吸模式,并且能够合理处理患者打喷嚏、咳嗽、讲话等干扰信号。
附图说明
图1为本发明的呼吸运动预测跟踪方法的流程图。
图2为本发明的基于小波分解和改进anfis的呼吸预测算法的概要流程图。
图3为本发明的采用的小波分解呼吸信号示例图。
图4为本发明提出的以位置和速度作为输入参数的anfis预测模型结构图。
图5为本发明的改进anfis预测模型中位置和速度的3x3模糊集合示意图。
图6为本发明的呼吸预测幅度调整流程图。
图7为本发明的幅度调整示意图。
图8为本发明的相关性模型更新判别逻辑流程图。
具体实施方式
下面结合具体附图和实施例对本发明作进一步说明。
如图1所示,本发明提出的一种患者胸腹部肿瘤呼吸运动预测跟踪方法,包括以下步骤:
步骤1,数据采集:采用光学位置跟踪设备,连续地获取体表呼吸运动;采用x射线立体平面成像定位设备,间断地获取体内肿瘤位置;
步骤2,数据预处理:对体表呼吸运动进行小波分解,得到基线、代表主要呼吸信号的低频部分、以及代表噪声的高频部分;
利用小波函数进行分解和重构的主流方法mallat算法,小波基选取5阶daubechies小波,首先将体表呼吸运动的原信号分解到第8层,其低频分量作为基线部分;然后将原信号去除基线的其余部分,再进行一次小波分解,分解得到的低频分量作为低频部分,高频分量作为高频部分;如图3所示,对图中左侧的原信号进行小波分解,得到右侧的基线、低频和高频信号;其中,基线部分反映了呼吸运动振荡位置的变化;高频部分为噪声;低频部分为去除噪声、去除基线变化的主要呼吸过程。
步骤3,如图2所示,通过呼吸预测算法得到体表呼吸运动的预测结果;经过小波分解后,基线部分较平滑,采用线性算法(lf)进行预测;低频部分是呼吸信号去除基线后的呼吸振幅部分,采用改进的自适应神经模糊推理系统(anfis)进行预测;高频部分主要是噪声,采用简单移动平均法进行预测;最后综合三部分预测值作为体表呼吸运动的预测结果;
具体地,进行低频信号预测的自适应神经模糊推理系统anfis采用一种新的模型结构,如图4所示,描述如下:
anfis有2个输入
规则1:if
规则2:if
……
规则9:if
其中,fr是规则r对应的函数,{pr,qr,zr}为结论参数(r=1,2,…,9);
anfis预测模型结构中每一层的结点具有相同的函数,设第1层的第1个结点的输出为o11;
第1层:有6个结点,将输入变量
{a,b,c}是隶属函数参数,称为前提参数,这些参数值改变,隶属函数也随之改变;
第2层:这一层每个结点的输出是所有输入变量在不同模糊集中隶属度的代数积,例如该层第1个结点的输出为:
第3层:将各条规则的权重归一化:
第4层:这一层每个结点的输出为每条规则的输出,是每条规则函数值与对应归一化权重的乘积:
第5层:计算所有规则的总输出:
依据预测模型输入输出参数构造训练集:
上述矩阵共k+1行(k=n-3τs-1),第一列和第二列分别为预测模型的位置输入数据和速度输入数据,第三列为预测模型的输出数据,即输入数据对应时间τs个采样点之后的呼吸位置;应用训练集训练预测模型,采用梯度下降法调节隶属函数参数,采用最小二乘法调节规则函数参数;进行预测时,将最新数据
采用混合学习算法训练anfis的参数,在每一次迭代中,输入信号首先沿网络正向传递到第4层,此时固定前提参数,利用最小二乘调整结论参数,然后信号继续沿网络正向传递,将获得的误差信号沿网络反向传播,利用梯度下降法调节前提参数;
具体地,下面以图6、图7所示的位置幅度调整过程为例进行,说明在应用anfis已训练好的预测模型进行预测时,当前时刻的呼吸位置或速度超出历史数据位置的幅度调整过程;
在应用已训练好的预测模型进行预测时,若当前时刻的呼吸位置超出历史数据位置的幅度范围
其中,
然后将经过幅度调整后的最新输入信号
最后进行图7中所示的幅度反调整,得到呼吸运动的位置预测值:
呼吸信号的位置和速度并不一定同时超出历史数据范围,该anfis模型根据信号的不规则情况具体选择需要调整的内容,上述例子仅调整了位置幅度;
步骤4:以获取的体内肿瘤位置和对应时间点的体表呼吸运动作为输入,采用线性和非线性混合多项式模型,建立体表-体内呼吸运动相关性模型;并优化该相关性模型;
具体地,采用的线性和非线性混合多项式模型描述如下:
步骤4.1,先采用线性一阶多项式模型pt=aps+b,ps为体表呼吸运动,pt为体内肿瘤位置,a、b为多项式参数;以最小二乘法拟合出多项式最优参数a和b。考虑到每个位置均为3维坐标(x,y,z),采用主成分分析pca方法对输入数据进行降维处理,将高维特征空间转化成低维特征空间,以减少“维数灾难”;
步骤4.2,统计相关性模型输出与原始体内肿瘤位置之间的偏差;采用偏差的平均值(mean)和标准偏差(stdev),评价相关性模型是否符合需求,其中标准偏差是评价线性/非线性的主要指标;
步骤4.3,若标准偏差在阈值内,则采用此线性多项式模型;
步骤4.4,否则,更换二阶非线性多项式模型pt=aps2+bps+c,ps为体表呼吸运动,pt为体内肿瘤位置,a、b、c为多项式参数,通过梯度下降法迭代优化获得多项式最优参数a、b和c。
步骤5:复制体表-体内呼吸运动相关性模型,以预测的连续的体表呼吸运动作为输入,计算连续的体内肿瘤位置。
步骤6:进入相关性模型更新判别逻辑,以小波分解后的体表呼吸运动和相关性模型输出与原始体内肿瘤位置之间的偏差作为输入;进行逻辑判别,并根据判别结果,决定沿用原相关性模型,或者继续获取体内肿瘤位置,更新相关性模型。
具体地,如图8所示,采用的相关性模型更新判别逻辑描述如下:
步骤6.1,通过小波分解后的体表呼吸运动,根据低频部分统计n个历史呼吸运动的周期{ts1、ts2…tsn}、振幅{as1、as2…asn},评估其变化情况ct&a是否超过阈值;结合呼吸基线变化情况cbase,评估体表呼吸模型变化情况cs=ct&a+cbase。
步骤6.2,若有一定时间t内获取的原始体内肿瘤位置,则获取相关性模型输出与原始体内肿瘤位置之间的偏差δp=|pt-pm|,pt为原始体内肿瘤位置,pm为相关性模型输出的体内肿瘤位置。评估该偏差所反映的相关性模型是否需要更新,为cm。
步骤6.3,判别相关性模型更新标识c=cs+cm。
步骤6.4,满足相关性模型更新条件,则在短时间内获取体内肿瘤位置,更新相关性模型;否则继续使用原相关性模型。
最后所应说明的是,以上具体实施方式仅用以说明本发明的技术方案而非限制,尽管参照实例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!