基于多层时延神经网络去噪的可穿戴PPG实时监测系统的制作方法
本实用新型属于医疗设备技术领域,具体涉及一种基于多层时延神经网络去噪的可穿戴PPG实时监测系统。
背景技术:
近年来,基于光电容积描记法(Photoplethysmography,PPG)的透射式和反射式脉搏血氧设备因其便携、廉价、准确而在健康、医疗产业中得到了极大的推广和发展,被广泛应用于生命体征监测、可穿戴设备等领域。
PPG信号的检测,通常是将一种或多种不同波长的光线由体表射入皮下血管网络,记录透射或反射出的光线强度来实现的。由于血液中氧合血红蛋白与未氧合血红蛋白对不同波长的光线吸收程度存在差异,PPG信号的稳态和波动部分可用于提取脉搏与血氧饱和度信息。
但也正是因为PPG信号检测的传感器紧贴皮肤,该信号极易受运动影响而混杂入运动伪迹。一方面,这些伪迹来源于体态变化而导致的局部血管网络灌注情况的变化;另一方面,由于运动而造成的PPG传感器与皮肤表面接触面的变化也是运动伪迹产生的重要原因。在诸如运动手环实时心率监测等某些应用场景下,运动伪迹对于测量准确性的影响不容小觑。
近十几年来,随着脉搏血氧监测设备的日益普及和嵌入式系统的迅猛发展,PPG信号运动伪迹的去除已成为国内外研究者的一个热点话题,许多线性和非线性方法被陆续提出。
由于运动伪迹的频率成分分布在0-15Hz的全通带范围内,与PPG信号在频谱上存在混叠,传统通带滤波器的方法无法解决该问题,基于固定步长和可变步长的LMS自适应FIR滤波器被首先提出并取得了一定的降噪效果[1–11]。对于这种方法,最大的挑战在于找到与PPG信号或运动伪迹强相关的参考信号作为滤波器抽头系数训练的输入。参考信号的来源多种多样,例如与PPG传感器位于同一位置的光电三极管输出[2, 5]、MEMS三轴加速度计[1–3, 6, 8]、基于ICA或SSA等方法从含噪PPG信号自身中提取的参考信号[10, 11]。但无论哪种方法,都面临着诸如参考信号相关性强弱、参考信号与含噪PPG信号间时延、滤波器抽头数与采样率间权衡等问题和挑战,在实际应用中效果有限。
除此之外,基于经典小波变换[12, 13]、双树复小波变换[14, 15]的方法也被提出并被证明适用于某些某些运动情形,但基于此的方法对于使用不同设备、针对不同实验对象而采集的多种PPG波形可能需要更改不同的阈值选择策略,不利于在智能设备间推广。
近年来,也有研究者提出基于时域或频域ICA[10, 16–18]、SSA[19, 20]、逐周期傅里叶级数[21]、经验模式分解[22]、卡尔曼滤波[23]、Wigner-Ville分布[24]等手段的去伪迹方法,但这些方法要么很难实际应用[21]、要么也只在特定的实验条件下被证明较为有效。实际上,目前针对这一问题仍缺乏普适的鲁棒的解决方案。
参考文献:
[1]P. T. Gibbs, L. Wood, and H. Asada, Active motion artifact cancellation for wearable health monitoring sensors using collocated MEMS accelerometers, vol. 5765. 2005.
[2]M. R. Ram, K. V. Madhav, E. H. Krishna, N. R. Komalla, and K. A. Reddy, “A Novel Approach for Motion Artifact Reduction in PPG Signals Based on AS-LMS Adaptive Filter,” IEEE Trans. Instrum. Meas., vol. 61, no. 5, pp. 1445–1457, May 2012.
[3]H. H. Asada, H.-H. Jiang, and P. Gibbs, “Active noise cancellation using MEMS accelerometers for motion-tolerant wearable bio-sensors,” in The 26th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, 2004, vol. 1, pp. 2157–2160.
[4]K. W. Chan and Y. T. Zhang, “Adaptive reduction of motion artifact from photoplethysmographic recordings using a variable step-size LMS filter,” in Proceedings of IEEE Sensors, 2002, vol. 2, pp. 1343–1346 vol.2.
[5]T. Shimazaki, S. Hara, H. Okuhata, H. Nakamura, and T. Kawabata, “Cancellation of motion artifact induced by exercise for PPG-based heart rate sensing,” in 2014 36th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, 2014, pp. 3216–3219.
[6]H. Han, M. J. Kim, and J. Kim, “Development of real-time motion artifact reduction algorithm for a wearable photoplethysmography,” in 2007 29th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, 2007, pp. 1538–1541.
[7]B. Lee, J. Han, H. J. Baek, J. H. Shin, K. S. Park, and W. J. Yi, “Improved elimination of motion artifacts from a photoplethysmographic signal using a Kalman smoother with simultaneous accelerometry,” Physiol. Meas., vol. 31, no. 12, p. 1585, 2010.
[8]L. B. Wood and H. H. Asada, “Low Variance Adaptive Filter for Cancelling Motion Artifact in Wearable Photoplethysmogram Sensor Signals,” in 2007 29th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, 2007, pp. 652–655.
[9]L. B. Wood, “Motion artifact reduction for wearable photoplethysmogram sensors using micro accelerometers and laguerre series adaptive filters,” Thesis, Massachusetts Institute of Technology, 2008.
[10] F. Peng, Z. Zhang, X. Gou, H. Liu, and W. Wang, “Motion artifact removal from photoplethysmographic signals by combining temporally constrained independent component analysis and adaptive filter,” Biomed. Eng. OnLine, vol. 13, p. 50, Apr. 2014.
[11] R. W. C. G. R. Wijshoff, M. Mischi, and R. M. Aarts, “Reduction of Periodic Motion Artifacts in Photoplethysmography,” IEEE Trans. Biomed. Eng., vol. 64, no. 1, pp. 196–207, Jan. 2017.
[12] M. Raghuram, K. V. Madhav, E. H. Krishna, and K. A. Reddy, “Evaluation of wavelets for reduction of motion artifacts in photoplethysmographic signals,” in 10th International Conference on Information Science, Signal Processing and their Applications (ISSPA 2010), 2010, pp. 460–463.
[13] C. M. Lee and Y. T. Zhang, “Reduction of motion artifacts from photoplethysmographic recordings using a wavelet denoising approach,” in IEEE EMBS Asian-Pacific Conference on Biomedical Engineering, 2003., 2003, pp. 194–195.
[14] M. Raghuram, K. V. Madhav, E. H. Krishna, N. R. Komalla, K. Sivani, and K. A. Reddy, “Dual-tree complex wavelet transform for motion artifact reduction of PPG signals,” in 2012 IEEE International Symposium on Medical Measurements and Applications Proceedings, 2012, pp. 1–4.
[15] M. R. Ram, K. V. Madhav, E. H. Krishna, N. R. Komalla, K. Sivani, and K. A. Reddy, “ICA-Based Improved DTCWT Technique for MA Reduction in PPG Signals With Restored Respiratory Information,” IEEE Trans. Instrum. Meas., vol. 62, no. 10, pp. 2639–2651, Oct. 2013.
[16] B. S. Kim and S. K. Yoo, “Motion artifact reduction in photoplethysmography using independent component analysis,” IEEE Trans. Biomed. Eng., vol. 53, no. 3, pp. 566–568, Mar. 2006.
[17] R. Krishnan, B. Natarajan, and S. Warren, “Motion Artifact Reduction in Photopleythysmography Using Magnitude-Based Frequency Domain Independent Component Analysis,” in 2008 Proceedings of 17th International Conference on Computer Communications and Networks, 2008, pp. 1–5.
[18] R. Krishnan, B. Natarajan, and S. Warren, “Two-Stage Approach for Detection and Reduction of Motion Artifacts in Photoplethysmographic Data,” IEEE Trans. Biomed. Eng., vol. 57, no. 8, pp. 1867–1876, Aug. 2010.
[19] S. M. A. Salehizadeh et al., “Photoplethysmograph Signal Reconstruction based on a Novel Motion Artifact Detection-Reduction Approach. Part II: Motion and Noise Artifact Removal,” Ann. Biomed. Eng., vol. 42, no. 11, pp. 2251–2263, Nov. 2014.
[20] Z. Zhang, Z. Pi, and B. Liu, “TROIKA: A General Framework for Heart Rate Monitoring Using Wrist-Type Photoplethysmographic Signals During Intensive Physical Exercise,” IEEE Trans. Biomed. Eng., vol. 62, no. 2, pp. 522–531, Feb. 2015.
[21] K. A. Reddy, B. George, and V. J. Kumar, “Use of Fourier Series Analysis for Motion Artifact Reduction and Data Compression of Photoplethysmographic Signals,” IEEE Trans. Instrum. Meas., vol. 58, no. 5, pp. 1706–1711, May 2009.
[22] Q. Wang, P. Yang, and Y. Zhang, “Artifact reduction based on Empirical Mode Decomposition (EMD) in photoplethysmography for pulse rate detection,” in 2010 Annual International Conference of the IEEE Engineering in Medicine and Biology, 2010, pp. 959–962.
[23]“Kalman Filter Based Adaptive Reduction of Motion Artifact from Photoplethysmographic Signal.” .
[24] Y. Yan, C. C. Poon, and Y. Zhang, “Reduction of motion artifact in pulse oximetry by smoothed pseudo Wigner-Ville distribution,” J. NeuroEngineering Rehabil., vol. 2, p. 3, Mar. 2005。
技术实现要素:
针对现有技术的不足,本实用新型的目的在于提供一种基于多层时延神经网络去噪的可穿戴PPG实时监测系统。本实用新型的系统结构简单,其呈可穿戴式,可实现剧烈运动下的PPG实时监测,其运动伪迹去除效果更为精准。
本实用新型的技术方案具体介绍如下。
本实用新型提供一种基于多层时延神经网络去噪的可穿戴PPG实时监测系统,其包括PPG探头、传输控制主板和PC上位机;其中:PPG探头和传输控制主板形成可穿戴式结构;PPG探头包括PPG传感器、IMU传感器和支持电路,印刷线路板PCB的正面固定PPG传感器以及为其供电的低压差线性稳压器LDO,背面安装IMU传感器以及FPC线连接器;PPG传感器和IMU传感器挂载在I2C总线上;PPG传感器和IMU传感器的中断提示线被分别接至一个有外部中断功能的通用目的输入/输出端口GPIO;传输控制主板通过FPC线与PPG探头相连接,传输控制主板和PC上位机相连;传输控制主板包括主控板和无线数据传输模块。
本实用新型中,PPG探头被包裹在食品级硅胶内,其通过印刷线路板PCB上设置的四个非金属化定位孔利用多股棉线固定在一个弹性织物指环上;弹性织物指环背侧设置魔术贴,玻璃开窗与四周硅胶面平齐,传输控制主板被放置在半指手套手背位置的口袋内,FPC线束通过若干线环固定在手套食指外侧部位,电池使用魔术贴贴于手背侧传输控制主板的上方。
本实用新型中,PPG传感器为双波长PPG传感器;IMU传感器为九轴运动传感器。
本实用新型中,无线数据传输模块包括蓝牙子模块、USB子模块或WiFi子模块中任一种或几种。
和现有技术相比,本实用新型的有益效果在于:
1、本实用新型可用于剧烈运动下的PPG实时监测。
2、可穿戴嵌入式PPG测量处理系统可以很容易地被固定于肢体相关位置,在不影响使用者舒适度和运动的情况下实时监测PPG生理参数。
附图说明
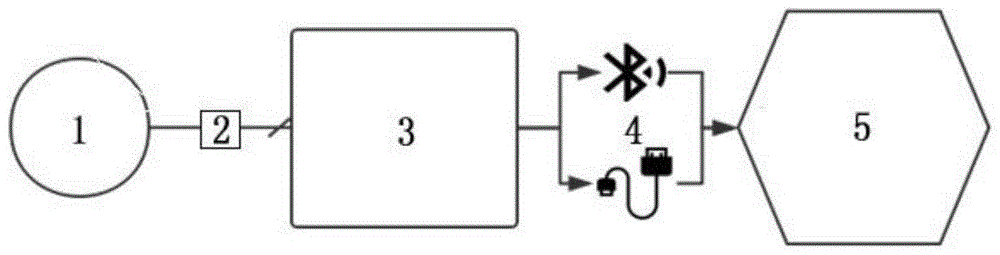
图1为系统框架简图。
图2为进程、中断程序间数据流向图。
图3为嵌入式软件流程图。
图4为上位机软件框架,图中方框为进程,圆形框为按键。
图中标号:1-PPG探头,2-FPC线,3-主控板,4-无线数据传输模块,5-PC上位机。
具体实施方式
下面结合附图和实施例,对本实用新型的技术方案进行具体、详细的描述。所描述的实施例仅是本实用新型的一种实施例,而不是全部实施例,基于本实用新型实施例,本领域普通技术人员没有创造性劳动的前提下所得到的其他实施例,均属于本实用新型保护的范围。
实施例1
一、系统框架
作为本实用新型的一个实施例,设计了一套包含可穿戴嵌入式系统和上位机终端的完整的电子系统,它的主体构架如图1所示。
PPG探头1被设计为一个体积很小的PCB,其上整合了高度集成化的双波长PPG传感器和一个九轴惯性测量单元(IMU)。通过FPC线2(柔性印刷电路连接线)和运行其上的I2C总线协议,PPG和运动数据被传至主控板3。
主控板3负责接收PPG和运动采样数据,对其进行必要的处理(例如去噪),并提取感兴趣的生理参数(心率、血氧饱和度等),将这些采样原始数据和生理参数通过无线数据传输模块4,即蓝牙4.0低功耗无线传输和USB 2.0高速有线传输的形式上传至PC上位机5。
PC上位机5运行上位机GUI程序,实时地显示其收到的数据,并提供同步存储功能以备后用。同时,上位机程序还具备全自动实验引导功能,被试可以通过程序的图文引导按预定实验序列进行自助实验,实验数据将被同步标记。
二、硬件设计与实现
研究平台的嵌入式系统硬件部分的设计与实现,主要包括PPG探头1、传输控制主板和可穿戴集成三部分。
2.1 PPG探头1
PPG探头1是一块体积很小的PCB,它由PPG传感器IC、IMU传感器和支持电路组成。本实施例中所选用的PPG传感器就是其中的一种。Maxim Integrated生产MAX30102被用于PPG信号的监测,这是一种高灵敏度的脉搏血氧IC解决方案,集成了两个片上LED和一个片上光电三极管,LED波长分别为660nm和880nm,光电三极管动态敏感范围600-900nm。LED和光电三极管通过一块玻璃开窗与外界接触,可以直接被紧贴于皮肤表面。此外,IC内部集成LED驱动和18bit高精度ADC,配有自动环境光消除电路和数字降噪模块。IC内部有48个读写寄存器,通过快速I2C总线与外部通讯。
IMU传感器采用InvenSense制造的MPU9250九轴运动传感器, 本研究平台的探头中使用了三轴加速度计和三轴陀螺仪作为运动参考信号。与MAX30102类似,MPU9250也可以使用快速I2C总线与外部通讯,通过读写其内部的寄存器,可以设置参数、发布指令、读取数据。
电路的设计中,MAX30102由于需要1.8V逻辑供电,配套了一个性能极为稳定的LP5907-1.8射频电路LDO。此外,MAX30102中引出一个低电平使能的中断信号,用于指示外部处理器PPG信号转换的完成。
MPU9250除了配有相应的退耦电容和RC滤波电容外,将AD0引脚接地以选择I2C总线地址为0X68。与MAX30102类似,这款传感器也有一个中断使能脚,同样被接出。
MAX30102和MPU9250均被挂载在400kHz的I2C总线上,总线的SCL和SDA通过10kΩ电阻被上拉至3.3V(MAX30102引脚耐受)。
PCB 布局布线(Layout)采用四层板工艺,最小线宽6mil,最小过孔直径0.3mm。PCB正面放置MAX30102和为其供电的LDO,此面与皮肤接触。PCB背面放置MPU9250和0.5mm间距FPC线5pin连接器,用于连接FPC线。
PCB四角经过钝化处理去除锋利棱角,并放置四个非金属化孔洞用于PPG探头的固定。整个版面结构紧凑,阻容元件多数选用0402封装,尺寸为14.9*9.8mm,大小只有成年人食指指腹的一半。
2.2传输控制主板
传输控制主板通过FPC线2与PPG探头1相连接,通过I2C总线配置PPG和IMU传感器,并根据中断线的提示定时读取数据。读取的原始数据将被进行一系列的处理,包括噪声去除和生理参数的提取。在这之后,所有这些数据通过蓝牙无线和USB 2.0的方式上传至PC上位机5。传输控制主板包括主控板3和无线数据传输模块4。 主控板3中包括多层时延网络的运动伪迹去除模块,多层时延网络的运动伪迹去除模块的PC上位机5通过界面引导使用者进行手指弯曲和沿手指指向运动以模拟运动伪迹发生时的数据,采集存储这些数据并使用其训练用于去除运动伪迹的多层时延神经网络。
主控板3采用的是STmicroelectronics出品的STM32L452CE。无线数据传输模块4中的蓝牙子模块采用Feasycom BT-822蓝牙4.0双模模组,该模块通过异步串口(UART)与处理器通讯,通过AT指令设置完成后可进行UART透传。
主控板3的电路中,电源通过POWER端口接入3.7V锂电池,通过LP5907-3.3产生3.3V的稳定电压供各部分使用。STM32调试相关总线通过SWD端口引出,用于程序下载和SWD在线调试。USB总线被引出至USB Micro端口,D+总线被上拉以便Host识别设备。STM32串口通过0Ω电阻与BT-822模块的UART连接,并放置BT-DEBUG端口用于通过AT指令设置蓝牙子模块。STM32的硬件I2C被接至FPC连接器端口以读写总线,MAX30102和MPU9250的中断提示线被分别接至一个有外部中断功能的通用目的输入/输出端口GPIO。
2.3 可穿戴集成
实施例中,采用食品级硅胶包裹整个探头,再通过精密切割技术将玻璃开窗所在面削平,使得玻璃开窗与四周硅胶面平齐。这样,当手指与探头接触时,既能使皮肤紧密贴合玻璃开窗,又通过柔软安全的食品级硅胶提供隔离保护防止电路板其他部分与皮肤接触。
接着,被硅胶包裹的探头通过预留的四个非金属化定位孔利用多股棉线固定在一个弹性织物指环上。弹性织物指环背侧有一定长度的魔术贴,使用者可以自行调节指环贴合后的直径从而达到紧贴而不紧勒的固定效果。
主控板3被放置在半指手套手背位置的订制口袋内,重要的接口被引出以便使用和调试。主控板3通过FPC线2与PPG探头1相连,FPC线束通过若干线环固定在手套食指外侧部位。电池使用魔术贴贴于手背侧主板上方以方便拆卸。
整个可穿戴手套集成使用方便,固定可靠,佩戴舒适,可以满足剧烈运动下长时间使用的要求。
本实用新型中,系统的工作流程如下:
每名使用者初次使用时,需要先进行运动伪迹模拟实验以确定针对其的个性化网络的具体参数。模拟实验进行时,使用者双侧上肢相同位置佩戴可穿戴嵌入式PPG测量处理装置(即PPG探头1和传输控制主板部分),根据上位机软件提示进行特定模式的运动,对应的运动数据被上传至PC上位机5存储,并用于训练一个多层时延神经网络用以去除运动伪迹。训练完成后,该网络相关参数被下载至可穿戴嵌入式PPG测量处理装置(即PPG探头1和传输控制主板部分),在那里被存储并实时运行,以实现PPG在线运动伪迹去除。
以上的实施例是一种对于本实用新型的实现方法的描述,用于帮助理解本实用新型的整体工作方法和权利要求的要点,不应理解为是对于本实用新型的限制。
- 还没有人留言评论。精彩留言会获得点赞!