对治疗目标在放射疗法中的可实现性的评估的制作方法
本发明主要涉及对患者的外部束放射疗法治疗进行计划。更具体地,本发明涉及用于帮助对用于患者的放射疗法治疗进行计划的系统、方法和计算机程序。
背景技术:
在外部束放射疗法中,向患者体内的靶结构(例如肿瘤)施加电离辐射,以控制癌细胞的生长或杀死癌细胞。在超前型外部束放射疗法中,例如在调强放射疗法(imrt)中,将限定的预定剂量的辐射施加于患者身体的多个区域。在这方面,通常,目标是向靶结构提供足够高的辐射剂量并且尽可能远地避开(spare)靶结构附近的敏感结构(通常也称为危及器官)。
用于递送辐射和控制放射治疗装置的治疗参数在治疗计划中予以限定,该治疗计划在计划系统中生成。特别地,可以借助于该计划系统来执行所谓的逆向计划过程。在这种过程中,识别靶结构和待避开的周围结构,并为这些结构指定治疗目标。这种治疗目标可对应于对于被递送到患者的某些区域的辐射剂量(例如待递送到相应区域的最大或最小剂量)的要求。然后,执行优化过程以找到实现这些指定治疗目标的治疗计划。
根据用于找到治疗计划的一种方法,在计划系统中执行操作者引导的迭代优化过程。在该过程中,治疗计划的优化在几个优化周期中进行,并且在每个优化周期之后,治疗计划者(通常是医生)可以检查在相应周期中计算出的治疗计划,以便检查他是否对由该治疗计划产生的剂量分布感到满意。如果不是这种情况,则计划者可修改治疗目标以便获得所期望的剂量分布,并且可基于下一优化周期中的修改后的治疗目标来执行对于治疗计划的计算。这对应于一种用于找到最佳治疗计划的“反复试验”方法。
使用这种方法,通常能够找到满足关于靶结构的治疗目标的治疗计划,这些治疗目标通常包括对于待递送到靶结构和/或其多个部分的最小剂量的要求。然而,向靶结构输送某一最小辐射剂量也导致向靶结构周围的危及器官输送某一最小量的辐射。因此,通常不可能找到一种治疗计划,该治疗计划也满足关于危及器官的所有治疗目标。因此,通常有必要在与靶结构相关的治疗目标与危及器官之间作出权衡。有时,最好的治疗计划甚至可能会错过危及器官的治疗目标,以致于达到在不存在严重健康风险的情况下不能对具体患者进行治疗的程度。
在这方面,前述迭代方法的缺点是治疗计划者仅在迭代优化过程结束时才能确定治疗目标的可实现性,该迭代优化过程是相对耗时的过程。
技术实现要素:
本发明的一个目的是允许对患者的放射疗法治疗的治疗目标(特别是与危险器官有关的治疗目标)的可实现性进行预测。
根据第一方面,本发明提出了一种用于帮助基于治疗目标对患者身体区域的放射疗法治疗进行计划的系统,这些治疗目标包括对于待递送到靶结构和被包括在身体区域中的至少一个危及结构的辐射剂量的要求。该系统包括评估单元,其被配置为:
-仅基于与靶结构相关的治疗目标生成放射疗法治疗的治疗计划,并获得与该治疗计划相对应的第一剂量分布,
-将身体区域分成围绕靶结构的多个同心壳层(shell)并根据第一剂量分布确定分配到每个壳层的平均辐射剂量,
-检查是否可确定另一剂量分布,其满足与至少一种危及结构有关的治疗目标并且被配置成使得根据该另一剂量分布分配到每个壳层的平均辐射剂量对应于根据第一剂量分布分配到同一壳层的平均辐射剂量,以及
-基于检查结果表明是否可实现与至少一个靶结构有关的治疗目标。
本发明基于以下发现:当在生成用于放射疗法治疗的治疗计划中减少分配到靶结构周围的危及器官的剂量时,标准化的整体壳层剂量在围绕靶结构的同心壳层上是恒定的。根据本发明,该发现被用于评估与至少一个危及结构有关的治疗目标是否是可实现的。因此,在执行用于确定放射疗法治疗的治疗计划的复杂优化程序之前,可以快速地且以相对低的计算复杂度确定与至少一个危及结构相关的治疗目标的可实现性。
在本发明的一个实施例中,该系统被配置成如果是否可以确定另一剂量分布的检查是肯定的,则表明与至少一个危及结构有关的治疗目标的该可实现性。在本发明的另一实施例中,评估单元被配置为通过执行解决用于确定另一剂量分布的优化问题的过程来执行所述检查,其中,如果过程的执行导致确定另一剂量分布,则所述检查是肯定的。另一方面,如果通过该过程无法找到优化问题的解决方案,则该检查并不是肯定的。
此外,评估单元优选地被配置为基于由多个体素组成的身体区域的三维图像来生成第一剂量分布。在该图像中,可以描绘靶结构和至少一个危及结构,使得可以识别属于靶结构和至少一个危及结构的体素。在确定第一剂量分布的过程中,评估单元可以基于与靶结构相关的治疗目标,特别地将剂量值分配到属于靶结构的体素。
在一个实施例中,评估单元被配置为检查是否可以确定另一剂量分布,使得它包括属于至少一个危及结构的体素的剂量值,这些剂量值并不超过基于与至少一个危及结构相关的治疗目标分配到这些体素的最大剂量值。通过将最大剂量值分配到这些体素,可以制定用于确定另一剂量分布的优化问题,其涉及相对低的复杂度。因此,是否可以确定该另一剂量分布的检查需要相对短的计算时间。
在本发明的一个实施例中,评估单元被配置为检查是否可以确定另一剂量分布,使得它包括不属于靶结构或至少一个危及结构的体素的剂量值,这些剂量值并不超过分配到这些体素的最大剂量值。该实施例考虑到这一事实,即,通常希望将递送到不属于靶结构或危及结构的患者区域的辐射剂量保持在某些值以下,以避免在这些区域中出现坏死。
在本发明的相关实施例中,分配到体素的最大剂量值被基于分配到体素的辐射剂量与根据第一剂量分布分配到靶结构的辐射剂量之间的预期差异来确定,该预期差异被基于预定剂量下降梯度加以确定。该预定剂量下降梯度可由系统的操作者指定。作为替代方案,预定剂量下降梯度可被预先存储在评估单元中。在这种情况下,预先存储的值可对应于剂量下降梯度,该剂量下降梯度通常可在被用于递送放射疗法治疗的放射疗法系统中实现。
在本发明的另一实施例中,评估单元被配置为通过实现解决用于基于第二剂量分布确定另一剂量分布的优化问题的过程来执行是否能够确定另一剂量分布的所述检查,其中,第二剂量分布为不属于靶结构的每个体素分配剂量值,该剂量值被基于该剂量下降梯度加以确定。
在该实施例中,评估单元可特别地尝试从第二分布开始确定另一剂量分布,以便执行所述检查。这样一来,评估单元可有效地尝试减少分配到属于至少一个危及结构的体素的剂量值,并且通过以使平均壳层剂量对应于第一剂量分布的平均壳层剂量的方式增加分配到不属于至少一个危及结构或靶结构的体素的剂量值来补偿该减少。在该过程中,分配到不属于至少一个危及结构或靶结构的体素的剂量值的增加还会受到预定阈值的限制。因此,可以实现这些剂量值并不超过基于剂量下降梯度确定的最大值。
在本发明的一个实施例中,评估单元被配置成确定第一剂量分布,使得分配到靶结构的辐射剂量至少近似对应于实现与靶结构相关的治疗目标所需的最小辐射剂量。以这种方式,通常还生成用于递送放射治疗的治疗计划,以便使递送到危及结构的辐射剂量最小化。
在本发明的另一实施例中,评估单元被配置成如果是否可确定满足治疗目标的另一剂量分布的检查不是肯定的,则确定属于至少一个危及结构的体素的最小剂量值,该最小剂量值允许确定一种剂量分布,使得根据另一剂量分布分配到每个壳层的平均辐射剂量对应于根据第一剂量分布分配到同一壳层的平均辐射剂量。基于最小剂量值,可以修改与至少一个危及结构相关的治疗目标,使得它们是可实现的。
在本发明的相关实施例中,最小剂量值还允许确定该剂量分布,使得它包括不属于靶结构或至少一个危及结构的体素的剂量值,该剂量值并不超过分配到这些体素的最大剂量值。这些最大剂量值可被再次基于分配到这些体素的辐射剂量与如上所述根据第一剂量分布分配到靶结构的辐射剂量之间的预期差异来确定。
根据另一方面,本发明提出了一种用于帮助基于治疗目标对患者身体区域的放射疗法治疗进行计划的方法,这些治疗目标包括对待递送到靶结构和被包括在身体区域中的至少一个危及结构的辐射剂量的要求。该方法包括:
-仅基于与靶结构相关的治疗目标生成用于放射疗法治疗的治疗计划,并获得对应于治疗计划的第一剂量分布,该治疗计划指定用于输送放射治疗的优化参数,
-将身体区域分割成围绕靶结构的多个同心壳层,并确定根据第一剂量分布分配到每个壳层的平均辐射剂量,
-检查是否可以确定另一剂量分布,其满足与至少一个危及结构有关的治疗目标并且被配置成使得根据另一剂量分布分配到每个壳层的平均壳层剂量对应于根据第一剂量分布分配到同一壳层的平均辐射剂量,以及
-基于检查结果表明是否可实现与至少一个靶结构有关的治疗目标。
根据另一方面,本发明提出了一种可在用于帮助对放射疗法治疗进行计划的系统的处理单元中执行的计算机程序,该计算机程序包括用于致使处理单元执行该方法的程序代码模块。
所明白的是,根据权利要求1所述的系统、根据权利要求14所述的方法和根据权利要求15所述的计算机程序具有类似和/或相同的优选实施例,特别是如在从属权利要求中所限定的实施例。
所明白的是,本发明的优选实施例也可以是从属权利要求或上述实施例与相应独立权利要求的任何组合。
参考下文描述的实施例,本发明的这些和其它方面将变得显而易见并得以阐明。
附图说明
在以下附图中:
图1示意性且示例性地示出了包括用于生成治疗计划的计划单元的放射治疗系统,
图2示意性且示例性地示出了用于检查与危及器官有关的治疗目标的可实现性的评估例程的步骤,和
图3示意性且示例性地示出了靶结构和围绕靶结构的剂量壳层。
具体实施方式
本发明涉及对患者体内的靶结构的外部束放射疗法治疗作出计划。该靶结构可以具体是肿瘤,并且可以进行该治疗以杀死肿瘤的癌细胞或控制其生长。为了控制治疗装置(例如辐射源),在输送该治疗的过程中使用治疗计划,该治疗计划明确指定了用于控制该治疗装置的相关参数,并且该计划过程的目的是生成用于具体治疗的治疗计划。
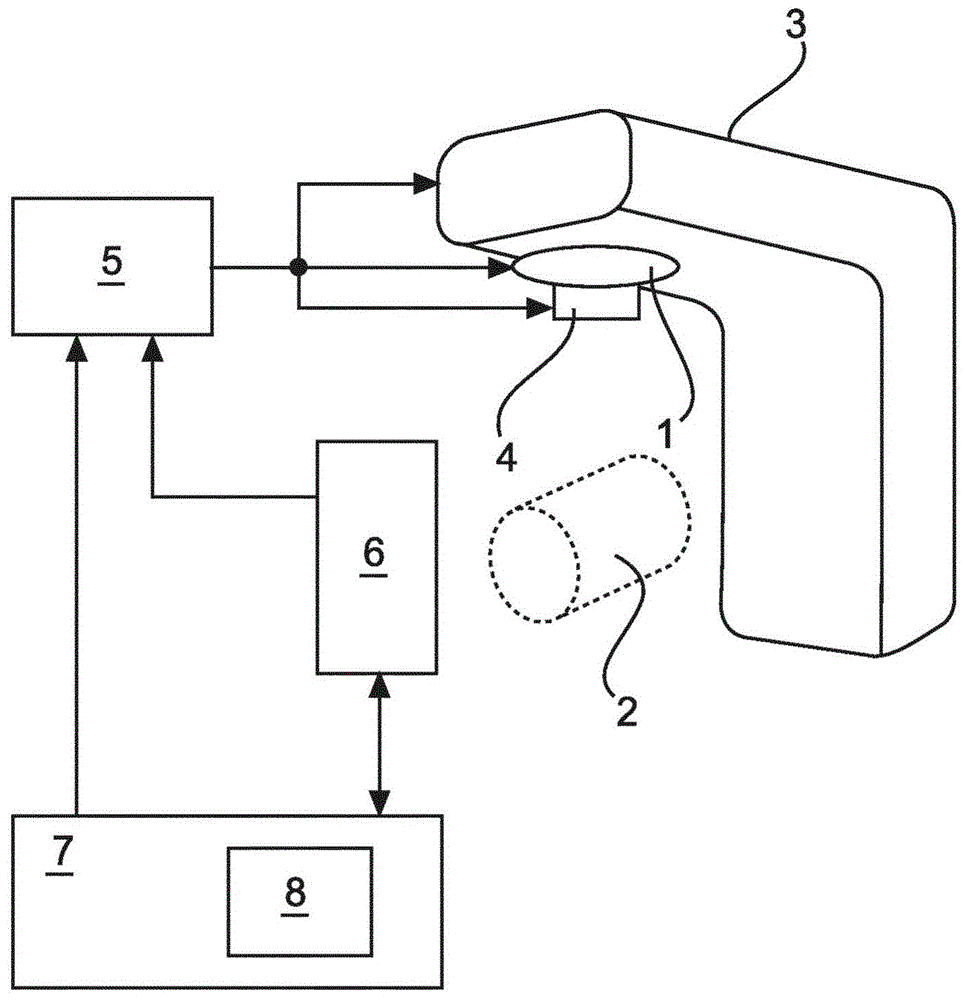
图1示意性且示例性地示出了用于递送外部束放射治疗的放射治疗系统的实施例。在该实施例中,该放射治疗系统包括辐射源1,该辐射源1可被操作以发射待被输送到位于治疗区域2中的患者身体的电离辐射。为了在治疗区域2内支撑患者身体,该系统可包括患者台。辐射源1相对于患者身体的相对位置和取向可在某一位置和取向的范围内变化。为此,辐射源1可被安装在可旋转的台架3上,使得辐射源1可在一定的角度范围内围绕治疗区域或身体旋转,该角度范围可以是360°或更小。另外,台架3和/或患者台可在平行于台架3的旋转轴线的方向上来回移动。此外,还可以使患者台围绕垂直于台架3的旋转轴线旋转。
辐射源1可包括x射线管或线性粒子加速器,用于产生至少一个电离辐射束。辐射源1是可控的,以便改变辐射束的强度和/或能量。此外,辐射源1可设置有准直器4,用于使辐射束成形。准直器4可以特别允许以限定的方式改变遍及该辐射束的辐射强度。为此,准直器4可被配置为多叶准直器。这种准直器可包括多个叶片,这些叶片可被独立地移入和移出粒子束的路径,以便使该射束成形。
在放射治疗的递送期间,辐射源1和/或准直器4的配置通常基于下文中所讨论的治疗计划而变化,使得辐射束被呈时变形状加以递送。在一个相关的实施方案中,根据连续的区段来传递该放射治疗,其中,每个区段对应于某个准直器配置或波束形状以及发射出的某一辐射剂量,其可在监视器单元(mu)中进行指定。在两个区段之间,准直器配置可被从第一区段的配置改变为第二区段的配置,并且在此期间,可以关闭该辐射束。该方法通常也被称为静态调强(step-and-shoot)方法。同样,例如,可在不中断该辐射束的情况下根据区段连续地改变准直器配置和/或发射出的剂量,就像在体积调制电弧疗法(vmat)中的情况一样。
为了在治疗期间控制辐射源1、准直器4和患者台(特别是为了控制辐射源1、准直器4和患者台的可修改参数),该系统包括控制单元5。在放射治疗期间,控制单元5通过定位台架3和/或患者台来控制辐射源1和身体的相对位置和取向。此外,控制单元5控制辐射束的强度和能量及辐射束形状。优选地,控制单元5被在处理器单元中实施,该处理器单元包括用于执行控制程序的微处理器,该控制程序包括由控制单元5执行的控制例程。
另外,放射治疗系统可包括或被联接到成像单元6,用于成像该患者身体的关注区域,该关注区域特别包括靶结构。成像单元6可以是能获取三维图像的并且可包括例如超声装置、计算机断层摄影(ct)装置或磁共振成像(mri)装置。使用成像单元6,可以预先和/或在放射治疗期间获取关注区域的身体区域的图像。基于这些图像,例如,可定位患者身体以用于进行治疗和/或该治疗可适应于靶结构和/或周围组织在治疗期间的变化。
可以在一个或多个分级(fraction)期间递送该放射治疗,其中,各个分级可被在连续的日子或在另一周期中进行递送。为了递送一个分级,将患者身体定位在放射治疗系统的相对于辐射源1处于限定位置的治疗区域2中。于是,控制单元5控制辐射向待治疗的结构的传递。这样一来,控制单元5对准辐射源1并根据存储在控制单元5中的治疗计划控制辐射源1和准直器4的其它参数,以用于特定患者的治疗。如上所述,治疗计划定义了用于放射治疗的照射参数。这些参数特别包括辐射源1与患者体内的靶区域的对准、待在治疗期间使用的准直器配置和辐射强度。
为了对放射治疗进行计划,放射治疗系统包括计划单元7。计划单元7可被配置为计算机装置(例如个人计算机),其执行用于生成治疗计划的计划软件,然后由控制单元5使用该计划软件来控制治疗分级的执行。优选地,在使用所关注的身体区域的计划图像来操作计划单元7的治疗计划者的控制下进行该计划过程,所关注的身体区域在下文中也被称为计划体积。可以使用被集成到放射治疗系统中的成像单元6或使用另一成像单元来获取计划图像。在该计划图像中,使用适用的描绘程序来描绘与放射治疗相关的结构。相关结构包括靶结构和围绕靶结构的敏感结构,这些敏感结构在本文中被称为危及器官(oar)。为了描绘靶结构和oar,可以使用本领域技术人员已知的任何适用的描绘过程,其包括自动描绘、半自动描绘或手动描绘,其中,操作者使用诸如计算机鼠标之类的适用的输入装置输入该靶结构的计数器。
治疗计划基于治疗目标来进行,这些治疗目标可以特别明确指定了待递送至靶结构的辐射剂量。该治疗目标可在患者的临床处方中加以明确指定,该临床处方被基于放射疗法治疗之前的临床诊断来准备。此外,治疗目标明确规定了对于向oar递送的辐射剂量的要求。这些治疗目标可同样被包括在患者的处方中,或者它们可以被在与该放射治疗有关的一般规则中进行指定。
治疗目标通常对应于硬或软约束,这些硬或软约束对应于对于待递送到患者身体的关注区域的某些区域的辐射剂量的要求。硬约束对应于必须满足的要求,软约束对应于应该被满足的要求。可能的约束特别包括最大剂量约束和最小剂量约束,其指定了待递送到计划体积的某些体素的最大或最小辐射剂量。另外,可能的是,指定某个区域接收均匀的辐射剂量(所谓的均匀剂量约束)或者某个区域接收指定的平均剂量值(所谓的平均剂量约束)。此外,可能的约束包括最大和最小平均剂量约束,其指定将最大或最小平均剂量递送到计划体积的某一区域。这种约束也被称为最大dvh约束或最小dvh约束(dhv:剂量体积柱状图)。
通常使用最大剂量约束和/或最大dvh约束来指定与oar相关的治疗目标,这是因为通常期望被递送至oar的辐射剂量并不超过规定的阈值。与靶结构有关的治疗目标通常被特别使用可与最大剂量约束和/或均匀剂量约束相结合的最小剂量约束予以指定。使用这种约束,可以确保该靶结构接收规定剂量且既不发生剂量不足(所谓的冷点),也不发生剂量过量(所谓的热点)。
为了生成用于控制特定患者的治疗的治疗计划,基于为该患者所指定的关于计划体积的硬和软约束来制定优化问题。计划单元7随后尝试至少大致解决该优化问题。这意味着该计划单元试图确定对应于满足该约束的剂量分布的治疗计划,其中,该剂量分布对应于辐射剂量值在计划体积中的空间分布。为了试图找到这种治疗计划,可以应用操作者引导的迭代优化程序,其中,计划者可修改治疗目标和/或该计算的其它参数,以便获得最佳治疗计划。在该过程的每个步骤中,计划单元7通过接近该优化问题的解决方案自动地计算初步治疗计划。然后,计划单元7确定对应于该治疗计划的剂量分布,并将该剂量分布向操作该计划单元7的计划者呈现。计划者检查该剂量分布以确定他/她是否对该剂量分布感到满意。如果在一个步骤中令用户感到满意,则将在该步骤中计算出的治疗计划用作最终治疗计划。如果用户感到不满意,则根据由用户作为他/她的检查的结果而指定的改变来修改该优化问题。然后,计划单元7在下一迭代步骤中计算新的初步治疗计划。
待解决的优化问题可对应于基于治疗目标而制定的成本函数f的最小化。成本函数f可包括各个目标函数fk的集合,其中,每个单独的目标函数fk表示一个软约束。在一个实施例中,成本函数f可特别对应于目标函数fk的加权和,即
其中,τ表示待确定的这组治疗参数(如将在下文中所解释的那样),并且参数wk表示目标函数fk的权重。由于加权,在这种约束彼此冲突的情况下,具有较高权重的软约束比具有较低权重的软约束更可能得到满足。因此,根据软约束关于治疗成功的重要性来选择权重。
作为示例,表示对于某一体积v的辐射剂量的最大/最小剂量软约束的目标函数可由下式给出
其中,在规定了最大剂量的情况下,f(di,dk)=h(di-dk),在规定了最小剂量的情况下,f(di,dk)=h(dk-di)。△vi表示体素i的体积,di=di(τ)是当使用照射参数τ时递送至体素i的辐射剂量,dk是待递送到体积v的最大/最小辐射剂量,并且h是由下式限定的赫维赛德(heaviside)阶跃函数
每个硬约束可由函数c(τ)表示,使得计划单元7可使上述函数f(τ)最小化并且可以同时确保满足
c(τ)≥0或c(τ)=0。
例如,对应于最大剂量要求的硬约束的相应函数c可以是c=dk-di,并且对应于最小剂量要求的约束的函数c可以是c=di-dk。
通过使成本函数最小化,可以确定优化的矢量τ,其表示用于待生成的治疗计划的治疗参数。
在一个实施例中,辐射束被建模为一组小射束元素,其中,射束元素可被基于将射束的横截面分成对应于射束元素的多个部分的预定网格来定义。在该实施例中,矢量τ可指定用于各个射束元素的辐射积分通量,并且剂量函数di可被配置为这些积分通量的函数,其中,该积分通量对应于辐射的积分通量。基于作为优化问题的解决方案而获得的积分通量,计划单元7可随后确定实际治疗参数,例如用于辐射源1和准直器4的配置参数,其也被称为机器参数。
在另一实施例中,矢量τ指定机器参数。这意味着剂量函数di可被配置为机器参数的而非积分通量的函数。在该实施例中,优化后的机器参数被直接确定为优化问题的解决方案。因此,该实施例的实施也被称为直接机器参数优化(dpmo)。
为了确定治疗参数使得目标函数被(大致)最小化并且满足硬约束,计划单元7可应用本领域技术人员已知的任何适用的优化算法。该优化算法本质上可以是一种(自动)迭代过程,其中,从一组初始治疗参数集开始计算最优的解决方案。在一个示例性实施方案中,计划单元7可使用在技术报告sol86-6的修订版2001中的p.e.gill等人的“用于npsol5.0的用户指南:用于非线性编程的fortran包(user’sguidefornpsol5.0:afortranpoackagefornonlinearprogramming)”中描述的npsol算法。然而,同样可以使用本领域技术人员已知的任何其它适用的算法。
使用这种算法,计划单元7可在上面解释的用户引导的优化过程的每个步骤中计算治疗计划。当应用迭代算法时,在第二和每个后续步骤中使用的这一组初始治疗参数可以(但不一定必须)对应于在前一步骤中计算的治疗参数。在第一步骤中,可以使用适用的启发方法来确定这一组初始治疗参数。此外,如上所述,当计划者对由生成的治疗计划所导致的剂量分布感到不满意时,可以根据计划者在程序的第二和每个后续步骤中所指定的变化来修改该优化问题。可能的变化包括软和/或硬约束的修改以及表示软约束的目标函数的权重的适配,其中,权重适配通常是优选的,以便保持约束和为患者制定的治疗目标之间的一致性。
如在引言中已经说过的那样,在操作者引导的迭代计划过程中确定治疗计划是一项耗时的任务。而且,有时不可能计算出满足所有治疗目标的最佳治疗计划。这可能特别是由于与靶结构有关的治疗目标和与oar有关的治疗目标之间的冲突所导致的。在这种情况下,计划者必须调整治疗目标,以便在计划程序期间在与靶结构相关的治疗目标和危及器官之间找到折衷方案。如果这种调整是可能的,则必须基于修改后的治疗目标重新计算该治疗计划。
因此,本发明特别提供了一种评估例程,其用于评估治疗目标的可实现性,而不必执行上述的迭代治疗计划程序。因此,除了与靶结构相关的治疗目标之外,计划者还可以检查是否同样可实现与危及器官相关的治疗目标。如果根据评估例程可以实现该治疗目标,则评估例程还允许确定剂量分布,基于该剂量分布,可以确定一组治疗参数,这组治疗参数可在上述操作者引导的治疗计划程序的第一步骤中被用作一组初始治疗参数。
如在下面将更为详细地解释的那样,评估例程基于医疗物理36(734)2009中的a.s.reese等人的公开文献“放射治疗中的积分剂量守恒(intergraldoseconservationinradiationtherapy)”中所描述的调查结果,当分配到靶结构周围的oar的剂量减少时,在靶结构周围的同心壳层上的标准化的整体壳层剂量是恒定的。这意味着,对于在递送至oar的辐射剂量不同的治疗计划,在靶结构周围的同心壳层上的使平均整体壳层剂量标准化的标准化整体壳层剂量是恒定的。因此,每个壳层中的辐射剂量并不能被消除,而是仅被重新分配以便避开器官。这意味着基于oar相对于靶结构的位置并且基于oar的几何形状,对于可避开oar的程度方面的限制。考虑到这些限制,所建议的评估例程特别使得检查与oar相关的治疗目标的可实现性成为可能。
评估例程可由软件实施的评估单元8执行。在以如上所述的方式配置的放射治疗系统中,评估单元8可被集成到计划单元7中。同样,评估单元8可被在其它适用的计算机装置中实现。该计算机装置并不一定必须被直接包括在放射治疗系统中。相反,治疗计划者或另一操作者可使用独立于放射治疗系统操作的计算机装置,以便执行该评估例程。
作为示例,图2示出了可被结合评估例程的执行来实施的步骤。
在第一步骤201中,评估单元8获得患者的所关注身体区域的计划图像以及与靶结构和被包括在所关注的身体区域中的危及结构相关的治疗目标。在计划图像中,特别是通过评估单元8描绘该靶结构(如果之前并未这样做的话)。
基于计划图像和对于其中的靶结构的描绘并且基于仅与靶结构相关的治疗目标,评估单元8在步骤202中确定满足这些治疗目标的治疗计划。该治疗计划被确定,使得在靶结构的区域中实现剂量分布的近似最佳值。这特别意味着实现了与靶结构相关的治疗目标。此外,分配到靶结构的辐射剂量至少近似对应于实现与靶结构有关的治疗目标所需的最小辐射剂量。
当在上述步骤中计算该治疗计划时,评估单元8忽略了与oar有关的治疗目标。因此,在确定治疗计划时不存在需要予以考虑的针对oar的潜在冲突的治疗目标,使得评估单元8将最有可能能够确定适用的治疗计划。如上所述,治疗目标之间的冲突主要存在于与靶结构相关的治疗目标(其通常需要待递送至靶结构的最小辐射剂量)和与oar相关的治疗目标(其通常需要递送到oar的辐射剂量并不超过规定的最大值)之间。由于这种冲突,导致可能无法确定满足与靶结构相关的治疗目标和与oar相关的治疗目标两者的治疗计划。但是,如果仅考虑与靶结构相关的治疗目标,则通常可以确定治疗计划。
为了在步骤202中基于与靶结构相关的治疗目标确定治疗计划,评估单元8可应用本领域技术人员已知的任何适用的计算算法。具体地,评估单元8可使用适用的算法最小化包括与如上所述的靶结构相关的各个治疗目标相对应的目标函数的成本函数,以确定用于辐射束模型的各个射束元素的优化后的治疗参数和/或积分通量。上面已经提到了这种算法的实施例。
一旦已经基于与靶结构相关的治疗目标确定该治疗计划,评估单元8就在步骤203中获得靶结构的区域内的相应剂量分布。该剂量分布(在本文中也被称为第一剂量分布)可被使用治疗计划的治疗参数和/或对应于这些治疗参数的射束元素的积分通量予以计算。
此外,在步骤204中,评估单元8将计划体积分割成围绕靶结构的同心壳层301a、301b。如图3中示意性和示例性地示出的那样,这些壳层301a、301b的边界对应于靶结构302的扩展轮廓。扩展轮廓具有与靶结构302的原始轮廓相同的形状并且同心地环绕该靶结构。此外,相邻壳层的边界之间的距离优选地是基本相等的(即壳层边界被等距地排列)。壳层的数量原则上可被任意选择,并且可被调整为例如计划区域的尺寸。
靶结构302和所获得的壳层的扩展轮廓可由评估单元8以本领域技术人员已知的任何适用方式加以确定。在一个实施方案中,轮廓可被基于距离变换来确定。具体地,评估单元8可确定靶结构外侧的计划体积的体素的距离变换,其向每个体素分配与靶结构相距的最小距离。然后生成壳层的边界,使得它们包含距离变换为其分配相同预定值的所有体素。
对于每个壳层,评估单元8在步骤205中确定用于第一剂量分布的平均壳层剂量值。对于每个壳层,该值对应于根据第一剂量分布递送到壳层的体素的平均辐射剂量。一旦计算用于壳层的平均壳层剂量值,评估单元8就将计算出的平均剂量值存储在存储器中以供将来使用。
此外,评估单元8可在步骤206中确定所关注的身体区域的虚拟剂量分布,其在本文中也称为第二剂量分布。在包括靶结构的区域中,第二剂量分布对应于第一剂量分布。对于靶结构周围的区域,优选地基于预定剂量梯度生成第二剂量分布,该预定剂量梯度描述了随着与靶结构相距的距离增加而被递送到靶结构周围的区域的辐射剂量的减少。因此,考虑到除了实现与靶结构和危及器官有关的治疗目标之外,通常还描述了某一最小剂量下降梯度这一事实,这种剂量下降梯度确保递送到患者身体区域的辐射剂量被最小化或至少被减少,其中,这些患者身体区域并不对应于靶结构或危及器官。
用于确定第二剂量分布的梯度值可以是用于递送放射治疗的放射治疗系统(特别是辐射源1)所特有的,并且在实践中可以对应于通过该放射治疗系统获得的典型梯度。作为一种替代方案,评估单元8的操作者可以指定所期望且可实现的梯度值。
此外,评估单元8在步骤207中获取被包括在计划单元中的与oar有关的治疗目标,并基于这些治疗目标将最大剂量值分配到属于oar的体素。
这样一来,评估单元8将指定的最大或平均剂量值分配到被包括在于治疗目标中被指定了最大或平均剂量值的区域中的体素。如果指定待递送到某一区域的最大剂量(最大dvh约束),则评估单元8将对应于剂量目标的最大剂量值分配到被包括在相应区域中的体素,直到达到最大剂量为止。因此,如果相应的约束指定某一体积的不到30%应接收高于45格雷(gy)的剂量,例如,最大剂量值45gy被分配到被包括在相关体积中的体素的30%。优选地,以这种顺序执行该分配,使得更接近靶结构的体素在与靶结构相距更大距离的体素之前与该相关剂量值相联系。因此,一旦已经达到剂量目标,未被分配剂量值的体素与已被分配剂量值的体素相比更为远离该靶结构。
如果治疗目标包括用于某些区域的多个约束,则以预定顺序进行分配。当以此顺序执行多个分配时,每个新分配都会替代或覆盖先前的分配。特别地,该顺序可以是:(i)最大剂量约束,(ii)平均剂量约束,(iii)最大dvh约束。在相同类别的约束范围内,可以按照从较高剂量目标到较低剂量目标的顺序进行分配。当以此顺序进行分配时,确保最严格的剂量目标被最终分配到每个体素。最小剂量约束不必以预定顺序出现,这是因为这种约束通常并不被分配到oar。
在下一步骤208中,评估单元8基于用于确定第三剂量分布的第二剂量分布执行用于寻求优化问题的解决方案的过程,其中,平均壳层剂量对应于由评估单元8针对第一剂量分布确定并存储的平均壳层剂量,并且其中,并不超过在前一步骤中被分配到体素的最大剂量值。此外,与根据第二剂量分布的这些体素的剂量值相比,在前一步骤中并未指定最大剂量值的剩余体素的剂量值的允许增加优选地受到预定阈值的限制。
从第二剂量分布开始,评估单元8有效地尝试解决执行过程中的优化问题并在必要的情况下(即,在根据第二剂量分布的剂量值较高的情况下)通过适当地减小在步骤207中被分配最大剂量值的体素的剂量值,并且通过增加其它体素的剂量值来确定第三剂量分布。这将以这样一种方式进行:每个壳层的平均壳层剂量对应于基于第一剂量分布确定的平均壳层剂量,并且其它体素的剂量值的增加并不超过该预定阈值。
该优化问题的计算复杂度明显小于基于所有治疗目标确定治疗计划的优化问题的计算复杂度。因此,如果存在这样的解决方案,则可以相对容易且快速地计算出该优化问题的解决方案。
基于用于确定第三剂量分布的优化问题的程序的执行结果,可以预测与oar相关的治疗目标的可实现性。该预测尤其可通过以下方式进行:
如果评估单元8成功地解决了该优化问题并且确定满足上述条件的第三剂量分布,则可以特别地假设治疗目标是可实现的。在这种情况下,可基于这些治疗目标生成治疗计划。这可根据上面解释的操作者引导的迭代优化过程来完成。
在该过程中,由评估单元8确定的第三剂量分布可被用于确定起始点。为此,可以确定导致第三剂量分布的相关治疗参数的值,并且这些值可被用作用户引导的迭代优化过程中的起始值。由于第三剂量分布被基于实际治疗目标加以确定,因此它可提供与待确定的治疗计划相对应的剂量分布的相对良好的近似值。因此,当基于第三剂量分布生成该治疗参数的起始值时,在几个步骤中快速地确定治疗计划会是可能的。
如果评估单元8并未找到优化问题的解决方案,则可假设治疗目标是不可实现的。在这种情况下,评估单元8可相应地输出通知操作者的指示。
如果治疗目标是无法实现的,则需要修改与危险器官有关的治疗目标,以便能够输送该放射治疗。
为了帮助操作者修改治疗目标,评估单元8可确定属于一个或多个oar的体素的剂量值的下限,这允许解决确定满足上述要求的第三剂量分布的优化问题。为此,评估单元8可在一个或多个步骤中将在步骤207中分配到属于这些oar的体素的最大剂量值减少预定量,并在每个步骤中,评估单元8可尝试解决该优化问题。一旦可在一个步骤中解决该优化问题,评估单元8就输出相应的减小值作为属于相关oar的体素的剂量值的下限。
相关的oar可被根据分配到与不同oar相关的治疗目标的优先级来进行选择,并可对应于已经被指定具有较低优先级的治疗目标的那些oar。以这种方式,相关oar可由评估单元8的操作者手动地选择,或者评估单元8可基于分配到治疗目标的优先级自动地选择相关的oar。可基于治疗目标对放射治疗的成功的临床重要性将优先级分配到这些治疗目标。
一旦已经确定了属于相关oar的剂量值的下限,操作者就可评估待进行的权衡,以便修改治疗目标,使得它们是可实现的。如果这些权衡是可接受的,则操作者可修改与相关oar相关的治疗目标,使得修改后的治疗目标并不要求属于相关oar的体素的剂量值小于所确定的下限。
因此,可以使用如上所述的操作者引导的优化程序,基于修改后的治疗目标来确定用于递送放射疗法治疗的治疗计划。在该过程中,由评估单元8确定的作为优化问题的解决方案的第三剂量分布可再次被用于获得治疗参数的起始值。
以上述方式,可以在生成治疗计划之前确定与oar相关的治疗目标的可实现性。此外,上述实施例允许在辐射剂量随着与靶结构相距的距离增加而根据剂量下降梯度减小时确定治疗目标的可实现性。为此,评估单元8生成第二剂量分布并试图找到第三剂量分布,其中,分配到每个体素的剂量值与根据第二剂量分布分配到体素的剂量值相比的差异并不超过预定量。
在其它实施例中,在不考虑辐射剂量根据剂量下降梯度的减少的情况下,对治疗目标的可实现性进行评估。在这些实施例中,省去了第二剂量分布的生成,并且在步骤207中并未分配最大剂量值的体素的剂量值的增加并不受到其它限制(即,除了要求第三剂量分布的平均壳层剂量值对应于第一剂量分布的平均壳层剂量值之外)。在所有其它方面,评估单元8可尝试解决如上文在这些实施例中所述的优化问题。
通过研究附图、公开内容和所附权利要求,本领域技术人员在实践所要求保护的本发明时可以明白和实现所公开实施例的其它变型。
在权利要求中,词语“包括”并不排除其它元件或步骤,并且不定冠词“一种”或“一个”并不排除多个。
计算机程序可被存储/分布在适用的介质(例如光学存储介质或固态介质)上,该计算机程序被与其它硬件一起提供或被作为其它硬件的一部分提供,但也可以以其它形式(例如经由因特网或其它有线或无线通信系统)分配。
权利要求中的任何附图标记均不应被解释为限制范围。
- 还没有人留言评论。精彩留言会获得点赞!