用于治疗部位的流体引流或递送装置的制作方法
本发明涉及一种用于在治疗部位处植入的装置,以将流体从该部位引流或递送至该部位。具体地,该装置是生物可吸收的。本发明还涉及一种系统,该系统包括该装置和用于施加负压或正压以帮助减少死区并改善流体从治疗部位的引流或流体向治疗部位的递送的装置。本发明还涉及一种使用本发明的装置将流体从治疗部位引流或将流体递送至治疗部位的方法,并且涉及一种制造所述装置的方法。
背景技术:
对流体的引流和来自手术或创伤伤口的死区的减少通常是患者及时有效恢复的关键因素。目前,没有消除手术时死区的好的解决方案。缝线提供线性闭合,而不是在整个分开的组织平面上提供闭合。手术引流管只能部分有效地移除流体,而不解决手术后死区立即闭合的主要问题。组织粘合剂未被证明是可靠有效的,并且在整个区域上手工缝合只能提供有限数量的局部闭合。
术后或外伤后皮下积液或血肿的形成会阻碍康复。皮下积液和血肿是在伤口处积聚的浆液性流体或血液。如果没有足够的引流,愈合不良、感染或裂开可能导致需要额外的手术和更长的住院时间。在重建整形手术、创伤、乳房切除术、肿瘤切除、剖腹产、疝气修补和涉及许多将组织抬高和分开的开放手术之后,皮下积液和血肿是常见的。
虽然在许多情况下,非常期望减少死区和提供流体从伤口部位的引流,但在其它情况下,能够将流体直接递送至伤口部位以协助伤口愈合过程是有用的。例如,将抗微生物溶液局部滴入感染组织可用于控制感染。类似地,滴注局部麻醉剂可有助于控制疼痛。
可以使用许多能植入到治疗部位的装置以实现对流体的引流。这些装置的范围从包括从中穿过的引流孔的简单硅管到由脱细胞组织制成的各种形状的结构的歧管。例如,us7,699,831描述了一种伤口引流组件,该伤口引流组件具有构造成用于放置在内部伤口部位中的壳体。泡沫海绵位于壳体中,以用于从伤口部位吸收流体。管道与壳体连接,并连接于体外的负压源。负压导致流体从泡沫海绵流到外部收集部位。
在伤口部位进行引流了一段时间后,必须将一些引流装置从体内移除。移除这些装置可能引起患者的不适或疼痛或需要不期望的另外的外科手术,而移除该装置的需要限制了将装置定位以在整个区域上提供有效治疗的能力。然而,其它引流装置由能够被身体吸收的材料构成。
us2015/0320911描述了基于组织的可植入引流歧管。歧管可包括形成为片材、管或柱的脱细胞组织。可施加负压以辅助经由管道从伤口部位到歧管中和身体外部的引流。完成引流程序后,不需要移除基于组织的歧管。歧管结构还为来自周围天然组织的细胞的迁移和增殖提供支架。
然而,虽然许多现有的排水结构是生物可吸收的,但它们的构造通常涉及完全合成的材料,并且使用诸如注射成型或挤出之类的制造技术构造,此类制造技术产生连续的管或结构,这些管或结构包括厚壁部分或具有大量合成物质的结构。
合成材料的植入可能导致炎症水平升高,这种炎症水平通常在植入后在体内出现,最具体地是在敏感和血管区域,比如骨盆底或腹壁。许多生物可吸收材料还通过整体水解过程进行降解和吸收,在合成过程中,合成材料的聚合物链吸收水以将化学结构分解为各种单体,这些单体释放出有害的酸,这些酸可引发炎症和异物反应,例如常用于疝气腹壁修复和盆腔器官脱垂修复的合成网中所见的。
因此,本发明的目的是提供一种流体引流或递送装置,该装置解决了上述缺点中的一个或多个,和/或至少提供了对现有装置的有用的替代方案。
在已经参考专利说明书,其它外部文件或其它信息源的本说明书中,这通常是提供用于讨论本发明的特征的内容。除非另有特别说明,否则对此类外部文件或信息源的引用不应解释为承认在任何管辖范围内此类文件或信息源是现有技术或构成本领域公知常识的一部分。
技术实现要素:
在第一方面,本发明提供了一种生物可吸收的装置,该装置用于植入在患者体内的治疗部位处,以将流体从治疗部位引流或将流体递送至治疗部位。该装置包括:生物可吸收的弹性桁架,该桁架用于保持间隔开的两个组织表面,从而限定出通道,来自治疗部位的流体可以被引流到该通道中,或者可以从该通道将流体递送至治疗部位;以及端口,该端口与一个或多个通道流体连通并且可连接至负压或正压源。
在一实施例中,桁架包括柔性的细长桁架构件。桁架可弯曲并且沿着通道的壁定位。
在一实施例中,桁架构件是基本上螺旋形的。
桁架可限定出该通道。例如,基本上圆柱形的螺旋形桁架的外径可对应于通道的直径。或者,桁架的宽度可对应于通道的宽度。在一实施例中,桁架形成限定出该通道的柔性管。该管可以是基本上圆柱形或卵形或椭圆形或其它形状。在一实施例中,桁架在待用的非植入状态下具有基本上圆形的横截面,并且在植入时响应于作用在桁架上的压缩力而呈现卵形或椭圆形横截面,以限定出具有对应的卵形或椭圆形横截面的通道。
该装置可包括多个柔性的细长桁架构件。在一种实施例中,桁架构件中的第一个桁架构件是具有第一节距长度的基本上螺旋形,并且桁架构件中的第二个桁架构件是具有第二节距长度的基本上螺旋形。在一实施例中,第二节距长度不同于第一节距长度。例如,第一节距长度可在第二节距长度的约三倍到约五倍之间,优选地为第二节距长度的约4.5倍。替代地,第一节距长度和第二节距长度可相同,并且两个相应的桁架构件沿相反的方向卷绕。第一桁架构件和第二桁架构件可在若干离散的点处连结在一起和/或连结于支承构件。
通道的横截面可以是圆形的或非圆形的,例如卵形或椭圆形。
该装置可包括两个柔性的细长侧桁架构件,每个细长侧桁架构件沿着通道的侧部纵向延伸并且在若干离散的点处连结于第一桁架构件和/或第二桁架构件。例如,桁架构件可通过热焊接、缝合或通过粘合剂来连结。在具有卵形或椭圆形横截面轮廓的实施例中,可以在横截面的短轴上设置柔性细长侧桁架构件。在一种实施例中,该装置包括沿着桁架的相对侧延伸的两对细长的侧桁架构件。
该装置还可包括柔性的生物可吸收片材,该片材形成该通道的壁的至少一部分。在一实施例中,通道形成在柔性片材的表面与治疗部位的组织或骨骼的表面之间。例如,可将片材放置在拱型桁架构件上。替代地,柔性片材可围绕桁架裹绕,例如以包封桁架。可沿着通道的壁在柔性片材中设置多个孔,以允许流体流到通道中。这些孔可设置为一排或多排规则间隔开的孔,或者不规则地布置。孔可仅设在装置的选定部分中,以选择性地将流体从治疗部位的目标区域引流或将流体递送至治疗部位的目标区域。
在一实施例中,该装置包括两个柔性的生物可吸收片材,其中,通道形成在两个柔性片材的相对表面之间。可沿着侧缝将片材缝合或粘附在一起。可沿着通道的壁在一个或两个柔性片材中设置多个孔,以允许流体流到通道中。这些孔可设置为一排或多排规则间隔开的孔,或者不规则地布置。孔可仅设在装置的选定部分中,以选择性地将流体从治疗部位的目标区域引流或将流体递送至治疗部位的目标区域。
在一实施例中,至少一个桁架构件可包括被纺织或缝制到或穿过至少一个柔性片材的一段长度的线或条带。例如,使用曲折形针迹将细丝/线缝制穿过一层或多层柔性片材。
在一实施例中,(一个或多个)桁架构件包括缝线。
在一实施例中,该柔性片材或每个柔性片材包括一层或多层细胞外基质(ecm)或聚合物材料。ecm可由反刍前胃的脱细胞的粘膜下固有层形成。ecm可包含选自强力霉素、四环素、银、fgf-2、tgf-b、tgf-b2、bmr7、bmp-12、pdgf、igf、胶原蛋白、弹性蛋白、纤连蛋白和透明质酸的生物活性剂。
在一实施例中,桁架形成限定有通道的细长柔性管,并且该装置包括一个或多个连结件,这些连结件将柔性管的至少一段长度保持为蜿蜒的形状。替代地或附加地,桁架可限定有多个通道,来自治疗部位的流体可被引流到这些通道中或可将流体从这些通道递送至治疗部位。例如,桁架可限定有主通道以及由该主通道分支出的多个副通道。
在一实施例中,治疗部位是在手术期间或由于创伤而分开的肌肉组织、结缔组织或皮肤组织的表面之间的空间。
在一实施例中,治疗部位是开放手术或隧穿伤口中的组织的暴露区域,比如肌肉或皮下组织。
在一实施例中,待递送至治疗部位的流体包含一种或多种营养物或治疗剂,以促进伤口愈合。
在第二方面,本发明提供了一种用于将流体从患者体内的治疗部位引流或将流体递送至患者体内的治疗部位的系统。该系统包括:以上关于第一方面描述的装置;导管,该导管可释放地联接于装置的端口或不透流体的敷料;位于患者身体外部的贮存器,该贮存器与导管流体连通,以用于从导管接纳流体或将流体递送至导管;以及压力源,该压力源联接于导管以向装置递送正压或负压。
在一实施例中,压力源能够向装置递送负压,使得流体从治疗部位被引流到装置中,并通过导管转移至贮存器。可连续施加压力或改变压力。例如,可在治疗过程中间歇地、脉冲地或变化地施加压力。
在一实施例中,压力源能够向装置递送正压,使得贮存器中的流体通过导管转移到装置中并转移至治疗部位。可连续施加压力或改变压力。例如,可在治疗过程中间歇地、脉冲地或变化地施加压力。
在一实施例中,治疗部位是开放手术或隧穿伤口中的组织的暴露区域,比如肌肉或皮下组织。
在第三方面,本发明提供了一种将流体从患者体内的治疗部位引流或将流体递送至患者体内的治疗部位的方法。该方法包括:在治疗部位处植入上述关于第一方面所述的装置;将导管联接至装置的端口,该导管连接于位于患者身体外部的贮存器,以用于从导管接纳流体或将流体递送至导管;以及向装置递送负压,使得将流体从治疗部位引入到装置中并通过导管转移至贮存器,或者向装置递送负压,使得贮存器中的流体通过导管进入装置和治疗部位。可选地,可将伤口敷料施加至治疗部位附近的切口,并将负压施加至伤口敷料,伤口敷料的负压供应源也联接于正压或负压源。在一实施例中,治疗部位可以是开放手术或隧穿伤口中的组织的暴露区域,比如肌肉或皮下组织。
附图说明
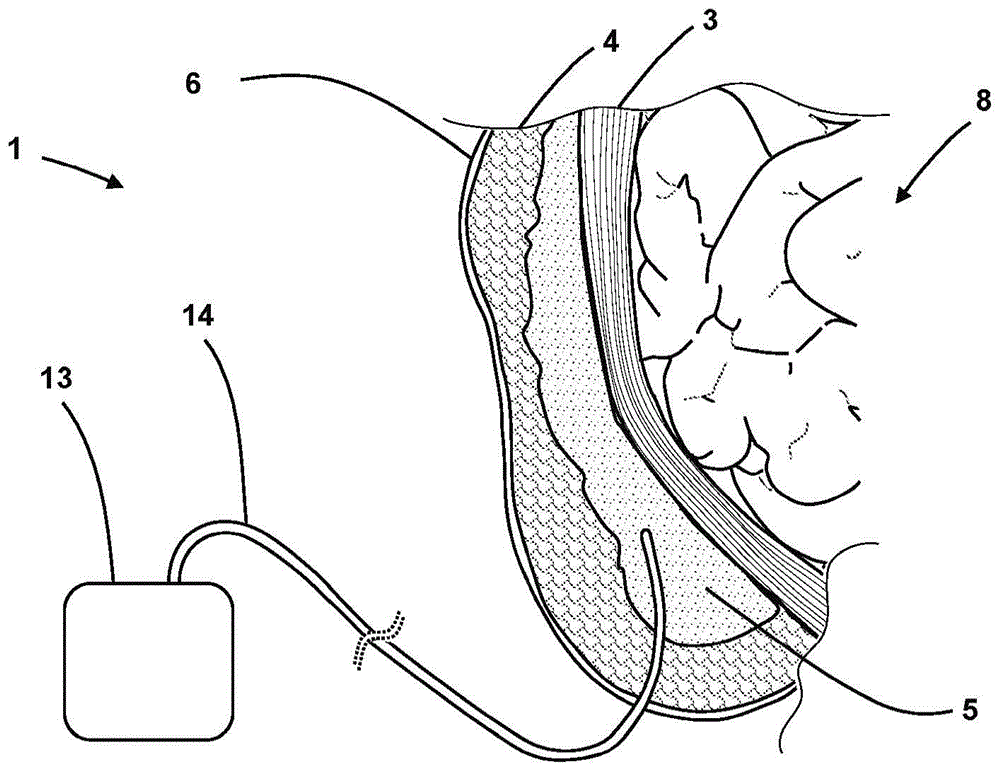
图1是腹部空间的剖视图,示出了用于管理与腹壁或肌肉相邻的皮下积液的现有技术的引流装置的放置。
图2a至2d示出了使用根据本发明的一种实施例的装置的各个治疗阶段,其中图2a示出了在皮下积液处附近植入的装置,图2b示出了尺寸减小的皮下积液和所伴随的死区,图2c示出了完全排空了皮下积液以及从装置的端口断开负压源,图2d示出了已完全吸收的装置。
图3a至3c示出了不可渗透敷料的各种构造,这些构造用于促进装置的各实施例上的外部定位的端口与真空或正压源的连接。
图4是概念性地示出了打开的腹部以及本发明的一种实施例的装置在腹壁肌肉上的放置的示意图,其中该装置的端口位于皮肤的外表面上。
图5a至5d是示出了用于产生流体流动通道的各种示例性桁架和片材构造的局部剖视图,其中图5a示出了具有拱形桁架的实施例,该拱形桁架具有设置在下部柔性片材的下侧上的下部连接或支承桁架构件,图5b示出了与图5a类似的实施例,但是其中下部桁架构件被夹在两个片材之间,图5c示出了其中由拱形桁架将上部片材和下部片材保持间隔开的实施例,并且图5d示出了与图5c类似的实施例,但是其中两个片材沿着通道的边缘缝合在一起。
图6是示出在两个柔性片材之间产生通道的拱形桁架的一种形式的剖切立体图。
图7是示出了替代拱形桁架的剖切立体图,在该桁架的侧部和顶部具有支承桁架构件。
图8a和图8b示出了具有穿过顶部柔性片材设置的孔以允许流体通过表面交换至装置的通道的实施例,其中图8a是示出了桁架结构的剖切立体图,图8b是更好地示出了孔的立体图。
图9是示出一实施例的剖切立体图,该实施例具有穿过上部柔性片材和下部柔性片材设置以允许横跨该装置的两个表面的流体交换的孔。
图10是示出了另外的替代桁架结构的剖切立体图,该结构具有拱形桁架部分和横跨桁架底部设置的对角支承桁架构件。
图11a至11d是示出了各种替代的装置桁架构件的通道的端视图,其中图11a示出了具有如图6所示的拱形桁架的实施例,图11b示出了具有在两个聚合物层之间形成通道的单个拱形桁架的实施例,图11c示出了具有波纹状桁架结构的实施例,在波纹之间形成了多个子通道,以及,图11d示出了其中桁架包括三个间隔开的细长桁架构件的实施例,这些细长桁架构件凭借它们的直径形成通道。
图12a和12b示出了本发明的实施例的装置,该装置在上部柔性片材与下部柔性片材之间具有从毂部延伸的多个通道,其中图12a是俯视立体图,图12b是仰视立体图。
图13a和图13b示出了与图12a和图12b中的实施例类似的实施例,但是其中装置的一个表面终止于皮肤的外表面以将端口向外定位,其中图13a是俯视立体图,图13b仰视立体图。
图14a至14d是示出了具有从毂部延伸的多个通道的装置的各种替代实施例的立体图,其中上部片材的一部分被切开以露出相应的桁架结构,其中图14a示出了在通道壁中没有孔且没有腹板孔的一种实施例装置,图14b示出了图14a的装置但是包括腹板孔以允许组织在相邻通道之间接触,图14c示出了图14b的实施例,但是在通道壁处的顶部片材中还包括用于使流体通入通道的孔;以及,图14d示出了图14a的装置,但是该装置在通道壁处的顶部片材中包括用于使流体通入通道的孔。
图15a和15b示出了与图14d所示实施例的装置类似的装置,但是附加地在通道壁处的下部片材中包括用于使流体通入通道的孔,其中图15a是俯视立体图,图15b是仰视立体图。
图16a和16b示出了与图14d所示的实施例装置类似的装置,但是其中主要通道的通道壁直接从装置的端口延伸,不包括穿过壁的孔,其中图16a是俯视立体图,图16b是仰视立体图。
图17a和17b示出了与图14a所示的实施例的装置类似的装置,但是在通道壁处的下部片材中包括用于使流体通入通道的孔,其中图17a是俯视立体图,图17b是仰视立体图。
图18a和18b示出了与图14a和14b所示的实施例装置类似的装置,但是该装置的一个表面终止于皮肤的表面。
图19是示出了又一种实施例的通道的剖切立体图,其中,桁架基本上是螺旋形的并且定位在两个柔性片材之间。
图20是示出了与图19类似的实施例的剖切立体图,但是还包括沿着通道的侧部缝合以连结两个柔性片材。
图21是示出图20的通道结构的剖切立体图,其中桁架延伸到用于连接至供应导管的联接管中,以向装置提供正压或负压。
图22是示出图20的通道结构的剖切立体图,其中桁架延伸到可释放地连接的导管中,以向装置供应正压或负压。
图23是示出了又一种实施例的通道的剖切立体图,该通道具有带侧支承部件的基本上为螺旋形的桁架部件,以及由单个柔性片材形成的通道壁,其边缘在侧缝处缝合在一起。
图24是与图23类似的实施例的剖切立体图,但是在通道壁中设置了单排孔。
图25是与图23和24类似的实施例的剖切立体图,但是在通道壁中设置了多排孔。
图26是示出了另一种实施例的通道的剖切立体图,其中桁架具有两个重叠的螺旋形构件和侧支承构件,以及由单个柔性片材形成通道壁,其边缘在侧缝处粘合在一起。
图27a和27b是示出具有图25的通道结构的实施例的剖切立体图,其中图27a示出了如下的装置:其中桁架结构延伸到扩大的联接导管中以向装置提供正压或负压;图27b示出了如下的装置:其中在该装置的端口附近对桁架结构进行了修改,以适应与导管的联接。
图28a和28b是装置的局部立体图,其中外层由具有组织保持倒钩的可吸收锁定部件固定,其中图28a是右侧立体图,图28b是左侧立体图。
图29是示出了一种实施例的单通道装置在治疗部位处的放置的示意图,该装置具有在内部定位的端口,该端口连接于负压或正压源。
图30a和30b是对应于图29的视图,但是示出了使用负压伤口疗法同时治疗切口伤口,其中图30a示出了类似于图29的治疗区域,图30b示出了对延伸至与切口伤口相邻的治疗区域的治疗。
图31是对应于图29的视图,但附加地示出了该装置的连接于治疗流体的供应源的一端。
图32是对应于图31的视图,但是治疗流体的供应源以及负压或正压源经由单个植入端口联接于装置。
图33a至33d示出了制造具有两个螺旋形构件和两个侧支承构件的桁架的一种方法,其中图33a示出了围绕着中央心轴卷绕的第一桁架构件,图33b示出了结合至第一桁架构件的两个细长侧支承构件,图33c示出了围绕着中央心轴、第一桁架构件和侧构件卷绕并结合至第一桁架构件和侧构件的第二桁架构件,以及,图33d示出了从桁架移除中央心轴。
图34a和34b示出了制造桁架的替代方法,其中图34a示出了围绕着中央心轴卷绕的第一桁架构件和两个细长侧支承构件,并且图34b示出了从桁架移除中央心轴。
图35a和35b是在治疗部位处植入的装置的一种实施例的剖视图,其中图35a示出了最初植入在皮下组织空间内的死区区域中的装置,图35b示出了治疗期之后死区的减少。
图36a和36b是对应于图35a和35b的视图,其中该装置附加地连接于局部施加伤口治疗的装置以同时治疗切开伤口,其中图36a示出了该最初植入在皮下组织空间内的死区区域中的装置以及最初使用的敷料;以及,图36b示出了治疗期之后死区的减少。
图37a和37b是一种单通道装置的说明性实施例,该单通道装置被构造成在发生阻塞的情况下允许形成替代的流体流动路径,其中图37a示出了未阻塞的装置中的流体流动,图37b示出了响应于阻塞的流体流动变化。
图38a和38b是图37a和37b的装置的说明性实施例,但是包括连接腹板或套筒,以辅助保持装置的形状,其中图38a示出了整个装置,而图37b是该装置在端口附近的一部分的放大图。
图39a和39b是示出了另一种实施例的桁架和通道的立体图,该通道可释放地联接于两个内腔导管,其中桁架结构延伸到导管中,其中图39a将导管显示为透明构件,图39b是剖切立体图。
图40a至图40c是图39a和图39b中的实施例的俯视立体图,示出了从桁架上移除可释放地联接的导管的顺序,其中图40a示出了联接于桁架和通道的导管,图40b示出了在从桁架中移除的过程中的导管,图40c示出了已从桁架中移除的导管。
图41是植入在打开的治疗部位处的装置的一种实施例的剖视图,在该部位处剩余的伤口已由敷料覆盖以促进治疗。
图42是植入在打开的治疗部位处的装置的一种实施例的剖视图,该装置示出为具有放置在植入物的顶部上的局部施加的伤口治疗。
具体实施方式
i.定义
如本文所使用的,术语“可生物吸收的”是指能够被身体分解和吸收或重塑,因此不需要手动移除。
如本文所使用的,术语“治疗部位”是指人或动物体内的肌肉组织、结缔组织或皮肤组织的表面在手术期间或由于创伤或移除而分开的部位。
如本文所使用的,术语“粘膜下固有层”是指通过在反刍动物的前胃中混合固有层和粘膜下层而形成的组织结构。
如本文所使用的,术语“固有层”是指粘膜下固有层的内腔部分,其包括细胞外基质的致密层。
如本文所使用的,术语“细胞外基质”(ecm)是指已被脱细胞的、并提供用于结构完整性的基质和用于携带其它物质的框架的动物或人类组织。
如本文所使用的,术语“脱细胞的”是指从组织或器官的一部分(例如,从ecm)移除细胞及其相关的碎屑。
如本文所使用的,术语“聚合物材料”是指包含许多重复的亚基的大分子或大分子,并且可以是天然材料,包括但不限于多肽和蛋白质(例如胶原蛋白)、多糖(例如藻酸盐)和诸如糖蛋白之类的其它生物聚合物,或者可以是合成材料,包括但不限于聚乙醇酸、聚乳酸、p4hb(聚-4-羟基丁酸酯)、聚乳酸和聚乙醇酸共聚物、聚己内酯和聚二恶烷酮。
ii.装置
现在将参照图1至42描述本发明的装置和系统的各种实施例。在这些附图中,相同的参考标记用于指示相同的特征。在示出了各种不同实施例的情况下,在随后的实施例中,相似的附图标记可用于相似或类似的特征,但是增加了100的倍数,例如2、102、202、302等。
在以下描述中使用的方向性术语仅是为了便于描述和参考,并非旨在进行限制。例如,术语“前”、“后”、“上”、“下”和其它相关术语通常参考装置在附图中的示出方式使用。
图2a至28b、37a至38b和39a至40c示出了用于在患者体内的治疗部位102处植入的生物可吸收的装置,目的是将流体从治疗部位引流或将流体递送至治疗部位。治疗部位102可以是在手术期间或由于创伤而分开的肌肉组织103、结缔组织104或皮肤组织的表面之间的空间。治疗部位可以是皮下积液105或血肿的部位,或者可以用作外科手术切除组织后的预防措施。替代地,治疗部位可以是诸如在坏死或感染组织的创伤、损伤或手术切除之后(图41和42)被打开的伤口。
装置101具有可生物吸收的弹性桁架107,在使用中,该桁架107保持两个组织表面103、104间隔开,从而限定出通道109,来自治疗部位的流体可以被引流到该通道109中,或者可以从通道109中将流体递送至治疗部位。在桁架107的一端处的开口形式的端口111与通道109流体连通,并允许通道与负压或正压源113连接。两个组织表面103、104需要保持分开,因为否则它们将塌缩在一起,特别是在施加负压或减小的压力(真空)以辅助流体引流的情况下。
在一些替代实施例中,装置101能够可操作地连接于一个或多个其它装置,其在不同的相应部位处植入,以利用相同的压力源来治疗相应的部位。
在一些替代实施例中,该装置可以与也连接于负压或正压源的另一个伤口治疗装置接触。
图5至11d、19至28b和39a至40c示出了弹性桁架107的各种示例性实施例。桁架107、207、307等可限定有单个通道109、209、309等或者例如呈分支结构的多个互连的通道。桁架107、207、307等沿其纵向方向是柔性的,以允许(一个或多个)通道挠曲成基本符合治疗部位102的轮廓,并减少或防止对周围组织的局部刺激或磨损。桁架是三维结构,其具有足够的强度以至少在植入时将两个组织表面103、104保持分开,而在移动或施加临床上适当的负压水平时,桁架不屈曲或者通道不塌缩或扭结。如果两个组织表面103、104塌缩到一起,则流体流动将受到严格限制并且可能完全被阻塞。
桁架107除了具有足够的横截面强度以将组织表面保持分开之外,还沿其径向方向具有弹性。这种弹性允许在力作用下通道壁的一些挠曲,以防止或减少对组织的损害,但是确保当移除力时通道109将返回其原始构造。例如,如果组织运动导致对桁架的压力增加。
参照图6和图19作为示例,桁架407、2307包括至少一个挠性的细长桁架构件415、2315,这些细长桁架构件415、2315布置成形成用于通道409、2309的框架。(一个或多个)细长桁架构件415优选地具有比其通道2309的长度或者通道409的沿着其延伸的一部分的长度更长的弧长。优选地,桁架构件2315或至少一个桁架构件415是弯曲的,以便遵循通道壁417、3217的内表面的弯曲轮廓。例如,桁架构件415、2315可以是基本上遵循通道壁的曲率的弓形、螺旋形、正弦形或其它弯曲形式。桁架可附加地或替代地包括基本上笔直的桁架构件。桁架构件可包括细丝/线。
桁架可具有“打开”形式,其中桁架构件仅沿着或主要沿着通道的上部或下部和/或侧部放置,例如形成拱形桁架407、507、607、707、807,如图5c、5d和6-10所示,其中相应的通道409、509、609、709、809被限定在该拱形的下方。参照图6,弯曲的桁架构件415布置成彼此交叉的通路,使得位于下方的桁架构件在被压缩时辅助防止或抵抗上覆构件的塌缩。参照图7,桁架607还可包括在离散的点618处结合或以其它方式连结于弯曲桁架构件615的支承桁架构件616a、616b,以将桁架构件616的相应结合点或连结点保持为间隔开的关系,由此减少或防止了由于各个桁架构件部分的相对运动导致的通道壁617的塌缩。例如,在图7至9的示例性装置601、701、801、901中,拱形桁架包括两个细长侧支承构件616b、716b、816b和在拱形部的顶点处的细长支承构件616a、716a、816a。支承构件616a、616b、716a、716b、816a、816b的长度与通道或它们沿着其延伸的通道部分的长度基本上相同。
替代地,桁架可具有“闭合”形式,其中桁架本质上是管状的,从而沿所有径向方向为组织表面提供支承。例如,图10的实施例附加地包括沿着拱形部的基部的一系列对角支承杆916c,以基本上维持拱形部916b的下边缘之间的间隔。图19至26进一步示出了具有闭合桁架形式2307的示例性实施例,该闭合桁架形式包括至少一个限定出圆柱形通道2309的基本上螺旋形的桁架构件2315。如图23至28b所示,螺旋形桁架2707可进一步包括一个或多个在离散的点处结合或以其它方式连结于螺旋形桁架构件2715的支承桁架构件2716,以将螺旋形桁架构件2715的相邻卷绕部保持间隔开,由此减少或防止由于桁架构件的相邻卷绕部的相对运动而引起管塌缩。图23至28b所示的实施例包括两个细长的侧支承构件2716,这两个细长的侧支承构件2716的长度与通道或通道的为侧支承构件所沿其延伸的部分的长度基本上相同。实施例能够可选地包括附加的支承构件,例如三个支承构件(如图27b所示),或者可选地具有更少的支承构件。
桁架可包括多个螺旋形桁架构件。例如,图33d示出了另一种实施例的桁架3507,该桁架3507包括相重叠的基本上螺旋形的第一桁架构件3515a和基本上螺旋形的第二桁架构件3515b。第一桁架构件3515a具有第一节距长度p1,并且第二桁架构件3515b具有第二节距长度p2,第二节距长度p2大于第一节距长度p1。在所示的实施例中,第二节距长度p2约为第一节距长度p1的3.5倍。然而,可以预期其它的比率,例如,第一节距长度p1可以是第二节距长度p2的约4.5倍或约三倍至约五倍之间,或者可以是第一节距长度p1的约二倍至约十倍之间。
在所示的实施例中,桁架3507还包括两个细长的侧支承构件,这两个细长的侧支承构件连结于第一螺旋形桁架构件和第二螺旋形桁架构件。细长侧构件的长度与通道或它们所沿着其延伸的通道的部分的长度基本上相同。在替代实施例中,桁架可具有更多或更少的支承构件,和/或可具有多于两个的螺旋形构件。
第一桁架构件3515a和第二桁架构件3515b在离散的点3518处结合在一起和/或连结于支承构件3516,在离散的点3518处,构件彼此重叠。具有结合在一起的多个螺旋构件的该示例性结构有利地允许使用较少的桁架材料来产生较高强度的桁架。
图39a至40c示出了另一种实施例的桁架3907,该桁架3907具有基本上螺旋形的第一桁架构件3915a和基本上螺旋形的第二桁架构件3915b,它们具有相等的节距长度,但是沿相反的方向卷绕。第一螺旋形桁架构件3915a和第二螺旋形桁架构件3915b限定出具有非圆形横截面轮廓的通道3909。在所示的实施例中(参见图41和42),通道3909具有卵形或椭圆形的横截面轮廓,该轮廓具有长尺寸以及小于长尺寸的短尺寸。当被放置在两个组织表面之间的伤口中时,该装置优选地定向成其长轴沿着两个组织的界面,使得两个组织表面之间的间隔对应于短尺寸。与具有相同横截面面积的圆柱形桁架的实施例相比,这允许两个组织表面更靠近在一起以更好地促进愈合,同时还改善了患者的舒适度。
桁架包括四个细长的支承桁架构件3916,如图40a和40b所示(在短轴上),两个在桁架的顶部,两个在桁架的底部,以使螺旋形桁架构件3915a、3915b的相邻卷绕部保持间隔开。与具有两个单支承构件的实施例相比,成对的支承构件3916的使用提供了附加的支承以及对桁架3907的压扁或扭结的抵抗。然而,在替代实施例中,桁架可以包括单个顶部支承构件和单个下部支承构件,并且这些支承构件可以比螺旋形桁架构件更厚和/或更宽,例如呈条带的形式,以提供改善的支承。每个支承桁架构件3916位于两个桁架构件3915a、3915b之间,其中第一桁架构件3915a在离散的点处结合于或以其它方式连结于支承桁架构件3916的内表面,并且第二桁架构件3915b在离散的点处结合或以其它式连结于支承桁架构件3916的外表面。第一桁架构件3915a和第二桁架构件3915b在它们与支承桁架构件相结合的点处彼此重叠。如在使用图41和42的剖视图中最佳示出的,第一桁架构件3915a具有向内扭结的部分,在该部分中第一螺旋形桁架构件3915a与相应的支承桁架构件3916连结,以容纳支承桁架构件3916和第二桁架构件3915b。第一桁架构件3915a围绕支承构件3916的这种向内扭结有助于减小如果桁架被挤压则通道3909将被完全阻塞的可能性。第一桁架构件3915a和支承构件限制侧壁3919朝向彼此的运动,从而当相对的支承构件压向彼此时允许具体地在支承构件的任一侧上的一些流动。
这种具有非圆形横截面轮廓和短轴上的支承构件的示例性结构有利地允许桁架3907沿一个方向具有更大的柔性,同时还防止了桁架在螺旋形桁架构件3915a、3915b之间的部分中的扭结或塌缩。
对于打开形式桁架和闭合形式桁架两者,任何支承构件的数量和性质将取决于组成桁架构件的强度特性、桁架构件的数量、其构造以及通道的横截面积,具有打开形式的桁架可包括一个或多个细长的桁架构件,以支承其它桁架构件。
在本发明的一些优选实施例中,通道的横截面积为约28平方毫米。这可由直径或最大宽度为约6毫米的圆柱形通道提供,也可以由卵形或椭圆形通道提供。然而,一定范围内的横截面积是可能的,并且不同的应用场合可能需要具有不同横截面的通道。例如,在替代实施例中,通道所具有的横截面积可在约3平方毫米至约80平方毫米的范围内,优选地在大约12平方毫米至50平方毫米的范围内,即,在圆柱形通道实施例中,直径或宽度在大约1毫米至10毫米的范围内,优选地为约4毫米至约8毫米的范围内。横截面积可以是恒定的或是可变化的。与常规的流体引流装置相比,较大的横截面积的通道在通道的长度上提供了更有利的、更低的压降,并且还有利于防止阻塞。
当与现有技术的现有装置相比时,通过减少每单位长度的合成材料的总质量,弹性桁架还提供了在两个表面之间提供通道的更有效的结构。
桁架还具有多孔结构,当与取决于小直径的孔/穿孔以使流体进入通道的现有技术的闭合形式相比时,该结构允许流体从内部通道自由交换至周围区域,从而使流体更有效地通过。合成的可生物吸收的聚合物通常在分解时还会释放出酸,这会导致炎症水平升高,在这些部段的厚度给定的情况下,这在现有技术中持续更长的时间。
作为图11c和11d所示的另一种替代方案,桁架1107、1207可包括一定长度的线条带1215或波纹部1115,其厚度t对应于通道1109、1209的期望厚度。然后,子通道1120、1220沿着线或条带1215的长度的任一侧在线或条带1215的两个长度之间纵向地形成,或者在由桁架构件的波纹部或其它三维结构1115限定的空腔内纵向地形成。
在一些实施例中,桁架107可直接植入到治疗部位处,使得桁架直接接触治疗部位的表面。治疗部位的表面将由组织(例如,肌肉组织、结缔组织或皮肤)或可能由组织和骨骼组合的骨架形成。然后,限定出通道的一个或多个壁由组织表面自身形成,其中它们通过桁架保持间隔开。通道可形成在一片柔性材料的表面与治疗部位的表面之间。
参照图5a至28b,替代地,该装置可包括一个或多个生物可吸收材料的柔性片材219、221,这些柔性片材形成通道壁217的至少一部分。在一些实施例中,一个或多个柔性片材219、221可仅部分地形成通道壁217,而通道壁的其余部分由组织表面形成。即,通道可形成在柔性片材的表面与治疗部位的组织或骨骼的表面之间。或者,一个或多个柔性片材可形成通道壁的大部分或基本上整个通道壁。这种实施例可包括两个或更多个生物可吸收的柔性片材,其桁架将片材保持分开,从而在片材219、319、419等与221、321、421等的相对表面之间限定出一个或多个通道(参见图1至22),或者单个柔性生物可吸收片材2719、2819、2919、3019等可围绕桁架裹绕以形成通道的壁(参见图23至28b)。
为了将一个或多个柔性片材固定在桁架上或周围,可沿着通道的一侧处的接缝将一个或多个柔性片缝合在一起。图5d和20至22示出了示例性实施例,其中两个上部柔性片材519和下部柔性片材521沿着两个侧缝523、2423、2523、2623缝合在一起。在具有围绕桁架裹绕的单个柔性片材的实施例中,如图23至25、27a和27b以及39a至40c所示,仅需要单个侧缝2723、2823、2923。替代地,例如如图26所示,可在接缝处使用粘合剂3024而不是缝合,来将相对的片材边缘连结在一起。
现在参照图8a至9,可在柔性片材719、819、821中的一个或两者中提供多个孔725、825,以促进流体流入通道709、809。可沿着顶表面、侧表面和/或下表面中的一个或多个来设置孔。孔725、825可排成一排或多排,或者可交错或以其它方式布置。图8a、8b和10示出了包括两个柔性片材的实施例,其中仅沿着通道壁在顶部片材719、919中设置有孔725、925,以促进流体流入或流出通道。而图9和14c至16b示出了替代实施例,其中在上部片材和下部片材819、821、1419、1421等中均沿着通道设置有孔825、1425等,以进一步改善流体流入或流出通道。替代地,如图17a至18b所示,可仅沿着通道壁的下侧在下部片材2121、2221中设置孔2125、2225。通道壁上的孔的位置可取决于所期望的性能特征而变化。例如,为了排除流体从治疗区域的某些部分的递送或抽出,可从装置的相应部分中的通道壁排除孔。而通道壁孔可仅沿着期望通道的将治疗流体递送至特定区域的特定部分设置,例如,有对于特定诸如神经或器官的表面的针对性的疼痛缓解。
在用单个片材围绕桁架裹绕的实施例中,可在柔性片材中设置多个孔,例如布置成一排或多排的孔。在仅提供单排的情况下,孔可以比具有两排或更多排的实施例的孔更大,以提供相似的流体流入或流出通道的速率。例如,图24示出了具有单排孔2825的通道,其中孔2825大于图25的具有两排通道孔的实施例中的孔。在图24所示的实施例中,孔2825的表面积约为通道壁2717的表面积的50%。然而,应当理解的是,在替代实施例中,在通道壁的包括孔的部分中,孔的表面积可以为通道壁2717的表面积的约20%至约70%,优选地为约30%至约60%。
因为该装置是生物可吸收的并且不需要移除,所以通道壁孔2825、2925的尺寸和间隔不受到在移除时限制组织的创伤的需要的限制。现有的具有孔的可移除引流件必须对通过装置壁孔的流体转移的需求以及减少移除过程中对患者造成的伤害的需求进行平衡。因此,现有的引流装置限制了通道孔的尺寸,以使通过孔的组织向内生长最小化,因为向内生长与移除装置时的创伤增加相关联,并导致装置阻塞,孔的这种尺寸减小降低了这种装置对流体进行引流的效率。相反地,在本装置中,孔下方的桁架减少了组织向通道中的可能导致阻塞的向内生长,同时允许流体通过桁架构件的相邻部分之间的间隙进入或排出。
如上所述,桁架103、203、303等可限定有单个通道等或者例如作为分支结构的多个互连的通道。将理解的是,本发明的一些装置将包括许多用于流体流动的通道,例如3、4、5、6、7、8、9、10个或更多个通道,而本发明的一些装置可仅包括1个或2个通道。图4和12a至18a示出了具有分支结构的各种实施例这种,其中多个副通道109b、1309b、……、2209b在一个或多个毂部或接合部110、1310、……、2210处从主通道109a、1309a、……、2209a分支。副通道沿不同方向朝向治疗部位的周界延伸。副通道的横截面面积可小于主通道,和/或通道中的一个或多个可沿着通道的一部分渐缩。
该装置能够可选地包括在相邻通道之间的生物可吸收幅材1322、……、2222,以维持通道的相对位置并提高植入装置或辅助的容易性。如在图12a至18b中所示的实施例中,可以由柔性片材1319、……、2219和1321、……、2221中的一个或两者来提供幅材1322、……、2222。
通常,包括幅材不期望地增加了装置的表面积,并且这可能对在死区内相对的组织面的并置产生障碍,因此阻止了先前分开的组织的愈合和随后的重新连接。为了使幅材的生理影响最小化,可在幅材中设置孔1627、1727(见图14b和14c)。除了减小幅材的表面积之外,这些幅材孔1627、1727通过用于加速愈合的装置有利地允许组织与组织之间的接触或组织并置。
在替代实施例中,该装置可以是单通道装置3401、3801。单通道装置3401、3801可以是细长的并且是柔性的,使得外科医生可以根据需要将装置3401、3801弯曲和构造为适配在治疗部位3402内。例如,该装置可以如图29至32和图37a至38b所示的弯曲形状而向后和向前弯曲到其自身上,或者形成为盘绕件或其它合适的形状。除了所示的弯曲结构之外,许多潜在的结构也是可能的,例如用于乳房切除术的三角形构造、例如用于创伤部位环形、椭圆形或不规则形状。该装置还能够以线性构造使用,具体的是在例如剖腹产、开放式腹壁修复中用于在切口线下皮下定位,或以用于t形切口的t形构造而被使用。各形状的组合可例如通过将多个装置联接在一起以治疗体内的多个部位来利用。
单线形状还可以在微创外科手术程序(例如腹腔镜)中很好地起作用,比如在腹腔镜手术中,它可以作为预防性或回顾性治疗血清肿的手段,或作为周期性注入药物治疗感染或疾病的手段等来在手术后进行部署。
如图38a和38b所示,单通道装置可包括例如在连续的通道弯曲之间的幅材或凸片3822,以将通道保持在期望的构造中并提高植入装置的容易性。优选地,该装置构造和布置成,使得通道的一个或多个部分定位在治疗部位的周界附近。在所示的实施例中,单通道装置具有恒定的通道直径,但是在替代实施例中,通道直径可变化,例如,它可渐缩以使其一端变窄。
装置的类型和大小将根据治疗部位的特征进行选择。例如,带分支的实施例可适合于具有相对大的表面积的治疗部位。在一些情况下,将期望所构造的装置具有大体上宽的形状,使得用于流体流动的一个或多个通道在最大可能的范围内横跨治疗部位的区域分布。在其它情况下,片材的形状可以是长而窄的,例如以恰好位于手术切口线的下方。
可选地,可通过可移除的定位仪器或装置将装置暂时保持在期望的构造中,该可移除的定位仪器或装置可在植入和固定在位时调节装置的形状以适合治疗部位的区域。
可选地,一个或多个通道或该装置可被布置成,在通道或装置被阻塞的情况下提供一个或多个替代的流动路径。图37a至图38b示出了具有单个通道的示例性装置,该单个通道以蜿蜒的方式构造,其中通道3841、3843的在相邻弯曲部处的部分紧密地布置。参照图37b,如果通道经历沿着主流动路径f的局部阻塞3840,则流体可在相邻弯曲部处的通道3841、3843的部分之间流动以建立替代流动路径xf。
该装置具有与装置的一个或多个通道流体连通的端口111,使得引入任何一个通道的流体将朝向端口111流动和从端口111流出。对于具有如图4和12a至18a中所示的具有多个副通道109b、1309b、……、2209b的分支结构的装置,将理解的是,副通道将在端口上游汇聚成主通道109a、1309a、……、2209a,其中端口位于主通道上。
该端口可构造成用于患者体内或体外的位置处,例如在患者皮肤的外表面上,或者在其它方面在患者身体外部靠近身体中的手术开口的位置。在端口位于内部的情况下,在使用时,装置的主要结构将位于治疗部位处,并且端口将位于治疗部位的内部或者替代地在治疗部位的边缘附近,或者相反地定位在身体其它部位的较远位置处。端口111可仅由在桁架或通道的端部处的开口组成,用于与来自负压或正压源13的导管14连通。在装置2501、2601、3101的一些实施例中,桁架2507、2670、3107延伸超出一个或多个柔性片材,并由导管2514、2614、3114接纳(参见图21、22、27a和27b),以将导管联接至通道。如图21、27a和39a至40c所示,当导管附连于桁架时,它可邻接柔性片材的边缘,或者可在片材下延伸(图22)。替代地,端口可包括增强导管与装置之间的联接的特征。例如,装置桁架的形状、直径和/或构造可在端口附近改变。参照图27b,作为一种示例,桁架3307可包括与端口相邻的长度段3346,该长度段3346具有增大的直径以与供应导管3314形成可释放的连接,其中供应导管3314被接纳在桁架3307内部中。桁架节距可在该区域3346中改变,以确保连接具有适当的机械性能,例如,所需的强度和刚度的增加。桁架3307优选地包括过渡区域3345,在过渡区域3345中节距的变化和直径的变化是逐渐的。
替代地,如图39a至40a所示,设备3901可包括桁架3907的一部分3946,该部分3946延伸超出待由导管3914接纳的一个或多个柔性片材3919,以将装置3901可释放地联接至导管3914。在该示例性实施例中,导管3914包括两个内腔,即主内腔和副内腔3947。将主内腔和副内腔3947分开的内壁或挡板可终止于桁架3907的联接部分3946的端部附近。然而,导管3914优选地包括在该点之前的流动引导特征部、例如呈导管壁中的凹部/通道的形式、或唇部或挡板的形式,以将流体从装置通道3909引导到副内腔3947中,从而减少堵塞的发生。副内腔可用于经由装置3901将流体滴注至治疗部位,或有助于测量治疗部位处的诸如压力或温度之类的参数。
图40a至40c示出了在该示例性实施例中从桁架移除导管3914的过程。如图40a所示,当导管3914联接至桁架3907时,导管的与桁架3946重叠的部分扩张以适配在桁架上,使得导管的直径与桁架重叠的区域更大。在导管的壁中的导管的联接区域中设有多个狭缝3948,以促进导管3914在桁架上的扩张。狭缝沿着导管壁纵向地延伸,并且可绕导管的周缘设置,或者仅在导管的特定区域中、例如在顶部和底部区域中设置,其中在导管壁的期望更大的扩张的区域中设置有更多的狭缝。这些狭缝3948用于促进椭圆形桁架3907与具有不同横截面形状的导管、例如圆柱形导管之间的联接。导管的扩张部分向桁架3907施加压缩力以形成牢固的连接。
如图40b和40c所示,为了从桁架3907移除导管3914,导管沿纵向方向被拉离桁架。当导管壁滑出桁架的端部时,狭缝3948协助进行移除,壁中的狭缝3948闭合并且导管壁收缩,直到它们基本上恢复到其原始形状和尺寸。导管壁优选地包括诸如硅树脂之类的弹性材料,以帮助将扩张的导管部分恢复到其原始尺寸并确保牢固的连接。
将理解的是,可以理解和设想将包括附加的保持特征的装置联接至供应导管的其它方法。例如,导管的内表面可以是带螺纹的或具有用于与桁架进行附加的配合以防止意外断开的突起/棘爪。第二种保持方法可包括利用经过导管的内腔并穿过桁架构件和导管的界面的线或缝线的环来提供牢固的连接,可以通过拉动线环以释放连接来简单地释放该连接。
如图13和18所示,在端口意在位于外部并且桁架的各个部分将不由组织围绕的实施例中,可将柔性片材或多个与端口相邻的部分切掉。
该装置可包括一个或多个特征部以相对于软组织固定该装置。图28a和28b示出了具有可吸收的锁定部件3226的实施例,该可吸收的锁定部件例如包括围绕装置3201裹绕的聚合物材料的箍套。组织保持倒钩3228从箍套突出,以用于将装置3201固定至治疗部位处的软组织。
外部定位的端口可具有与上述关于内部定位的端口的形式类似的形式。有利地,当完成流体递送的流体引流功能时,导管可以与外部定位的端口脱开,并且该端口可以通过外科手术开口插入体内以及该开口通过外科手术闭合。由于整个装置是由生物可吸收的材料形成的,因此随着时间的流逝,端口将随身体一起与装置一起被吸收或重塑。替代地,可将装置的端口切除或以其它方式从装置上移除,然后通过手术将手术开口闭合。
上述装置旨在用于将流体从患者体内的治疗部位引流或将流体递送至患者体内的治疗部位的系统中。在图2a至4、29至32、35a至36b和41至42中示出了示例性系统。该系统包括导管3414,该导管3414可释放地联接于装置3401的端口3411或不透流体的敷料,或者联接于位于患者身体外部的贮存器3429,该贮存器与导管3414流体连通以用于从导管接纳流体。替代地或附加地,系统可具有保持治疗流体的贮存器3437,用于将流体递送至导管3414。压力源3413联接于导管3414,用于将正压或负压递送至装置3401。
在一些实施例中,端口3411可联接于位于皮肤3406的外表面上的不可渗透的敷料3433,该敷料3433围绕皮肤的切口提供气密密封,以及导管可释放地联接于该敷料的替代方式。在图2a中示意性地示出了一种示例性系统,该系统提供了腹腔108的剖视图,其中装置101放置成与肌肉103相邻以从皮下积液105移除流体。装置101的端口111示出为从皮肤106的外表面突出并且被覆盖并连接于不可渗透的密封敷料112,该不可渗透的密封敷料112可释放地联接于呈管114形式的导管,该导管与负压或正压源113连接。装置101和桁架107从皮肤106的外表面穿过皮下组织104而继续到达治疗部位102,在该部位处装置101与皮下积液105或死区以及肌肉组织103两者接触。装置101内的通道109在皮下积液105与装置101的端口111之间提供流体连通。在替代实施例中,端口111可替代地是内部的,例如设置在治疗部位102的边缘附近。
参照图29,替代地,导管3414与端口3411之间的联接部可设置在患者体内,如图29至32的实施例所示。在该实施例中,装置3401定位在皮下组织或者皮下和肌肉组织3404的层底下。用于该系统的压力源3413还可用于向伤口敷料3436、例如手术切口3434上的敷料施加压力。在图30a和30b中示出一种这样的系统,其中连接件3435将用于敷料3436和引流装置3401的相应导管联接至压力源3413和导管3429。
压力源3413能够向装置3401递送负压,使得流体从治疗部位3402引入装置3401,并通过导管3414转移至贮存器3429,或者能够向装置递送正压,使得贮存器中的流体通过导管转移到装置中并到达治疗部位。在附图所示的实施例中,流体流动路径由流动箭头f指示。
压力源将典型地是用于将流体从贮存器泵送到装置3401中以递送至治疗部位的泵,或者是用于施加负压以将流体从治疗部位3402引流的真空泵3413。该泵可以例如使用挤压球来进行手动操作,也可以是电子控制的,以将流体更精确地递送到位。
在将流体递送至治疗部位的系统中,待递送的流体可包含一种或多种营养物、诸如触变凝胶之类的“可流动的流体”或仍可以经由导管进行输送的高粘性流体、用于促进伤口愈合的细胞悬浮治疗剂。可以有利地定制本文描述的装置以针对任何给定应用场合来调节该装置在原位起作用的持续时间。例如,通过调节壁厚或桁架构件的厚度或密度。
iii.制造方法
图33a至33d示出了形成具有两个螺旋形桁架构件3515a、3515b的桁架的示例性方法的步骤。在图33a中所示的第一步骤中,缝线或其它可生物吸收的聚合物细丝形式的第一桁架构件3515a在一端处由夹具3544夹持,并以螺旋方式以第一节距长度p1围绕杆状心轴3530卷绕。然后,两个细长支承构件3516在其端部处也由夹具3544夹紧,并沿着心轴的相对侧放置在螺旋形桁架构件上。然后,第二桁架构件3515b由夹具3544夹持,围绕第一螺旋形构件3515a、支承构件3516和心轴3530卷绕,如图33c所示。然后加热心轴3530或环境,从而导致支承构件在它们重叠的点处融合至第一螺旋形构件。如图33d所示,允许桁架3507冷却,设定桁架构件的形状,然后将夹具3544和心轴3530移除,从而留下空心桁架3507。显而易见的是,方法步骤的顺序可以变化,并且并非所有步骤都是必需的。
图34a和34b示出了其中连续制造桁架的替代示例性方法。如图34a所示,沿着心轴3630的相对侧馈送两个细长的支承构件3616,然后将桁架构件3615围绕支承构件3616卷绕,其中该构件的一部分3607a通过局部施加或加热而附连于支承构件3616,或者相对于心轴3630被夹紧或以其它方式固定。当卷绕桁架构件3615时,在桁架构件3615、3616的顶点3618附近局部地施加热量以将桁架构件和支承构件结合在一起。允许桁架3607冷却,从而在将桁架从心轴3630脱离之前设定桁架构件3615的螺旋形状,然后继续进行该过程。
在替代实施例中,比如具有图5a至图11b的桁架和片材布置的那些装置中,可以将一定长度的生物可吸收的弹性线或条带、例如缝线纺织或缝制到或穿过至少一个柔性片材以形成桁架。例如,通过机器在杆上缝制曲折形针迹以提供产生通道的三维形式。用于产生机器缝制的曲折形针迹的上线和下线可具有不同的规格或厚度,以有助于针迹的互锁。使用曲折形针迹构造的实施例可包括附加的下部片材221、321(参见图5a和5b),以防止在制造期间撕裂。
iv.材料
本发明的装置由生物可吸收材料形成。典型地,将使用两种类型的生物可吸收材料,一种用于柔性片材和任何幅材,另一种用于桁架。
在本发明的一些实施例中,柔性片材由ecm形成。ecm片典型地是基于胶原的可生物降解片,其包含天然结构和天然浓度的高度保守的胶原、糖蛋白、蛋白聚糖和糖胺聚糖。ecm可以从各种来源获得,例如,从饲养用于肉类生产的动物(包括猪、牛、羊或其它温血脊椎动物)获得的真皮心包或肠组织。
适用于本发明的ecm组织包括天然相关联的ecm蛋白、糖蛋白以及根据ecm的来源在ecm内天然发现的其它因子。ecm组织的一种来源是温血脊椎动物的前胃组织。适用于本发明的ecm可以是网状片材或海绵片材的形式。
前胃组织是用于本发明的ecm组织的优选来源。合适的前胃ecm通常包含反刍动物前胃的粘膜下固有层。在本发明的具体实施例中,粘膜下固有层来自前胃的瘤胃、网胃或瓣胃。这些组织托架通常具有波状的内腔表面。在一种实施例中,ecm组织包含脱细胞的组织,包括上皮、基底膜或肌膜的部分及其组合。组织还可包括一种或多种原纤维蛋白,包括但不限于胶原蛋白i、胶原蛋白iii或弹性蛋白及其组合。根据脊椎动物物种的来源,已知这些片材的厚度和定义各不相同。
在美国专利第8,415,159号中描述了根据本发明制备供使用的ecm组织的方法。
在本发明的一些实施例中,可使用聚合物材料的片材。聚合材料可以是片材或网状件的形式。诸如聚乙醇酸、聚乳酸和聚卡普隆-25(poliglecaprone-25)之类的合成材料在短期内会提供附加的强度,但在长期内将会吸收。或者,聚合材料可以是天然材料或衍生自天然材料,比如蛋白质(例如胶原蛋白)、多糖(例如藻酸盐)和糖蛋白(例如纤连蛋白)。
将理解的是,形成桁架的桁架构件将由具有一定程度的柔性的材料形成,以允许装置符合治疗部位的轮廓,并且将具有足够的结构强度和完整性以保持两个表面间隔开,并由此允许通道形成。这种材料的结构完整性和最终形状还将在任何情况下装置扭结或受挤压时提供恢复流体流动通道的手段。例如,桁架构件可包括由诸如聚乙醇酸(pga)、聚乳酸(pla)、聚乙醇酸-聚乳酸共聚物,p4hb(聚4-羟基丁酸酯)、聚己内酯或聚二恶烷酮之类的生物可吸收材料制成的一定长度的缝线、线、绳或条带。
v.生物活性物质的递送
可以将任何期望的生物活性分子掺入ecm或聚合物材料或桁架构件材料本身中。合适的分子包括例如小分子、肽或蛋白质,或其混合物。生物活性材料对于ecm可以是内源性的,或者可以是在移植物制造过程期间或之后结合到ecm和/或聚合物材料中的材料。在一些实施例中,可以将两个或更多个(例如2、3、4、5、6、7、8、9、10或更多个)不同的生物活性分子非共价地结合到ecm或聚合物中。生物活性分子可以作为悬浮液、压封的颗粒、微粒和/或胶体或它们的混合物非共价地结合到材料中。生物活性分子可以分布在ecm/聚合物材料之间。生物活性物质可以包括但不限于蛋白质、生长因子、抗菌剂和抗炎药,包括强力霉素、银、fgf-2、tgf-b、tgf-b2、bmr7、bmp-12、pdgf、igf、胶原蛋白、弹性蛋白、纤连蛋白和透明质酸。
vi.手术放置
在图4中最佳地示出了该装置的外科手术位置,其中装置101示出为固定于例如腹部内的肌肉103。装置101的端口111示出为从与主手术切口134分开的切口142离开,并允许将装置101放置在皮肤106的外表面上。装置101的用于分开装置层119、121的结构在皮肤106的外表面上可见,并且在该具体视图中,该装置101示出了穿过组织104的皮下层,其中装置101的下表面固定于下面的肌肉103。
图2a示出了装置101的端口111由不可渗透的气密皮肤敷料112覆盖的示例,该敷料112提供了围绕图4所示的装置和离开切口142的气密密封。不可渗透的密封敷料还提供了将管114可释放地连接至负压或正压源113的手段,以便交换来自源或治疗部位102的流体。根据临床应用场合,主手术切口通常覆盖有可透气或不可渗透的敷料(未示出)。
替代地,该装置可以放置在打开的伤口的底部,并与敷料结合使用。图41和图42是利用具有椭圆形桁架3907和通道3909的装置3901放置在打开的伤口中的示例。装置3901在皮下组织4004内定位在暴露出的肌肉4003的表面处或附近,以产生引流通道3909。负压可施加至装置3901,以在伤口愈合时从通道3909抽吸流体。
在图41的示例4034中,将空气阻塞敷料4039施加在伤口的其余暴露区域上,以允许经由装置3901向治疗部位施加负压,同时还保护伤口的暴露表面。可选地,负压伤口敷料4139可施加在伤口上,与装置3901流体连通,如图42所示。在图42所示的实施例中,泡沫敷料放置在装置3901上的伤口中,而密封敷料4112放置在皮肤上和伤口周围。
vii.治疗流体的滴注
在手术切除癌性组织后或关注持续感染的许多临床程序中,期望在手术后可控地向治疗部位滴注可流动的基于细胞的流体并使其剂量化。精确控制各种参数(例如剂量浓度、收缩时间、剂量体积和治疗部位的位置)的能力也提供了优于现有药物洗脱或剂量植入装置的优势,这些装置通常依赖于材料的降解特性来确定剂量分布。
以下的附图31、32和示例5描述了能够以精确且有针对性的方式将治疗流体滴注至治疗部位的实施例。例如,该流体可包括衍生自ecm、透明质酸、有助于愈合的生长因子的可流动凝胶、用于治疗感染的抗微生物药、用于缓解疼痛的镇痛药(例如芬太尼或吗啡)和抗炎药(例如酮咯酸或双氯芬酸),不过可以设想其它流体,并且对于技术人员而言是显而易见的。
滴注含有丰富血小板的血浆、干细胞、基质细胞、角质形成细胞、淋巴细胞、骨髓抽吸液,血清和树突状细胞的自体或同种异体细胞疗法可协助伤口的修复和愈合。
例如,肠干细胞的滴注可以帮助治疗炎症性肠病,而部分或完全胰腺切除术后滴入胰岛细胞可以帮助修复和再生受损组织。
滴注化学治疗药物还可以帮助对可能无法操作的癌细胞进行局部治疗,或者可以在切除癌组织后用作总体治疗方案。
示例
示例1:闭合手术切口下方的皮下组织死区
在涉及大量用于贮存脂肪的(脂肪)组织的手术中,在闭合的手术切口下对皮下组织的治疗可能在临床上具有挑战性。已知脂肪组织在保持缝合能力方面的机械强度较差,皮肤与基础肌肉之间距离的增加会导致死区的形成,死区会在手术后集聚流体,从而可能导致以后的并发症,比如伤口裂开和手术部位感染。下面给出的示例演示了如何利用该装置消除手术切口下方的手术死区。
在图35a和35b的剖视图中最佳地示出了该装置的手术放置,其中,该装置3701示出为在皮肤切口3734下方的治疗部位3701处固定于肌肉3703。植入的治疗装置3701示出为包括空心桁架3707,该空心桁架3707由单层ecm或聚合物材料围绕,以限定出通道3709,从而允许流体在治疗部位3702与联接于装置的负压源之间通过(联接件未示出)。如图35b所示,一旦施加负压或抽吸,就将来自治疗部位3702的流体f引向装置3701,从而导致皮下组织内死区的减少和闭合,以产生先前分开的组织3704的两个相对面的并置3739。
示例2:手术切口的双重管理
将负压施加至主手术切口的表面的局部施加伤口治疗的装置已被广泛用于预防诸如伤口开裂和手术部位感染之类的手术并发症。这些局部施加装置主要通过提供辅助机械保持来减少主缝线上的张力,并通过覆盖和移除来自皮肤的多余的渗出液来防止浸软和感染,从而协助愈合。
尽管这些装置已证明可以有效地支持皮肤切口的愈合,但它们无法有效地处理较深的皮下组织的死区,特别是那些经受了大量破坏、分开或切除的皮下组织,而这些组织与皮肤切口相比通常需要更长的时间来治愈。在这些情况下,可以利用植入的治疗装置3701和局部施加伤口治疗的装置3736的组合系统来消除内部治疗部位的死区,同时管理外科手术皮肤切口3734的愈合。
在图36a和36b的剖视图中最佳地示出了组合的局部和植入的治疗系统的手术放置。装置3701示出为在皮肤切口3734下方的治疗部位3702处固定于肌肉3703。植入的治疗装置3701包括桁架3707,该桁架3707由单层ecm或聚合物材料围绕,以限定出通道3709,从而允许流体在治疗部位3702与负压源之间通过。局部施加伤口治疗的装置3736定位在皮肤切口3734上,以允许同时治疗切口伤口。
如图36b所示,一旦朝向植入的治疗装置3701施加负压或抽吸,就将来自治疗部位3702的流体f引向装置3701,从而减少和闭合皮下组织内的死区,以产生先前分开的组织3704的两个相对面的并置部3739。
附加地,在图30a和30b中示出了组合治疗系统的示意图,其中已将植入的治疗装置3401定位并固定在体内的治疗部位3402处,并且将局部施加伤口治疗的装置3436应用于皮肤切口3434。图30a示出了治疗部位3402位于皮下组织3404层之下,皮下组织3404层可以在由脂肪组织、肌肉、骨骼、肌腱或这些组织的任何组合组成的部位处。
参照图30b,治疗部位3402可以包括皮下组织3404内的死区,其定位在皮肤切口或用缝线或u形钉闭合的主皮肤切口3434的下方。在图30a和图30b中,所植入的治疗装置3401和局部施加伤口治疗的装置3436已经联接于经由管连接件3435彼此连接的管道上,以通过压力源3413提供的负压或正压将流体传送至伤口和从伤口传送流体。压力源3413还包含合适的贮存器3429,用于存储从治疗部位抽取的流体或可选地用于供应至治疗部位的流体。
在两个图中,植入的治疗装置3401是布置成弯曲构造的单通道装置,以允许装置3401在大面积上有效地递送治疗。然而,可采用其它装置类型或构造。
示例3:桁架部件的制造方法
以上参照图33a至33d大致描述了制造装置桁架部件的一种示例,其中桁架构件3515a、3516和3515b在其第一端处被夹紧,紧密地围绕中央心轴3530卷绕,并且在其相对端处被夹紧。
此时,将整个组件在约120℃的温度下放置在烘箱中约5分钟,以使桁架构件3516、3515a、3515b的所有相交顶点3518结合在一起。如图33d所示,一旦形成了充分的结合,就将组件从烘箱中取出,并使其冷却,然后移除两个夹具3544,并移除中央成形心轴3530,从而使装置桁架3507成为单个弹性而又柔韧的部件图。
在该示例中,第二(外部)桁架构件3515b以与第一桁架构件的节距不同的连续节距以3.5:1的比率缠绕。
在该示例中的桁架构件包括直径约为0.4毫米的usp尺寸#0的生物可吸收的聚二恶烷酮单丝缝线材料,但是该方法可以用于具有任何材料类型的任何直径的缝线。对于不同的实施例,例如,根据桁架构件的尺寸和材料特性以及桁架构件的数量,烘箱温度和施加热量的时间将变化。对于该示例,选择单丝缝线以提供形成弹性而又柔韧的最终桁架结构所需的合适刚度,但是取决于所需的结构和桁架特性,可以使用单丝或编织或两种类型的细丝的任意组合。
示例4:以连续制造方法制造桁架部件的方法
以下给出了在连续过程中制造桁架的另一种方法。参照图34a,两个纵向“支承”桁架构件3616沿着中央成形心轴3630被馈送。第一桁架构件3615通过局部施加热量来沿着端部3607a附连于两个纵向“支承”桁架构件3607a。该区域的后续冷却完成了该局部截面的熔合,以将桁架构件锚定在一起,从而允许旋转卷绕馈送机在沿着中央成形心轴3630馈送时连续地将第一桁架构件3615围绕中央心轴3630和支承桁架构件3616裹绕。
当第一桁架构件3615被卷绕时,热量被局部地施加至组件的一个区域以结合桁架构件3615、3616的相交顶点3618。如图34b所示,一旦施加足够的热量,成形桁架3607就被冷却并脱离中央心轴53,以允许连续过程继续进行。
示例5:通过向治疗部位供应流体和从治疗部位移除流体来治疗伤口部位
将药物和流体给药到体内目标治疗部位的能力已成为医学领域的一个重要工具,具体地是用于治疗疼痛、局部感染或疾病。尽管药物常规给药在全球许多患者中很常见,但治疗时间从短的到有终身依赖的患者可能有很大的不同。
本文公开的装置的一方面是能够在规定的接触时间内将植入的装置联接至治疗流体的来源,例如抗生素药物、可流动凝胶、基于细胞的流体和止痛药物。这种治疗系统的示意图如图31所示。在该示例中,治疗部位3402定位在皮下组织3404下面或者皮下组织3404和肌肉组织的组合下面的隔离的局部区域中,其中植入物治疗装置3401在该治疗装置的一端处经由导管3414可释放地连接于治疗流体源3437,而该治疗装置3411的另一端可释放地连接于负压源3413。
植入的治疗装置3401还示出为在通道壁中包含多个孔3425,以允许流体通过装置表面3419从装置中流出。通道孔3425的定位对于将药物受控地给药至期望的治疗部位3402特别重要。虽然所示的植入的治疗装置3401沿着装置3401的大部分长度具有通道孔3425,但是可调节这些孔的位置和频率以适合治疗部位3402。
在该示例中,负压源3413能够以连续、间歇、不断变化或不连续的模式操作,其中所施加的负压可以在0毫米汞柱至200毫米汞柱的范围内或在操作期间的任何规定水平之间循环。可以通过打开治疗流体贮存器3437上的阀或将流体注入治疗贮存器3437中来进行药物的滴注,其中负压源将把治疗流体引向负压源3413。药物与治疗部位接触的时间可以通过在压力源3413处负压的操作来控制,可以停止该负压以将药物静态地保持在装置3401的通道内。
替代地,可以通过将治疗流体贮存器3437注射或连接至无菌盐水或其它流体源以清除管路中的任何治疗药物来控制药物的给药。
本说明书中对现有技术文件的任何引用均不应被认为是承认该现有技术是本领域公知的或形成本领域公知常识的一部分。
如本说明书中所使用的,词语“包括”、“包含”和类似词语不应以排他性或穷举性的意义来解释。换言之,它们旨在表示“包括但不限于”。
尽管已经通过示例的方式描述了本发明,但应当理解的是,在不脱离权利要求所限定的本发明的范围的情况下,可以做出各种变化和修改。此外,在具体特征存在已知等同物的情况下,这些等同物被并入,就如同在本说明书中具体提及一样。
- 还没有人留言评论。精彩留言会获得点赞!