干式植入物组合物和可注射的水性植入物制剂的制作方法
背景技术:
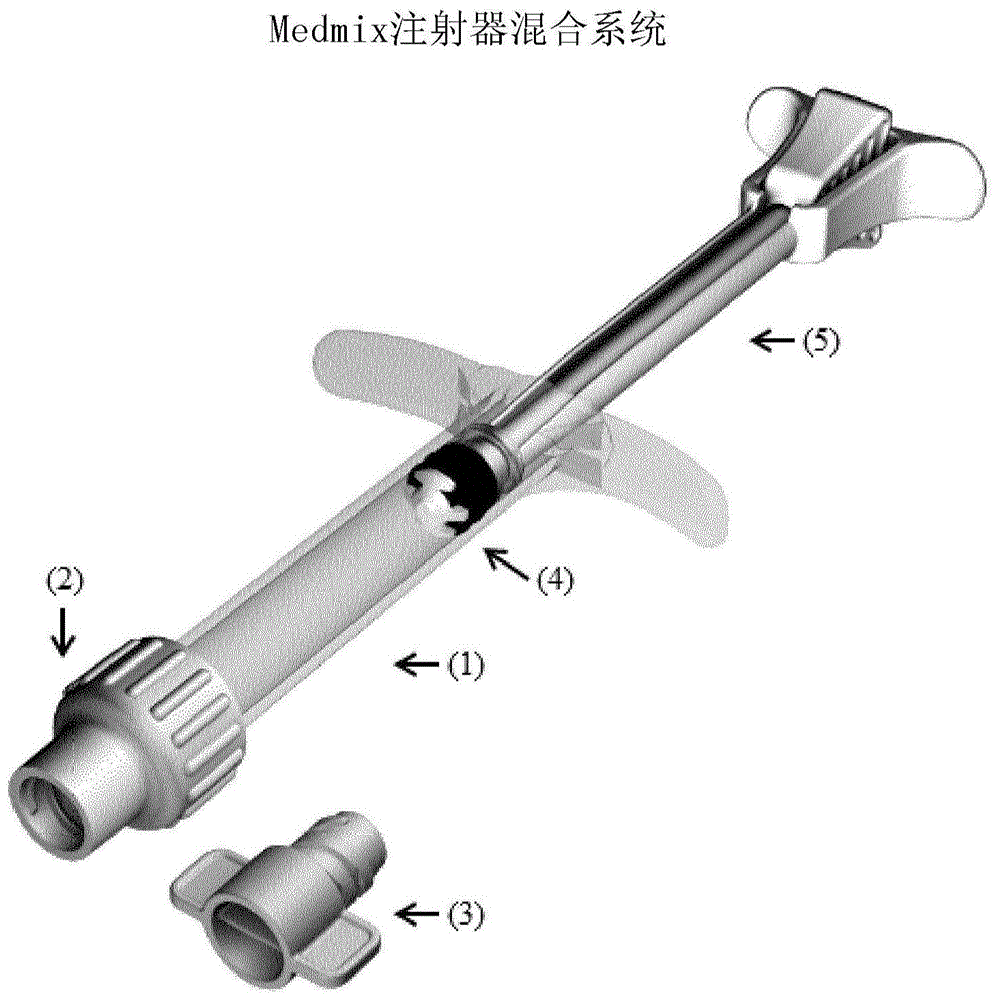
:本发明涉及一种新型干式植入物组合物,其用于制备新型可注射的水性植入物制剂,该制剂可用于组织再生,特别是口腔组织再生,特别是在牙槽骨、根牙骨质(rootcementum)或牙周膜(pdl)的再生中,其易于通过锥形系统和18号规格套管注入牙周袋,以及涉及使用该干式植入物组合物制备的新型可注射的水性植入物制剂,用于制备所述新型可注射的水性植入物制剂的方法和试剂盒。牙周疾病的风险因素很多,诸如口腔卫生差、吸烟、糖尿病、肥胖、遗传倾向、年龄和社会经济状况,这些因素会促进细菌的积累,生物膜的形成和牙龈沟的感染,从而导致牙龈感染的形成或牙龈炎。如果不及时治疗,炎症会沿着牙根发展,并引起pdl和周围的牙槽骨的破坏,这被称为牙周炎。随着牙周疾病的发展,在牙齿和软组织之间会逐渐形成小窝,并不断增长,直到牙齿失去稳定性并可能脱落。牙周疾病的临床症状是软组织发炎,(组织)探查出血,可能伴有化脓和牙槽骨的放射照相损失。牙医可以使用探针测量牙周袋的深度(即软组织或骨骼与牙齿之间的深度)来确定牙周疾病的存在和程度,这指的是临床(牙齿)附着的丧失。引导组织再生(gtr)是一种广泛用于治疗牙周结构损失的外科手术。在此过程中,牙周医师可通过切开软组织以提起皮瓣而接近患病的牙根和周围的骨头。下一步是使用合适的手动器械、超声波或激光设备对患病的骨头、软组织和根部表面进行清创,其中去除患病的组织,并剔除和刨平根表面。清创后,较大的骨缺损将被骨再生材料填充。引导的组织再生屏障(如ep-b1-1676592中描述的,可从geistlichpharmaag购买的geistlich)被置于骨再生材料上较深的骨缺损中。牙周医师通过适当的缝合线关闭皮瓣。然后,重新形成骨与齿之间的牙龈、上皮附着、骨和牙周附着。尽管此方法有效,但在牙龈上切开会导致患者不适、疼痛、肿胀、牙龈退缩、牙齿敏感、愈合时间长并增加了再次感染的可能性。许多天然和合成材料及组合物已被用作骨缺损部位的骨再生材料。geistlich是一种众所周知的天然骨传导性骨替代材料,可促进牙周骨缺损中的骨骼生长,可从geistlichpharmaag购买。该材料是通过美国专利号5,167,961和5,417,975中所述的方法由天然骨制成的,该方法能够保留天然骨的小梁结构和纳米晶体结构,从而获得出色的骨传导性基质,该基质未被吸收或吸收得非常缓慢。为了减少与牙龈中的切口相关的上述缺点,需要一种可注射的植入物制剂。为了方便患者将其注射到牙周袋中并使用注射器方便地手动注射,可注射的水性植入物制剂应可通过直径不大于18号规格(内径0.838mm)的套管或针头的套管挤出,优选用不超过60n的力挤出。为了最佳的口腔组织再生,特别是用于牙槽骨、根牙骨质或牙周膜的再生,期望的是,注入的植入物制剂提供羟基磷灰石和胶原的基质,其接近发生这种再生的天然体内环境。与合成(非生物)羟基磷灰石或陶瓷相比,源自天然骨的羟基磷灰石更接近发生再生的自然体内环境。与通过研磨合成的羟基磷灰石或陶瓷获得的圆形颗粒相比,通过研磨来自天然骨的羟基磷灰石获得的颗粒具有更不规则和纵向的形状:因此,它们存在堵塞18号规格套管的更高风险。参见图5,其在左侧代表来自天然骨的纳米晶体羟基磷灰石颗粒的扫描电子显微照片(sem),在右侧代表合成的β-tcp颗粒的sem。因此,含有合成羟基磷灰石或陶瓷颗粒的制剂通过套管挤出的结果仅部分预测了含有来自天然骨的羟基磷灰石颗粒的类似制剂的挤出。人类天然骨骼的一个重要特征是羟基磷灰石晶体的形态和非常小的尺寸(纳米尺寸),这对于人类骨骼矿物质而言是:六角形空间群p63/m,约为30nm至50nm长(c轴:[0,0,1])和14nm至25nm长(a和b轴:[1,0,0]和[0,1,0])。参见weiner,s等,1992,faseb,6:879-885。为了更接近发生再生的自然环境,因此期望使用来自天然骨的纳米晶体羟基磷灰石颗粒,优选的是其晶体的形态和大小接近于人类天然骨骼的的形态和大小。us2012/0107401描述了可流动的可植入的骨传导性基质,其包含0.1mm至2mm的陶瓷的矿物质颗粒(如合成的羟基磷灰石和β-tcp或来自天然骨的羟基磷灰石),可为人或动物来源的可溶性胶原或不溶性胶原的胶原,以及包括他汀类药物的治疗剂的混合物。那些可流动的可植入的骨传导性基质被教导适合用作可以注射,喷洒或滴注到靶组织部位的油灰或凝胶。陶瓷与胶原的重量比被教导为0.15至22.5(权利要求4)或1.5至11.5(权利要求5),公开的陶瓷与胶原的唯一特定比例为5和4.83(权利要求2和[0089],[0090])。美国专利号7,322,825公开了一种通过将组合物注射到牙周袋中来治疗牙周疾病的方法,该组合物是细磨的尺寸为50μm至400μm的微晶羟基磷灰石骨颗粒与直径小于1mm的“游离胶原蛋白”颗粒的混合物,那些“游离胶原蛋白”颗粒被教导为非交联的胶原蛋白小原纤维或者含有原纤维胶原蛋白和可选地生理相容性增稠剂的凝胶。在通过施加热量(例如通过微波辐照)额外注入能量之后,该混合物仅具有足够低的粘度以通过18号规格(内径0.838mm)针头。根据该专利,交联的胶原蛋白(如avitene或collastat)不能切成足够小的碎片以穿过18号规格针头。对于具体描述的组合物,羟基磷灰石与胶原的重量比为0.5至1.5。美国专利号7’322’825的牙周疾病治疗方法尚未得到广泛应用。诸如“游离胶原蛋白”等非交联胶原蛋白与天然的体内环境相距甚远,天然的体内环境对于口腔组织再生,特别是对于牙槽骨、根牙骨质或牙周膜的再生而言是理想的。美国专利号5'352'715公开了一种用于软组织和硬组织修复和增强的可注射陶瓷制剂,其在可药学上可接受的流体载体中包含胶原蛋白和磷酸钙陶瓷颗粒,其中磷酸钙陶瓷颗粒的尺寸为50μm至250μm,磷酸盐陶瓷颗粒与胶原蛋白的重量比为1/19至1/1,优选为1/4至1/2。根据该专利的教导,磷酸钙陶瓷颗粒优选是非生物(合成)来源的烧结陶瓷颗粒,并且胶原蛋白基本上没有交联,即,缺乏端肽,优选的胶原蛋白是纯化的无端肽的重组胶原蛋白。该可注射陶瓷配方可通过20号(内径0.603mm)的针头。缺乏端肽的胶原蛋白和合成的磷酸钙颗粒的组合与发生再生的自然体内环境相距甚远。ep-0270254-a2公开了一种包含一种混合物的干式植入物组合物,该混合物包含以不含水分的重量计的2%至40%的重构的原纤维无端肽的胶原蛋白(其基本上不交联),和60-98%的尺寸范围为100μm-2000μm的磷酸三钙,例如羟基磷灰石,因此磷酸三钙与无端肽的胶原蛋白的质量比为1.5至49。对该干式植入物组合物进行γ射线辐照,以提高生物学和处理性能。缺乏端肽的胶原蛋白与合成的磷酸三钙颗粒的组合与发生再生的自然体内环境相距甚远。含有胶原蛋白的可注射的水性植入物制剂不能通过γ或x射线辐照灭菌。无菌可注射的水性植入物组合物的长期稳定性(超过6个月)将需要严格的制备和储存无菌条件,而这些条件并不总是容易获得:因此,需要提供一种干式植入物组合物,该组合物长期稳定并且易于通过再水化得到可注射的水性植入物制剂。技术实现要素:本发明的问题或目的是找到一种干式植入物组合物,其可用于制备用于口腔组织再生,特别是牙槽骨、根牙骨质或pdl的再生的可注射的水性植入物制剂,该可注射的水性植入物制剂可以通过锥形系统和18号规格套管挤出,并且不具有现有技术的植入物制剂的缺点。通过改变包含来自天然骨的纳米晶体羟基磷灰石颗粒和天然交联的纤维胶原的超过300种原型的干式植入物组合物的制备方法、成分和比例,并且使用18号规格套管将干式植入物组合物进行再水化和均质混合而获得的制剂进行挤压试验(实施例9中所述),发明人发现了这些干式植入物组合物的特征,其使再水化的且均匀混合的水性植入物制剂通过锥形系统和18号规格套管而出人意料地提供了可挤出性,所述水性植入物制剂提供了接近发生再生的自然环境的基质。该目的是通过所附权利要求书中限定的本发明实现的。本发明涉及:-一种干式植入物组合物,其基本上由尺寸为50μm至200μm的来自天然骨的纳米晶体羟基磷灰石颗粒与通过0.5mm筛的天然交联的纤维状胶原材料的碎片的混合物组成,其中纳米晶体羟基磷灰石与胶原蛋白的重量比为1.8至4.5。-该干式植入物组合物在通过将25-45w/w%的上述干式植入物组合物与药学上可接受的水性载体进行再水化和均匀混合而制备用于口腔组织再生的可注射的水性植入物制剂中的应用,所述可注射的水性植入物制剂可通过锥形系统和规格为18号规格(内径0.838mm)25.4mm长的套管挤出,以及-用于口腔组织再生的可注射的水性植入物制剂,其可以通过锥形系统和规格为18号规格(内径0.838mm)25.4mm长的套管以不超过60n的力挤出,其包含25-45w/w%的上述干式植入物组合物,其用无菌水或无菌等渗盐水溶液再水化并均匀混合。术语“基本上由…组成”是指非常高的比例,通常至少为干式植入物重量的99%由所列举的混合物和至多6%的无机盐例如盐(氯化钠)组成,其他组分,通常最多占干燥植入物重量的1%,是从天然来源中获得的,不会显著影响可注射的水性植入物制剂的挤出行为。此类成分可能是脂肪、硫酸盐灰分、氨基葡萄糖、半乳糖胺和少量残留蛋白质的一部分,如骨膜蛋白、核心蛋白聚糖(decorine)和内腔蛋白(lumican)或类似蛋白质。其他组分不包括任何合成聚合物,特别是任何聚环氧乙烷,任何聚环氧丙烷或任何合成润滑剂。其他组分不包括任何他汀类药物或任何人工羟基磷灰石,即非生物来源的羟基磷灰石。“来自天然骨的纳米晶体羟基磷灰石颗粒”是通过能够保持天然骨的纳米晶体结构的过程而来自天然骨的颗粒。这样的过程必须在足够低的温度下进行,以使天然骨的矿物质部分不会再结晶,通常温度不超过700℃。在美国专利号5,167,961或5,417,975中公开了合适的此类方法:该方法包括通过与氨一起加热来降解脱脂骨中的有机物,通过在低于60℃的温度下用流动水洗涤以提取溶解的降解产物,并在250℃至600℃的温度下在空气中处理骨矿物质,以使天然骨的小梁结构和纳米晶体结构得以保存,从而产生有机杂质或蛋白质含量非常低的纳米晶体羟基磷灰石。可以通过研磨和筛分上述纳米晶体羟基磷灰石来获得来自天然骨的纳米晶体羟基磷灰石颗粒。也可以通过研磨和筛分geistlich小颗粒(获自geistlichpharmaag,ch-6110,瑞士)方便地获得来自天然骨的纳米晶体羟基磷灰石颗粒。适合掺入本发明组合物中的“来自天然骨的纳米晶体羟基磷灰石颗粒”的尺寸为50μm至200μm。实际上,当来自天然骨的纳米晶体羟基磷灰石颗粒的尺寸超过200μm时,通过再水化和均匀混合获得的植入物制剂往往会堵塞18号规格(内径为0.838mm)的注射器套管,并且当来自天然骨的纳米晶体羟基磷灰石颗粒的尺寸小于50μm时,由这些小颗粒引起炎症的风险增加。因此,50μm至200μm的范围大小至关重要。优选地,那些来自天然骨的纳米晶体羟基磷灰石颗粒的尺寸为100μm至180μm。然后将发炎或阻塞的风险降到最低。术语“天然交联的纤维状胶原蛋白材料”是指通过允许保留其端肽结构和大部分天然交联的过程而衍生自天然组织材料的纤维状胶原蛋白材料。这种天然交联的纤维状胶原蛋白材料是一种不溶性胶原材料,其未经过任何酶处理,任何化学交联或任何物理交联(如通过dehydrothermal处理dht,uv照射等)。实际上,后述处理的任一种均可显著改变天然组织材料中存在的端肽结构和/或天然交联。合适地,天然交联的纤维状胶原蛋白材料来自天然来源的组织,其包含50至100w/w%的胶原蛋白和0至50w/w%的弹性蛋白,优选70至95w/w%和5至30w/w%的弹性蛋白,这根据已知的涉及水解和rp-hplc的方法的修改方法,通过去糖胺/碘代己糖测定来测量(参见例如guidae.等,1990,developmentandvalidationofahighperformancechromatographymethodforthedeterminationofdesmosinesintissues,journalofchromatography,或者rodriguqep,2008,quantificationofmouselungelastinduringprenataldevelopment,theopenrespiratorymedicinejournal)。这样的组织的实例包括脊椎动物,特别是哺乳动物(例如猪、牛、马、绵羊、山羊、兔)腹膜或心包膜、胎盘膜、小肠粘膜下层(sis)和真皮。这样的组织优选猪、牛或马。感兴趣的组织是猪、牛或马的腹膜和真皮。优选地,天然交联的纤维状胶原蛋白材料选自下组:猪真皮和猪腹膜或心包膜。通常,胶原蛋白主要是i型胶原、iii型胶原或其混合物。胶原蛋白还可以包括一定比例的ii型、iv型、vi型或viii型胶原蛋白,或者这些或任何胶原蛋白类型的任意组合。通常,天然交联的纤维状胶原蛋白材料包含50至100w/w%的胶原蛋白和0至50w/w%的弹性蛋白,优选70至95w/w%和5至30w/w%的弹性蛋白。来自天然组织的适合的天然交联的纤维状胶原蛋白材料是来自猪、牛或马的腹膜或心包的胶原蛋白膜,其通过类似于ep-b1-1676592的“实施例”中所述的方法制备,包括碱处理、酸处理和有机溶剂处理,然后切成通过0.5mm筛的碎片。来自天然组织的另一种合适的天然交联的纤维状胶原蛋白材料是geistlich(购自geistlichpharmaag),其被切碎成可通过0.5mm筛的碎片。来自天然组织的另一种合适的天然交联的纤维状胶原蛋白材料是通过类似于ep-b1-2654816的实施例7中所述的方法制备的猪真皮,其包括碱处理、酸处理、冷冻干燥和用有机溶剂清洁,然后切成通过0.5mm筛的碎片。有趣的是,天然交联的纤维状胶原蛋白材料包括显示出三重螺旋的成熟胶原纤维,如圆二色性光谱法所示。这样的纤维确实形成了有利于口腔组织再生细胞,特别是用于骨再生的细胞和用于pdl韧带再生的细胞定居的支架。天然交联的纤维状胶原蛋白材料必须存在于穿过0.5mm筛的碎片中。此类碎片通常通过将天然交联的纤维状胶原蛋白通过涉及离心研磨机和筛分胶原蛋白碎片的过程进行研磨而获得。通过0.5mm筛的碎片中存在的天然交联纤维胶原蛋白材料的特性对于通过锥形系统和18号规格(内径00.838mm)的套管进行挤压至关重要。实际上,如对许多原型进行的实验所示,当在干式植入物组合物中使用较大的天然交联材料的碎片时,例如通过0.6mm或0.7mm筛的碎片,通过再水化和均匀混合干式植入物组合物而获得的植入物制剂存在堵塞18号规格套管的很大风险。纳米晶体羟基磷灰石与胶原蛋白的重量比是通过锥形系统和18号规格(内径0.838mm)的套管挤出的另一个关键参数。实际上,如对许多原型进行的实验所示,当纳米晶体羟基磷灰石与胶原蛋白的重量比低于1.8或高于4.5时,通过再水化和均匀混合而获得的植入物制剂不容易注射,通过锥形系统和18号规格(内径0.838mm)的套管挤压所需的力过大。这是一个意想不到的结果,似乎没有直接的解释。挤压所需的力从1.8急剧增加到1.5,但仅从4.5适度增加到6。但是,如对许多原型进行的实验所示,当比率大于4.5时,例如5,挤出植入物制剂所需的力的再现性不足。仅当纳米晶体羟基磷灰石与胶原蛋白的比例为1.8至4.5时,才能达到商业植入产品所需的高重现性。因此纳米晶体羟基磷灰石与胶原蛋白的重量比的范围为1.8至4.5是关键的。优选地,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.5至4.2。在该范围内,挤出所需的力通常较小。最优选地,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.5至4.0。对于具有纳米晶体羟基磷灰石与胶原的重量比的可注射的水性植入物制剂,确实已经发现了以较小的力获得的挤出结果的最高再现性。为了增强可注射的水性植入物制剂的可挤出性,适合的是,干式植入物组合物已经通过γ-射线或x-射线辐照进行了灭菌,使用通常用于灭菌的辐照剂量,通常为27-33kg。实际上,这种处理破坏了天然交联的纤维状胶原蛋白中的某些键,因此有利于其流动性和可挤出性。术语“可注射的水性植入物制剂”是指通过将25-45w/w%的干式植入物组合物与药学上可接受的水性载体再水化和均匀混合而制备的植入物制剂,其能够被方便地注射到人或动物体内,用于口腔组织再生,特别是在牙周袋中,其可以通过锥形系统和18号规格(内径0.838mm)25.4mm长的套管进行挤压。通常,可注射的水性植入物制剂可通过锥形系统和18号规格(内径0.838mm)25.4mm长的套管以不超过60n的力挤出。通常,药学上可接受的水性载体是无菌水、无菌等渗盐水溶液、血液或其部分,通常是患者自己的血液。优选通过将25-45w/w%的干式植入物组合物,更优选30-40w/w%的干式植入物组合物与无菌水、无菌等渗盐水溶液或血液再水化和均匀混合,获得可注射的水性植入物制剂。当使用一定量的干式植入物组合物时,可注射的水性植入物制剂是一种新型制剂,其可以通过锥形系统和18号规格(内径0.838mm)25.4mm长的套管以不超过60n的力从注射器中挤出。当可注射的水性植入物制剂是通过将30-40w/w%的上述干式植入物组合物与无菌水、无菌等渗盐水溶液再水化和均匀混合而获得时,通过锥形系统和18号规格(内径0.838mm)25.4mm长的套管挤出可注射的水性植入物制剂所需的力低于40n,优选低于20n。当可注射的水性植入物制剂是通过将30-40w/w%的上述干式植入物组合物与血液再水化和均匀混合而获得时,挤出在药学上可接受的载体中包含30-40w/w%的干式植入物组合物的可注射的水性植入物制剂所需的力低于45n,优选低于25n。本发明中使用的干式植入物组合物可以通过包括以下步骤的方法制备:(a)提供尺寸为50μm至200μm的来自天然骨的纳米晶体羟基磷灰石颗粒,(b)通过包括碱处理、酸处理和有机溶剂处理并切碎成可通过0.5mm筛的碎片的方法而制备研磨的天然交联的纤维状胶原蛋白材料,(c)将在(b)中获得的研磨的天然交联的纤维状胶原蛋白混合物添加到水性溶液中,剧烈混合以得到胶原蛋白浆料,添加在(a)中制备的尺寸为50μm至200μm的纳米晶体羟基磷灰石颗粒,并剧烈混合,ph保持在4.2至7.5,(d)干燥在(c)中获得的包含纳米晶体羟基磷灰石颗粒和胶原蛋白的混合组合物,和(e)通过γ射线或x射线辐照对(d)中获得的干式植入物组合物进行灭菌。如上所述,来自天然骨的陶瓷的纳米晶体羟基磷灰石颗粒是通过能够保持天然骨的纳米晶体结构的方法获得的来自天然骨的颗粒。可以将通过上述方法获得的高纯度骨矿物质进行研磨和筛分,以具有所需的尺寸。作为另一种选择,可以使用研磨和筛分步骤由geistlich(购自geistlichpharmaag)生产具有所需尺寸的来自天然骨的陶瓷颗粒。可以通过类似于ep-b1-2654815的实施例7中所述的方法制备步骤(b)的研磨的天然交联的纤维状胶原蛋白,该方法包括在水中将猪、牛、马、山羊或兔皮研磨成0.5mm至30mm的碎片,使用水溶性溶剂(如醇或酮)去除水,使用氯代烃(如二氯乙烷或二氯甲烷)或非氯代烃(如己烷或甲苯)脱脂,在高于12.0的ph值下用强无机碱并在0至1的ph值下使用强无机酸处理胶原蛋白,冷冻干燥并清洁海绵的干燥胶原纤维,该海绵是由有机溶剂(如醇、醚、酮和氯代烃)获得的,在真空下去除溶剂,并进一步将清洁的胶原蛋白海绵切碎成碎片,该碎片通过包括离心研磨机和筛分胶原蛋白碎片的程序通过0.5mm筛。也可以通过类似于ep-b1-1676592中所述的方法来制备步骤(b)的研磨的天然交联的纤维状胶原蛋白,该方法包括通过机械处理除去猪、牛、马腹膜或心肌膜的肉和油脂,用水洗涤,用1%至5%氢氧化钠溶液处理,用水洗涤,用0.2%至0.8%盐酸酸化,用水洗涤至ph3.5,用nahco3溶液中和,用水洗涤,用水溶性溶剂(如醇或酮)脱水,用碳氢化合物(如己烷)脱脂,然后将清洁的胶原蛋白膜切成碎片,该碎片通过包括离心研磨机和筛分胶原蛋白碎片的程序通过0.5mm筛。在步骤(c)中,将在步骤(b)中制备的磨碎的天然交联的纤维状胶原蛋白添加到水性溶液中并剧烈混合以得到胶原蛋白浆料,然后将步骤(a)中制备的尺寸为50μm至200μm的纳米晶体羟基磷灰石颗粒加入到胶原蛋白浆料中并与之剧烈混合。通常,在步骤(c)中测量的ph为4.2至7.5,优选4.5至7.5。步骤(d)通常包括优选在减压下通过冷冻干燥或空气干燥来干燥包含在(c)中获得的纳米晶体羟基磷灰石颗粒和胶原蛋白的混合组合物。步骤(b)中获得的干式植入物组合物的水含量通常为3%至7%,如通过卡尔·费歇尔滴定法测量的。可选地,步骤(d)之后是通常通过γ-射线或x-射线辐照进行灭菌的步骤(e),通常使用常用于灭菌的辐照剂量,通常为27-33kgy。本发明还涉及用于口腔组织再生的新型可注射的水性植入物制剂,其可以通过锥形系统和18号规格(内径0.838mm)25.4mm长的套管以不超过60n的力挤出,其包含25-45w/w%的再水化并与无菌水或无菌等渗盐水溶液均匀混合的上述干式植入物组合物。当可注射的水性植入物制剂包含30-40w/w%的再水化并与无菌水或无菌等渗盐水溶液均匀混合的上述干式植入物组合物时,通过锥形系统和18号规格(内径0.838mm)25.4mm长的套管挤出可注射的水性植入物制剂所需的力低于40n,经常低于20n。已经观察到,骨形成细胞可以在本发明的可注射的水性植入物制剂中体外生长。这显示出该可注射的水性植入物制剂的高生物相容性,其在植入时提供非常接近发生再生的天然体内环境的基质。本发明还涉及制备上述可注射的水性植入物制剂的方法,该方法包括分别将25-45w/w%,30-40w/w%的上述干式植入物组合物用无菌水或无菌等渗盐水溶液再水化并均匀混合。再水化材料的均匀混合对于以较低的力从注射器中挤出是至关重要的。在配备有混合装置的注射器中,方便地对干式植入物组合物与无菌水或无菌等渗盐水溶液进行再水化和均匀混合。合适的此类注射器是图1中所示的medmix注射器混合系统(medmix,sp003-00m-02/b,目录号507211)。本发明进一步涉及一种包含可注射植入物制剂的即用型注射器。这样的即用型注射器可以通过制备上述干式植入物制剂,并将25-45w/w%的上述干式植入物组合物用无菌水或无菌等渗盐水溶液再水化并均匀混合,并将可注射的水性植入物制剂引入注射器,而在非常严格的无菌条件下在注射之前很长时间制备。这样的即用型注射器也可以在即将注射前从配备有混合装置的注射器制备,所述混合装置通过该干式植入物组合物用无菌水、无菌等渗盐水溶液或血液再水化并在注射器中均匀混合,而包含上述干式植入物组合物。本发明还涉及用于制备上述用于口腔组织再生的可注射的水性植入物制剂的试剂盒,其包括:-配备有混合装置的注射器,该注射器包含如上定义的干式植入物组合物,锥形系统和18号规格(内径0.838mm)25.4mm长的套管。-装有适量无菌水或无菌等渗溶液的容器。优选地,装有适量的无菌水或无菌等渗溶液的容器是具有套管的注射器。因此可以方便地将液体引入装有混合装置的注射器中,该注射器包含干式植入物组合物。本发明还涉及通过将上述可注射的植入物制剂植入口腔中来促进牙槽骨、根牙骨质或pdl再生的方法。附图描述将参考本发明的优选实施方式的说明性实例和附图来更详细地描述本发明,其中:图1表示medmix注射器混合系统(medmix,sp003-00m-02/b,目录号507211),(1)是包含干燥生物材料的注射器,(2)是带有开放式鲁尔出口的注射器盖,它与任何鲁尔套管兼容,(3)是在混合过程中关闭注射器的开放式盖,(4)是混合装置,一旦移除了柱塞,它就是柔性混合器,(5)是柱塞,可以将其取出以混合注射器中的材料,然后可以将其复位以推出材料。图2是medmix混合程序的副本,该程序在随附于medmix注射器混合系统的操作说明中列出。图3a和3b表示通过将实施例中的干式植入物组合物2和4分别与等渗盐水(曲线(1)和(3))或新鲜人血(曲线(2)和(4))再水化并均匀混合而获得的可注射的水性植入物制剂的挤出曲线。图4是使用cv1000共聚焦旋转圆盘显微镜的显微镜图像,其中通过将干式植入物组合物4(实施例6中制备的)与人血液再水化并均匀混合获得的而可注射的水性植入物制剂4通过561nm激光照射激发:生长的mc3t3cytolightred细胞在明场中可见。图5在左侧示出了来自天然骨的纳米晶体羟基磷灰石颗粒的扫描电子显微图(sem),并且在右侧示出了合成的β-tcp颗粒的sem。具体实施方式下列实施例说明本发明而不限制其范围。实施例1原料制备1)尺寸为100μm至150μm或者125μm至180μm的纳米晶体羟基磷灰石细颗粒的制备分别使用100μm至150μm或125μm至180μm的额外筛分步骤,如us-a-5417975的实施例1至4中所述,由皮质或松质骨产生纳米晶体羟基磷灰石骨矿细颗粒。作为另一种选择,通过研磨geistlich小颗粒(获自geistlichpharmaag,ch-6110,瑞士),使用手枪(pistol)小心撞击并且分别在100μm至150μm或者125μm至180μm之间进行额外的筛分步骤来生产纳米晶体羟基磷灰石骨矿物质细颗粒。将上述制备的尺寸为100μm至150μm或者125μm至180μm的纳米晶体羟基磷灰石骨矿物质细颗粒保存在玻璃瓶中直至使用。2)胶原蛋白a的制备在绞肉机中将猪皮研磨成1mm至20mm的碎片。使用水溶性溶剂(如醇或蛋白酮)除去水。使用氯化烃(例如二氯乙烷或二氯甲烷)或非氯化烃(例如己烷或甲苯)对胶原纤维进行脱脂。除去溶剂后,用强无机碱在ph值高于12的条件下处理胶原蛋白6至24小时,并用强无机酸在ph值0-1的条件下处理1至12小时。通过用水漂洗除去过量的酸,并在溶胀调节剂(如无机盐)存在下,将悬浮液匀质化为胶原纤维的0.5%至2%均质悬浮液。通过冷冻干燥将悬浮液干燥,依次用不同的有机溶剂(如醇、醚、酮和氯代烃)清洁所得海绵的干燥胶原纤维,然后在真空下将溶剂蒸发至残留溶剂少于1%。用剪刀手工切出1×1cm的清洁的胶原蛋白海绵。通过首先使用包括0.5mm至4.0mm的筛的切割机,然后使用具有0.5mm的筛的包括梯形孔的离心研磨机(retsch,zm200)进一步切碎切割的碎片。作为另一种选择,也可以直接用离心磨机研磨剪刀切割的碎片。由此获得了通过0.5mm筛的由天然交联的纤维状胶原蛋白碎片组成的胶原蛋白a。3)胶原蛋白b的制备用机械方法将幼猪的腹膜完全清除肉和油脂,在流水下洗涤并用2%naoh溶液处理12小时。然后将膜在流水下洗涤并用0.5%hcl酸化。在将材料酸化通过其整个厚度后(约15分钟)后,将材料洗涤直至获得3.5的ph值。然后将该物质用7%盐水溶液收缩,用1%nahco3溶液中和并在流水下洗涤。然后将该材料用丙酮脱水并用正己烷脱脂。使用乙醇醚干燥材料,并用包括0.5mm至1.0mm的梯形筛的切割机研磨(例如,来自fritsc的pulverisette25:参见www.fritsch.de./produkte/mahlen/schneidmuehlen/pulverisette-25或者来自retsch的sm300:www.retsch.de/de/produkte/zerkleinern/schneidmuehlen.htlm)。通过使用带有0.5mm筛的包括梯形孔的离心研磨机(retsch,zm200)进一步切碎所切割的胶原纤维段。由此获得了穿过0.5mm筛的由天然交联的纤维状胶原蛋白碎片组成的胶原蛋白b。实施例2含有纳米晶体羟基磷灰石颗粒和胶原蛋白的混合组合物的干燥和灭菌在减压下通过冻干或风干来干燥包含纳米晶体羟基磷灰石颗粒和胶原蛋白的混合组合物(如以下实施例3至8中所述获得),并通过γ射线或x射线辐照灭菌。1)冷冻干燥从50ml注射器中,从背面将物质填充到1mlcyclicolefincopolymer(coc)注射器中。每个1ml注射器充满约0.5ml的体积。将注射器从两侧密闭保存在4℃的冰箱中5个小时。然后将注射器两侧打开并放在冻干机中的金属板上,每个注射器均处于与金属板有较大的接触表面的平躺位置。然后启动以下冻干程序:1.冷冻7小时至-40℃2.在-40℃保持4小时3.在-10℃和850μbar进行20小时的初步干燥4.在+20℃和100μbar进行6小时的二次干燥作为另一种选择,粘性胶原蛋白-纳米晶体羟基磷灰石块不是在注射器中冻干,而是在直径小于25mm且深度小于10mm的不锈钢板上或小的不锈钢形式中冻干的。通过使用具有1.5mm至10mm的筛的离心研磨机(retsch,zm200)将冻干后的干燥的所得材料粉碎成0.1mm至2mm大小的颗粒。用磨碎机粉碎后,重构的最终产品中的纳米晶体羟基磷灰石颗粒变小。作为另一种选择,为了压碎粘性胶原蛋白-纳米晶体羟基磷灰石块,将其从注射器的标准鲁尔出口中挤出并在不锈钢板上形成为直线。然后将材料原样冷冻干燥。2)风干作为另一种选择,例如作为直线形成的粘性胶原蛋白-纳米晶体羟基磷灰石块在真空烘箱中在30℃和10mbar下通过空气干燥24小时。用手将干燥的直线分成5mm至10mm长的棒。然后将粒状材料或小棒填充到3ml注射器混合系统(medmix,sp003-00m-02/b,目录号507211)中,该系统具有带开放式鲁尔接头和开放式盖帽的注射器帽(medmix,cp000-76m/d,目录号506964)。3)灭菌通过在减压下冻干或风干获得的干式植入物组合物在注射器中通过27-33kgy的γ射线或x射线辐照灭菌。通过卡尔·费舍尔滴定法测量,刚灭菌后干燥产品中的水含量为3-7%。实施例3干式植入物组合物1的制备,其包含尺寸为100μm至150μm或者125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白a,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0胶原蛋白-纳米晶体羟基磷灰石组合物的制备将水和盐酸(2m)在带有小勺(spatula)的烧杯中混合。添加实施例1中获得的研磨的胶原蛋白a,并小心地推入液体中以润湿所有胶原蛋白。用螺口盖封闭烧杯,并通过speedmixer(cossearchgmbh,speedmixerdac400.1fvz)以2500rpm将水-胶原蛋白浆料在4分钟内均匀混合。在混合过程中将胶原蛋白浆料稍微加热。然后,将胶原蛋白浆料在4℃的冰箱中冷却30分钟。通过speedmixer在2分钟内以2500rpm再次混合胶原蛋白浆料。然后,将在实施例1中制备的尺寸为100μm至150μm或125μm至180μm的纳米晶体羟基磷灰石骨矿物质细颗粒与胶原蛋白浆料一起添加到烧杯中,所述团块通过speedmixer在2分钟内以2000rpm混合。所得的ph为约4.5。下表指定了上述实验中使用的材料的量:胶原蛋白-纳米晶体羟基磷灰石组合物的干燥如实施例2中所述在减压下进行冻干或风干并灭菌。由此获得干式植入物组合物1,其包含尺寸为100μm至150μm或125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白a,并且纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0,并且如实施例9中所述用去矿物质水进行再水化后ph为4.5。实施例4干式植入物组合物2的制备,其包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白b,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0。胶原蛋白-纳米晶体羟基磷灰石组合物的制备将实施例1中获得的研磨的胶原蛋白b小心地推入去矿物质水中以润湿所有胶原蛋白。用螺口盖封闭烧杯,并通过speedmixer以2500rpm将水胶原蛋白浆料在1分钟内均匀混合。然后在4小时内在水浴中将胶原蛋白浆料加热至70℃。然后将胶原蛋白浆料在环境温度下或在冰箱或水浴中冷却30分钟。通过speedmixer在2分钟内以2500rpm再次混合胶原蛋白浆料。然后,将实施例1中制备的尺寸在125μm至180μm之间的纳米晶体羟基磷灰石骨矿物质细颗粒与胶原蛋白浆料一起添加到烧杯中,所述团块通过speedmixer在2分钟内以2000rpm混合。所得的ph为6.2。下表指定了上述实验中使用的材料的量:材料净重[g]水6.36胶原蛋白b0.60羟基磷灰石颗粒125μm-180μm2.40胶原蛋白-纳米晶体羟基磷灰石组合物的干燥如实施例2中所述在减压下进行冻干或风干并灭菌。由此获得干式植入物组合物2,其包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白b,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0,并且如实施例9中所述用去矿物质水进行再水化后ph为6.2。实施例5干式植入物组合物3的制备,其包含2份胶原蛋白a和1份胶原蛋白b的混合物和尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒,纳米晶体羟基磷灰石与胶原蛋的重量比为2.67胶原蛋白-纳米晶体羟基磷灰石组合物的制备将水和盐酸(2m)在带有小勺的烧杯中混合。将实施例1中获得的研磨的胶原蛋白b小心地推入液体中以润湿所有胶原蛋白。用螺口盖关闭烧杯,并通过speedmixer以2500rpm将水-胶原蛋白浆料在2分钟内均匀混合,得到的ph在0.9和1之间。然后在水浴中在20分钟内将胶原蛋白浆料加热至70℃。然后将胶原蛋白浆料在25℃的水浴中冷却30分钟。添加实施例1中获得的研磨的胶原蛋白a,并小心地推入胶原蛋白浆料中以润湿所有胶原蛋白。然后将浆料通过speedmixer以2500rpm在4分钟内混合。最后,将在实施例1中制备的尺寸为125μm至180μm的纳米晶体羟基磷灰石骨矿物质细颗粒与胶原蛋白浆料一起添加到烧杯中,将所述团块通过speedmixer以2000rpm在2分钟内混合。所得的ph约为4.5。下表指定了上述实验中使用的材料的量:纳米晶体羟基磷灰石-胶原蛋白组合物的干燥如实施例2中所述在减压下进行冻干或风干并灭菌。由此获得干式植入物组合物3,其包含2份胶原蛋白a和1份胶原蛋白b的混合物和为125μm至180μm的纳米晶体羟基磷灰石颗粒,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.67,并且如实施例9中所述用去矿物质水进行再水化后ph为4.5。实施例6干式植入物组合物4的制备,其包含2份的胶原蛋白a和1份的胶原蛋白b的混合物和尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.67。胶原蛋白-纳米晶体羟基磷灰石组合物的制备将实施例1中获得的研磨的胶原蛋白b小心地推入去矿物质水中以润湿所有胶原蛋白。用螺口盖关闭烧杯,并通过speedmixer以2500rpm将水-胶原蛋白浆料在1分钟内均匀混合。然后在水浴中在20分钟内将胶原蛋白浆料加热至70℃。然后将胶原蛋白浆料在25℃的水浴中冷却30分钟。添加实施例1中获得的研磨的胶原蛋白a,并小心地推入胶原蛋白浆料中以润湿所有胶原蛋白。然后将浆料通过speedmixer以2500rpm在4分钟内混合。最后,将在实施例1中制备的尺寸为125μm至180μm的纳米晶体羟基磷灰石骨矿物质细颗粒与胶原蛋白浆料一起添加到烧杯中,所述团块通过speedmixer以2000rpm在2分钟内混合。所得的ph为6.0。下表指定了上述实验中使用的材料的量:纳米晶体羟基磷灰石-胶原蛋白组合物的干燥如实施例2中所述在减压下进行冻干或风干并灭菌。由此获得干式植入物组合物4,其包含2份的胶原蛋白a和1份的胶原蛋白b的混合物和尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.67,并且如实施例9中所述用去矿物质水进行再水化后ph为6.0。实施例7干式植入物组合物5的制备,其包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白a,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0胶原蛋白-纳米晶体羟基磷灰石组合物的制备将研磨的胶原蛋白a小心地推入去矿物质水中以润湿所有胶原蛋白。添加在实施例1中制备的尺寸为125μm至180μm的纳米晶体羟基磷灰石骨矿物质细颗粒,并用螺旋盖将烧杯封闭。将水-胶原蛋白-纳米晶体羟基磷灰石浆料在1分钟内通过vortex混合器,并且在1分钟内通过勺均匀混合。所得的ph为6.1。下表中描述了使用的材料的量:材料净重[g]水7.0胶原蛋白a0.60羟基磷灰石颗粒125μm-180μm2.40纳米晶体羟基磷灰石-胶原蛋白组合物的干燥如实施例2中所述在减压下进行冻干或风干并灭菌。由此获得干式植入物组合物5,其包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白a,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0,并且如实施例9中所述用去矿物质水进行再水化后ph为6.1。实施例8干式植入物组合物6的制备,其包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白a,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.0。胶原蛋白-纳米晶体羟基磷灰石组合物的制备将研磨的胶原蛋白a小心地推入去矿物质水中以润湿所有胶原蛋白。添加在实施例1中制备的尺寸为125μm至180μm的纳米晶体羟基磷灰石骨矿物质细颗粒,并用螺旋盖将烧杯封闭。将水-胶原蛋白-纳米晶体羟基磷灰石浆料在1分钟内通过vortex混合器,并且在1分钟内通过勺均匀混合。所得的ph为5.8。下表中描述了使用的材料的量:材料净重[g]水7.0胶原蛋白a1.0bio-oss125μm-180μm2.0纳米晶体羟基磷灰石-胶原蛋白组合物的干燥如实施例2中所述在减压下进行冻干或风干并灭菌。由此获得干式植入物组合物6,其包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白a,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.0,并且如实施例9中所述用去矿物质水进行再水化后ph为5.8。实施例9通过使注射器中的干式植入物组合物再水化来制备包含可注射的水性植入物制剂的即用型注射器。1)包含通过将干式植入物组合物再水化和均匀混合而获得的可注射的水性植入物制剂的即用型注射器的制备a)使用三通旋塞阀luer-lok适配器和1ml注射器2)通过使用三通旋塞阀luer(luer-lok)适配器(bdconnecta,3-waystopcock,目录号394600),vaclok注射器(qosina,vacloksyringe,目录号c1097)和一个普通的一次性补充注射器1ml(luer-lok)将1ml产品注射器中干燥的无菌纳米晶体羟基磷灰石-胶原蛋白组合物再水化。使胶原蛋白再水化的液体是去矿物质水、等渗盐水溶液,包含150mm磷酸钠缓冲液的ph7.4的pbs溶液(通过将nah2po4溶解在去矿物质水中并用氢氧化钠调节ph来制备)或血液。注射器中的干燥生物材料(实施例3至8之一中获得的干式植入物组合物)的重量是已知或测量过的。在补充注射器中填充一定量的再水化液,以获得包含按38重量%的干燥生物材料的可注射糊剂。然后将产品注射器连接到三通旋塞阀,并用一个封闭盖将三通旋塞阀的180°对应口关闭。在三通旋塞阀的第三位置(与产品注射器呈90°位置),将60mlvaclok注射器连接至系统。通过拉动vaclok注射器的柱塞并锁定在50ml的体积,从产品注射器中抽空空气。然后将三通阀旋转180°,以保持产品注射器中的真空,而vaclok注射器被装满液体的补充注射器代替。然后将三通阀旋转180°。由于真空,液体自动流入产品注射器并润湿产品。为了确保将液体完全转移到产品注射器中,将产品注射器的柱塞抽回。在将材料从产品注射器推入补充注射器并返回之前,将材料静置30秒以使其能够再水化,此过程重复40次以获得均匀混合的材料。混合程序完成后,将三通旋塞阀换成施用器,该施用器是一个锥形系统和一个末端钝的18号规格(内径0.838mm)25.4mm长的套管。通过将干式植入物组合物1至6中的每一个用去矿物质水再水化和均匀混合而获得的重构的可注射的水性植入物制剂的ph值接近冻干前测得的ph,即分别为约4.5、6.2、4.5、6.0、6.1和5.8。b)使用3mlmedmix注射器混合系统作为另一种选择,在具有带开放式鲁尔接头和开放式盖的注射器盖(medmix,cp000-76m/d,目录号506964)的medmixx注射器混合系统(medmix,sp003-00m-02/b,目录号507211)中,将干燥的材料的颗粒用去矿物质水、等渗盐水溶液、含150mm磷酸钠缓冲液的ph7.4的pbs溶液或血液再水化,如图1所示,其中(1)是装有干燥生物材料的注射器,(2)是带有开放式鲁尔出口的注射器盖,该鲁尔出口与任何鲁尔套管兼容,(3)是在混合过程中用于关闭注射器的开孔盖,(4)是混合装置,一旦移除柱塞,它就是柔性混合器,(5)是柱塞,可以将其卸下以与注射器中的材料混合,然后可以将其复位以推出材料。遵循图2中列出的medmix混合程序。为了获得最佳结果,在步骤4之后,将柱塞推入3次,以将液体推入材料中以使其湿润,并执行60秒的混合步骤(步骤6)。在步骤8中除去所有空气。3)挤出测试用张力和压力测试装置(zwick&roell,bt1-fr2.5ts.d14)测试获得的重构的可注射的水性植入物制剂的可挤出性。将以上制备的即用型注射器垂直放置在注射器固定架中,将柱塞从机器上向下压,同时通过包括锥形系统和钝末端的18号规格(内径0.838mm)25.4mm长的套管(nordsonefd,precisiontip18ga1”,目录号7018110)的施加器将产品从注射器中压出的力是通过以下程序测量的:ο直至阻力的力:0.1nο直至阻力的速度:100mm/minο测试速度:1mm/s,位置受控ο测试结束:力极限,150nο力传感器:200n对于通过用去矿物质水、等渗盐水溶液或pbs溶液进行再水化和均匀混合而获得的所有测试的可注射植入物制剂,特别是对于由干式植入物组合物1至6制备的可注射植入物制剂而言,测得的力不超过40n。对于通过用血液进行再水化和均匀混合而获得的所有测试的可注射植入物制剂,特别是对于由干式植入物组合物1至6制备的可注射植入物制剂而言,测得的力不超过45n。对于通过用去矿物质水、等渗盐水溶液或pbs溶液进行再水化和均匀混合而获得的可注射植入物制剂,其由干式植入物组合物1、2、3、5和6制备,测得的力不超过20n。对于通过用血液进行再水化和均匀混合而获得的可注射植入物制剂,其由干式植入物组合物1(包含尺寸为100μm至150μm或125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白a,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0)和干式植入物组合物2(包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白b,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0)制备,测得的力不超过25n。参见图3a和3b,其分别表示通过将干式植入物组合物2和4用等渗盐水或新鲜人血再水化并均匀混合而获得的可注射植入物制剂的挤出曲线。-在图3a中,(1)和(2)分别是用等渗盐水或新鲜人血再水化的干式植入物组合物2(包含尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒和胶原蛋白b,纳米晶体羟基磷灰石与胶原蛋白的重量比为4.0)的挤出曲线。-在图3b中,(3)和(4)分别是用等渗盐水或新鲜人血再水化的干式植入物组合物4(包含2份的胶原蛋白a与1份的胶原蛋白b的混合物和尺寸为125μm至180μm的纳米晶体羟基磷灰石颗粒,纳米晶体羟基磷灰石与胶原蛋白的重量比为2.67)的挤出曲线。实施例10生物相容性:在本发明的可注射的水性植入物制剂中两种骨形成细胞系生长的体外试验细胞来自:-mc3t3cytolightred,一种源自小鼠颅盖的成骨细胞细胞系(atcccrl-2593),其使用cytolightred慢病毒(essenbioscience)转导以在细胞质中表达红色荧光蛋白,或-mg63(源自人骨肉瘤的细胞系)如下测试其定植本发明的可注射的水性植入物制剂的能力。这些细胞在供应商推荐的条件下进行培养,即对于mc3t3cytolightred细胞:在补充有10%胎牛血清(fbs,lubio)、1%青霉素-链霉素(gibco)和0.5μg/ml的嘌呤霉素(sigma)的αmem(gibco)中培养,对于mg63细胞:在补充有10%fbs(lubio)、1%青霉素-链霉素(gibco)的dmem(gibco)中培养。将一层这些细胞引入多层板的孔中,并使用3mlmedmix注射器将大约1ml生物材料添加到每个孔中细胞层的顶部,该medmix注射器包含通过将干式植入物组合物1至4(在实施例3-6中制备)用人血或等渗盐水溶液再水化和均匀混合而获得的可注射的植入物制剂1至4。将细胞培养8天这些实验表明,对于可注射的植入物制剂1至4中的每一种,每种mc3t3cytolightred和m63细胞系对生物材料的定植。参见图4,其为使用cv1000共聚焦旋转圆盘显微镜(yokogawa)的显微图像,其通过561nm激光照射激发可注射的水性植入物制剂4,所述可注射的水性植入物制剂4通过将干燥的植入物组合物4(实施例6中制备)与人血再水化并均匀混合而获得:在明场下可见生长的mc3t3cytolightred细胞。这些实验表明,骨形成细胞可以在本发明的可注射的水性植入物制剂中体外生长。这证明了该可注射的水性植入物制剂的高生物相容性,其在植入时提供非常接近发生再生的天然体内环境的基质。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1