一种草鱼细菌性败血症及赤皮病联合疫苗及其制备方法与流程
本发明属于鱼类养殖领域,特别涉及一种草鱼细菌性败血症及赤皮病联合疫苗及其制备方法。
背景技术:
草鱼是广东省主要养殖品种之一,年产量达400万吨以上,但每年因病害损失就高达20亿元以上。草鱼败血症、赤皮病是危害草鱼极为严重的细菌性疾病,其流行范围广,死亡率高。草鱼细菌性败血症由嗜水气单胞菌感染引起,为近年来草鱼的高发高危病害疾病,发病急来势猛,短时间内引起大量鱼类死亡且呈暴发性流行,一旦发病很难控制,而且发病季节长,流行范围广,全国草鱼主养区均有不同程度地发病。草鱼赤皮病长久以来一直困扰着我国广大草鱼养殖户,病原为铜绿假单胞菌,流行区域广且终年可见,如不及时治疗会引起较高的死亡率,并且严重影响草鱼外观品质。因此,草鱼细菌性疾病已成为我国草鱼养殖可持续发展的障碍。
草鱼细菌性疾病的防控,多采用组织浆疫苗或单一菌苗免疫的方式,但都无法达到满意的效果。因此,针对此问题,开发一种能够联合预防草鱼细菌性败血症和赤皮病的疫苗是迫在眉睫的解决手段。
技术实现要素:
本发明的首要目的在于提供一种草鱼细菌性败血症及赤皮病的高效联合防治方法。
本发明所采取的技术方案是:
一种草鱼细菌性败血症及赤皮病疫苗,由佐剂β-丙内酯、灭活嗜水气单胞菌液和灭活铜绿假单胞菌液组成。
进一步的,所述的一种草鱼细菌性败血症及赤皮病疫苗,该疫苗还含有佐剂;优选的,所述佐剂为水包油包水型佐剂。
上述所述的草鱼细菌性败血症及赤皮病疫苗的制备方法,包括以下步骤:
(1)将嗜水气单胞菌和铜绿假单胞菌分别扩大培养;
(2)将扩大培养得到嗜水气单胞菌液和铜绿假单胞菌液分别加入β-丙内酯,灭活,在37~40℃中水浴2~3h;
(3)将上步所得嗜水气单胞菌液、铜绿假单胞菌液与佐剂混合成灭活的二联疫苗。
进一步的,所述的草鱼细菌性败血症及赤皮病疫苗的制备方法,步骤(2)所述扩大培养后嗜水气单胞菌菌液浓度为7.5×108~9×108cfuml-1,铜绿假单胞菌菌液浓度为4.2×108~6×108cfuml-1;步骤(2)所述β-丙内酯的体积浓度为0.1%~0.5%。
进一步的,所述的草鱼细菌性败血症及赤皮病疫苗的制备方法,步骤(2)所述灭活具体条件为4~5℃灭活72~80h。
进一步的,所述的草鱼细菌性败血症及赤皮病疫苗的制备方法,步骤(3)所述嗜水气单胞菌液、铜绿假单胞菌液和佐剂体积比例为1~2:1~2:1~4。
进一步的,所述的草鱼细菌性败血症及赤皮病疫苗的制备方法,所述佐剂为水包油包水型佐剂。
上述所述的疫苗在制备治疗草鱼细菌性败血症及赤皮病的试剂中的应用。
上述所述的疫苗在制备提高草鱼免疫力基因表达的试剂中的应用。
进一步的,所述的免疫力基因为igm、il-1β、ifn、mx、c3和tlr3。
本发明的有益效果是:
本发明根据前期筛选的流行菌株,加入灭活剂β-丙内酯,不仅安全高效,而且有效控制草鱼细菌性败血症和赤皮病的发生;本发明可以刺激鱼体脾脏、头肾组织中igm、il-1β、ifn、mx、c3以及tlr3免疫相关基因的表达,还可对草鱼产生高达80~90%的相对免疫保护率,免疫后1年相对保护率仍可达到50%;本发明操作简便、安全有效,一次免疫即可预防两种疾病,不仅减少了抗生素和化学药物的使用,而且降低了对养殖环境的破坏,保证了食品安全和水生态安全。
附图说明
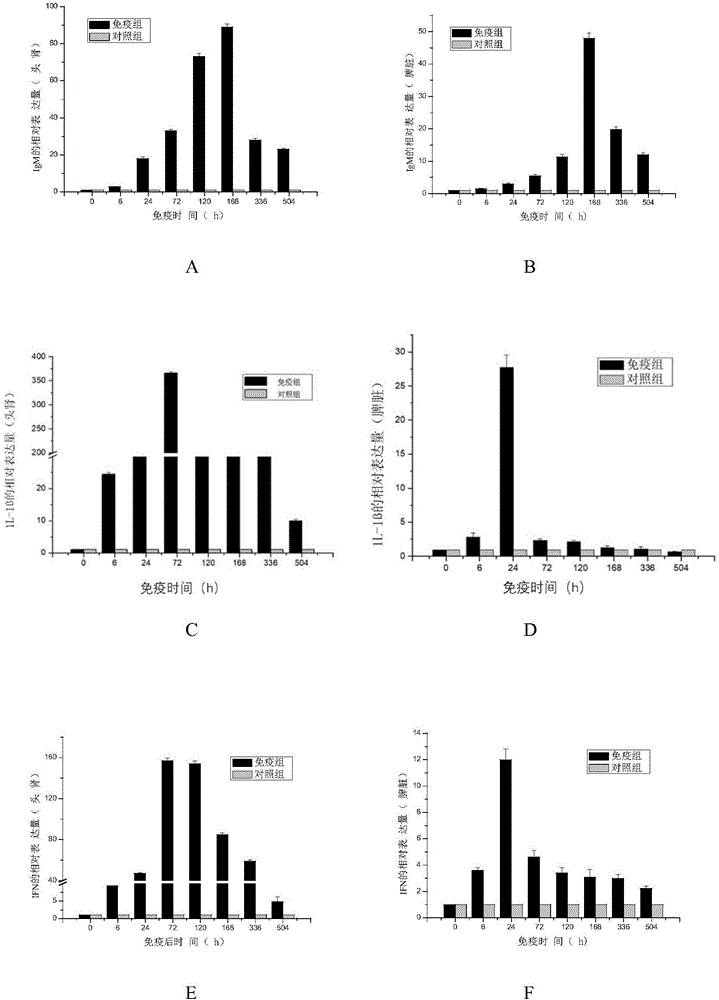
图1a~l分别为注射本发明二联灭活疫苗对草鱼头肾igm、脾脏组织igm;草鱼头肾il-1β、脾脏组织il-1β;草鱼头肾ifn、脾脏组织ifn;草鱼头肾mx蛋白、脾脏组织mx蛋白;草鱼头肾c3、脾脏组织c3;草鱼头肾tlr3、脾脏组织tlr3的表达量的影响。
图2为本发明二联灭活疫苗的有效期。
具体实施方式
实施例1疫苗制备
(1)将保藏于-70℃的嗜水气单胞菌(ga201株)和铜绿假单胞菌(jp802株),分别接种营养琼脂培养基,28℃恒温培养24h,分别挑取单菌落接种于营养肉汤培养基中,28℃培养过夜(18h)。
(2)吸取步骤(1)中过夜培养的嗜水气单胞菌和铜绿假单胞菌菌液各100μl,分别再次接种于营养肉汤培养基中,28℃,180转/分钟,摇床震荡18~20h进行扩大培养,麦氏比浊法测定菌液浓度嗜水气单胞菌为7.5×108cfuml-1,铜绿假单胞菌为4.2×108cfuml-1。
(3)在扩大培养的嗜水气单胞菌液和铜绿假单胞菌液分别加入终浓度为0.1%(v/v)的β-丙内酯,4℃灭活72h,再在37℃水浴2h,将灭活剂进行水解。取少许上步获得的菌液接种营养琼脂培养基,28℃培养72h进行灭活检验,无菌落产生表明菌液已灭活彻底,可用于后续配苗使用。
(4)将灭活的嗜水气单胞菌液、灭活的铜绿假单胞菌液和水包油包水佐剂montanidetmisa201vg按照1:1:2的比例乳化搅拌成灭活的二联疫苗,于4℃保存备用。
其中,营养肉汤培养基配方为(每升):蛋白胨10.0g,牛肉膏粉3.0g,氯化钠5.0g,最终ph7.4±0.2。营养琼脂培养基配方为(每升):蛋白胨10.0g,牛肉膏粉3.0g,氯化钠5.0g,琼脂15.0g,最终ph7.4±0.2。
实施例2疫苗制备
(1)将保藏于-70℃的嗜水气单胞菌(ga201株)和铜绿假单胞菌(jp802株),分别接种营养琼脂培养基,28℃恒温培养24h,分别挑取单菌落接种于营养肉汤培养基中,28℃培养过夜(24h)。
(2)吸取步骤(1)中过夜培养的嗜水气单胞菌和铜绿假单胞菌菌液各90μl,分别再次接种于营养肉汤培养基中,28℃,180转/分钟,摇床震荡18~20h进行扩大培养,麦氏比浊法测定菌液浓度嗜水气单胞菌为9×108cfuml-1,铜绿假单胞菌为6×108cfuml-1。
(3)在扩大培养的嗜水气单胞菌液和铜绿假单胞菌液分别加入终浓度为0.5%(v/v)的β-丙内酯,5℃灭活80h,再在40℃水浴3h,将灭活剂进行水解。取少许上步获得的菌液接种营养琼脂培养基,28℃培养72h进行灭活检验,无菌落产生表明菌液已灭活彻底,可用于后续配苗使用。
(4)将灭活的嗜水气单胞菌液、灭活的铜绿假单胞菌液和水包油包水佐剂montanidetmisa201vg按照2:2:4的比例乳化搅拌成灭活的二联疫苗,于4℃保存备用。
其中,营养肉汤培养基配方为(每升):蛋白胨10.0g,牛肉膏粉3.0g,氯化钠5.0g,最终ph7.4±0.2。营养琼脂培养基配方为(每升):蛋白胨10.0g,牛肉膏粉3.0g,氯化钠5.0g,琼脂15.0g,最终ph7.4±0.2。
下面对制备的灭活疫苗作进一步的效果检测。
嗜水气单胞菌败血症和铜绿假单胞菌赤皮病二联白油灭活疫苗对草鱼的安全性
方法:试验用草鱼(体长8-10cm,体重12-15g)购自广州市番禺区某养殖场,经镜检无虫,细菌分离发现没有嗜水气单胞菌及铜绿假单胞菌等常见菌株。暂养一周后,选择状态良好、体表无伤的健康草鱼120尾,随机分为6组,即疫苗注射组和空白对照组各3组,每组20尾。其中,疫苗注射组选用2倍使用剂量即0.4ml每尾,腹腔注射实施例1制备好的灭活的二联疫苗,空白对照组不做任何处理。试验期间控制水温在(28±2)℃,连续观察14d。
结果:每日早、中、晚3次观察试验鱼的健康状况和死亡个体数,整个试验期间,疫苗注射组和空白对照组均无死鱼,鱼体健活、摄食正常,存活率为100%,说明注射加倍剂量的二联疫苗不会对草鱼的健康状况产生影响。
注射嗜水气单胞菌败血症和铜绿假单胞菌赤皮病二联白油灭活疫苗后草鱼头肾、脾脏组织中免疫相关基因的表达
方法:每尾草鱼腹腔注射实施例1制备的二联疫苗0.2ml,每组注射30尾,同时设置3个平行组,取等量空白健康草鱼作为对照。于免疫后0、6h、12h、1d、3d、5d、7d、14d、21d分别取免疫草鱼和对照草鱼组的脾脏和头肾组织,分别提取脾脏和头肾组织的rna,反转录为cdna,以cdna为模板,选取β-actin作为内参基因,实时荧光定量pcr(qrt-pcr)检测方法对干扰素(ifn)、免疫球蛋白m(igm)、补体3(c3)、白细胞介素1β(il-1β)、mx蛋白(mx)、toll样受体3(tlr3)共6个免疫相关基因的mrna进行相对表达量的测定。其中qrt-pcr的扩增体系见表1,引物序列见表2。
表1实时荧光定量pcr扩增体系
表2实时荧光定量pcr的引物序列
qrt-pcr反应扩增程序为:95℃预变性10min;95℃变性30sec,60℃退火1min,72℃延伸30s,共40个循环。
结果:整个试验期间,6种免疫相关基因mrna表达量(见图1a~l)在草鱼头肾和脾脏组织中均呈现先升高后下调的趋势,但峰值高低及出现时间存在差异。其中以igm、il-1β、ifn、tlr3在头肾中的表达量较高(见图1a、图1c、图1e和图1k)。
igm基因的相对表达量在头肾和脾脏组织中都是在免疫后168h达到峰值,头肾中的表达量高于对照组80倍,脾脏中的表达量为对照组的50倍,在头肾中的表达量整体高于脾脏。
il-1β是一种促炎及具有免疫调控的细胞因子,具有引发炎症及促进免疫学活性等作用,增强免疫反应的潜力。il-1β基因在脾脏中的相对表达量于免疫后24h达到峰值,为对照组的28倍,在头肾中于72h达到峰值,为对照组的300多倍,远高于脾脏中的表达量。
ifn是一种糖蛋白,在机体遭受病原入侵刺激时快速且大量产生,可发挥免疫调节作用,在感染后数小时内即可达到峰值。草鱼ifn主要由头肾等免疫组织中的淋巴细胞产生,具有促进巨噬细胞吞噬杀菌、调节淋巴细胞转化等功能。本实验中ifn在草鱼脾脏中的相对表达量于免疫后24h达到峰值,为对照组的12倍;在头肾中于72h达到峰值,为对照组的150多倍,远高于脾脏中的表达量。
mx蛋白是一类由i型ifn诱导产生的具有gtp酶活性的物质。本实验中该基因在草鱼脾脏中的相对表达量于免疫后120h达到峰值,为对照组的18倍;在头肾组织中于168h达到峰值,为对照组的25倍。
补体系统组成成分非常复杂,是固有免疫与适应性免疫之间的重要枢纽。c3分子作为固有成分中的一种,是补体系统的核心,它参与多种免疫调节及应答反应,当细菌、多糖、抗原抗体复合物激活任意一条补体途径,都将通过级联反应使c3分子活化。本实验中c3基因的相对表达量在草鱼脾脏和头肾组织中均于免疫后120h达到峰值,头肾中的表达量高于对照组4.5倍;脾脏中的表达量为对照组的12倍,但高于头肾中的相对表达量。
toll样受体(toll-likereceptor,tlrs)以其特有的myd88非依赖途径激活下游免疫因子,诱导i型干扰素(α-ifn和β-ifn)表达和分泌,达到抑制病毒复制的目的。本实验中tlr3基因在脾脏和头肾组织中的相对表达量均较高,于免疫后120h达到峰值,头肾中的表达量高于对照组130倍,脾脏中的表达量为对照组的100倍。
注射二联灭活疫苗对预防草鱼细菌性败血症及赤皮病的有效性
方法:选取150尾健康草鱼,随机分为5组,其中两组为疫苗免疫组,另外3组为空白对照组,每组30尾鱼。疫苗免疫组每尾腹腔注射二联疫苗0.2ml。免疫21d后,选取1个疫苗免疫组及1个空白对照组的草鱼腹腔注射嗜水气单胞菌强毒株菌液;选取另1个疫苗免疫组及另1个空白对照组的草鱼腹腔注射新鲜培养的铜绿假单胞菌强毒株菌液。
攻毒剂量选取可使空白健康草鱼100%死亡的最小活菌量,即嗜水气单胞菌为0.6×107cfu/尾,铜绿假单胞菌为1×108cfu/尾。使用菌液攻毒后每日观察鱼体存活情况,记录发病、死亡数量,连续观察14d。选择不同时间分别进行了3次独立重复试验。本实验每组设置3个平行实验。
参照下列公式计算相对免疫保护率(rps%):
rps=(1-免疫组死亡率/对照组死亡率)×100%
结果:经过3次有效性试验发现,二联灭活疫苗中嗜水气单胞菌疫苗组份的有效保护率分别为90%、100%、95%,铜绿假单胞菌疫苗组份的有效保护率分别为80%、90%、95%。
疫苗的免疫保护率
方法:准备3500尾健康草鱼,其中1500尾腹腔注射免疫本发明实施例1制备的嗜水气单胞菌和铜绿假单胞菌二联白油灭活疫苗(免疫组),2000尾作为对照组备用。免疫疫苗21d后开始首次攻毒,然后每隔30d攻毒1次,每次分别取100尾免疫组的鱼及100尾对照组的鱼,分组,即免疫鱼2组,每组50尾;对照组2组,每组50尾。置于水族箱中暂养3d后进行攻毒实验。1组免疫鱼和1组对照鱼注射嗜水气单胞菌强毒株菌液,另1组免疫鱼和另1组对照鱼注射铜绿假单胞菌强毒株菌液。
攻毒剂量同实施例4,即嗜水气单胞菌为0.6×107cfu/尾,铜绿假单胞菌为1×108cfu/尾。实验持续1年,每一个月一次,共攻毒12次,每次攻毒的有效保护率见图2。
结果:疫苗腹腔注射草鱼后的第1个月到第6个月,发现两种疫苗组份(灭活的即嗜水气单胞菌疫苗和灭活的铜绿假单胞菌疫苗)的相对免疫保护率均维持在60%~90%之间;第6个月到第12个月相对免疫保护率降为50%~60%。说明本发明制备的疫苗腹腔免疫草鱼6个月,对嗜水气单胞菌强毒株菌液和铜绿假单胞菌强毒株菌液感染具有良好的免疫保护作用,6个月后只能起到部分保护作用。
本发明筛选出β-丙内酯作为本发明二联疫苗的灭活剂,免疫保护率相对于其他灭活剂提高了20%~30%。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>广州普麟生物制品有限公司中国水产科学研究院珠江水产研究所
<120>一种草鱼细菌性败血症及赤皮病联合疫苗及其制备方法
<130>
<160>14
<170>patentinversion3.5
<210>1
<211>21
<212>dna
<213>人工引物
<400>1
tctacctccaactccaccacc21
<210>2
<211>24
<212>dna
<213>人工引物
<400>2
tgtttattgtatttgccacctgat24
<210>3
<211>27
<212>dna
<213>人工引物
<400>3
gacacatacagtaggatattcactcgc27
<210>4
<211>27
<212>dna
<213>人工引物
<400>4
gacacatacagtaggatattcactcgc27
<210>5
<211>23
<212>dna
<213>人工引物
<400>5
ccttccgcttggtggtggcttat23
<210>6
<211>21
<212>dna
<213>人工引物
<400>6
tgttctggtgtttgttcctcc21
<210>7
<211>23
<212>dna
<213>人工引物
<400>7
cttactataagaccagcaagacc23
<210>8
<211>20
<212>dna
<213>人工引物
<400>8
cgggatatttaagggattca20
<210>9
<211>25
<212>dna
<213>人工引物
<400>9
gcaggggacaaaaagagattataga25
<210>10
<211>26
<212>dna
<213>人工引物
<400>10
agccaacttaggaatagtagcaaaac26
<210>11
<211>22
<212>dna
<213>人工引物
<400>11
gagaacaatcgtgactccctga22
<210>12
<211>44
<212>dna
<213>人工引物
<400>12
accgaccatgacgccctgatgtccagtagagaacacagcgaggt44
<210>13
<211>23
<212>dna
<213>人工引物
<400>13
ggatgatgaaattgccgcactgg23
<210>14
<211>22
<212>dna
<213>人工引物
<400>14
accgaccatgacgccctgatgt22
- 还没有人留言评论。精彩留言会获得点赞!