突破血脑屏障治疗阿尔兹海默症的载药靶向纳米微泡递送系统的制备方法与流程
本发明属于医药
技术领域:
。所制备的新型载药纳米微泡递送系统,对其靶向修饰后具有良好的靶向效果,纳米级微泡在超声作用下能够克服血脑屏障的障碍使药物发挥治疗作用。
背景技术:
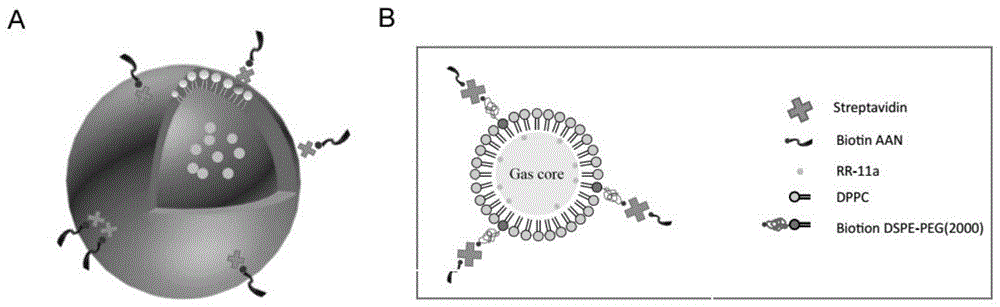
:阿尔兹海默病(alzheimer’sdisease,ad),是一种由神经系统变性引发的进行性痴呆,老年者发病率较高,亦称老年痴呆。临床表现以记忆障碍、认知功能障碍、精神症状以及人格、行为方面的异常为主。典型的三大病理特征为:神经原纤维缠结(tau)、老年斑(aβ沉积)以及神经元的广泛缺失。然而鉴于血脑屏障难突破的限制,对于阿尔兹海默病症治疗的突破性进展报道还很少。legumain是一丝氨酸蛋白酶,是asparaginylendopeptidase家族中的成员之一。它首先被证明在植物的种子芽苞形成中起着重要作用。研究发现阿尔兹海默病患者脑中legumain高表达。技术实现要素:本发明目的是解决目前阿尔兹海默病症治疗的药物难以突破血脑屏障达到治疗部位的问题,提供一种突破血脑屏障治疗阿尔兹海默症的载药靶向纳米微泡递送系统的制备方法及应用。针对上述问题本发明制备了一种靶向修饰的载药纳米微泡递送系统,结合超声技术药物可突破血脑屏障;制备的rgd修饰的载药纳米微泡使得纳米微泡可在血脑屏障内皮细胞处富集,而经过aan修饰的纳米微泡可以与阿尔兹海默相关app识别并结合。本发明的技术方案突破血脑屏障治疗阿尔兹海默症的载药靶向纳米微泡递送系统的制备方法,所述载药的纳米微泡递送系统的制备步骤如下:第1、配置磷脂混合液:将dppc与biotindspe-peg2000按19:1的摩尔比与三氯甲烷溶剂加于锥形瓶中,密封后置于摇床上摇匀大约3-4h;若制备载药组,将37.6μlrr-11a溶液混于上述混合液中(100mgrr-11a溶解于3ml甲醇中)相当于1.25mg。若需dii染色的纳米微泡组,在配置磷脂混合液时加入8μldii(1.2mg/ml)。第2、旋蒸及乳化:待旋转蒸发仪使得磷脂分子层干燥后,向梨形瓶pbs溶液中加入1ml含甘油的pbs溶液,将梨形瓶置于旋转蒸发仪上室温旋转使梨形瓶内壁表面的脂质体分散于水中,此为脂质体的水化过程。再探针超声并用激光笔丁达尔效应初步验证粒径。第3、包覆全氟丙烷(c3f8)气体:将梨形瓶内分散体系转移至ep管中,将管中气体置换为c3f8,将ep管机械振荡得到的纳米微泡储存于4℃环境中。(实验过程在避光条件下进行)过凝胶柱去除游离的rr-11a及不需要的过大粒径的微泡,得到载药纳米微泡递送系统。第4、载药纳米微泡递送系统的靶向修饰;nb(rr-11a)-aan结合物及nb(rr-11a)-rgd结合物的合成,具体步骤如下:运用亲和素生物素方法连接第3步得到的纳米微泡递送系统与生物素化的aan或rgd分子。将链霉亲和素加于纳米微泡递送系统悬液中,4℃下震荡30min。超速离心用pbs除去未结合上的链霉亲和素,随后将生物素化的aan分子或生物素化的rgd分子加于纳米微泡递送系统悬液中并在4℃下震荡30min。再超速离心去除多余的biotin-aan分子或biotin-rgd分子,将浓缩液加pbs配置成所需浓度的nb(rr-11a)-aan或nb(rr-11a)-rgd,4℃下避光保存。本发明的优点和有益效果:该发明针对靶向血脑屏障内皮细胞设计了nb-rgd,靶向阿尔兹海默相关app蛋白而设计了nb-aan,而所载药物rr-11a为legumain的小分子抑制剂。legumain能够促进tau的剪切,加速阿尔兹海默病症病情发展,因此该发明所载药物rr-11a既legumian小分子抑制剂可治疗阿尔兹海默症。该发明设计了靶向修饰的载药纳米微泡,并联用超声技术,使静脉注射的纳米微泡在血脑屏障内皮细胞富集,并通过超声技术,使得药物通过血脑屏障达到治疗效果。结果发现nb(rr-11a)-aan,nb(rr-11a)-rgd,nb(rr-11a)-aan/nb(rr-11a)-rgd均体现较好的治疗效果。附图说明图1(a)具有靶向性修饰的载药纳米微泡示意图,(b)靶向修饰的载药纳米微泡结构示意图。图2(a(a))dii染色的纳米微泡荧光照片,(a(b,c))纳米微泡的sem照片,其中(b)为(c)的放大图;(b)体外超声造影图,(a,b,c,d,e,f)分别为pbs,nb,nb-aan,nb-rgd,nb-aan/nb-rgd,sonovue的超声造影图;(c)载药纳米微泡在4℃及37℃条件下储存,微泡中rr-11a的释放情况;(d)纳米微泡所载药物rr-11a的浓度对细胞存活率的影响。图3dii染色的nb,nb-aan,nb-rgd,nb-aan/nb-rgd对于sy-sh-5y细胞的亲和能力评估。(a)为荧光显微镜结果,(b)细胞被不同组纳米微泡亲和后,细胞显现dii的细胞个数百分比。图4dii染色的nb,nb-aan,nb-rgd,nb-aan/nb-rgd对于bend3细胞的亲和能力评估。(a)为荧光显微镜结果,(b)细胞被不同组纳米微泡亲和后,细胞显现dii的细胞个数百分比。图5nb(rr-11a),nb-aan(rr-11a),nb-rgd(rr-11a),nb-aan(rr-11a)/nb-rgd(rr-11a)对于阿尔兹海默病症小鼠治疗后的水迷宫评估,其中(a)为测试60s内水迷宫轨道结果显示,(b)为水迷宫测试过程中小鼠首次通过平台位置的时间;(b)为不同治疗组测试小鼠的新异物体识别结果。具体实施方式突破血脑屏障治疗阿尔兹海默症的载药靶向纳米微泡递送系统的制备方法,具体步骤如下:实施例1.制备nb,具体步骤如下:1)配置磷脂混合液:将1568.07μldppc(10mm)及82.53μlbiotindspe-peg2000(10mm)与3ml三氯甲烷溶剂加于锥形瓶中,密封后置于摇床上摇匀(大约3-4h)。2)旋蒸及乳化:待旋转蒸发仪使得磷脂分子层干燥后,向梨形瓶pbs溶液中加入1ml(5μl/ml)甘油的pbs溶液,将梨形瓶置于旋蒸仪上室温旋转30min,使梨形瓶内壁表面的脂质体分散于水中,此为脂质体的水化过程。再探针超声30min,并用激光笔丁达尔效应初步验证粒径。3)包覆全氟丙烷(c3f8)气体:将梨形瓶内分散体系转移至4mlep管中,将管中气体置换为c3f8,将ep管机械振荡1min,得到的纳米微泡储存于4℃环境中。(实验过程在避光条件下进行)过凝胶柱去除不需要的过大粒径的微泡,得到载药纳米微泡递送系统。实施例2.制备nb(rr-11a),具体步骤如下:1)配置磷脂混合液:将dppc(10mm)与biotindspe-peg2000(10mm)按19:1的摩尔比与3ml三氯甲烷溶剂加于锥形瓶中,将37.6μlrr-11a溶液也混于其中(100mgrr-11a溶解于3ml甲醇中)相当于1.25mg,密封后置于摇床上摇匀(大约3-4h)。若需dii染色的纳米微泡组,在配置磷脂混合液时加入8μldii(1.2mg/ml)。2)旋蒸及乳化:待旋转蒸发仪使得磷脂分子层干燥后,向梨形瓶pbs溶液中加入1ml(5μl/ml)甘油的pbs溶液,将其置于旋蒸仪上室温旋转30min,使梨形瓶内壁表面的脂质体分散于水中,此为脂质体的水化过程。再探针超声30min,并用激光笔丁达尔效应初步验证粒径。3)包覆全氟丙烷(c3f8)气体:将梨形瓶内分散体系转移至4mlep管中,将管中气体置换为c3f8,将ep管机械振荡1min,得到的纳米微泡储存于4℃环境中。(实验过程在避光条件下进行)过凝胶柱去除游离的rr-11a及不需要的过大粒径的微泡。实施例3.制备靶向修饰的载药纳米微泡nb(rr-11a)-aan,具体步骤如下:运用亲和素生物素方法连接纳米微泡与生物素化的aan或rgd分子。将链霉亲和素(493.8μl,100mg/ml)加于1ml实施例2方法制备的纳米微泡悬液中,4℃下震荡30min。超速离心用1xpbs(600μl)洗30min以去除未结合上的链霉亲和素,随后将生物素化的aan分子(619.135μl,2mg/ml)加于溶液中并在4℃下震荡30min。再超速离心去除多余biotin-aan分子,将浓缩液加pbs配置成所需浓度4℃下避光保存。实施例4.制备靶向修饰的载药纳米微泡nb(rr-11a)-rgd结合物,具体步骤如下:运用亲和素生物素方法连接纳米微泡与生物素化的aan或rgd分子。将链霉亲和素(493.8μl,100mg/ml)加于1ml实施例2方法制备的纳米微泡悬液中,4℃下震荡30min。超速离心用1xpbs(600μl)洗30min以去除未结合上的链霉亲和素,随后将生物素化的生物素化的rgd分子(706.875μl,2mg/ml)加于溶液中并在4℃下震荡30min。再超速离心去除多余biotin-rgd,将浓缩液加pbs配置成所需浓度4℃下避光保存。测试方法:1.纳米微泡的表征将1mlnb混合液稀释于14mlpbs中,将2μl稀释后的样品滴加于载玻片与盖玻片间,并用荧光显微镜油镜观察。另取2μl稀释后的样品,通过扫面电子显微镜观察纳米微泡的结构。声诺维微泡作为阳性对照。随后,用azetapotential/nanometerparticlesizeanalyzer在25℃下测定1ml稀释后的纳米微泡与声诺维微泡的粒径与电位。实验重复三次,所有数据表达为±sd。此外,为测定纳米微泡的毒性,我们选用sy-sh-5y细胞运用cck-8评估体外环境中纳米微泡的毒性。实验过程中,将细胞以密度为2000cells/well培养于96孔板中,将梯度浓度的rr-11a加于孔板中,运用platereader(tecan,mannedorf,switzerland)测定各孔在450nm波长下吸光度。2.nb及靶向修饰的nb体外环境中超声影像的检测将不同组纳米微泡分散于10mlpbs的系统作为模拟体外环境超声反射的装置,并将其至于水浴中且一侧用超声探头检测。用amylabtwiceultrasoundsystem(esaote,italy)记录,频率设定为7.5mhz。首先用超声影像观检测模拟装置中的pbs,再200μl(6.0x106bubbles/ml),nb,nb-aan,nb-rgd,nb-aan/nb-rgd,sonovuembs结合物悬液分别注射于pbs底部,并在室温条件下获取超声影像。3.nb(rr-11a)对在不同温度条件下的药物释放情况分析多组nb-(rr-11a)分散于pbs中在4℃及37℃条件下离心,下层不溶物进行冷冻干燥并收集,通过hplc测定rr-11a的量(wleakage),rr-11aleakagepercentage(%)=wleakage/wrr-11ax100%。4.体外环境中nb-aan,nb-rgd特异性靶向作用的测定为测定体外实验中nb-aan的特异性靶向作用,sy-sh-5y细胞及bend3细胞分别培养于添加10%fbs的dmem中,并维持在37℃二氧化碳培养箱中,每两天换液一次。当细胞密度为70-80%,去除dmem,并用无菌pbs洗三次。将6.0x106bubbles/ml灭菌的nb-aan,nb-rgd,nb-aan/nb-rgd分别加于孔板细胞中,另一组用6.0x106bubbles/ml灭菌的nbs作为阴性对照组。孔板轻微搅拌并在室温下孵育30min。重复三次,并用铝箔在避光条件下进行实验。随后,用荧光显微镜观察细胞并记录。并可以通过imagej软件测算得到merge图中被dii染色的不同nb组靶向连接后的细胞百分比。5.nb(rr-11a),nb-aan(rr-11a),nb-rgd(rr-11a),nb-aan(rr-11a)/nb-rgd(rr-11a)对阿尔兹海默病症小鼠治疗后的水迷宫行为学测试及新异物体识别测试1)水迷宫行为学测试:水温控制在25±1℃。将直径为10cm的平台至于第一象限,并低于水面2cm,在训练过程中平台位置保持不变。摄像机至于水池顶端可追踪运动轨迹。对不同组别的小鼠每天训练6-8次,训练五天后进行测试。训练过程中,保持平台在水中,将小鼠从不同象限背向入水,限制时间为每次60s,若小鼠在60s内找到平台,将其置于平台维持30s。若小鼠在60s内未找到平台,也将其引导至平台并维持30s。测试时将平台移除,将小鼠从原平台位置对侧象限背向入水,60s内测试首次通过原平台位置的时间,并记录60s内的小鼠行动轨迹。2)新异物体识别实验:封闭空间放置两个相同物体a与b,上方置摄像装置可记录小鼠轨迹及物体近处滞留时间。小鼠背向放入此封闭空间,记录10min内a物体与b物体近处滞留时间。1h后,将其中一物体b换位新物体c,再将小鼠重新放入此封闭空间,记录10min内a物体与c物体近处滞留时间。实验结果:图1描述了所制备的靶向修饰的载药纳米微泡示意图,球壳由单层磷脂构成,构成球壳的磷脂包括dppc磷脂及biotindspe-peg(2000),此纳米球壳中为c3f8气体,并负载rr-11a药物,通过链霉亲和素可以将biotin的纳米微泡进行靶向修饰与biotinaan或biotinrgd相结合,图1仅以biotinaan为例进行结构描述。图2(a(a))可以看到我们对球壳成功地进行了dii染色,并能够在荧光显微镜下进行成像,由(a(b,c))sem照片也可以看到,我们所制备的纳米微泡呈圆形且粒径均一,具体的不同组纳米微泡的粒径及电位数值见表1。表1nb、nb-aan、nb-rgd及nb-aan/nb-rgd的粒径、分散性指数及电位分析testsamplesdiameter(nm)polydispersityindexzeta-potentioal(mv)nb316.5±9.10.15±0.03-35.82±0.01nb-aan317.1±9.30.17±0.04-35.80±0.01nb-rgd317.0±9.50.16±0.02-35.79±0.01nb-aan/nb-rgd317.1±10.20.17±0.04-35.80±0.01由图2(b)超声造影成像显示我们所制备的nb(rr-11a),nb-aan(rr-11a),nb-rgd(rr-11a),nb-aan(rr-11a)/nb-rgd(rr-11a)均具有很好的成效效果,也说明成功的包裹了气体,为纳米微泡。此结果并与pbs及临床所应用的sonovue相对比进行参照。图2(c)显示nb(rr-11a)包裹药物的稳定性,可以看到相较37℃在4℃条件下具有很好的稳定性。图2(d)的毒性实验显示纳米微泡所载的rr-11a在一定浓度范围内对sy-sh-5y细胞的存活率无影响。而我们在治疗小鼠所用药量在此范围内。图3显示nb-aan及nb-rgd均能够很好的亲和sy-sh-5y细胞,因此nb-aan/nb-rgd也显示较好亲和性。图4显示nb-rgd对于bend3细胞具有很好的亲和性,而nb-aan对此细胞并不显示亲和性,因此也可以看到nb-aan/nb-rgd对于bend3细胞具有一定亲和性,荧光强度均可由图3及图4右图的显现dii荧光的细胞百分比显示。由于球壳由dii染色,亲和在细胞上的纳米微泡也会使得细胞部分显现荧光红色,因此dii显色的细胞数量百分比能过够体现纳米微泡对细胞的亲和性。结果也显示纳米微泡确实成功地进行了靶向修饰。图5(a)显示不同治疗组的小鼠进行水迷宫行为学测试,测试过程中移除平台,从对侧象限背向使小鼠入水,记录60s并记录60s内小鼠行动轨迹(图5a(a)),图5a(b)显示测试过程中,小鼠首次穿过原平台位置的时间,可以看到对于痴呆小鼠生理盐水治疗组所用时间最长,始终未找到平台,时间记录为60s。rr-11a治疗组有一定的治疗效果,nb-(rr-11a)效果略好,而具有靶向修饰的nb(rr-11a)-aan及nb(rr-11a)-rgd具有更好的治疗效果,也由于图3及图4的验证结果,aan修饰的纳米微泡可以亲和sy-sh-5y细胞,rgd修饰的纳米微泡可以亲和sy-sh-5y细胞及bend3细胞。因此水迷宫测试结果显示相较nb(rr-11a)-aan,nb(rr-11a)-rgd显现更好的治疗效果。治疗组中,nb(rr-11a)-aan/nb(rr-11a)-rgd组显示最好的治疗效果,与正常组小鼠的评估数值最为相近。新异物体识别为行为学另一验证方式,治疗效果趋势与水迷宫测试结果的趋势相一致。结论:nb(rr-11a)-aan,nb(rr-11a)-rgd显现较好更好的治疗效果,而nb(rr-11a)-aan/nb(rr-11a)-rgd组显示最好的治疗效果。本发明所制备的靶向载药纳米微泡结合超声技术对于治疗阿尔兹海默病具有很好的治疗效果,克服了目前血脑屏障难以突破的限制,在临床具有良好应用前景。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1