构建大鼠大动脉损伤出血动物模型的方法及在止血材料评价体系中的应用与流程
本发明涉及一种实验动物模型的构建,及将其应用于止血材料性能的评价方法和评价体系构。
背景技术:
出血是人们生活中遇到的常见问题,也是急诊创伤救治和外科手术中威胁伤病员生命安全的重要问题。由于手术止血规范的推广与新型止血器械的发明,外科医生对于手术过程中的止血有了良好的办法。但是,平时生活中受到创伤后出血的急救,纱布压迫止血仍为首选方法,但其效果不尽人意。创伤后1小时是止血救治的“黄金时间”。研究表明,如果能够在此时间内控制出血,80%以上伤病员的生命能够得到充分救治。因此,如何进行有效的止血,对提高患者的医疗效果有重要的意义。
止血材料的开发方兴未艾,国内外已有多种新型止血材料在临床急救与手术中得到应用,包括:天然高分子止血材料、合成高分子止血材料、无机类止血材料、凝血酶类材料等。不同的止血材料具有不同的止血机制。
目前,常见的止血材料有效性实验评估主要包括体内实验和体外实验。
对于止血材料评价的体外实验主要包括:玻片法、毛细血管法、试管法凝血实验、teg血栓弹力图实验等。但由于急救过程中的止血并不只有凝血一项机理,止血材料的凝血性能对于急救止血无法起到决定性作用,上述针对止血材料的体外实验评价方法,存在着一定的局限性。
体内实验一般采用小型猪股动脉损伤止动物血模型,其方法主要是通过股动脉半切构建大动脉损伤出血损伤模型,其关键步骤为:分别在近心端和远心端使用动脉夹阻断血流,后在两动脉夹之间剪断部分动脉壁,先放开远心端的动脉夹,再放开近心端的动脉夹。但是由于各大研究机构的条件差异,受限于实验经费,小型猪实验在某些机构无法开展;并且小型猪实验对于实验操作人员有着较高的要求,不适于在普通研究机构开展研究,因而限制了普通机构对于止血产品的评价。
因此,开发并构建一种简单易行的体内评价模型体系至关重要。目前,采用小动物体内实验对止血材料的性能评价尚未见详细报道。主要原因是由于业界普遍认为小动物的血压低于人体,且小动物出血量小于人体实际出血量,因此模拟不合适。实际上,根据tanase.h.1971年的报道(tanaseh,suzukiy,ooshimaa,etal.geneticanalysisofbloodpressureinspontaneouslyhypertensiverats.[j].japanesecirculationjournal,1970,34(12):1197-212.),正常的15周龄wistar大鼠、donryu大鼠、jaudiced大鼠、spraguredawley大鼠、holtzman大鼠,其收缩压位于118~136mmhg之间,其血压完全满足模拟人体需要。而导致出血量少、出血情况不明显的原因主要是由于器械刺激造成血管痉挛。
技术实现要素:
本发明针对现有用于止血材料评估的动物模型构建及性能评价方法存在的不足,提供一种简单易行、结果可靠的对止血产品性能进行评价的实验模型、评价体系及方法。
实现本发明目的的技术方案是提供一种大鼠大动脉损伤出血动物模型的构建方法,包括如下步骤:
(1)将体重为250~600g的实验大鼠禁食不禁水8~12h,称重,麻醉处理后,取仰卧位固定,将双侧腹股沟充分暴露,对一侧腹股沟区域进行备皮处理;
(2)于一侧髂外动脉垂直腹股沟处切口3~5cm;逐层钝性分离皮下筋膜、肌间结缔组织,选择动脉充分暴露并分离,进一步打开包饶动脉的鞘膜;所述动脉为髂总动脉、髂外动脉或股动脉中的一种,分离长度大于1cm;
(3)将大鼠仰卧位置于37℃热台15min,完全离断暴露的所选动脉,得到大鼠大动脉损伤止血动物模型。
对实验大鼠的麻醉处理包括以6g/kg的剂量腹腔注射水合氯醛、以5l/min吸入异氟烷诱导麻醉、以2.5l/min吸入异氟烷维持麻醉或以1ml/kg盐酸氯胺酮/盐酸甲苯噻嗪肌肉注射麻醉。
本发明技术方案还包括上述大鼠大动脉损伤出血动物模型在评价止血材料性能中的应用,评价过程包括如下步骤:
(1)将大鼠大动脉损伤出血动物模型仰卧位置于37℃热台,计算0~10s时间内伤口的出血量,记为第一阶段的出血量;
(2)将称量过质量的止血材料置于出血伤口处进行止血,按压60s,再撤除按压力,由止血材料自行止血,观察止血材料止血情况,有无活动性出血,持续观察大鼠生命体征,包括呼吸、心跳、瞳孔大小;
(3)活动大鼠伤肢,做髋关节屈曲伸展往复运动10次,观察伤口有无活动性出血;
(4)取下止血材料,计算第10s~10min时间内模型第二阶段的出血量,观察伤口情况,以第一阶段出血量与第二阶段出血量之和为总出血量;
(5)对止血材料的性能进行评价。
本发明提供的大鼠大动脉损伤出血动物模型在用于评价止血材料性能中,其评价体系包括:
(1)前10s出血量:
离断大鼠大动脉后0~10s的出血量,用于间接评价模型建立的一致性;
(2)前10s出血量与体重比:
离断大鼠大动脉后0~10s的出血量与大鼠体重之比,用于直接评价模型建立的一致性;
(3)总出血量:
第一阶段出血量与第二阶段出血量之和为大鼠的总出血量,用于间接评价止血产品的止血效果;
(4)总出血量与体重比:
第一阶段出血量与第二阶段出血量之和,与大鼠体重之比,用于直接评价止血产品的止血效果;
(5)止血时间:
在评价过程的10min内,至无活动性出血所需的时间,用于直接评价止血产品的止血效果;
(6)止血材料有效率:
止血材料质量与出血量之比;
(7)血栓稳定性:
观察髋关节屈曲伸展往复运动10次后,伤口有无活动性出血;
(8)伤口表面情况:
观察伤口是否有化学性、物理性损伤,是否有继发性出血;观察止血材料与止血部位组织的粘合度,及组织急性炎症反应;
(9)组织学切片观察:
处死大鼠后,将止血部位组织切下,进行相关组织学观察,包括:苏木素-伊红染色、masson染色、免疫组化染色,对伤口进行组织学评价。
可采用过量注射麻醉药物、胸腔气胸处死、过量二氧化碳吸入方法处死大鼠。
本发明用于进行性能评价的止血产品包括:止血粉、止血凝胶、止血喷剂、止血敷料、止血棉和止血纱布等。
在构建大鼠大动脉损伤出血动物模型时,可使用眼科剪、手术刀片、环锯等工具对大鼠做离断大动脉;在对大鼠出血动物模型施加压力时,应该由同一实验人操作;每次给予的外部压力应一致,不宜过大,以不使止血产品滑脱或冲出为标准;自由出血10s,可以棉球收集血液,10s后立即用止血产品作用于出血位置,并施加压力辅助止血1min;1min后撤除外部压力,观察出血情况,是否有活动性出血渗出;10min后取出止血产品,观察伤口是否有化学性、物理性损伤,是否有继发性出血;观察止血材料与止血部位组织的粘合度,及组织急性炎症反应。
与现有技术相比,本发明技术方案具有以下显著的有益效果:
1.本发明采用的大鼠相较于小型猪其作为实验模型载体,来源广泛,操作容易,小动物的选择使得这一评价体系更具普适性。
2.本发明将大鼠置于37℃热台15min后进行试验,克服了器械对于血管的刺激作用,使痉挛的血管得以舒张,出血情况与人体接近;37℃的温度使得大鼠的血液循环接近于正常情况,因此,评价体系的科学性进一步提升。这是大动物实验无法实现的。
3.本发明将前10s出血量与体重比、总出血量与体重比作为评价体系,避免了实验动物之间的个体差异性对评价的影响,保证了评价结果的科学性。
附图说明
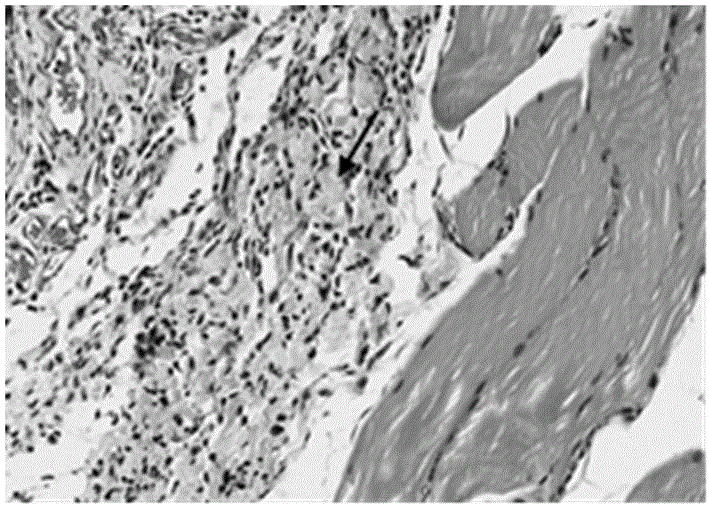
图1是本发明实施例提供的止血材料用于实验部位后皮肌经he染色的切片图。
具体实施方式
下面结合附图和实施例对本发明技术方案作进一步的阐述。
实施例1
本实施例对市售止血材料在大鼠髂外动脉全切损伤出血模型的止血性能进行测试。
1.实验材料
450~550gsd大鼠4只,雌雄不限;
某市售止血产品;
干净棉球若干;
灭菌实验器械2套;
无菌实验服2套;
控温热台1套;
无菌脱毛刀2把。
2,实验步骤
步骤(1):实验准备
a.称量棉球质量;
b.大鼠术前禁食8~12小时;
c.术前称重,用7%水合氯醛6ml/kg腹腔注射麻醉或5l/min吸入异氟烷诱导麻醉,2.5l/min吸入异氟烷维持麻醉或1ml/kg盐酸氯胺酮/盐酸甲苯噻嗪肌肉注射麻醉等;
d.实验员者洗手消毒、穿无菌实验服、佩戴手套;
e.大鼠取仰位固定在手术台上,备皮、消毒、铺单。
步骤(2):大鼠髂外动脉全切损伤出血模型建立
a.术者触摸探查大鼠大腿内侧、腹股沟处,确定髂外动脉波动处,此处即为切口位置;
b.沿大腿内侧皮肤作一切口,逐层分离周围组织,充分暴露髂外动脉,带线标记髂外动脉;
c.将大鼠置于37℃控温热台10分钟,使大鼠体温维持在正常范围,以减小由于手术器械造成的髂外动脉收缩;
d.将大鼠从控温热台取下,固定于手术台上,拉勾充分暴露髂外动脉视野,用眼科剪完全剪断髂外动脉,见动脉近心端血液喷出后,立即使用一枚已称量过质量的棉球收集血液10秒;
步骤(3):按压阶段
a.棉球对照组
立即使用一枚已称量过质量的棉球按压60秒;如血液过多完全浸湿棉球,则更换一枚已称量过质量的棉球,继续按压,直至60秒。
b.市售止血材料组
取适量市售止血材料,直接将其倒于伤口,由同一术者按压60秒;如血液过多完全材料,则增加材料使用量,继续按压,直至60秒。
c.材料组材料使用量
称量剩余材料质量(g),材料使用量(g)=使用前材料质量(g)-剩余材料质量(g)
步骤(4):无按压阶段
去除拉钩与外力按压,等待至10分钟,期间观察大鼠心跳、呼吸、瞳孔大小等生命体征,观察伤口有无活动性出血。
步骤(5):材料取出阶段
出血量试验:取下棉球或止血材料,观察材料取下状态、观察伤口是否止血成功(取下材料后是否有二次出血)。
血栓稳定试验:取患肢髋关节屈曲伸展往复运动10次,观察伤口有无活动性出血。
步骤(6):出血情况评价阶段
出血量试验:
(1)止血情况
观察伤口是否有化学性、物理性损伤,观察止血材料与止血部位组织的粘合度,及组织急性炎症反应,材料取下状态及二次出血情况。
(2)出血量
前10s出血量(g)=前10s用棉球质量(g)-原前10s用所有棉球质量(g)
对照组出血量(g)=所有棉球质量(g)-原所有棉球质量(g);实验组出血量(g)=取出材料质量(g)-材料使用量(g)。
前10s出血量:
离断大鼠大动脉后前10s的出血量,用于间接评价模型建立的一致性;
前10s出血量与体重比:
离断大鼠大动脉后前10s的出血量与体重之比,用于直接评价模型建立的一致性;
(3)出血量与体重比
总出血量与体重比=出血量(g)/大鼠体重(g)×100%
(4)止血时间:
在评价过程的10min内,至无活动性出血所需的时间,用于直接评价止血产品的止血效果。
(5)止血材料有效率:
材料使用量与总出血量之比。
(6)大鼠生命体征:在评价过程的10min内,持续观察大鼠生命体征,包括于呼吸、心跳、瞳孔大小等。
(7)血栓稳定性平行试验,观察髋关节屈曲伸展往复运动10次后,伤口有无活动性出血。
(8)组织学切片观察:
采用过量注射麻醉药物、胸腔气胸处死、过量二氧化碳吸入等方法处死大鼠后,将止血部位组织切下,进行相关组织学观察,将止血部位组织切下,进行苏木素-伊红(he)染色,并行组织学观察。参见附图1,它是本实施例所取某市售止血材料实验部位皮肌经he染色后的切片图,图中局部可见肌纤维溶解坏死,并伴有大量的炎性细胞浸润(黑色箭头处)。
实验结果参见表1。
表1
- 还没有人留言评论。精彩留言会获得点赞!