维生素D及其组合物的抗菌用途的制作方法
本发明涉及维生素d化合物在制备用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物中的用途。更为特别地,涉及用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物组合物和药物制剂。
背景技术:
尿路感染(urinarytractinfection,uti)又称泌尿系统感染,是致病菌侵入尿路,在尿液中生长繁殖,并侵染尿路黏膜或组织而引起的炎症。尿路感染是一种多发性疾病,在感染性疾病中仅次于呼吸道感染而居第二位,也是成年人中最常见的感染性疾病之一。全世界范围内每年感染的患者超过1.5亿人。在美国,每年因尿路感染就诊者超过800万,住院患者约100万,因尿路感染致休克而死亡者在所有因感染致死者中居第三位。在我国,尿路感染约占医院感染的20.8%~31.7%,其发病率根据我国人口统计占总人口的0.91%,女性与男性的比例约为8:1。据统计,未婚女青年尿路感染的发病率为2%,而已婚女性的发病率增至5%,这与女性成年后开始月经周期、性生活和妊娠等有关。而对于绝经后妇女,下尿路感染更为常见,且发病率随年龄增长而升高,60~65岁以后的下尿路感染发病率为10~20%,80岁以后为25~50%。尿路感染极易复发,一份独立的回顾性研究表明,曾发生一次或多次尿路感染的患者,一年内复发的概率高达70%。
尿路感染本身有容易反复发作的特点,其与抗生素的滥用,细菌耐药性的产生,粘膜局部免疫功能的下降等有着密切的关系。临床实践中,女性反复发作性尿路感染患者主诉症状多而繁杂,不仅包括尿路刺激症状,还有失眠、心跳快、胸闷、饭量减少、便秘或腹泻等其他系统症状,而且常常伴有诸如情绪低落、焦虑烦躁等精神症状,给患者带来极大的身体和精神上的痛苦。
尿路感染根据发生的部位可以分为上尿路感染和下尿路感染。上尿路感染是指肾盂肾炎,感染部位包括肾盂,输尿管和肾实质。下尿路感染包括膀胱炎和尿道炎。肾盂肾炎严重时引发肾功能损伤甚至衰竭,而革兰氏阴性杆菌败血症多由尿路感染引起,少数败血症病人可发生明显的休克,伴有心、脑、肾缺血的临床表现。
尿道炎是一种常见病,指尿道粘膜的炎症,女性好发。临床上可分为急性和慢性、非特异性尿道炎和淋菌性尿道炎。多为致病菌逆行侵入尿道引起。当细菌进入膀胱或肾脏在尿液中繁殖,便引起尿道炎。致病菌包括大肠杆菌,链球菌和葡萄球菌等。
膀胱炎是发生在膀胱的炎症。细菌性膀胱炎是最常见的一种膀胱炎,发病原因是身体表面的细菌从尿道口入侵,在膀胱内增殖,常并有频尿、尿急、排尿灼热感或疼痛、血尿等症状。发作的过程大多很迅速,半天之内就会造成严重不适,甚至在几天内蔓延到肾脏而成为急性肾盂肾炎。大肠杆菌是最常引起膀胱炎的细菌之一,尤其在喝水量不足、憋尿的状况下,更容易让细菌有机会在膀胱滋生。
任何致病菌均可引起尿路感染,但绝大多数为革兰阴性杆菌,如大肠杆菌、副大肠杆菌、变形杆菌、克雷伯杆菌、绿脓杆菌、少数为肠球菌和葡萄球菌。尿路致病性大肠杆菌(uropathogenice.coli,upec)是尿路感染中最常见的致病菌,约占60%~80%。据统计,90%的尿路感染门诊病人和50%左右的住院病人是由致尿路感染大肠杆菌upec导致的。当致病菌感染泌尿道时,致病菌可释放内毒素,作用于输尿管平滑肌,使其蠕动减退,从而导致输尿管尿液淤滞,管腔内压力升高,形成生理性梗阻,引起膀胱输尿管返流,使得感染尿液逆流而上,造成上行性感染。致病菌细胞壁的特殊结构使其很容易黏附在尿道上皮,一旦黏附,致病菌在排尿时就不容易被冲走,从而能够在尿道和膀胱内共生、繁殖、形成菌落等。致病菌还可以进一步侵袭膀胱上皮细胞,开始进入致病周期,致病菌在细胞内大量生长、形成菌膜,并形成胞内菌落,在体内长期贮存,这也是导致泌尿道反复发作的主要原因。
正常情况下,致病菌在尿路不易停留、繁殖,故不会引起感染。这是由于泌尿、生殖系统的生理防御功能,其中最为主要的是分泌抗菌肽。一旦有病原体入侵时,抗菌肽就能起到杀菌的作用,且这个反应过程相当迅速,使得致病菌尚未在体内繁殖就已经被清除。但是,这种抗感染的防御功能一旦减弱,致病菌就会趁虚而人,从而诱发感染。
抗菌肽作为天然免疫系统的第一道防线,对病原微生物具有很好的防御作用。抗菌肽又被称为抗生素肽、抗微生物肽,是由多种生物细胞特定基因编码经外界条件诱导产生的一类具有光谱抗细菌、真菌、病毒、原虫、抑杀肿瘤细胞等活性作用的多肽。抗菌肽多为20~60个氨基酸的肽,一般带正电且具有两亲性,后者使得它们在水溶环境和疏水环境(如膜)都能达到较高浓度。抗菌肽能快速吸附在入侵微生物的膜上并将其杀死。由于其杀菌机制不同于传统抗生素,细菌不易产生耐药性。现研究较多的人抗菌肽是防御素和cathelicidin(也称为ll-37)。正常情况下人尿路中可检测到低水平的cathelicidin,一旦有微生物侵入,编码cathelicidin的mrna表达量迅速上升。chromek等用大肠杆菌分别感染cathelicidin基因敲除和野生型鼠,结果基因敲除的鼠下尿道细菌数明显高于野生型。
维生素d在人体营养中占重要地位,它是一种脂溶性维生素,人体内主要以维生素d2(麦角钙化醇)和维生素d3(胆钙化醇)两种形式存在。人体主要依靠食物摄取和皮肤合成获得维生素d。皮肤中的7-脱氢胆固醇经波长290~320mm的紫外光照射下合成维生素d前体。两种来源的维生素d都不能在血液中长期循环,而是马上就被脂肪组织或肝脏摄取,以用来储存或活化。活化后的维生素d能够与其受体vdr结合进入细胞核内,调节多种基因的表达,vdr广泛存在于人体各种细胞中,因而维生素d具有广泛的生物学作用,比如以往所熟知的促进钙磷代谢吸收的功能,以及近年来逐渐被发现的促进细胞分化、抑制细胞增殖、促进分泌抗菌肽、增强固有免疫、抑制特异性免疫等。
通过太阳直接照射皮肤是人体产生天然维生素d的主要方式,但由于现代社会生活习惯的改变,现代人待在室内时间加长,较多地使用防晒产品,使得人们接受到足够的阳光照射机会较少,而能够提供维生素d的食物来源又非常有限(如鱼肝油、一些水栖哺乳动物的肝脏和脂肪等),因此大部分人无法从常规饮食中补充维生素d,导致目前全球范围内维生素d缺乏呈普遍趋势,国外众多大型流行病学调查显示(包括美国、加拿大、英国、法国、德国、西班牙、俄罗斯、新西兰、以色列等),在大龄儿童、青年和中年人中约有50%~70%的人群处于维生素d缺乏状态。而我国维生素d缺乏形势更为严峻,特别是中国人的膳食结构中缺乏富含维生素d的食物,在现代生活中接触阳光和户外活动的机会也大大减少,因此我国居民出现维生素d缺乏的几率将比西方人更高,据中科院研究发现我国中老年人群缺乏维生素d现象更为严重,其调查结果显示我国中老年人血液中含有的维生素d的水平整体较低,维生素d不足者占93.6%,维生素d充足者仅占6.4%。
维生素d缺乏或不足对人体的免疫能力具有极其不利的影响,降低对尿路感染反复发作的抵抗力。虽然暂未有流行病学研究数据证实维生素d缺乏会导致免疫能力下降的直接证据,但已有流行病学研究显示体内25(oh)d血清浓度降低而呈现上呼吸道感染率增加的关系,另有流行病学研究显示母婴体内维生素d缺乏与婴儿急性下呼吸道感染的高发病率相关,gibney等人研究显示维生素d缺乏与肺结核发病率相关,这些研究都从侧面揭示维生素d缺乏或不足对系统免疫能力或会造成一定负面的影响。另外孕妇和高龄妇女都是维生素d缺乏或不足的高危人群,有研究显示2%~10%的孕妇及高达20%的80岁以上妇女有无症状菌尿,发病概率远远超过普通人,提示我们这两者之间可能存在某种内在联系。
现膀胱炎、尿道炎和/或尿路感染治疗主要采取抗生素疗法,包括磺胺类、硝基呋喃类、磷霉素、氟喹诺酮类、青霉素类、头孢菌素类、碳青霉烯类、氨基糖苷类、大环内酯类、糖肽类等抗菌药物。常用的抗生素有:甲氧苄啶和磺胺甲恶唑(tmp-smx)、呋喃妥因(nitrofurantoin)、环丙沙星(ciprofloxacin)、左氧氟沙星(levofloxacin)头孢曲松、青霉素、阿莫西林等。由于抗生素治疗尿路感染见效快,能够快速缓解症状,所以大剂量的抗生素受到医生和患者的认可,然而抗生素的使用,却为患者埋下了成为尿路感染易感人群的隐患。长期使用抗生素会使细菌产生耐药性,使药物效果变差,甚至无效。因此尽管抗生素一定程度上能降低膀胱炎、尿道炎和/或尿路感染,但是抗生素广泛应用的代价同样是高昂的:耐药菌的不断增加以及破坏患者体内的正常菌群数量。有一项研究表明从膀胱炎、尿道炎和/或尿路感染患者中分离的大肠杆菌在1998年至2003年5年间对环丙沙星、阿莫西林-克拉维酸、tmp-smx抗性明显增加。抗生素滥用将导致耐药性的细菌不断增加,细菌对药的抗性使得抗生素用量加大或不断寻求杀菌更强的抗生素,造成经济上的浪费;并且其盲目杀菌作用也导致体内有益菌的减少,对人体造成不必要的伤害。抗生素可以快速抑制细菌增殖,但不能提高机体自身的固有免疫,当病原体再次侵入时,体内固有免疫仍不足以将病原体杀死,感染易复发。前文也提到膀胱炎、尿道炎和/或尿路感染的高复发率,现阶段单用抗生素疗法不能降低其高复发率,且易造成医疗资源的浪费和经济的重大损失。例如对于女性复发性尿路感染,即半年内复发2次或2次以上或者1年内复发3次或3次以上,还需抗生素预防治疗,包括持续性给药法和性交后服药法。对于持续性给药法,在急性发病期采用高剂量抗生素痊愈后,根据病人的药敏实验结果选择低剂量抗生素服用半年至一年。因此现亟需一种有效的新的防治方法,能够单独使用或同抗生素疗法联用以降低膀胱炎、尿道炎和/或尿路感染的高复发率。
膀胱炎、尿道炎和/或尿路感染的一大诱因是机体自身固有免疫力下降,增强自身固有免疫能力是降低膀胱炎、尿道炎和/或尿路感染复发率的一条途径。而活性维生素d与vdr(vitamindreceptor,维生素d受体)结合进入细胞核内,作用于多种靶基因,可增强人的固有免疫、上调抗菌肽的表达,抑制病菌粘附,杀灭或抑制病原体,减少复发率,其理论依据和实验结果使新的膀胱炎、尿道炎和/或尿路感染的防治药物成为可能。同时由于传统抗生素的大量使用导致了耐药病原微生物的迅速增长,因此现在亟待开发出新型抗生素来对付世界范围内日益严重的病原微生物耐药性。抗菌肽在自然界分布广泛,是生物体产生的抵御外源性感染的内源性物质,历经数百万年而很少产生耐受性,具有作用迅速、强大、广谱等特点,具有广谱抗菌且有独特的抗菌机制的抗菌肽显然在克服细菌耐药性方面具明显优势。因此抗菌肽单独使用或者与抗生素联合使用在治疗细菌感染性尿道炎领域具有较好的应用前景。本申请提供了一种可有效降低膀胱炎、尿道炎和/或尿路感染复发的药物制剂,通过降低膀胱炎、尿道炎和/或尿路感染的复发,改善患者的生活质量,并减少抗生素的应用,缓解目前临床上抗生素滥用的状况。维生素d化合物在制备用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物中的应用必将大大改观膀胱炎、尿道炎和/或尿路感染的防治状况。维生素d化合物应用诱导产生的抗菌肽在制备用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物中的应用也必将大大改观膀胱炎、尿道炎和/或尿路感染的防治状况。
技术实现要素:
a.发明概述
本发明涉及维生素d化合物在制备用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物中的用途。本发明涉及维生素d化合物在制备用于预防或治疗膀胱炎的药物中的用途。本发明涉及维生素d化合物在制备用于预防或治疗尿道炎的药物中的用途。本发明涉及维生素d化合物在制备用于预防或治疗尿路感染的药物中的用途。本发明涉及抗菌肽在制备用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物中的用途。本发明涉及抗菌肽在制备用于预防或治疗膀胱炎的药物中的用途。本发明涉及抗菌肽在制备用于预防或治疗尿道炎的药物中的用途。本发明涉及抗菌肽在制备用于预防或治疗尿路感染的药物中的用途。其中所述尿路感染包括上尿路感染和下尿路感染,根据病原体的感染部位可分为尿道炎、膀胱炎、肾盂肾炎。其中所述尿路感染由致病菌引起的,致病菌绝大多数为革兰阴性杆菌,如大肠杆菌、副大肠杆菌、变形杆菌、克雷伯杆菌、绿脓杆菌、链球菌、肠球菌和葡萄球菌。在一个优选实施方案中,维生素d化合物是维生素d受体配体(vdr配体)。在一个更优选的实施方案中,维生素d化合物是维生素d受体的激动剂。优选地,维生素d化合物包括维生素d2化合物、维生素d3化合物、其异构体、活化形式或类似物。优选地,维生素d化合物包括维生素d2、d3和其类似物。在某些实施方案中,维生素d化合物是维生素d的活化形式,例如骨化二醇(25-ohd3)或骨化三醇(1,25-(oh)2d3)。在一个优选的实施方案中,其中所述尿路感染是由革兰阴性杆菌引起的。在一个更优选的实施方案中,其中所述尿路感染是由大肠杆菌引起的。
另一方面,本发明涉及一种预防或治疗膀胱炎、尿道炎和/或尿路感染的药物组合物,该组合物包括维生素d化合物和其它用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物。本发明涉及一种预防或治疗膀胱炎的药物组合物,该组合物包括维生素d化合物和其它用于预防或治疗膀胱炎的药物。本发明涉及一种预防或治疗尿道炎的药物组合物,该组合物包括维生素d化合物和其它用于预防或治疗尿道炎的药物。本发明涉及一种预防或治疗尿路感染的药物组合物,该组合物包括维生素d化合物和其它用于预防或治疗尿路感染的药物。本发明涉及一种预防或治疗膀胱炎、尿道炎和/或尿路感染的药物组合物,该组合物包括抗菌肽和其它用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物。本发明涉及一种预防或治疗膀胱炎的药物组合物,该组合物包括抗菌肽和其它用于预防或治疗膀胱炎的药物。本发明涉及一种预防或治疗尿道炎的药物组合物,该组合物包括抗菌肽和其它用于预防或治疗尿道炎的药物。本发明涉及一种预防或治疗尿路感染的药物组合物,该组合物包括抗菌肽和其它用于预防或治疗尿路感染的药物。在一个优选实施方案中,维生素d化合物是维生素d受体配体(vdr配体)。在一个更优选的实施方案中,维生素d化合物是维生素d受体的激动剂。优选地,维生素d化合物包括维生素d2化合物、维生素d3化合物、其异构体、活化形式或类似物。优选地,维生素d化合物包括维生素d2、d3和其类似物。在某些实施方案中,维生素d化合物是维生素d的活化形式,例如骨化二醇(25-ohd3)或骨化三醇(1,25-(oh)2d3)。在一个优选实施方案中,其它用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物是某一抗生素,如磺胺类、硝基呋喃类、磷霉素、氟喹诺酮类、青霉素类、头孢菌素类、碳青霉烯类、氨基糖苷类、大环内酯类、糖肽类等类别的抗生素。如甲氧苄啶和磺胺甲恶唑(tmp-smx)、呋喃妥因(nitrofurantoin)、环丙沙星(ciprofloxacin)、头孢曲松、左氧氟沙星(levofloxacin)、青霉素阿莫西林等。在某些实施方案中,本发明的药物组合物适合于局部或口服施用于受试者。在其它实施方案中,正如下文所描述的,本发明的药物组合物可以被特殊配制成以固体或液体形式施用,如口服施用、肠胃外施用、局部施用等。
另一方面,本发明提供了一种预防或治疗膀胱炎、尿道炎和/或尿路感染的药物制剂,该药物制剂含有维生素d化合物以及药学上可接受的载体。本发明提供了一种预防或治疗膀胱炎的药物制剂,该药物制剂含有维生素d化合物以及药学上可接受的载体。本发明提供了一种预防或治疗尿道炎的药物制剂,该药物制剂含有维生素d化合物以及药学上可接受的载体。本发明提供了一种预防或治疗尿路感染的药物制剂,该药物制剂含有维生素d化合物以及药学上可接受的载体。本发明提供了一种预防或治疗膀胱炎、尿道炎和/或尿路感染的药物制剂,该药物制剂含有抗菌肽以及药学上可接受的载体。本发明提供了一种预防或治疗膀胱炎的药物制剂,该药物制剂含有抗菌肽以及药学上可接受的载体。本发明提供了一种预防或治疗尿道炎的药物制剂,该药物制剂含有抗菌肽以及药学上可接受的载体。本发明提供了一种预防或治疗尿路感染的药物制剂,该药物制剂含有抗菌肽以及药学上可接受的载体。在一个优选实施方案中,维生素d化合物是维生素d受体配体(vdr配体)。在一个更优选的实施方案中,维生素d化合物是维生素d受体的激动剂。优选地,维生素d化合物包括维生素d2化合物、维生素d3化合物、其异构体、活化形式或类似物。优选地,维生素d化合物包括维生素d2、d3和其类似物。在某些实施方案中,维生素d化合物是维生素d的活化形式,例如骨化二醇(25-ohd3)或骨化三醇(1,25-(oh)2d3)。在某些优选实施方案中,药学上可接受的载体是下述某一物质,如:糖类、淀粉、纤维素及其衍生物、明胶、滑石粉、赋形剂、油类、多元醇、酯类、缓冲剂、海藻酸或药物制剂中采用的其它无毒的相容性物质。本发明组合物可加入制备不同剂型时所需的各种常规辅料,如崩解剂、润滑剂、粘合剂、抗氧剂、络合剂等药用载体,以常规的制剂方法制成任何一种常用的口服剂型,如分散片、颗粒剂、胶囊剂、口服液等其他剂型。本发明的药物制剂的剂型可以为片剂、胶囊、注射剂、输注剂、吸入剂软膏剂或栓剂,但不限于此。
另一方面,本发明涉及提供了一种预防或治疗膀胱炎、尿道炎和/或尿路感染的药盒,该药盒含有如上所述的药物组合物或药物制剂以及如何使用该组合物或药物制剂的说明书。本发明涉及提供了一种预防或治疗膀胱炎的药盒,该药盒含有如上所述的药物组合物或药物制剂以及如何使用该组合物或药物制剂的说明书。本发明涉及提供了一种预防或治疗尿道炎的药盒,该药盒含有如上所述的药物组合物或药物制剂以及如何使用该组合物或药物制剂的说明书。本发明涉及提供了一种预防或治疗尿路感染的药盒,该药盒含有如上所述的药物组合物或药物制剂以及如何使用该组合物或药物制剂的说明书。
b.释义
除另有定义,这里使用的所有科技术语与本发明所属技术领域的普通技术人员理解含义相同。所有专利文献、专利申请文献、公开的专利文献和其它出版物均作为参考。如本节阐述的定义与上述参考文献所述的定义不一致或相反时,以本节阐述的定义为准。
本文所用的术语“维生素d化合物”包括任何能够预防或治疗膀胱炎、尿道炎和/或尿路感染的维生素d化合物,一般而言,为维生素d受体配体(vdr配体)并且能够预防或治疗膀胱炎、尿道炎和/或尿路感染的维生素d化合物被视为本发明的范围内,维生素d化合物优选地是维生素d受体的激动剂。因此,维生素d化合物旨在包括开环甾类,适用本发明的方法的具体维生素d化合物的实例在本文中有进一步描述。维生素d化合物包括维生素d2化合物、维生素d3化合物、其异构体、活化形式或类似物。优选的维生素d化合物是维生素d3化合物,它们是维生素d受体的配体(更优选地是激动剂)。维生素d2化合物和维生素d3化合物分别包括维生素d2、d3和其类似物。在某些实施方案中,维生素d化合物可以是甾类,例如开环甾类,例如骨化醇(vd3)、骨化二醇(25-ohd3)或骨化三醇(1,25-(oh)2d3)。
术语“抗菌肽”是指是由多种生物细胞特定基因编码经外界条件诱导产生的一类具有光谱抗细菌、真菌、病毒、原虫、抑杀肿瘤细胞等活性作用的多肽。多为20~60个氨基酸的肽,不同来源、不同结构的抗菌肽的一级结构具有较强的保守性,且n端富含极性氨基酸,绝大多数抗菌肽的第二位氨基酸残基是trp,c端通常酰胺化,分子中间富含pro,现研究较多的人抗菌肽是防御素和cathelicidin(也称为ll-37)。作为例子,但并非为了限制的目的,本发明的抗菌肽氨基酸序列如下:llgdffrkskekigkefkrivqrikdflrnlvprtes(seqidno:1)。
术语“其它用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物”是指已知的可用于预防或治疗膀胱炎、尿道炎和/或尿路感染的药物,包括现有的各种抗生素,包括磺胺类、硝基呋喃类、磷霉素、氟喹诺酮类、青霉素类、头孢菌素类、碳青霉烯类、氨基糖苷类、大环内酯类、糖肽类等抗菌药物。常用的抗生素有:甲氧苄啶和磺胺甲恶唑(tmp-smx)、呋喃妥因(nitrofurantoin)、环丙沙星(ciprofloxacin)、左氧氟沙星(levofloxacin)、头孢曲松、青霉素、阿莫西林等。术语“药学上可接受的”表示在合理的医学判断范围内适合于与人类和动物的组织接触使用、没有过度的毒性、刺激作用、变态反应或者其它问题或并发症。
术语“药学上可接受的载体”包括药学上可接受的材料、组合物或媒介物,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料,它们参与将主题化学物质从机体的一个器官或一个部分携带或运输到机体的另一个器官或另一个部分。每种载体必须是“可接受的”,意义是与制剂其它成分相容并对患者无害。
术语“施用”包括向受试者引入维生素d化合物以发挥它们预期功能的途径,可使用的施用途径的实例包括注射(皮下、静脉内、肠胃外、腹膜内)、口服、吸入、直肠、透皮或经由膀胱滴注,口服施用是优选的。本发明的制剂可以口服、或经静脉、皮下、肌内、经皮肤、鼻内、或直肠途径的胃肠外给药,或吸入给药。用于口服给药的剂型包括片剂、丸剂、粉剂、颗粒剂、液体剂、悬浮剂、糖浆剂、胶囊剂等。
附图说明
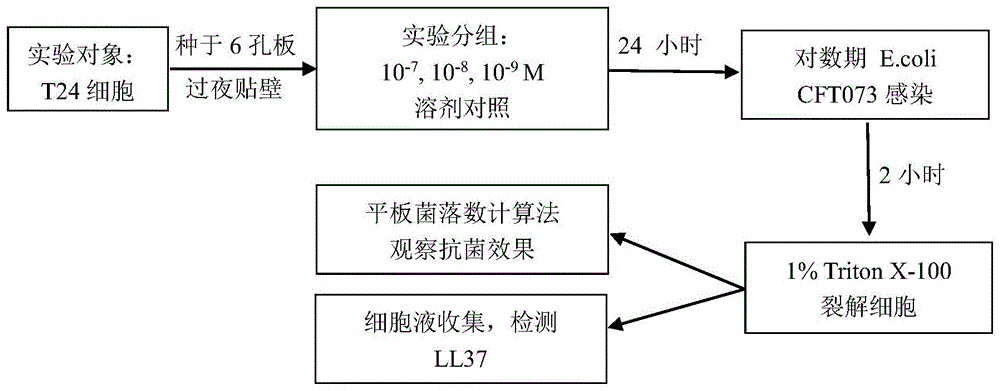
图1:1α,25-(oh)2d3抑菌作用实验设计与分组。
图2:1α,25-(oh)2d3预处理促进尿路致病菌e.colicfto73感染后的尿路上皮细胞(t24细胞)分泌抗菌肽ll37。
图3:1α,25-(oh)2d3对尿路上皮细胞(t24细胞)的预处理抑制尿路致病菌e.colicfto73菌落生长。
图4:ll37对万古霉素耐药屎肠球菌atcc700221的杀菌曲线。
图5:ll37对esbls阳性大肠埃希菌15f017的杀菌曲线。
图6:1α,25-(oh)2d3抑菌作用实验设计与分组。
图7:1α,25-(oh)2d3对上皮细胞t24的预处理抑制尿路致病菌e.colicfto73菌落生长。
图8:1,25-(oh)2d3对上皮细胞5637的预处理抑制尿路致病菌e.colicfto73菌落生长。
图9:1α,25-(oh)2d3对上皮细胞sv-huc-1的预处理抑制尿路致病菌e.colicfto73菌落生长。
图10:1α,25-(oh)2d3和头孢曲松联合用药抑菌作用实验设计与分组。
图11:1α,25-(oh)2d3与头孢曲松联合用药抑制t24细胞尿路致病菌e.colicfto73菌落生长。
图12:1α,25-(oh)2d3与头孢曲松联合用药抑制t24细胞尿路致病菌e.colicfto73菌落生长。
图13:ll37和头孢曲松联合用药抑菌作用实验设计与分组。
具体实施方式
实施例1:1α,25-(oh)2d3(维生素d3活性形式)诱导感染大肠杆菌的t24细胞
分泌ll37抗菌肽的浓度检测
1研究目的
本研究旨在考察活性维生素d3(1α,25-(oh)2d3)对尿路上皮细胞的预处理,是否可以促进该细胞产生足够的抗菌肽ll37,抑制致病性大肠杆菌e.colicfto73对该细胞的感染,以为维生素d3治疗反复下尿路感染提供药效学实验依据,同时阐明维生素d3剂量与膀胱上皮局部分泌抗菌肽间的定量关系。
2实验材料
2.1供试品
1α,25-(oh)2d3(维生素d3的活性形式)
生产厂家:sigma-aldrich纯度:≥99%(hplc)
2.2实验用细胞和菌株
2.2.1实验用细胞
t24细胞购买于中国科学院典型培养物保藏委员会细胞库。培养条件为含10%胎牛血清(fbs)的1640培养基,5%co2,37℃。sv-huc-1细胞购于中国科学院典型培养物保藏委员会细胞库,培养条件为含10%胎牛血清(fbs)的f12培养基,5%co2,37℃。
2.2.2实验用菌株
e.colicfto73购买于atcc。
2.3主要试剂
3实验仪器与设备
4实验方法
4.11α,25-(oh)2d3储存液配置
4.1.10.1mg包装(2×10-4m)
加入1.2ml无水乙醇,混匀。储存液浓度为2×10-4m,分装100μl/每支,避光冻存于-20℃。将储存液用无水乙醇梯度稀释至2×10-5m、2×10-6m、2×10-7m、2×10-8m,待用。
4.2e.colicfto73培养
4.2.1备用菌液
从液氮中取出1支保种用的e.colicfto73,冷冻状态下,用枪头取出小块,加入5ml牛肉汤培养基(atcc建议培养基),37℃,220rpm,过夜培养。第二天,将5ml菌液倒入100ml牛肉汤培养基,混匀,37℃,220rpm,约8小时,将菌液分装100μl/每支,储存于-80℃备用。
4.2.2对数生长期的菌液
从-80℃中取1支备用菌液,以1:300比例加入lb培养基中(10μl备用菌液加入到3mllb培养基中),37℃,220rpm,过夜培养。第二天,取50μl菌液加入到3mllb培养基,37℃,220rpm,约2~3小时,e.colicfto73此时处在生长对数期。用纯化水将此菌液稀释,使96孔板一孔中加入200μl菌液的od600=0.55,对应细菌浓度约为5×108个/ml,之后再用纯化水稀释32倍,作为感染用菌液。感染细胞时,每2ml培养基中加20μl菌液。
4.3试剂配制
4.4检测方法
4.4.1维生素d3诱导细胞分泌抗菌肽的抗菌作用检测
1α,25-(oh)2d3处理细胞24小时后,用一定数量处于对数期生长的e.colicfto73感染细胞,2小时后,将细胞进行裂解,使用平板菌落计数法观察细胞感染细菌数的变化。这部分细菌主要是黏附在细胞表面的细菌和侵入到细胞内的细菌,它们是反复发作的尿路感染的重要致病原因。实验设计及分组见图1。
4.4.1.1实验对象
t24细胞
4.4.1.2实验分组
实验分溶剂对照组和受试药组(1α,25-(oh)2d3)。其中受试药设3个剂量组,分别为10-7m、10-8m和10-9m剂量组。
4.4.1.3给药方法
细胞过夜贴壁后,按照实验分组,将溶剂以及受试药物储备液配制在不含fbs的培养基中(终浓度为10-7m、10-8m和10-9m),每组对应一个培养皿,毎皿10ml。给药时间为24小时。
4.4.1.4平板菌落计数法观察抑菌效果
给药后24小时,加入约3×105个的对数期生长的e.colicfto73,在co2培养箱中37℃孵育2小时。弃去上清液,2ml/皿pbs溶液洗3次,加入1ml/皿1%tritonx-100溶液,放置10min左右。用移液枪将细胞吹下,吸取细胞裂解液放入已灭菌的1.5mlep管中,400ul/g管。另外吸取10μl细胞裂解液稀释于990μlpbs溶液中,再吸取10μl稀释液并加入990μl预热含0.8%琼脂的牛肉汤培养基,进行浇板(事先将1ml含0.8%琼脂的牛肉汤培养基铺于6孔板中,室温放置半小时待培养基完全凝固后浇板,浇板半小时后再铺1ml含0.8%琼脂的牛肉汤培养基),置于37℃恒温培养箱,过夜培养。
4.4.1.5观察指标及计算方法
第二天,对生长的菌落数进行计数(cfu)。
4.4.1.6ll37检测
将收集的裂解液,利用酶联免疫吸附试剂盒(elisa)测定ll37蛋白表达量。
4.5数据分析
数据均用平均值±标准差表示,采用spssstatistics19(ibm)软件进行单因素方差分析,组间比较采用lsd检验(方差齐)。
5实验结果
5.11α,25-(oh)2d3可增强泌尿道上皮细胞(t24细胞)分泌达到抗菌浓度的抗菌肽,从而抑制e.colicfto73生长
为了检测1α,25-(oh)2d3是否会促进受感染尿路致病菌e.colicfto73后的t24细胞分泌足够量的抗菌肽,起到抑菌作用,我们检测了感染后的t24细胞分泌的ll37浓度。通过酶联免疫吸附剂测定,我们发现10-7和10-8m的1α,25-(oh)2d3能显著的提高受感染后t24细胞的抗菌肽分泌(图2)。为了进一步了解维生素d3的剂量与膀胱上皮局部分泌抗菌肽间的定量关系,我们检测了平行试验中该细胞的抑菌效率。结果显示(图3)1α,25-(oh)2d3能增强该细胞抑制尿路致病菌e.colicfto73的生长能力,且这种抑制表现出剂量依赖关系。与溶剂对照组相比,10-7、10-8m和10-9m的1,25-(oh)2d3都能显著提高细胞的抑菌率(与溶剂对照组相比,***p<0.001)。
6结论
本研究中,我们对维生素d3的活性形式1α,25-(oh)2d3的抑菌效果进行了检测。利用平板菌落计数法,我们发现1α,25-(oh)2d3可明显减少感染尿路致病菌e.colicfto73的t24细胞的菌落形成数,说明1α,25-(oh)2d3可提高t24细胞系的抑菌能力。为了进一步验证该抑制效果是否与膀胱上皮局部分泌抗菌肽间的关系,我们对其也进行了细胞液的ll37检测。实验结果显示通过10-7和10-8m1α,25-(oh)2d3预处理后的受感染t24细胞能显著提高ll37的分泌。以上结果说明维生素d3足以促进产生足够的抗菌肽达到抗菌浓度,从而起到显著的抗菌效果,也说明了维生素d3和抗菌肽存在作用效果间的关系。
实施例2:评价抗菌肽ll37对我国近三年临床尿路分离常见致病菌的体外抗菌作用
1研究目的
评价抗菌肽ll37对我国近三年临床尿路分离常见致病菌的体外抗菌作用。
2试验药品
ll37:效价:98.51%,上海泽生科技开发股份有限公司;
3试验菌株
3.1标准菌株:粪肠球菌atcc29212,who14;
屎肠球菌atcc700221;
大肠埃希菌atcc25922,atcc35218。
3.2临床分离菌株:2015-2017年全国范围内收集尿路来源临床分离菌76株,其中部分万古霉素耐药屎肠球菌来自2013和2014年,包括:
万古霉素敏感粪肠球菌11株,
万古霉素敏感屎肠球菌11株,
万古霉素耐药屎肠球菌11株,
超广谱β-内酰胺酶(esbls)阴性大肠埃希菌11株,
esbls阳性大肠埃希菌11株,
esbls阴性肺炎克雷伯菌11株,
esbls阳性肺炎克雷伯菌10株。
每株细菌在试验前都经过平板转活分纯,以新鲜菌体用于试验。每次实验均用标准菌株作为敏感实验质控菌。
4培养基与孵育条件
按文献,将配制的mhb培养液以1ml/min的流速3次通过sep-pakplusnh2阴离子交换柱,每柱处理培养液量为20ml,收集经过交换柱的培养液(refinedmhb,rmhb)高压备用。本研究中所有试验均使用rmhb培养基。孵育条件:35℃孵育16~20h。
5最低抑菌浓度(mic)测定
采用微量肉汤二倍稀释法,菌液终浓度约5×105cfu/ml,反应体积100μl。
6杀菌曲线绘制
在rmhb培养基中加入一定浓度的ll37及菌应用液,使培养液中细菌的终浓度在1~5×105cfu/ml左右(对照管中不含抗生素)。取即刻、1、2、4、6、8、12及24小时的培养物,进行菌落计数,并绘制杀菌曲线。
7实验结果
7.1mic结果ll37对标准菌株的mic结果(表1)
7.1.1ll37对万古霉素耐药屎肠球菌atcc700221的mic值为8mg/l,明显优于其对2株标准粪肠球菌的抗菌活性。对于大肠埃希菌,ll37对产esbls的atcc35218的mic值为16mg/l,低于标准质控菌株atcc25922。
表1.ll37对5株标准菌株的mic结果
7.1.2ll37对76株临床分离致病菌的mic结果(表2)
同标准菌株结果一致,ll37对屎肠球菌表现出较好的抗菌作用,mic值最低可达4mg/l,众数为8mg/l,mic范围4~32mg/l,且不论屎肠球菌是否对万古霉素耐药,其抗菌作用相同。对于粪肠球菌,ll37抗菌作用较弱。
对于大肠埃希菌,ll37也具有一定抗菌作用,不论菌株是否产esbls,所测定的11株细菌中,均有9株的mic值在8-16mg/l。ll37对于肺炎克雷伯菌的抗菌作用弱于大肠埃希菌。
表2.ll37对株临床分离菌的mic结果
7.2ll37对2株临床分离致病菌的杀菌曲线结果
图4为不同浓度ll37对万古霉素耐药屎肠球菌atcc700221的杀菌曲线。由图可见,经过2小时,8倍mic浓度ll37即可将细菌由3.5×104cfu/ml杀至10cfu/ml以下,杀菌率达99.9%。2~4倍mic浓度时,经4小时,可使菌落数下降3个log值;1倍mic浓度时,经6~8小时,可达同样效果。ll37对这株屎肠球菌的杀菌速率与浓度显示出一定相关性。
图5为不同浓度ll37对esbls阳性大肠埃希菌15f017的杀菌曲线。经4小时,1~8倍mic浓度药物均可将细菌由2.4×105cfu/ml杀至300cfu/ml以下,菌落数下降3个log值,杀菌率达99.9%。但8小时后,1~4倍mic浓度下,细菌开始恢复生长,24小时后已接近起始浓度。ll37对大肠埃希菌的杀菌速率与浓度相关性不明显。
8结论
ll37对尿路感染主要致病菌大肠埃希菌和屎肠球菌具有一定抗菌作用。粪肠球菌和屎肠球菌的相对活性也相似,但由于粪肠球菌和屎肠球菌的测定方法不同,不能直接进行数值比较。由于ll37的作用机制为增加细菌膜通透性,故也可推测其与临床常用抗菌药物联合,对因膜通透性下降而产生的耐药菌可能有一定协同作用。ll37对尿路感染常见致病菌具有一定抗菌作用,且由于与目前临床常用药物作用机制不同,与目前临床常用药物无交叉耐药,因此其在耐药菌所致感染治疗中的作用值得进一步探讨。
实施例3:1α,25-(oh)2d3(维生素d3活性形式)对感染大肠杆菌的三种细胞(t24细胞、5637细胞和sv-huc-1细胞)的抑菌能力
1研究目的
本研究旨在考察活性维生素d3(1α,25-(oh)2d3)对尿路上皮细胞的预处理,是否可以抑制致病性大肠杆菌e.colicfto73对该细胞的感染,以为维生素d3治疗反复下尿路感染提供药效学实验。
2实验材料
2.1供试品
1α,25-(oh)2d3(维生素d3的活性形式)
生产厂家:sigma-aldrich货号:d1530纯度:≥99%(hplc)
2.2实验用细胞和菌株
2.2.1实验用细胞
5637细胞、t24细胞购买于中国科学院典型培养物保藏委员会细胞库。培养条件为含10%胎牛血清(fbs)的1640培养基,5%co2,37℃。sv-huc-1细胞购于中国科学院典型培养物保藏委员会细胞库,培养条件为含10%胎牛血清(fbs)的f12培养基,5%co2,37℃。
2.2.2实验用菌株
e.colicfto73购买于atcc。
2.3主要试剂
同实施例1中2.3主要试剂。
3实验仪器与设备
同实施例1中3实验仪器与设备。
4实验方法
4.11α,25-(oh)2d3储存液配置
4.1.10.1mg包装(2×10-4m)
加入1.2ml无水乙醇,混匀。2017年10月16号配制,储存液浓度为2×10-4m,分装100μl/每支,避光冻存于-20℃。将储存液用无水乙醇梯度稀释至2×10-5m、2×10-6m、2×10-7m、2×10-8m,待用。
4.2e.colicfto73培养
4.2.1备用菌液
从液氮中取出1支保种用的e.colicfto73,冷冻状态下,用枪头取出小块,加入5ml牛肉汤培养基(atcc建议培养基),37℃,220rpm,过夜培养。第二天,将5ml菌液倒入100ml牛肉汤培养基,混匀,37℃,220rpm,约8小时,将菌液分装100μl/每支,储存于-80℃备用。
4.2.2对数生长期的菌液
从-80℃中取1支备用菌液,以1:300比例加入lb培养基中(10μl备用菌液加入到3mllb培养基中),37℃,220rpm,过夜培养。第二天,取50μl菌液加入到3mllb培养基,37℃,220rpm,约2~3小时,e.colicfto73此时处在生长对数期。用纯化水将此菌液稀释,使96孔板一孔中加入200μl菌液的od600=0.55,对应细菌浓度约为5×108个/ml,之后再用纯化水稀释32倍,作为感染用菌液。感染细胞时,每2ml培养基中加20μl菌液。
4.3试剂配制
同实施例1中4.3试剂配制。
4.4检测方法
4.4.1维生素d3诱导细胞分泌抗菌肽的抗菌作用检测
1α,25-(oh)2d3处理细胞24小时后,用一定数量处于对数期生长的e.colicfto73感染细胞,2小时后,将细胞进行裂解,使用平板菌落计数法观察细胞感染细菌数的变化。这部分细菌主要是黏附在细胞表面的细菌和侵入到细胞内的细菌,它们是反复发作的尿路感染的重要致病原因。实验设计及分组见图6。
4.4.1.1实验对象
5637细胞、t24细胞和sv-huc-1细胞。
4.4.1.2实验分组
实验分溶剂对照组、无溶剂对照组(e.coliptc)、受试药组(1α,25-(oh)2d3)。其中受试药设四个剂量组,分别为10-7m、10-8m、10-9m和10-10m剂量组。
4.4.1.3给药方法
细胞过夜贴壁后,按照实验分组,将溶剂以及受试药物储备液配制在不含fbs的培养基中(终浓度为10-7m、10-8m、10-9m和10-10m),每组对应一孔,毎孔2ml。给药时间为24小时。
4.4.1.4平板菌落计数法观察抑菌效果
给药后24小时,加入约3×105个的对数期生长的e.colicfto73,在co2培养箱中37℃孵育2小时。弃去上清液,1ml/孔pbs溶液洗3次,加入500μl/孔1%tritonx-100溶液,放置10min左右。用移液枪将细胞吹下,吸取细胞裂解液放入已灭菌的1.5mlep管中。吸取10μl细胞裂解液稀释于990μlpbs溶液中,再吸取10μl稀释液并加入990μl预热含0.8%琼脂的牛肉汤培养基,进行浇板(事先将1ml含0.8%琼脂的牛肉汤培养基铺于6孔板中,室温放置半小时待培养基完全凝固后浇板,浇板半小时后再铺1ml含0.8%琼脂的牛肉汤培养基),置于37℃恒温培养箱,过夜培养。
4.4.1.5观察指标及计算方法
第二天,对生长的菌落数进行计数(cfu)。
4.5数据分析
数据均用平均值±标准差表示,采用spssstatistics19(ibm)软件进行单因素方差分析,组间比较采用lsd检验(方差齐)。
5实验结果
1α,25-(oh)2d3可增强泌尿道上皮细胞的抑菌能力
为了检测1α,25-(oh)2d3对泌尿道上皮细胞的抑菌能力的影响,我们选用t24、5637和sv-huc1三种人泌尿道系统来源的细胞系进行1α,25-(oh)2d3处理,用平板抑菌试验计数了感染尿路致病菌e.colicfto73后,感染细胞的该细菌的生长情况。结果显示1α,25-(oh)2d3能增强三种尿路上皮细胞抑制尿路致病菌e.colicfto73生长的能力,且这种抑制表现出剂量依赖关系。在t24细胞中(图7),10-7m、10-8、10-9和10-10m浓度的1α,25-(oh)2d3能显著提高细胞的抑菌率。以上剂量组与溶剂对照组相比,其抑菌效率都达到统计学显著差异(p<0.001或p<0.01);对于5637细胞(图8),10-7、10-8和10-9m浓度的1α,25-(oh)2d3也能提高抑菌力,与溶剂对照组相比,其抑菌效果达到显著统计学差异(p<0.001或p<0.05)。在sv-huc-1细胞中(图9),与溶剂对照相比,10-7m浓度的1α,25-(oh)2d3能显著的降低细菌的生长。(与溶剂对照组相比,***p<0.001;**p<0.01;*p<0.05)
6实验结论
本研究中,我们对维生素d3的活性形式1α,25-(oh)2d3的抑菌效果进行了检测。利用平板菌落计数法,我们发现1α,25-(oh)2d3可明显减少感染尿路致病菌e.colicfto73在三种不同人源尿路上皮细胞系的菌落形成数,说明1α,25-(oh)2d3可提高三种人源尿路上皮细胞系的抑菌能力。
实施例41α,25-(oh)2d3(维生素d3活性形式)与头孢曲松联合用药对感染大肠杆菌的t24细胞的抑菌能力
1研究目的
本研究旨在考察活性维生素d3(1α,25-(oh)2d3)与头孢曲松联合用药对尿路上皮细胞的预处理,是否能加强头孢曲松抑制t24细胞内大肠杆菌e.colicfto73的感染,为抗生素及维生素d3联合治疗反复下尿路感染提供依据。
2实验材料
2.1供试品
2.1.11α,25-(oh)2d3(维生素d3的活性形式)
生产厂家:sigma-aldrich纯度:≥99%(hplc)
2.1.2头孢曲松
生产厂家:中央药检所
2.1.3实验用细胞
t24细胞购买于中国科学院典型培养物保藏委员会细胞库。培养条件为含10%胎牛血清(fbs)的1640培养基,5%co2,37℃。sv-huc-1细胞购于中国科学院典型培养物保藏委员会细胞库,培养条件为含10%胎牛血清(fbs)的f12培养基,5%co2,37℃。
2.1.4实验用菌株
e.colicfto73购买于atcc。
2.2主要试剂
同实施例1中2.3主要试剂。
3实验仪器与设备
同实施例1中3实验仪器与设备。
4实验方法
4.11α,25-(oh)2d3储存液配置
4.1.10.1mg包装(2×10-4m)
加入1.2ml无水乙醇,混匀。2017年10月16号配制,储存液浓度为2×10-4m,分装100μl/每支,避光冻存于-20℃。将储存液用无水乙醇梯度稀释至2×10-5m、2×10-6m、2×10-7m、2×10-8m,待用。
4.2e.colicfto73培养
4.2.1备用菌液
从液氮中取出1支保种用的e.colicfto73,冷冻状态下,用枪头取出小块,加入5ml牛肉汤培养基(atcc建议培养基),37℃,220rpm,过夜培养。第二天,将5ml菌液倒入100ml牛肉汤培养基,混匀,37℃,220rpm,约8小时,将菌液分装100μl/每支,储存于-80℃备用。
4.2.2对数生长期的菌液
从-80℃中取1支备用菌液,以1:300比例加入lb培养基中(10μl备用菌液加入到3mllb培养基中),37℃,220rpm,过夜培养。第二天,取50μl菌液加入到3mllb培养基,37℃,220rpm,约2~3小时,e.colicfto73此时处在生长对数期。用纯化水将此菌液稀释,使96孔板一孔中加入200μl菌液的od600=0.55,对应细菌浓度约为5×108个/ml,之后再用纯化水稀释32倍,作为感染用菌液。感染细胞时,每2ml培养基中加20μl菌液。
4.3试剂配制
同实施例1中4.3试剂配制。
4.4检测方法
4.4.1维生素d3诱导细胞分泌抗菌肽的抗菌作用检测
不同浓度的1α,25-(oh)2d3和头孢曲松处理细胞24小时后,用一定数量处于对数期生长的e.colicfto73感染细胞,2小时后,将细胞进行裂解,使用平板菌落计数法观察细胞感染细菌数的变化。这部分细菌主要是黏附在细胞表面的细菌和侵入到细胞内的细菌,它们是反复发作的尿路感染的重要致病原因。实验设计及分组见图10。
4.4.1.1实验对象
t24细胞
4.4.1.2实验分组
实验分溶剂(空白)对照组、1α,25-(oh)2d3+头孢曲松联合用药组。其中联合用药组分组如下:
4.4.1.3给药方法
细胞过夜贴壁后,按照实验分组,将溶剂以及受试药物储备液配制在不含fbs的培养基中(1α,25-(oh)2d3终浓度为10-7m、10-8m和10-9m;头孢曲松终浓度为2nm;1α,25-(oh)2d3终浓度为10-7m和10-9m;头孢曲松终浓度为3nm),每组对应一孔,毎孔2ml。给药时间为24小时。
4.4.1.4平板菌落计数法观察抑菌效果
给药后24小时,加入约3×105个的对数期生长的e.colicfto73,在co2培养箱中37℃孵育2小时。弃去上清液,1ml/孔pbs溶液洗3次,加入500μl/孔1%tritonx-100溶液,放置10min左右。用移液枪将细胞吹下,吸取细胞裂解液放入已灭菌的1.5mlep管中。吸取10μl细胞裂解液稀释于990μlpbs溶液中,再吸取10μl稀释液并加入990μl预热含0.8%琼脂的牛肉汤培养基,进行浇板(事先将1ml含0.8%琼脂的牛肉汤培养基铺于6孔板中,室温放置半小时待培养基完全凝固后浇板,浇板半小时后再铺1ml含0.8%琼脂的牛肉汤培养基),置于37℃恒温培养箱,过夜培养。
4.4.1.5观察指标及计算方法
第二天,对生长的菌落数进行计数(cfu)。
4.5数据分析
数据均用平均值±标准差表示,采用spssstatistics19(ibm)软件进行单因素方差分析,组间比较采用lsd检验(方差齐)。
5实验结果
5.11α,25-(oh)2d3联合头孢曲松可增强泌尿道上皮细胞的抑菌能力
为了检测1α,25-(oh)2d3联合头孢曲松是否能提供泌尿道上皮细胞的抑菌能力,我们选用t24细胞-人泌尿道系统来源的细胞系进行不同浓度1α,25-(oh)2d3和2nm或3nm头孢曲松处理,用平板抑菌试验计数了感染尿路致病菌e.colicfto73后,观察感染细胞的细菌生长情况。结果显示10-7和10-8m1α,25-(oh)2d3联合2nm头孢曲松能增强t24细胞抑制尿路致病菌e.colicfto73的生长能力,且这种抑制表现出剂量依赖关系,随着1α,25-(oh)2d3浓度增加,头孢曲松浓度不变的情况下,细胞的抑菌能力呈梯度增加。在2nm头孢曲松联合1α,25-(oh)2d3实验中,添加10-7、10-8和10-9m1α,25-(oh)2d3能显著增加细胞的抑菌能力(与不加1α,25-(oh)2d3,只加2nm头孢曲松组比较)(图11)。同样的,我们在3nm头孢曲松联合1α,25-(oh)2d3实验中也发现,添加10-7m1α,25-(oh)2d3组比单独只用3nm头孢曲松组的抑菌能力明显加强(图12)。
6实验结论
本研究中,我们检测了维生素d3和头孢曲松联合用药后的抑菌能力。利用平板菌落计数法,我们发现1α,25-(oh)2d3和头孢曲松联合用药可以加强被感染致病菌e.colicfto73细胞的抑菌能力,说明1α,25-(oh)2d3联合头孢曲松用药可提高人源尿路上皮细胞系的抑菌能力,为临床1α,25-(oh)2d3联合用药提供依据。
实施例5ll-37对小鼠尿路感染模型的药效学研究
1实验目的
摸索ll-37以及ll-37联用抗生素对小鼠细菌尿路感染的治疗作用。
2.试验材料
2.1供试品
ll-37
配制方法:以ph7.4pbsbuffer按方案中所需浓度配置
配制后暂存条件:现配现用
2.2对照品
名称或代码:头孢曲松
生产厂家:中检所
配制方法:200mg加入2mlddh2o
配制后暂存条件:-20℃
2.3其它试剂
escherichiacoli(migula)castellaniandchalmers。
lb肉汤及lb琼脂培养基
按照配方1%胰蛋白胨(oxoid,批号:1938556),0.5%酵母提取物(oxoid,1%氯化钠配置,琼脂培养基另加1.5%琼脂粉。
异氟烷用于小鼠的麻醉。
甘油分装灭菌,用于膀胱接种时小鼠尿道的润滑。
3.实验动物
清洁级balb/c小鼠共72只,雌性,体重:18g----22g
来源:上海杰思捷实验动物有限公司
4.实验方法
4.1动物分组
根据随机数排序,完全随机分组
4.2给药途径及给药时间
受试物ll-37通过膀胱灌流给药,灌流体积50ul,1.25mg/只,0.625mg/只三个剂量。每24h一次,共给2次。阳性药通过皮下注射给药,在感染后5小时,2.5mg/只,每12h一次,共给药3次。联合给药组两种药物给药方式和频率相同,给药剂量分别为1.25mgll-37+1.25mg头孢曲松,0.625mgll-37+0.625mg头孢曲松和0.3125mgll-37+0.3125mg头孢曲松。
4.3动物实验过程
利用pe10管和30g针头制作尿道注射针,并安装于1ml注射器上,紫外灭菌。
e.coliatcc700928在接种动物前3天开始培养,连续的继代培养可以使绝大部分的e.coliatcc700928菌株表面表达1型菌毛,使该菌能够侵染膀胱上皮细胞。前3天用接种环蘸取冰箱中冻存的菌液后在lb平板上划线,37℃培养12h。前2天挑取单菌落后放入5mllb肉汤培养基试管中37℃220rpm震荡培养8-12h,后转接入25mllb肉汤培养基摇瓶中37℃220rpm震荡培养过夜。接种前1天,将25ul菌液转接入新鲜的25mllb肉汤培养基摇瓶中静置培养24h。
测定菌液的od600值,通过估算,将约od600值0.94的菌液25ml离心4000rpm,15min,用ph=7.4的pbs重悬为od值约为2的细菌重悬液用于接种。
接种前4小时禁水,用异氟烷麻醉小鼠并用少量异氟烷棉球维持,用手指轻按排尿口上部找到皮下膀胱,轻柔按摩使膀胱排空。利用尿道注射针插入小鼠尿道注射50ul菌液[1]。
接种1h后开始给予受试物,每24小时通过膀胱灌流的方式给药,通过皮下注射的方式给予阳性药头孢曲松。在第2天无菌环境下解剖小鼠,取膀胱,加1mlpbs研磨后,稀释3-4个浓度,每个浓度涂2个平板作为重复,菌落数取平均值,37℃倒置培养18-24h,检查菌落数。
4.4指标检测
接种第二天麻醉后断颈处死小鼠,无菌取膀胱,研磨,稀释梯度涂板计算膀胱荷菌数。
4.5统计方法
以student’sttest检验模型组和给药组的差异显著性n=8*p<0.05或**p<0.01。
5.实验结果
5.1小鼠接种菌量
将接种用菌液梯度稀释后涂板计算定植的菌量,结果见表3,可知每只小鼠的接种菌量约为903.5×108×50ul(接种体积)/100ul(每板涂菌液体积)=4.5*1010cfu/只
表3接种菌液梯度稀释结果(单位:菌落数)
5.2受试物ll-37单独给药及联合抗生素给药对小鼠尿路感染模型中膀胱荷菌数的影响。
受试物ll-37剂量组分别为1.25mg/只,0.625mg/只两个剂量。阳性药头孢曲松剂量2.5mg/只,每12h一次,共给药3次。联合给药组两种药物给药方式和频率相同,给药剂量分别为1.25mgll-37+1.25mg头孢曲松,0.625mgll-37+0.625mg头孢曲松和0.3125mgll-37+0.3125mg头孢曲松。通过图13,表4可知,模型组(4.315±0.2608,n=8)细菌定植成功,定植菌量接近每只小鼠104cfu。ll-371.25mg/只的中剂量组均值较模型组低。联合组三个剂量(1.25mgll-37+1.25mg头孢曲松,0.625mgll-37+0.625mg头孢曲松和0.3125mgll-37+0.3125mg头孢曲松)都和模型组有显著差异(p<0.01),且均值相近(分别为1.25mgll-37+1.25mg头孢曲松:2.427±0.1382,n=8;0.625mgll-37+0.625mg头孢曲松:2.405±0.1632,n=8;0.3125mgll-37+0.3125mg头孢曲松:1.951±0.3221,n=8),这说明联合用药在较低剂量(0.3125mgll-37+0.3125mg头孢曲松)依然可以有效降低尿路感染小鼠模型的膀胱荷菌量。模型组和阳性药组(3.619±0.1540n=8)有显著差异(p<0.05)。
*0的log10值不存在此处设为0
表4不同组别正式实验膀胱荷菌量(mean±sem,n=8)
6结论
抗菌肽ll37能改善尿路感染小鼠模型的尿路感染情况,抑制尿路感染小鼠尿道的细菌数量;联合用药时,较低剂量的头孢曲松联合ll37抗菌肽都能起到更好的抗菌作用,说明ll37抗菌肽能够与抗生素在尿路感染的治疗中起到协同治疗的作用。
结论
维生素d足以促进产生足够的抗菌肽达到抗菌浓度,从而起到显著的抗菌效果。ll37对尿路感染主要致病菌具有一定抗菌作用。维生素d能够提高人源尿路上皮细胞的抑菌能力。维生素d联合抗生素可提高人源尿路上皮细胞的抑菌能力,与抗生素在尿路感染的治疗中起到协同治疗的作用。
序列表
<110>上海泽生科技开发股份有限公司
<120>维生素d及其组合物的抗菌用途
<160>1
<170>siposequencelisting1.0
<210>1
<211>37
<212>prt
<213>人类(homosapiens)
<400>1
leuleuglyaspphephearglysserlysglulysileglylysglu
151015
phelysargilevalglnargilelysasppheleuargasnleuval
202530
proargthrgluser
35
- 还没有人留言评论。精彩留言会获得点赞!