IL-22作为制备治疗PCOS药物的应用及药物制剂的制作方法
本发明涉及多囊卵巢综合征治疗领域,更具体地,涉及一种il-22作为制备治疗pcos药物的应用及药物制剂。
背景技术:
多囊卵巢综合征(简称pcos)是无排卵性不孕症的最常见原因之一。pcos是一种内分泌代谢紊乱的综合征,以高雄激素血症、排卵异常和卵巢多囊样改变为特征,常伴发胰岛素抵抗。研究表明,中国人群中pcos患者14.2%伴发胰岛素抵抗,但pcos的病因尚不明确。由于其临床表现的高度异质性,pcos的治疗已经成为妇科和内分泌领域共同关注的热点和难点问题。pcos给患者带来的影响已远不局限于生殖问题,时间上也不仅仅局限于女性的育龄期:胎儿期的宫内高雄和宫内营养不良;儿童期的肾上腺功能早现;育龄期的月经紊乱、不孕不育、子宫内膜疾病等;甚至中老年期的糖尿病、心脑血管病、子宫内膜癌都可能使pcos患者的健康受到一定的影响。
针对pcos,目前主要的药物治疗方法为通过口服避孕药、氯米芬、促性腺激素、促性腺激素释放类似物、二甲双胍等药物帮助患者改善月经周期、调节排卵异常及代谢异常。
但是,口服避孕药常伴有恶心、呕吐、头晕、乳涨、白带增多等早孕反应,还会产生乏力、嗜睡、色素增加、食欲亢进、痤疮、月经过少或出血等问题。氯米芬会伴有潮热及多胎妊娠风险加大的问题。促性腺激素及促性腺激素释放类似物会增加多胎妊娠和卵巢过度刺激的风险。二甲双胍会产生胃肠道反应甚至乳酸性酸中毒。
因此,如何提供一种可有效治疗pcos的药物成为本领域亟需解决的技术难题。
技术实现要素:
本发明的一个目的是提供一种il-22作为制备治疗pcos药物的应用的新技术方案。
根据本发明的第一方面,提供了一种il-22作为制备治疗pcos药物的应用。本发明中的il-22是指白细胞介素22。
可选的,用于制备药剂,所述药剂适合全身、局部施用,或直接注射进卵巢部位。
可选的,所述施用通过静脉内或动脉内、肌肉内、透皮、腹膜内、鞘内、淋巴管内给药,皮下、口服或局部区域给药来进行。
可选的,用于制备治疗哺乳动物的pcos药剂,所述哺乳动物选自人、小鼠或大鼠。
根据本发明的第二方面,提供了一种药物制剂。
该药物制剂包括il-22及一种或多种药学上可接受的载体和/或赋形剂。
可选的,所述载体包括固体辅料或液体辅料。
可选的,所述液体辅料为生理盐水。生理盐水的浓度可例如为0.9wt%。
可选的,所述药物制剂的剂型包括片剂、丸剂、胶囊、膏剂、散剂、溶液剂、颗粒剂、混悬剂、注射剂、缓释制剂和控释制剂。
可选的,所述il-22的有效剂量为20-200ug/kg。
可选的,所述il-22的有效剂量为100ug/kg。
本公开提供了il-22的新的应用领域,il-22可应用在制备治疗pcos药物中。本公开有助于开发出新型的治疗pcos的药物。
通过以下参照附图对本发明的示例性实施例的详细描述,本发明的其它特征及其优点将会变得清楚。
附图说明
被结合在说明书中并构成说明书的一部分的附图示出了本发明的内容,并且连同其说明一起用于解释本发明的原理。
图1至图86为本公开il-22作为制备治疗pcos药物的应用及药物制剂的检测图或统计图。
具体实施方式
现在将参照附图来详细描述本发明的各种示例性实施例。应注意到:除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对布置、数字表达式和数值不限制本发明的范围。
以下对至少一个示例性实施例的描述实际上仅仅是说明性的,决不作为对本发明及其应用或使用的任何限制。
对于相关领域普通技术人员已知的技术、方法和设备可能不作详细讨论,但在适当情况下,所述技术、方法和设备应当被视为说明书的一部分。
在这里示出和讨论的所有例子中,任何具体值应被解释为仅仅是示例性的,而不是作为限制。因此,示例性实施例的其它例子可以具有不同的值。
应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步讨论。
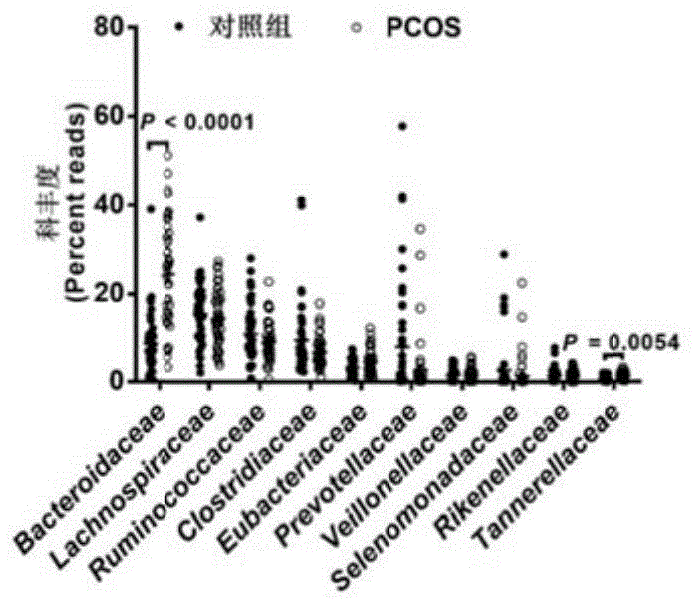
图1至图3体现了pcos患者及对照肠道菌群差异。对照组与pcos组肠道菌群宏基因组分析结果,两组之间bacteroidesvulgatus在科(图1)、属(图2)和物种水平(图3)上不同菌群的丰度(其中,对照组的n=43,pcos组的n=50,n为每组病例数,p表示两组之间的统计学意义,p<0.05认为两组间有统计学差异)。
图1中的bacteroidaceae是指拟杆菌科,lachnospiraceae是指毛螺菌科,ruminococcaceae是指疣微菌科,clostridiaceae是指梭菌科,eubacteriaceae是指优杆菌科,prevotellaceae是指是指普雷沃氏菌科,veillonellaceae是指韦荣氏菌科,selenomonadaceae是指月形单孢菌科,rikenellaceae是指理研菌科,tannerellaceae是指坦纳菌科。图2中的bacteroides是指拟杆菌属,clostridium是指梭菌属,faecalibacterium是指粪杆菌属,eubacterium是指优杆菌属,roseburia是指氏菌属,prevotella是指普氏菌属,ruminococcus是指瘤胃球菌属,blautia是指布劳特氏菌属,alistipes是指枝菌属,megamonas是指巨单胞菌属。图3中的bacteroidesvulgatus是指普通拟杆菌。
由图1至图3可见,与健康人群比较,pcos患者的肠道菌群有显著变化,其中拟杆菌科(bacteroidaceae)及拟杆菌属(bacteroides)是差异最明显、变化程度最大的菌科和菌属。普通拟杆菌(bacteroidesvulgatus,b.vulgatus)的水平较正常对照组相比显著升高。
图4至图10体现了b.vulgatus灌胃小鼠糖耐量。对照组、b.vulgatus灌胃小鼠及dhea小鼠(图4)口服糖耐量实验,图5为胰岛素抵抗实验,图6为口服糖耐量曲线下面积,图7为胰岛素抵抗实验曲线下面积,图8为空腹血糖,图9为胰岛素水平,图10为胰岛素抵抗指数(其中,n=8/组,*p<0.05,**p<0.01vs.对照组,一个*代表p值小于0.05,两个**代表p值小于0.01,差异更显著)。
由图4至图10可见,用b.vulgatus灌胃的小鼠及公认的pcos小鼠模型之一—dhea小鼠可出现了糖耐量受损的表现:在给予葡萄糖或注射胰岛素后,两组小鼠的血糖水平较对照组有明显升高,且血糖下降较慢,其口服糖耐量实验(gtt)、胰岛素抵抗实验(itt)的曲线下面积都有明显升高(图4-图7)。此外,小鼠的空腹血糖、空腹胰岛素及胰岛素抵抗指数均显著高于对照组。这表明b.vulgatus灌胃有与dhea类似的诱发小鼠胰岛素抵抗的作用,小鼠糖耐量受损(图8-图10),这也是pcos患者常见的临床表现之一。
图11至图14体现了对照组、b.vulgatus灌胃小鼠及dhea小鼠的动情周期。对照组小鼠的典型动情周期(图11),b.vulgatus组小鼠的典型动情周期(图12),dhea小鼠的典型动情周期(图13),对照组、b.vulgatus灌胃小鼠及dhea小鼠动情周期的各期所占比例(图14)(其中p为动情前期、e为动情期、m为动情后期、d为动情间期,n=8/组)。动情周期是评价小鼠性周期的一个重要指标,正常小鼠的动情为4-5天,动情前期(p)、动情期(e)、动情后期(m)及动情间期(d)重复出现,动情周期紊乱是pcos小鼠的一个重要特征。
由图11至图14可见,dhea小鼠主要表现为停留在持续的动情期,b.vulgatus灌胃小鼠的动情周期以间期为主(图11-13),但二者都存在动情周期紊乱表现为特定的动情周期所占的比例异常升高(图14)。
图15至图19体现了对照组、b.vulgatus灌胃小鼠及dhea小鼠卵巢形态。图15为对照组小鼠的典型卵巢he染色,图16为b.vulgatus组小鼠的典型卵巢he染色,图17为dhea组小鼠的典型卵巢he染色,图18为对照组、b.vulgatus灌胃小鼠及dhea小鼠黄体数,图19为对照组、b.vulgatus灌胃小鼠及dhea小鼠囊状卵泡数(其中,*表示黄体,#表示囊状卵泡,n=8/组)。
由图15至图19的卵巢形态学检查显示,正常小鼠的卵巢黄体数目正常,没有囊状卵泡(图15),b.vulgatus灌胃小鼠的卵巢黄体数目减少,囊状卵泡增多(图16、18和19),这都是pcos样小鼠卵巢形态的典型表现,与dhea建立的pcos动物模型表现类似(图17-19)。
图20和图21为对照组、b.vulgatus灌胃小鼠及dhea小鼠的睾酮(testosterone,t)(图20)和黄体生成素(luteinizinghormone,lh)(图21)水平(其中,n=8/组)。
由图20和图21可见,在激素水平上,b.vulgatus灌胃小鼠的睾酮(testosterone,t)和黄体生成素(luteinizinghormone,lh)较对照组都有显著升高。此外,b.vulgatus灌胃的小鼠雌激素与对照组相比没有显著变化,与pcos患者的内分泌谱类似。
图22体现了小鼠肠上皮mrna相对表达量。对照组、b.vulgatus灌胃小鼠及dhea小鼠肠上皮il22,ifng,il10,il13,il17a,il17f,il18,il1b,il2,il23和tnfa的相对表达量(其中,n=8/组)。体内的肠道菌群构成了一个复杂的肠道内微生态系统,在宿主的肠道免疫系统、营养物质的合成与吸收、抑制致病菌等众多方面均发挥着重要作用,肠粘膜固有层免疫细胞平衡着肠道微生物的免疫耐受和对肠道微生物致病菌的防御作用,肠粘膜免疫细胞对肠道菌群抗原的过度应答导可能致肠道屏障功能受损过度,导致炎症因子的比例失调。
由图22可见,通过检测了肠上皮中包括il22,干扰素-γ(ifng),白细胞介素10(il10),白细胞介素13(il13),白细胞介素17a(il17a),白细胞介素17f(il17f),白细胞介素18(il18),白细胞介素1b(il1b),白细胞介素12(il2),白细胞介素23(il23),肿瘤坏死因子α(tnfa)等炎症因子在内的mrna水平,发现与对照组相比,b.vulgatus灌胃或dhea小鼠肠上il22的表达变化最大,降低了约90%。
图23体现了小鼠血清il-22表达水平,对照组、b.vulgatus灌胃小鼠及dhea小鼠血清il-22的水平(其中,n=8/组)。
由图23可见,b.vulgatus灌胃和dhea小鼠血清中的il-22较对照小鼠明显降低。
图24和图25为人的il-22表达水平。图24为对照组及pcos患者血清il-22的表达水平(其中,对照组n=43,pcos组n=50)。图25为对照组及pcos患者卵泡液il-22的表达水平(其中,对照组n=47,pcos组n=49)。
由图24可见,通过对43名正常对照及50名pcos患者的血清进行了il-22的检测,结果发现pcos患者血清中il-22明显降低。由图25可见,通过对47名对照和49名pcos患者的卵泡液检测其卵泡液中的il-22水平,发现pcos患者卵泡液中的il-22水平也明显降低。
图26-32体现了il-22治疗b.vulgatus灌胃模型小鼠糖耐量。对照组、b.vulgatus灌胃小鼠、il-22治疗b.vulgatus灌胃小鼠口服糖耐量实验(图26),胰岛素抵抗实验(图27),口服糖耐量曲线下面积(图28),胰岛素抵抗实验曲线下面积(图29),空腹血糖(图30),胰岛素水平(图31),胰岛素抵抗指数(图32)(其中,n=6/组,*p<0.05,**p<0.01vs.对照组,#p<0.05,##p<0.01vs.b.vulgatus)。
由图26至图32可见,il-22(100ug/kg,溶于0.9wt%生理盐水,注射)可以改善b.vulgatus灌胃造成的胰岛素抵抗,主要表现为给b.vulgatus灌胃小鼠注射葡萄糖或者胰岛素后,其升高的血糖水平可被il-22抑制(图26和图27),gtt、itt的曲线下面积也可恢复到正常水平(图28和图29)。此外,b.vulgatus灌胃小鼠升高的空腹血糖、空腹胰岛素、胰岛素抵抗指数,可以在il-22帮助下恢复正常(图30-32)。
图33至图36体现了il-22治疗b.vulgatus灌胃模型小鼠的动情周期。对照组小鼠的典型动情周期(图33),b.vulgatus组小鼠的典型动情周期(图34),il-22治疗b.vulgatus灌胃小鼠的典型动情周期(图35),对照组、b.vulgatus灌胃小鼠、il-22治疗b.vulgatus灌胃小鼠各动情周期各期所占比例(图36)(其中,p为动情前期、e为动情期、m为动情后期、d为动情间期,n=6/组)。
由图33至图36可见,b.vulgatus小鼠的动情周期紊乱,持续停留在动情间期。在给予b.vulgatus小鼠il-22治疗(100ug/kg,溶于0.9wt%生理盐水,注射)后,小鼠紊乱的动情周期可以恢复正常,以4-5天为一个循环周期(图33-35),各期所占的比例也恢复至正常(图36)。
图37至图41体现了il-22治疗b.vulgatus灌胃模型小鼠的卵巢功能。对照组小鼠的典型卵巢形态(图37),b.vulgatus组小鼠的典型卵巢形态(图38),il-22治疗b.vulgatus灌胃小鼠的典型卵巢形态(图39),对照组、b.vulgatus灌胃小鼠、il-22治疗b.vulgatus灌胃小鼠卵巢黄体数(图40),对照组、b.vulgatus灌胃小鼠、il-22治疗b.vulgatus灌胃小鼠卵巢黄体数囊状卵泡数(图41)(其中,n=6/组)。
由图37至图41可见,b.vulgatus小鼠的异常卵巢形态,包括出现的囊状卵泡及减少的黄体数,在给予il-22(100ug/kg,溶于0.9wt%生理盐水,注射)后,可观察到其囊状卵泡消失,黄体数有所增加,表明il-22可以使b.vulgatus小鼠的卵巢形态恢复正常。
图42和图43体现了il-22治疗b.vulgatus灌胃模型小鼠的激素水平。对照组、b.vulgatus灌胃小鼠、il-22治疗b.vulgatus灌胃小鼠睾酮(图42)、lh(图43)水平(其中,n=6/组)。
睾酮t和黄体生成素lh升高是pcos患者内分泌异常的典型表现,t和lh水平的下降也被认为是pcos改善的标志之一。由图42和图43可见,b.vulgatus小鼠升高的t、lh水平在给予il-22治疗(100ug/kg,溶于0.9wt%生理盐水,注射)后可以恢复正常。
图44为对照组、b.vulgatus灌胃小鼠、il-22治疗b.vulgatus灌胃小鼠第一窝子代数(其中,n=6/组)。
由图44可见,在生育力方面,il-22治疗(100ug/kg,溶于0.9wt%生理盐水,注射)可使b.vulgatus小鼠降低的每窝产仔数恢复至正常水平。
图45至图48体现了对照组、pamh小鼠及pamh+il-22小鼠的动情周期。对照组小鼠的典型动情周期(图45),pamh组小鼠的典型动情周期(图46),pamh+il-22小鼠的典型动情周期(图47),对照组、pamh小鼠及pamh+il-22小鼠各动情周期各期所占比例(图48)(其中,n=6/组)。
由图45至图48可见,经amh建立的小鼠(pamh)动情周期紊乱,与b.vulgatus灌胃的小鼠类似,动情周期以动情间期为主;给予3周il-22(pamh+il-22)(100ug/kg,溶于0.9wt%生理盐水,注射)后,动情周期有所改善,基本恢复正常。
图49至图53体现了对照、pamh及il-22治疗pamh小鼠的卵巢形态。对照组小鼠的典型卵巢形态(图49),pamh小鼠的典型卵巢形态(图50),il-22治疗pamh灌胃小鼠的典型卵巢形态(图51),对照组、pamh及il-22治疗pamh小鼠巢黄体数(图52)和囊状卵泡数(图53)(其中,n=6/组)。
由图49至图53可见,pamh小鼠的卵巢有pcos样变:较对照组(图49)而言,pamh组小鼠卵巢黄体数目减少,并伴有囊状卵泡出现(图50);给予il-22(100ug/kg,溶于0.9wt%生理盐水,注射)后,黄体数目增多,囊状卵泡消失,卵巢形态恢复正常(图51),说明il-22可以改善pcos小鼠异常的卵巢形态(图49-53)。
图54和图55为对照、pamh及il-22治疗pamh小鼠的激素水平。对照、pamh及il-22治疗pamh小鼠睾酮(图54)、lh(图55)水平(其中,n=6/组)。
由图54和图55可见,和dhea小鼠、病人菌移植小鼠、b.vulgatus小鼠的内分泌谱类似,amh小鼠的t和lh也较对照组有显著升高。然而,amh小鼠升高的t和lh水平可以在il-22的治疗(100ug/kg,溶于0.9wt%生理盐水,注射)下恢复至正常水平。
图56为对照、pamh及il-22治疗pamh小鼠第一窝子代数(其中,n=6/组)。
由图56可见,il-22(100ug/kg,溶于0.9wt%生理盐水,注射)可以改善pamh小鼠生育力下降的问题。
图57至图61为il-22治疗dhea小鼠糖耐量。dhea组及il-22治疗dhea灌胃小鼠(图57)口服糖耐量实验,胰岛素抵抗实验(图58),空腹血糖(图59),胰岛素水平(图60),胰岛素抵抗指数(图61)(其中,n=6/组,*p<0.05,**p<0.01vs.dhea)。
图62至图64为il-22治疗dhea小鼠动情周期。dhea小鼠的典型动情周期(图62),il-22治疗dhea小鼠的典型动情周期(图63),dhea与il-22治疗dhea小鼠动情周期各期所占比例(图64)(其中,n=6/组)。
图65至图71为il-22治疗dhea小鼠卵巢功能评价。dhea小鼠的典型卵巢he染色(图65),il-22治疗dhea小鼠典型卵巢he染色(图66),dhea及il-22治疗dhea小鼠黄体数(图67)和囊状卵泡(图68)数,dhea及il-22治疗dhea小鼠胚胎数(图69),dhea及il-22治疗dhea小鼠睾酮(图70)和lh(图71)水平(其中,n=6/组)。
由图57至图71可见,通过给予了dhea模型鼠3周的il-22治疗(100ug/kg,溶于0.9wt%生理盐水,注射),dhea小鼠的胰岛素抵抗、动情周期、卵巢形态、激素水平、胚胎数也得到了一定程度的恢复。
图72和图73体现了小鼠脂肪棕色化相关分子表达量。对照组、移植b.vulgatus菌小鼠及dhea小鼠皮下脂肪棕色化相关分子表达量(图72),棕色脂肪脂肪棕色化相关分子表达量(图73)(其中,n=8/组)。
白色脂肪棕色化可以改善pcos小鼠的代谢水平及胰岛素抵抗,给pcos大鼠移植棕色脂肪可以显著改善pcos大鼠的卵巢多囊样改变及生育力下降等问题。由图72和图73可见,b.vulgatus灌胃小鼠皮下脂肪的ucp1,pgc1a,cited1,cox8b及棕色脂肪ucp1,pgc1a和cox8b的表达水平显著下降。
图74至图77为小鼠脂肪组织棕色化相关分子表达量。il-22治疗移植b.vulgatus菌小鼠皮下脂肪棕色化相关分子表达量(图74)和棕色脂肪脂肪棕色化相关分子表达量(图75)(其中n=6/组),il-22治疗dhea小鼠脂肪棕色化相关分子表达量(图76)和棕色脂肪脂肪棕色化相关分子表达量(图77)(其中,n=8/组)。
由图74至图77可见,在给予il-22治疗(100ug/kg,溶于0.9wt%生理盐水,注射)后,b.vulgatus小鼠皮下脂肪及棕色脂肪的ucp1,pgc1a,cox8b表达明显升高(图74和图75);给予il-22预防的b.vulgatus小鼠皮下脂肪ucp1,pgc1a及棕色脂肪ucp1和pgc1a的表达有明显的恢复(图76和图77)。
图78至图82为il-22治疗dhea模型小鼠皮下脂肪he染色及ucp-1的表达。dhea组皮下脂肪典型he染色(图78),il-22治疗dhea小鼠皮下脂肪典型he染色(图79),dhea皮下脂肪典型免疫组化ucp-1染色(图80),il-22治疗dhea小鼠脂肪典型免疫组化ucp-1染色(图81),dhea小鼠及il-22治疗dhea小鼠ucp-1的相对表达量(图82)。
由图78至图81可见,il-22治疗(100ug/kg,溶于0.9wt%生理盐水,注射)dhea小鼠的脂肪棕色化水平较dhea小鼠有明显的改善。由图82可见,对小鼠皮下脂肪的western发现,il-22治疗(100ug/kg,溶于0.9wt%生理盐水,注射)后,dhea小鼠ucp-1的表达明显增加。
图83至图86为患者颗粒细胞炎症因子的表达。pcos患者颗粒细胞(对照)及添加il-22的pcos病人颗粒细胞(il-22)炎症因子ccl2,ccl20,crp,ifng,il18,il1b,il6,il8,tnfa和wnt5amrna表达量(图83),pcos患者颗粒细胞及添加il-22的pcos病人颗粒细胞上清液中炎症因子ccl2(图84)、ccl20(图85)和il-1β(图86)的含量(其中n=6/组)。
慢性炎症在pcos发生发展的过程中起着重要的作用。通过收集部分pcos患者的颗粒细胞并进行了体外培养,取培养液的上清用msd进行了相关炎症因子的检测,并取细胞的cdna进行了炎症因子的qpcr检测。结果发现,添加il-22可以使pcos患者ccl2,ccl20,ifng,il1b和wnt5的mrna表达减少(图83),并且细胞上清中ccl2,ccl20,il-1β的蛋白水平表达也明显减少(图84-86)。以上数据表明,il-22可以减轻pcos患者的慢性炎症状态。
实验小鼠:3周龄或6-8周龄大雌性小鼠,购自北京大学医学部实验动物中心,spf级。用于生育力实验的雄鼠为10周龄大,生育力正常的雄鼠,购自北京大学医学部实验动物中心,spf级。
小鼠饲养:所有小鼠饲养于北京大学医学部动物房,3-5只/笼,饲养温度维持在25-25℃,光照时间为12l:12d的人工昼夜节律,自由摄食饮水。实验中所使用动物均经北京大学医学部和北京大学第三医院动物伦理委员会审核批准。
实验细菌:普通拟杆菌(bacteroidesvulgatus,atcc8482)。所有实验细菌均购自美国atcc公司。
临床样本收集:
pcos组:22-45周岁,2015年9月到2016年12月在本生殖中心初诊的女性患者,符合鹿特丹pcos诊断标准。
对照组:22-45周岁,本院体检中心体检正常的健康正常的女性,无胰岛素抵抗,高血压、高血脂,无pcos。
排除标准:(1)入组前三个月未接受过治疗,未进行过肥胖性的外科手术及影响免疫系统的治疗;(2)无常规使用抗生素类药物或接受治疗史,三个月内未参与其他研究;(3)三个月内未服用过肝毒性药物,无关节炎、风湿性关节炎、肾脏和肝脏疾病;(4)无腹痛、便秘或腹泻等胃肠道症状;(5)非哺乳期、孕期妇女。所有入组对象签署知情同意书,填写调查问卷,测量身高、体重、腰围和臀围,实验过程通过北京大学第三医院伦理委员会审查。饮食要求:正常饮食,采样前一个月内不能服用任何药物及酸奶或其它含有益生菌类食物。
标本收集:所有志愿者于月经第2-4天早晨空腹采血,离心1500rpm,10min,分装为500ul/管,-80℃保存。非经期嘱志愿者来本实验室留取适量粪便,立即分装为250mg/管,-80℃保存。
粪便dna提取(康为世纪提取粪便dna试剂盒):(1)取250mg粪便样本,置于1.5mlep管中,加入1mlbuffersw,涡旋振荡3-5分钟,使样本均匀分散于溶液中。12,000rpm离心1min,弃上清。(2)加入1mlbuffersl,涡旋振荡3-5min,使样本均匀分散于溶液中,65℃水浴20min,12,000rpm离心3min,将上清移至新的1.5mlep管中。(3)向上清液中加等体积buffergl,颠倒混匀15-25次,冰上放置5min。12,000rpm离心5min,所得上清加入到已装入收集管的吸附柱中,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(4)向吸附柱中加入500μlbuffergw1,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中,重复一遍。(5)向吸附柱中加入500μlbuffergw2,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(6)12,000rpm离心2min,倒掉收集管中的废液。将吸附柱置于室温数分钟,以彻底晾干。(7)将吸附柱置于一个新的1.5mlep管中,向吸附柱的中间部位悬空滴加50-100μl灭菌水,室温放置2-5min,12,000rpm离心1min,收集dna溶液,-20℃保存dna。
人血清样本检测:(1)将收集的血清从-80℃拿出,室温融化后,瞬离5s。(2)用免疫发光法检测血il-22的水平。
卵泡液及颗粒细胞收集及提取:(1)准备1.5ml的ep管,标记好编号,用于储存第一皿卵泡液,4℃离心3000rmp,10min,取上清即为卵泡液,放在-80℃保存。(2)准备50ml离心管,将剩余卵泡液吸到离心管中,4℃离心3000rmp,10min。(3)离心后小心吸取沉淀上层白色膜状物,加入8ml的pbs混匀,4℃离心3000rmp,8min。(4)弃去上清,吸取上层粉红色液体转入含有透明质酸酶的离心管中,消化3-4min后,加入3-4ml无菌pbs,混匀;(5)按照1:2体积将上述液体铺在淋巴细胞分离液ficoll表面,2000rmp,30min离心;(6)离心后液体分成三层,将中间的白色绒毛样颗粒细胞吸至含有3-4mlpbs的无菌离心管中,混匀,3000rmp离心10min,重复pbs洗涤两次;(7)弃上清,加入含10%fbs及1%双抗的dmem/f12培养基均匀铺板培养(6孔培养皿),每孔加入培养基3ml。(8)颗粒细胞铺板6h后换液,去除未贴壁细胞及血细胞。
dhea动物模型的建立:21天大小的c57bl/6j雌性小鼠连续21天dhea(6mg/100g体重,溶于0.05m1芝麻油内)皮下注射。对照组为连续21天芝麻油皮下注射。
普通拟杆菌灌胃实验:将普通拟杆菌5000rpm,离心5min,弃上清,pbs重悬沉淀至5×108cfu/ml。给予21天大小鼠灌胃,2×108cfu/只,一周两次。对照组给予高压蒸汽灭活的普通拟杆菌灌胃,持续处理3周。
il-22注射实验:il-22按100ug/kg/day,皮下注射。
小鼠动情周期检测:从给药第10天开始,每日上午9点行阴道涂片,直至造模完成。沾取:将消毒的细棉签用生理盐水润湿,轻轻插入小鼠的阴道内,慢慢转动一下取出。涂片:将带有阴道内含物的细棉签在载玻片上均匀的转动做成涂片,然后将涂片散在空气中自然干燥(以载玻片上发白为准)。固定:将玻片置于95%乙醇中固定30-60min。染色:将玻片置于绍氏液中10min左右,95%乙醇两遍,每遍数秒,纯乙醇两遍,3-5min/次;二甲苯两遍,5min/次。结果观察:将涂片置于显微镜下,观察阴道涂片的组织学变化,确定动情周期变化的不同阶段。
动情前期(p):显微镜下可见阴道涂片中有核上皮细胞占优势,有的是单个的,有的呈片状,可伴有少量白细胞。动情期(e):涂片中有很多无核的角化鳞状细胞,细胞大而扁平,边缘不整齐,视野中看不到或很少白细胞与上皮细胞。动情后期(m):阴道腔内角化上皮细胞减少,出现许多白细胞及有核上皮细胞。动情间期(d):小鼠阴道粘膜薄,白细胞从粘膜内游离出来,使阴道涂片中几乎全是白细胞。
糖耐量实验:(1)将小鼠换入干净的笼子禁食8h(禁食期间保证正常的饮水)后,称取每只小鼠的体重,并逐一对小鼠进行标记,以便在实验过程中能快速辨认所测小鼠。(2)用剪刀剪去小鼠尾巴末端约1-2mm,轻轻挤压尾巴让血液富集成一滴后,用血糖测试仪测定小鼠血糖水平,记为空腹血糖。(3)向每只小鼠腹腔注射剂量为2g/kg的葡萄糖溶液。(4)测定其空腹血糖值及注射葡萄糖后15min,30min,60min,120min采用尾静脉取血的方式测定小鼠的血糖值。
胰岛素抵抗实验:(1)将小鼠换入干净的笼子禁食4h(禁食期间保证正常的饮水)后,称取每只小鼠的体重,并逐一对小鼠进行标记,以便在实验过程中能快速辨认所测小鼠。(2)用剪刀剪去小鼠尾巴末端约1-2mm,轻轻挤压尾巴让血液富集成一滴后,用血糖测试仪测定小鼠血糖水平,记为空腹血糖。(3)向每只小鼠腹腔注射剂量为1.5iu/kg的胰岛素。(4)测定其空腹血糖值及注射葡萄糖后15min,30min,60min,120min采用尾静脉取血的方式测定小鼠的血糖值。
血激素检测:根据胰岛素elisa试剂盒、睾酮elisa试剂盒、lhelisa试剂盒说明书,分析各激素含量。
卵巢形态检测:取卵巢置于bollin固定剂中固定24h,按常规梯度脱水、透明、浸蜡、包埋、切片等步骤制备石蜡切片,37℃烤干后常温保存备用。二甲苯洗2次,每次5min。100%、95%、90%、80%、70%酒精梯度水化,每梯度5min,2次,结束后用蒸馏水洗两遍。苏木素复染15min后,蒸馏水5min洗2次;1%盐酸酒精浸30s,蒸馏水5min洗2次;1%伊红溶液染色5min后蒸馏水5min洗2次;70%、80%、90%、95%、100%酒精梯度脱水,每梯度5min,2次;二甲苯洗2次,每次5min;中性树胶封片。制片完成后,在光镜下观察卵巢形态,评估各组小鼠卵巢组织的形态结构学变化。
脂肪组织免疫组化:(1)抗原修复:取脂肪组织石蜡切片,高压锅热修复,使标本自然降温到室温。蒸馏水浸洗,5min/次,共3次;(2)封闭内源性的过氧化物酶:3%过氧化氢水溶液,浸泡切片或者用液滴覆盖组织,5~10minpbs浸洗5min,洗3次;(3)抗原封闭:抗原封闭液覆盖组织放入湿盒内,室温下封闭15-30min,结束后切勿洗涤;(4)ucp-1抗体孵育:轻轻甩掉抗原封闭液,用滤纸或者卫生纸将组织周边多余的水分吸干(组织不能干),滴加1:100的ucp-1抗体,放入湿盒,4℃过夜;(5)二抗孵育:滴加二抗工作液,放入湿盒,室温,15-30minpbs浸洗,5min/次,洗3次;(6)显色:滴加dab显色剂,镜下观察显色,通常几秒-5min流水洗5min蒸馏水浸洗5min;(7)封片:中性树胶适量,封片。
总rna提取:(1)准备细胞样品时,弃去培养液,用pbs洗3次,加入1mltrizol吹打细胞;准备组织样品时,将组织块直接放入研钵中,加入少量液氮,迅速研磨。组织变成细粉状,加入trizol50-100mg组织/ml,继续研磨,直到trizol和组织充分混匀,静置5-10min,等融化了用枪吹打壁上残留,转移入1.5mlep管,加入trizol使总体积达到1ml。(2)按所加trizol的1/5体积加入氯仿200μl,颠倒混匀,剧烈震荡30s呈乳状。冰上放置5min,可以看到水相和有机相慢慢分离。(3)离心4℃12,000rpm离心10min,吸取上层水相到新的1.5mlep管(勿接触dna层)。(4)按所加等体积的异丙醇混匀,充分混匀,-20℃过夜或者冰上放置10min。(5)4℃12,000rpm离心10min,弃上清,留管底沉淀rna。(6)加入75%乙醇1ml(depc水配制)洗涤沉淀,温和振荡离心管悬浮沉淀,4℃12,000rpm离心5min,弃去上清,尽量减少残留液体。重复1遍。(7)室温晾干5-10min。加入20ul无菌depc水溶解rna样品。(8)取1ul测定rna浓度。od值定量rna浓度。
生育力检测:(1)购买10周龄大雄性c57bl/6j小鼠,与无实验用途的性成熟雌鼠1:1合笼,雌鼠见栓后雌雄分开;(2)确定雌鼠怀孕后,证明与其合笼的雄鼠性能力正常,可以使用,若不能使同笼雌鼠怀孕,则更换雄鼠;(3)挑选出足够数目的生育力正常的雄鼠,与待检测雌鼠1:1合笼;(4)检验第一窝产仔数。
虽然已经通过例子对本发明的一些特定实施例进行了详细说明,但是本领域的技术人员应该理解,以上例子仅是为了进行说明,而不是为了限制本发明的范围。本领域的技术人员应该理解,可在不脱离本发明的范围和精神的情况下,对以上实施例进行修改。本发明的范围由所附权利要求来限定。
- 还没有人留言评论。精彩留言会获得点赞!