反相色谱分离非人动物羊水中的活性成分的制作方法
本发明属动物提取物领域,具体涉及使用反相色谱分离非人动物羊水中的活性成分提取及在细胞增殖活性中的作用。
背景技术:
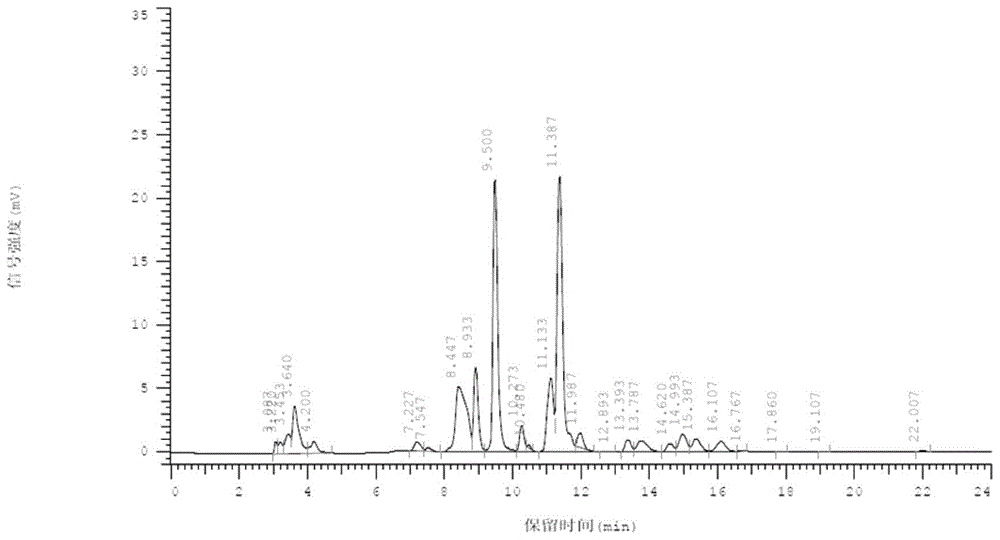
:动物羊水中含有种类繁多的氨基酸、有机酸、糖类、类固醇、核苷酸、脂质、及其衍生物、微量元素等物质。根据不同物质之间物理和化学性质的差异,包括分子量、溶解度、等电点以及疏水性等性质,纯化羊水的技术通常有沉淀技术、层析技术、双液相萃取技术等。然而目前这些技术成本较高,过程复杂,回收率低,并且往往在分离纯化过程中造成目标化合物的生物活性降低甚至丢失。作为化学分离的重要手段,根据流动相和固定相极性的相对不同,液相色谱分为正相色谱和反相色谱。反相色谱(rpc)是指利用非极性的反相介质为固定相,极性有机溶剂的水溶液为流动相,根据溶质极性(疏水性)的不同进行溶质分离与纯化的洗脱色谱法。高效液相色谱和超高效液相色谱,能有效地分离、鉴定、半定量粗品中的目标化合物而被广泛地运用。因此,rpc非常适合于分离相对分子质量小于2000道尔顿、中性、稳定性好的物质或复合物质。本发明采用c18及其衍生物作为反相介质,结合akta系统和hplc系统两步分离非人动物羊水中的活性物质。本发明的提取物能促进细胞增殖。技术实现要素:本发明提供一种非人动物羊水的提取物,所述提取物所含活性成分的辛醇/水分配系数logp在0.05-1.897的范围内。在一个或多个实施方案中,所述提取物中活性成分的辛醇/水分配系数logp在0.3-1.5之间。在一个或多个实施方案中,所述提取物在ph5.8-8.0之间不和离子交换柱结合。在一个或多个实施方案中,所述羊水为来自禽蛋的羊水。在一个或多个实施方案中,所述禽蛋为胚龄为5-12天的鸡蛋,优选胚龄为6-11天的鸡蛋,更优选胚龄为7-9天的鸡蛋、更优选胚龄为7-8天的鸡蛋,或者为发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋。在一个或多个实施方案中,所述禽蛋为家禽的蛋,如鸡蛋、鸭蛋、鸵鸟蛋和鹅蛋等。在一个或多个实施方案中,所述羊水为非人哺乳动物羊水;优选地,所述羊水来自啮齿类动物;优选地,所述羊水来自胎龄为8-20天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-20天的啮齿类动物的发育时期相对应的非人哺乳动物的胚胎。在一个或多个实施方案中,所述提取物采用反相色谱分离得到。本发明还提供一种非人动物羊水提取物的制备方法,所述方法包括采用反相色谱从所述羊水中分离出辛醇/水分配系数logp在0.05-1.897之间的具有细胞增殖活性和/或促进心肌梗死后心功能恢复的馏分的步骤。在一个或多个实施方案中,所述方法包括进行两次反相色谱分离,其中,第二次反相色谱分离所使用的反相色谱柱的分辨率高于第一次反相色谱分离所使用的反相色谱柱的分辨率。在一个或多个实施方案中,所述方法包括:(1)对非人动物胚胎羊水进行首次反相色谱分离,分离得到辛醇/水分配系数logp在0.05-1.897范围内的馏分;(2)对步骤(1)获得的馏分再次进行反相色谱分离,分离得到辛醇/水分配系数logp在0.05-1.897范围内的馏分。在一个或多个实施方案中,所述方法包括两次反相色谱,其中,第一次反相色谱中,洗脱体积在51-731毫升之间的馏分,优选洗脱体积在250-504毫升之间的馏分,更优选洗脱体积在278-353毫升之间和/或在354-429毫升之间和/或在430-504毫升之间的馏分,或以其它相似色谱柱以同比例所获相似馏分,用于第二次反相色谱;第二次反相色谱中,取洗脱时间在11-12.5分钟之间的馏分和13-14分钟之间的馏分,或以其它相似色谱柱以同比例所获相似馏分。在一个或多个实施方案中,所述反相色谱所用的反相色谱柱的固定相以硅胶为载体,表面键合的非极性基团选自苯基、c8或c18烷基及其衍生物;使用一定比例的有机溶剂如甲醇、乙腈、乙醇和水作为流动相。在一个或多个实施方案中,步骤(1)所用的流动相为乙腈和ddh2o。在一个或多个实施方案中,步骤(1)采用梯度方式洗脱,流动相为乙腈和ddh2o,其中乙腈的浓度梯度为5%-12%,ddh2o的浓度梯度为95%-88%。在一个或多个实施方案中,步骤(2)的流动相为乙腈和纯水。在一个或多个实施方案中,步骤(2)采用梯度方式洗脱,流动相为乙腈和纯水,乙腈浓度梯度为0%-7%,纯水浓度梯度为100%-93%。在一个或多个实施方案中,采用c18反相色谱柱进行反相分离。在一个或多个实施方案中,所述方法还包括,第一次反相色谱分离后,测试分离得到的各馏分的细胞增殖活性,挑取细胞增殖活性最强的馏分实施第二次反相色谱分离。本发明还提供采用本文所述的方法分离得到的来自非人动物羊水的活性成分。本发明还提供一种药物组合物,所述药物组合物含有本文所述的提取物或活性成分,和任选的药学上可接受的载体。本发明还提供反相色谱柱在分离非人动物的羊水中具有细胞增殖活性的成分中的应用。本发明还提供本文所述的活性成分在制备促进细胞增殖和/或促进心肌梗死后心功能恢复的产品中的应用。附图说明图1:鸡蛋羊水的hplc图。图2:鸭蛋羊水的hplc图。图3:鸡蛋和鸭蛋羊水提取物的细胞增殖检测结果。图4:新鲜鸡蛋羊水经unisil10-100c18分离的色谱图。图5:羊水提取物组分p6、p7、p8峰的hplc图。图6:细胞活力检测发现图4中的p6、p7、p8峰具有生物活性。图7:p8峰进一步在日立hplc系统上经c18aq分离,细胞活力检测发现较高纯度的p8-2具有细胞活性。图8:较高纯度的p8、l-多巴(logp=0.05)和维生素b12(logp=1.897)的hplc图。图9:具有细胞活性的p6、p8峰有助于降低由于心肌梗死引起的小鼠死亡率。图10-11:具有细胞活性的p6、p8峰有助于促进心肌梗塞的心脏功能修复。具体实施方式应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,各技术之间结合顺序可以互相调整,从而构成优选的技术方案。本发明提供了一种针对非人动物胚胎羊水中活性成分的纯化提取方法,得到了具有促进细胞增殖和心肌梗死后心功能恢复的生长因子群。本文的方法包括从非人动物胚胎的羊水中分离出辛醇/水分配系数logp在0.05-1.897之间的馏分的步骤,优选在0.1-1.897之间,更优选在0.5-1.897之间或在0.5-1.5之间。本文中,羊水可来自禽蛋和非人哺乳动物。禽蛋指禽类的蛋。优选的禽类为家禽,如鸡、鸭、鸵鸟蛋和鹅等。优选的是,本发明使用胚龄在5-20天、优选6-15天的禽蛋。应理解为,不同禽蛋,合适的胚龄未必相同。例如,当使用鸡蛋时,优选使用胚龄为5-12天的鸡蛋,更优选使用胚龄为6-11天的鸡蛋,更优选使用胚龄为7-9天的鸡蛋、更优选使用胚龄为7-8天的鸡蛋。当使用其它禽类的蛋时,可使用其发育时期与上述胚龄的鸡蛋所处的发育时期相对应的蛋。例如,当使用鸭蛋时,胚龄为8-10天、尤其是8-9天的鸭蛋是最好的。可采用常规的方法获得禽蛋羊水。例如,可敲击相应胚龄的蛋的钝端,使蛋壳碎裂,将蛋壳剥开形成一个直径约为2厘米的口子。然后用镊子小心撕开壳膜和卵黄膜,注意不要破坏羊膜。将包裹着胚胎的羊膜和相连组织从壳中倾倒至培养皿中,用注射器刺入羊膜抽取羊水,直至羊膜紧贴胚胎,由此即可获得用于本发明的羊水。本文中,羊水还可来自非人哺乳动物,尤其是啮齿类动物,如来自小鼠。在某些实施方案中,羊水来自胎龄为8-20天的啮齿类动物的胚胎,或来自其发育时期与胎龄为8-20天的啮齿类动物所处的发育时期相对应的非人哺乳动物的胚胎。可采用常规的方法获得羊水。例如,用手术剪剖开怀孕8-20天的小鼠腹腔,小心取出并剪开子宫,用注射器刺入羊膜抽取羊水,直至羊膜紧贴胚胎,由此即可获得用于本发明的羊水。优选地,羊水来自胎龄为8-14天或11-16天、更优选13-14天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-14天或11-16天、更优选13-14天的啮齿类动物所处的发育时期相对应的非人哺乳动物的胚胎。应理解,必要时,可对羊水进行离心,以分离出可能含有的杂质,例如卵黄等,尽可能获得纯的羊水。获得羊水后,可对羊水进行预处理,以除去脂溶相,获得水相。例如,加入适量己烷,离心,获得水相,滤膜过滤,即可获得用于下一步分离的样品。可对羊水实施反相色谱。反相色谱柱的固定相通常以硅胶为载体,表面键合有非极性分子层。通常,键合的非极性基团可选自c18烷基、c8烷基、苯基和c4烷基等及其衍生物。本发明优选使用c18反相色谱柱,即键合有c18烷基的反相色谱柱。可使用本领域周知的反相色谱柱来实施本发明,如可从市售途径获得这类反相色谱柱,包括unisil10-100c18、lachrom-c18、inertsilods、zorbaxods、acec18、sunfirec18、symmetryc18、hypersilgoldc18、lunac18、hypersilbdsc18、hypersilodsc18、syncronisaqc18和syncronisc18等。反相色谱的流动相为一定比例的水和可以与水混溶的有机溶剂。有机溶剂可选自甲醇、乙腈、乙醇、四氢呋喃、异丙醇、二氧六环、丙酮等,优选使用甲醇和乙腈。使用的有机溶剂为色谱级有机溶剂,水为100%超纯水。在实施反相色谱前,可用流动相平衡反相色谱柱。待吸收曲线平稳、回归基线后,可停止平衡。可采用常规的方式上样,样品的流速可根据实际生产情况,如所使用的柱的材料、规格以及流动相等确定。上样结束后,可进行梯度洗脱。流动相中有机溶剂的浓度可根据有机溶剂种类的不同而稍有差异,这可由本领域技术人员容易确定。在某些实施方案中,本发明的流动相中有机溶剂的百分比梯度变化可以是从5%到12%(体积百分比),水的梯度变化可以从95%到88%(体积百分比)。流动相的流速也可根据实际生产情况确定。选择洗脱体积在51-731毫升之间的馏分,优选洗脱体积在250-504毫升之间的馏分,更优选洗脱体积在278-353毫升之间和/或在354-429毫升之间和/或在430-504毫升之间的馏分,或以其它相似色谱柱以同比例所获相似馏分,即为本文所述的提取物。洗脱体积如下确定:反相分离柱:c18反相分离柱;流动相:乙腈和超纯水;洗脱方式:梯度洗脱,0-10cv,乙腈(a)从5%到12%,ddh2o(b)从95%到88%;流动相流速:10ml/min;柱温:25.0℃;上样流速:1ml/min;上样量:50ml。当采用其它色谱柱时,洗脱体积的选择可参照上述方法进行;换言之,当采用其它色谱柱时,所选择的洗脱体积应与采用上述方法确定的洗脱体积相对应。在某些实施方案中,可实施两次反相色谱分离。首次反相色谱分离的分辨率可低于第二次反相色谱分离的分辨率。首次反相色谱分离进行梯度洗脱时,极性有机溶剂的百分比梯度变化可从5%-12%(体积百分比),水的百分比梯度变化可从95%-88%(体积百分比)。如上所述,实施首次反相色谱分离时,取洗脱体积在51-731毫升之间的馏分,优选洗脱体积在250-504毫升之间的馏分,更优选洗脱体积在278-353毫升之间和/或在354-429毫升之间和/或在430-504毫升之间的馏分,或以其它相似色谱柱以同比例所获相似馏分,进行第二次反相色谱分离。由于上样样品体积不同和/或反相分离柱柱体积不同,洗脱体积会相应不同。第二次反相色谱分离进行梯度洗脱时,有机溶剂的梯度变化可以是从0%到7%(体积百分比),水的梯度变化可以从100%到93%(体积百分比)。在某些实施方案中,第二次反相色谱分离进行梯度洗脱时,前0-3分钟,有机溶剂从0%梯度变化到5.5%,超纯水从100%梯度变化到94.5%;第3-50分钟,有机溶剂从5.5%梯度变化到7%,超纯水从94.5%梯度变化到93%。优选地,第二次反相色谱分离时,取洗脱时间在11-12.5分钟之间的洗脱液和13-14分钟之间的洗脱液。洗脱时间如下确定:反相分离柱:c18反相分离柱;流动相:乙腈和超纯水;洗脱方式:梯度洗脱,0-3分钟,乙腈从0%梯度变化到5.5%,超纯水从100%梯度变化到94.5%;3-50分钟,乙腈从5.5%梯度变化到7%,超纯水从94.5%梯度变化到93%;50-52分钟,乙腈从7%梯度变化到100%,超纯水从93%梯度变化到0%;流动相流速:0.8ml/min;柱温:25.0℃;上样量:20微升。应理解,两次反相色谱分离时,当使用不同的色谱分离柱时,可根据不同分离柱的组成、性能和规格选用不同的流动相、梯度变化及流速,以获得最佳的洗脱效果。此外,当采用不同的反相柱、流动相和洗脱方式时,洗脱液的选取会有所不同,可参照本文所述的确定洗脱液的方法选择合适的洗脱液,作为本发明的提取物。在某些实施方案中,进行首次反相色谱分离时,收集馏分,然后采用本领域常规的技术测试各馏分促进细胞(如人心肌细胞系ac16)增殖的活性。之后用对具有促进细胞增殖活性的馏分做出进一步的反相色谱分离。第二次反相色谱分离后,可测试收集到的馏分的细胞增殖活性,以获得具有细胞增殖活性的馏分。该馏分可以是一种不同成分的混合物。在某些实施方案中,本发明提供一种从非人动物胚胎羊水中分离具有细胞增殖活性的成分的方法,所述方法包括:(1)对非人动物胚胎羊水进行首次反相色谱分离;(2)测试步骤(1)获得的各馏分的细胞增殖活性;(3)对步骤(2)获得的具有细胞增殖活性的馏分进行第二次反相色谱分离;和(4)测试步骤(3)获得的各馏分的细胞增殖活性;从而分离得到具有细胞增殖活性的成分。该方法所述的各反相色谱分离以及细胞增殖活性测试可如本文任一实施方案所述。在某些实施方案中,本发明尤其提供一种从鸡蛋羊水中分离具有细胞增殖活性的成分的方法,所述方法包括:(1)对鸡蛋羊水进行首次反相色谱分离,获取具有生物活性的第6峰、第7峰和第8峰的馏分;任选地,(2)对第8峰的馏分进行第二次反相色谱分离,获取第2峰馏分;从而分离得到具有细胞增殖活性的成分;其中,步骤(1)和(2)使用的反相色谱柱均为c18反相色谱柱。优选的实施方案中,两个步骤使用的流动相均为乙腈和纯水;其中,步骤(1)的反相色谱分离中,乙腈的百分比梯度变化可从5到12%(体积百分比),水的百分比梯度变化可从95%到88%(体积百分比),分离获得第6峰、第7峰和第8峰;步骤(2)中,乙腈的梯度变化可以是从0%到7%(体积百分比),水的梯度变化可以从100%到93%(体积百分比)。更优选的实施方案中,步骤(2)中,前0-3分钟,乙腈从0%梯度变化到5.5%,水从100%梯度变化到94.5%;第3-50分钟,乙腈从5.5%梯度变化到7%,水从94.5%梯度变化到93%。在某些实施方案中,本发明的提取物为采用本文任一实施方案所述的方法提取得到的提取物。本文的提取物能有效加快细胞分裂的速度,改善老化细胞的再生功能;帮助减少皱纹,让皮肤更红润、水嫩、有光泽,同时促进伤口愈合,修复器官损伤(如本案例中提出的修复心肌梗死后心功能)。因此,在某些实施方案中,本文还提供一种组合物,用于促进细胞增殖、促进伤口愈合、修复器官损伤。在某些实施方案中,该组合物为药物组合物,该药物组合物含有本文任一实施方案所述的提取物或活性成分,和任选的药学上可接受的载体。合适的载体可以是本领域周知的载体,例如适用于将活性成分制成片剂、注射剂、冻干剂或膏剂等的载体。在某些实施方案中,该组合物为化妆品,含有本文所述的提取物和化妆品中常用的载体。本文中,纯化与提取和分离可互换使用,意指从羊水中分离或提取出活性成分。下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并非意图限制本发明的范围。实施例中所用到的方法和试剂,除非另有说明,否则为本领域常规的方法和试剂。实施例1:鸡蛋和鸭蛋的成分分析1.材料和预处理取新鲜的胚龄为7天的鸡蛋羊水和胚龄为8天的鸭蛋羊水各400ml,分别加入适量己烷,2500rpm、4℃离心20分钟,获得水相,0.22μm滤膜过滤。获得用于分析的鸡蛋羊水样品和鸭蛋羊水样品。2.hplc分析(1)采用日立hplc系统进行,分离柱为lachrom-c18aq。洗脱溶剂为经脱气的色谱级乙腈和ddh2o。(2)洗脱方法流动相为乙腈(acn)和超纯水。采用梯度方式洗脱,具体参数如下:0-3分钟,乙腈从0%梯度变化到5.5%,超纯水从100%梯度变化到94.5%;3-50分钟,乙腈从5.5%梯度变化到7%,超纯水从94.5%梯度变化到93%;50-52分钟,乙腈从7%梯度变化到100%,超纯水从93%梯度变化到0%。流动相流速为0.8毫升/分钟,柱温为25.0℃,进样量为20微升。dad检测器的检测波长为250nm。等体积收集馏分,3毫升/管供细胞活性测试。3.测细胞活性将ac16消化后,铺于96孔板中,8000个/孔,每一组五个复孔。在5%co2饱和湿度37℃培养箱培养2小时,细胞贴壁。用培养基dmem饥饿培养24小时后,替换成含10%fbs的dmem、dmem和含不同体积浓度的鸡蛋羊水馏分或鸭蛋羊水馏分的培养基。培养24小时后,每孔加入10微升cck-8试剂。孵育2小时后,于酶标仪在450nm检测吸收值。4.结果结果如图1(鸡蛋)和图2(鸭蛋)所示。由图1和2可知,鸡蛋与鸭蛋的羊水具有相同的图型,因此其活性成分相同。图3显示,鸡蛋羊水提取物(cee)和鸭蛋羊水提取物(dee)能促进细胞增殖。实施例2:鸡蛋中活性成分的分离1、实验材料(1)纯化样品:新鲜的胚龄为7天的鸡蛋羊水,400ml。(2)主要实验设备及耗材geaktapurifier;相分离柱为unisil10-100c18;日立hplc系统;使用lachrom-c18aq分离柱;洗脱溶剂为经脱气的色谱级乙腈和ddh2o。2、实验方法(1)样本处理:新鲜鸡蛋羊水400ml,加入适量己烷,2500rpm、4℃离心20分钟,获得水相,0.22μm滤膜过滤。(2)样品纯化第一步:以乙腈(a)和ddh2o(b)作为流动相,unisil10-100c18反相分离柱分离;平衡反相柱:以流动相5%乙腈(a)平衡反相柱,流速10ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样流速:1ml/min,上样量50毫升;梯度洗脱:0-10cv,乙腈(a)从5%到12%,ddh2o(b)从95%到88%。流速10毫升/分钟,等体积收集馏分,3毫升/管;重复分离纯化20次,合并每一次实验中相同出峰时间的馏分;冷冻干燥每一部分样品。测细胞活性:将ac16消化后,铺于96孔板中,8000个/孔,每一组五个复孔。在5%co2饱和湿度37℃培养箱培养2小时,细胞贴壁。用培养基dmem饥饿培养24小时后,替换成含10%fbs的dmem、dmem和20%(体积比)不同馏分的培养基。培养24小时后,每孔加入10μlcck-8试剂。孵育2小时后,于酶标仪在450nm检测吸收值。细胞活力(cellviability)%=(实验组吸收值-空白孔吸收值)/(对照组吸收值-空白孔吸收值)×100%。第二步:日立c18反相分离柱分离经akta分离得到的初级活性馏分第8峰,用hplc(日立)进一步分离纯化。流动相为乙腈和超纯水。采用梯度方式洗脱,具体参数如下:0-3分钟,乙腈从0%梯度变化到5.5%,超纯水从100%梯度变化到94.5%;3-50分钟,乙腈从5.5%梯度变化到7%,超纯水从94.5%梯度变化到93%;50-52分钟,乙腈从7%梯度变化到100%,超纯水从93%梯度变化到0%。流动相流速为0.8ml/min,柱温为25.0℃,进样量为20μl。dad检测器的检测波长为250nm,检测时间为0-20分钟。冷冻干燥每一部分样品;测细胞活性:将ac16消化后,铺于96孔板中,8000个/孔,每一组五个复孔。在5%co2饱和湿度37℃培养箱培养2小时,细胞贴壁。用培养基dmem饥饿培养24小时后,替换成含10%fbs的dmem、dmem和含20%(体积比)不同馏分的培养基。培养24小时后,每孔加入10μlcck-8试剂。孵育2小时后,于酶标仪在450nm检测吸收值。细胞活力(cellviability)%=(实验组吸收值-空白孔吸收值)/(对照组吸收值-空白孔吸收值)×100%。3、实验结果1、新鲜羊水经unisil10-100c18分离的色谱图如图4所示。细胞活力检测结果如图6所示。结果显示,图4中的p6、p7、p8峰在ac16细胞中具有主要生物活性。2、p6、p7、p8峰hplc结果如图5所示。和原始粗品羊水相比,结果表明unisil10-100c18分离具有较高的分辨率,非常适合作为制备分离的第一步。如图7所示,细胞活力检测发现p8峰中含有的p8-2在ac16细胞中具有生物活性。以上结果说明较高纯度的p8-2是p8峰中以及羊水中能促进细胞增殖及的重要化合物之一。3、为了确定p8峰的疏水系数,用水分别配制p8峰、l-多巴和vb12标准化合物溶液,以安捷伦sb-aq柱洗脱,具体洗脱条件如下:色谱柱:安捷伦sb-aq,4.6x250mm,5micron;仪器:日立primaide型高效液相色谱仪;参数:检测波长250nm,柱温25℃;流动相:乙腈,水;样品处理:各样品用水溶解;洗脱:时间(分钟)乙腈(%)水(%)0010011010017595301090454555501000结果如图8所示。图8显示,p8的疏水性介于l-多巴与vb12之间。由于l-多巴的辛醇/水分配系数logp为0.05,vb12的辛醇/水分配系数logp为1.897,因此,p8的辛醇/水分配系数logp在0.05-1.897之间,更优选在0.1-1.897之间,更优选在0.5-1.897之间或在0.5-1.5之间。实施例3:鸡蛋中活性成分对修复心肌梗塞后心功能1、实验材料(1)8周龄c57bl/6j成年雄性小鼠;(2)小动物气麻装置;小动物呼吸机;小鼠气管插管和心梗模型无菌手术器械;(3)尾静脉注射装置和注射器;(4)2100高分辨率小动物超声成像系统。上述材料均从市售途经获得。2、实验方法(1)8周龄c57bl/6j小鼠在诱导箱中用5%的异氟烷诱导麻醉,医用胶带固定,拉直颈部,然后迅速经口腔用20g留置针气管插管接入呼吸机,进行机械通气,并切换气麻通道到呼吸机上,麻药量调为2.5%维持麻醉。呼吸机频率为115次/分钟,呼吸比1:1,潮气量为1.5毫升。将小鼠固定在手术台上,维持热板温度为37℃,将小鼠四肢与信号采集处理系统连接,监测手术中心电图的变化。左胸部脱毛备皮,碘伏消毒并覆盖高压灭菌的纱布。左前外侧经第四肋间隙开胸,暴露心脏。打开心包,于左心耳下缘2mm处穿入,用7-0prolene线经室间沟处结扎,经室间沟出结扎冠状动脉左前降支,会看到心尖变白,心电图st段抬高。缝合肋间,肌肉和皮肤。消毒。关掉麻药,持续通气至小鼠苏醒。(2)术后第二天,通过心脏超声测定心脏功能,根据左心射血分数,符合心梗指标的小鼠随机分为3组,每组8只。(3)尾静脉注射对照5%葡萄糖、葡萄糖溶解的实施例2获得的p6和p8,每只每次100微升,隔天注射。(4)每周通过2100高分辨率小动物超声成像系统检测心功能。观测4周,统计,同时计算心梗小鼠的生存率。3、实验结果(1)尾静脉注射对照5%对照葡萄糖、葡萄糖溶解的p6和p8小鼠存活率如图9所示,图中从上到下三根曲线依次对应p8、p6和对照。结果显示,p6、p8峰可以显著降低由于心肌梗塞导致的死亡。(2)如图10显示,p6、p8峰可以显著改善心肌梗塞小鼠左心室射血分数。(3)如图11显示,p6、p8峰可以显著改善心肌梗塞小鼠左心室短轴缩短率。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1