一种共载两性霉素B和阿霉素的靶向药物组合物及其应用的制作方法
本发明属于医药生物技术领域,具体涉及一种共载两性霉素b和阿霉素的靶向药物组合物及其应用。
背景技术:
描述据世界卫生组织统计,利什曼病在全球造成约26,000至65,000名人口的死亡,新增约700,000至1,000,000名人口的感染。该疾病常发于经济欠发达地区,并与营养不良、卫生条件恶劣、免疫能力低下(患者并发艾滋病等免疫疾病)和经济资源匮乏等问题有着密切联系。
利什曼病是由利什曼原虫属引起的寄生虫疾病,主要有皮肤利什曼病、黏膜利什曼病和内脏利什曼病三种。其中,内脏利什曼病最为严重,又被称为黑热病,主要由杜氏利什曼原虫引起。据世界卫生组织统计,2017年95%以上的内脏利什曼新增病例集中分布在以下的十个国家:孟加拉国、巴西、中国、埃塞俄比亚、印度、肯尼亚、尼泊尔、索马利亚、南苏丹和苏丹,其不治疗致死率高达95%。
利什曼原虫藉由雌白蛉叮咬人和动物时在雌白蛉与人和动物之间双向传播,从而完成其两个生命周期。利什曼虫前鞭毛体寄生于雌白蛉的咽部,当雌白蛉吸食人和动物的血液时,进入人和动物体内,随后进入巨噬细胞,由前鞭毛体转型为无鞭毛体并扩增。此时,人和动物被感染成为利什曼原虫的储蓄宿主,之后再次被叮咬时,反向感染雌白蛉,利什曼虫又进入雌白蛉的中肠,由无鞭毛体转型为前鞭毛体,并逐渐转移至雌白蛉的咽部。
现阶段治疗利什曼病的临床药物主要有脂质体两性霉素b、五价锑化合物、唑类、米替福新等。其中,锑类药物由于其广泛使用,耐药问题已逐渐显现。同时,对于并发艾滋病或者免疫力低下的利什曼病患者,其药物用量需要提高、治疗周期需要延长,这带来的毒副作用和经济支出给患者身体和心理都带来了沉重的负担。
技术实现要素:
本发明提供一种新型胶束,该胶束同时包载两性霉素b和阿霉素,实现了药物的协同治疗,较少药物用量即可达到较好的治疗利什曼病效果;该胶束表面具有甘露糖残基,实现了主动靶向巨噬细胞;该胶束结构具有酸不稳定性,实现了药物的定点释放。
本发明的第一个目的是提供一种用于治疗利什曼病的药物组合物,所述组合物包括甘露糖修饰的β-环糊精丙酸酯、两性霉素b、阿霉素;所述甘露糖修饰的β-环糊精丙酸酯的结构如下所示:
在本发明的一种实施方式中,所述甘露糖修饰的β-环糊精丙酸酯、两性霉素b、阿霉素的摩尔比为1:(0.1-1):(0.1-1)。优选1:0.5:0.5。
在本发明的一种实施方式中,所述甘露糖修饰的β-环糊精丙酸酯是利用1份β-环糊精、7份甘露糖残基试剂、14份丙酰碳链试剂为原料制备而成。
在本发明的一种实施方式中,所述甘露糖修饰的β-环糊精丙酸酯的制备方法具体包括如下步骤:
(1)合成七(6-叠氮基-6-去氧-2,3-二-o-丙酰基)-β-环糊精:将七(6-叠氮基-6-去氧)-β-环糊精、4-二甲氨基吡啶、丙酸酐混合均匀,反应完全后提纯即得;
(2)合成甘露糖修饰的β-环糊精丙酸脂(man7-β-cd-c3,mcc):将七(6-叠氮基-6-去氧-2,3-二-o-丙酰基)-β-环糊精与炔丙基d-甘露糖溶于有机溶剂中,加入含有硫酸铜和的抗坏血酸钠水溶液,反应完全后提纯即得。
在本发明的一种实施方式中,所述步骤(2)中七(6-叠氮基-6-去氧-2,3-二-o-丙酰基)-β-环糊精与丙酸酐摩尔比为1:14。
在本发明的一种实施方式中,所述步骤(2)中七(6-叠氮基-6-去氧-2,3-二-o-丙酰基)-β-环糊精与炔丙基d-甘露糖摩尔比为1:7。
本发明的第二个目的是提供一种制备上述药物组合物的方法,所述方法包括如下步骤:
按照摩尔比1:(0.1-1):(0.1-1),将甘露糖修饰的β-环糊精丙酸酯、两性霉素b、阿霉素溶解于溶剂中,配置成总质量浓度为0.1-10mg/ml的溶液,然后加入超纯水,移入透析袋进行透析,滤器过滤后,取滤液,得到纳米胶束。
在本发明的一种实施方式中,水相对溶液的添加量为1-5倍体积。
所述透析时的体积比为1:100-1:500,透析液的换液次数为5-10次。所述透析袋是mw2000,即“透过分子量2000”,透过分子量2000指的是球蛋白。所述透析是在避光、室温环境下进行的。
本发明的第三个目的将上述药物组合物用于制备治疗利什曼病的药物。
所述药物的剂型包括传统剂型,例如汤剂、丸剂、散剂、膏剂、丹剂、酒剂、糖浆剂、浸膏剂、锭剂、棒剂、栓剂、曲剂、炙剂等;还包括现代剂型,例如片剂、冲剂、袋泡剂、口服液剂、胶囊剂、滴丸剂、合剂、酊剂、气雾剂、膜剂、针剂、注射剂等。
所述药物还含有其他医学上可接受的辅料,包括黏合剂、填充剂、崩解剂、润滑剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、增溶剂、渗透压调节剂、着色剂等。
有益效果:
本发明的纳米胶束,其载体材料的生物兼容性较好,因此不会给患者带来额外代谢负担;其表面的甘露糖残基可以主动靶向巨噬细胞,因此实现了药物的定向输送;其同时负载两性霉素b和阿霉素,因此实现了药物的协同治疗;其在体液环境中能稳定存在的同时具有酸不稳定性,因此实现了药物的可控释放。这些特性能够提高药物的治疗效率,缩短治疗周期,并有助于避免耐药现象的出现。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制;
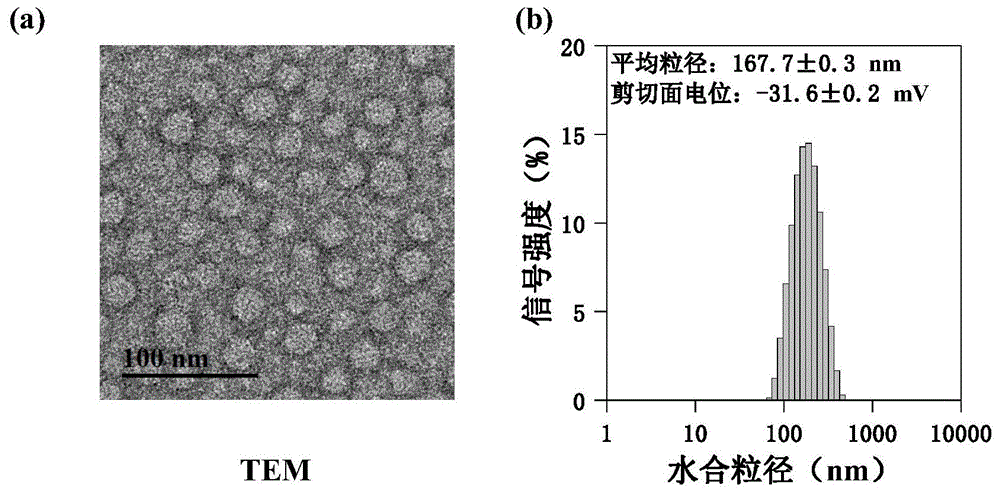
图1为纳米胶束amb&dox@mcc的透射电镜图(a)和粒径分布图(b);
图2为纳米胶束amb&dox@mcc的稳定性图(a)和ph敏感释放图(b);
图3为纳米胶束amb&dox@mcc的细胞毒性(a)和溶血毒性(b);
图4为纳米胶束amb&dox@mcc对raw264.7细胞的靶向效率图(a);amb&dox@mcc对hek293细胞的靶向效率图(b);甘露糖竞争试验验证靶向效率图(c);
图5为纳米胶束amb&dox@mcc按两性霉素b计算的量效曲线(a);50%和80%抑制柱状图(b);按阿霉素计算的量效曲线(c);50%和80%抑制柱状图(d);非治疗组(e)及治疗组(f)的三维切片图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1甘露糖修饰的β-环糊精丙酸酯的制备
(1)合成七(6-叠氮基-6-去氧-2,3-二-o-丙酰基)-β-环糊精:将1.5g的七(6-叠氮基-6-去氧)-β-环糊精和4.5g的4-二甲氨基吡啶溶于36ml的吡啶中,加入8.2ml的丙酸酐,然后将体系温度升至60℃,氮气保护下搅拌48小时;将反应液冷却至常温后,加入200ml的水,用150ml的乙酸乙酯萃取3次,再加入过量的无水硫酸钠除水,过滤后减压蒸馏除去溶剂,最后过硅胶柱纯化(石油醚:乙酸乙酯=4:1);
(2)合成甘露糖修饰的β-环糊精丙酸脂(man7-β-cd-c3,mcc):将208mg的七(6-叠氮基-6-去氧-2,3-二-o-丙酰基)-β-环糊精与200mg的炔丙基d-甘露糖溶于5ml的二甲基甲酰胺中。将98mg的硫酸铜和242mg的抗坏血酸钠溶于5ml的水中,滴加至反应液中,然后升温至60℃,氮气保护下搅拌48小时。将反应液过滤后减压蒸馏至约1ml后,过g25葡聚糖凝胶柱纯化。
其中,步骤(1)中的七(6-叠氮基-6-去氧)-β-环糊精(cas53958-47-7)可以购买得到,也可以通过如下方法制备得到:将2.99g的七(6-碘-6-去氧)-β-环糊精溶于50ml的二甲基甲酰胺中,缓慢加入1g的叠氮化钠,将体系温度升至60℃,氮气保护下搅拌20小时。将反应液减压蒸馏至约5ml后,加入400ml的水搅拌10分钟后,过滤干燥后得到产物。
其中,七(6-碘-6-去氧)-β-环糊精(cas53958-47-7)可以购买得到,也可以通过如下方法制备得到:将2.99g的七(6-碘-6-去氧)-β-环糊精溶于50ml的二甲基甲酰胺中,缓慢加入1g的叠氮化钠,将体系温度升至60℃,氮气保护下搅拌20小时。将反应液减压蒸馏至约5ml后,加入400ml的水搅拌10分钟后,过滤干燥后得到产物。
其中,炔丙基d-甘露糖(cas854262-01-4)可以购买得到,也可以通过如下方法,以d-甘露糖作为原料制备得到:
(1)合成1,2,3,4,6-五-o-乙酰基甘露糖:将135mg的4-二甲氨基吡啶溶于72ml的吡啶中,冰浴搅拌30分钟后,缓慢加入5g的d-甘露糖,待其完全溶解后,再缓慢加入42ml的乙酸酐,撤除冰浴,常温下反应至薄层色谱法(thin-layerchromatography,tlc)检测原料点消失时,加入100ml的4℃水淬灭反应;产物先后用100ml的二氯甲烷萃取3次、用100ml的1m盐酸洗涤3次、用100ml的饱和碳酸氢钠溶液洗涤3次、用100ml的饱和氯化钠溶液洗涤3次,再加入过量的无水硫酸钠除水,过滤后减压蒸馏除去溶剂,最后过硅胶柱纯化(石油醚:乙酸乙酯=4:1);
合成炔丙基2,3,4,6-四-o-乙酰基甘露糖:将6.2g的1,2,3,4,6-五-o-乙酰基甘露糖溶于75ml的无水二氯甲烷中,加入1.05ml的2-丙炔-1-醇,冰浴搅拌5分钟后,在15分钟内缓慢滴入3ml的三氟化硼乙醚,再冰浴搅拌10分钟;撤除冰浴,常温下反应10小时后,加入100ml的饱和碳酸钾溶液终止反应。产物先后用100ml的二氯甲烷萃取3次、用100ml的饱和氯化钠溶液洗涤3次,再加入过量的无水硫酸钠除水,过滤后减压蒸馏除去溶剂,最后过硅胶柱纯化(石油醚:乙酸乙酯=5:1);
合成炔丙基d-甘露糖:将1.4g的炔丙基2,3,4,6-四-o-乙酰基甘露糖溶于30ml的0.3m甲醇钠溶液中,常温下过夜搅拌,用ir-120的氢离子树脂在精密ph试纸的监测下将体系调节至中性后,过滤后减压蒸馏除去溶剂,再用油泵抽干,得到蜂窝状的粗产物。
实施例2一种药物组合物的制备
称取10mg的实施例1制得的甘露糖修饰的β-环糊精丙酸酯、2mg的两性霉素b、2mg阿霉素溶解于二甲基亚砜中(mcc:amb:dox摩尔比1:0.5:0.5),溶液的质量浓度为0.1mg/ml,充分溶解并均匀混合后,滴入1倍体积的超纯水,均匀混合后移入透析袋中用超纯水透析,滤器过滤后,即得到纳米胶束;所述的透析体系的体积比为1:100-1:500,透析液的换液次数为5-10次;所述的纳米胶束的粒径范围为100-200nm。
实施例3一种药物组合物的制备
称取10mg的实施例1制得的甘露糖修饰的β-环糊精丙酸酯、2mg的两性霉素b、2mg阿霉素溶解于二甲基亚砜中(mcc:amb:dox摩尔比1:0.5:0.5),溶液的质量浓度为1mg/ml,充分溶解并均匀混合后,滴入1倍体积的超纯水,均匀混合后移入透析袋中用超纯水透析,滤器过滤后,即得到纳米胶束;所述的透析体系的体积比为1:100-1:500,透析液的换液次数为5-10次;所述的纳米胶束的粒径范围为100-200nm。
实施例4一种药物组合物的制备
称取10mg的实施例1制得的甘露糖修饰的β-环糊精丙酸酯、2mg的两性霉素b、2mg阿霉素溶解于二甲基亚砜中(mcc:amb:dox摩尔比1:0.5:0.5),溶液的质量浓度为10mg/ml,充分溶解并均匀混合后,滴入1倍体积的超纯水,均匀混合后移入透析袋中用超纯水透析,滤器过滤后,即得到纳米胶束;所述的透析体系的体积比为1:100-1:500,透析液的换液次数为5-10次;所述的纳米胶束的粒径范围为100-200nm。
实施例5一种药物组合物的制备
称取10mg的实施例1制得的甘露糖修饰的β-环糊精丙酸酯、2mg的两性霉素b、2mg阿霉素溶解于二甲基亚砜中(mcc:amb:dox摩尔比1:0.5:0.5),溶液的质量浓度为0.1mg/ml,充分溶解并均匀混合后,滴入5倍体积的超纯水,均匀混合后移入透析袋中用超纯水透析,滤器过滤后,即得到纳米胶束;所述的透析体系的体积比为1:100-1:500,透析液的换液次数为5-10次;所述的纳米胶束的粒径范围为100-200nm。
实施例6一种药物组合物的制备
称取10mg的实施例1制得的甘露糖修饰的β-环糊精丙酸酯、2mg的两性霉素b、2mg阿霉素溶解于二甲基亚砜中(mcc:amb:dox摩尔比1:0.5:0.5),溶液的质量浓度为1mg/ml,充分溶解并均匀混合后,滴入5倍体积的超纯水,均匀混合后移入透析袋中用超纯水透析,滤器过滤后,即得到纳米胶束;所述的透析体系的体积比为1:100-1:500,透析液的换液次数为5-10次;所述的纳米胶束的粒径范围为100-200nm。
实施例7一种药物组合物的制备
称取10mg的实施例1制得的甘露糖修饰的β-环糊精丙酸酯、2mg的两性霉素b、2mg阿霉素溶解于二甲基亚砜中(mcc:amb:dox摩尔比1:0.5:0.5),溶液的质量浓度为10mg/ml,充分溶解并均匀混合后,滴入5倍体积的超纯水,均匀混合后移入透析袋中用超纯水透析,滤器过滤后,即得到纳米胶束;所述的透析体系的体积比为1:100-1:500,透析液的换液次数为5-10次;所述的纳米胶束的粒径范围为100-200nm。
其中,两性霉素b的载药率为9.8±0.3%,阿霉素的载药率为6.9±0.3%,且纳米胶束的粒中两性霉素b与阿霉素的质量比为1.42:1。(载药率是指组合物中含量与总添加量的比值)
实施例8药物组合物(纳米胶束)的形貌、分布表征
(1)tem测定:
取约0.1mg冻干后的实施例7制得的amb&dox@mcc溶于10ml的磷酸缓冲溶液(phosphate-bufferedsaline,pbs,ph=7.4)后,滴1滴在铜网的碳膜上,待液滴快干时,再滴1滴2%(w/v)的磷钨酸钠溶液(sodiumphosphotungstatesolution)负染胶束,自然风干后,将其通过样品杆放入一台透射电子显微镜(transmissionelectronmicroscope,tem)在200kv下观察其形貌特征及分布情况。
(2)dls/zetapotential:
取约0.1mg冻干后的实施例7制得的amb&dox@mcc溶于1ml的pbs溶液(ph=7.4)后,分别放入水合粒径和剪切面电位的测量皿,密封后,将其放入一台纳米粒度仪通过动态光散射法(dynamiclightscattering,dls)测定其水合粒径的分布情况,并使用同一仪器测定其剪切面电位(slippingplanepotential,ζ-potential)。
通过透射电子显微镜所观测的amb&dox@mcc胶束(如图1所示),其形貌呈球状,粒径约为30nm,分散较为均匀。通过纳米粒度仪所测得的amb&dox@mcc的平均水合粒径为167.7±0.3nm,其多分散指数为0.122,表明胶束的粒径分布较为集中,其剪切面电位为-31.6±0.2mv,表明胶束表面呈负电位,这是由于胶束表面甘露糖残基上的羟基解离所致。两种方法的结果都显示制备得到的amb&dox@mcc胶束尺寸较为均一,但是与透射电子显微镜下观察到的胶束实际粒径相比,动态光散射法因其所测得的结果为粒子的水力直径,因此更大一些。
实施例9药物组合物的稳定性及酸不稳定性测定
分别取约0.1mg冻干后的实施例7制得的amb&dox@mcc溶于1ml的完全培养基(改良的杜氏伊格尔培养基(dulbecco'smodifiedeaglemedium,dmem)辅加10%(v/v)的热灭活胎牛血清(heat-inactivatedfetalbovineserum,hifbs))和pbs溶液(ph=7.4)后,放入水合粒径得测量皿,密封后,连续7天在同一时间放入一天纳米粒度仪通过动态光散射法测定其平均水合粒径,根据其随时间的变化绘制稳定性图。
分别取1mg冻干后的实施例7制得的amb&dox@mcc溶于1ml的ph值为7.4和4.5的pbs溶液,然后将胶束溶液转移至mw2000的透析袋中,再分别浸入49ml的ph值相同的pbs溶液中透析。在预设的时间点每次取样200μl并立刻补偿相同体积和ph值的pbs溶液。将样品加入荧光专用的黑壁透明底96孔板中,使用酶标仪检测阿霉素在480nm处激发,590nm处发射的荧光值,再根据标准曲线和载药量计算并绘制出不同ph值下药物的释放曲线。
结合图2可知,将冻干后的amb&dox@mcc分别复溶在模拟正常血液环境的完全培养基和常用试剂pbs溶液(ph值均为7.4)中,两种溶液中胶束的粒径相近,均约为165~175nm,且在7天内都没有明显变化,即胶束的稳定性较好;将冻干后的amb&dox@mcc分别复溶在ph=7.4(胞外体液环境)和ph=4.5(酸性溶酶体环境)的pbs溶液中,胶束在ph=4.5的pbs溶液中药物释放较快,24小时内已超过50%,在ph=7.4的pbs溶液中较为稳定,药物释放量极低,24小时后不达2%。72小时后,胶束在酸性和中性pbs溶液中的药物释放量分别为3.15±1.97%和73.74±4.03%,即胶束在中性环境中较为稳定,在酸性ph环境下药物释放较为完全。胶束酸性ph响应释放的特性是由于其表面甘露糖残基的羟基在溶液ph值下降时电离情况发生了变化,从而引起其溶解度提高,最终导致胶束结构的破裂与药物的释放。
实施例10药物组合物的毒性测定
将raw264.7和hek293细胞悬液稀释至5×104ml-1后,在96孔板中每孔种入200μl。孵育24小时后,加入不同浓度的胶束单体mcc溶液。继续孵育48小时后,移去孔中溶液,用pbs溶液轻柔地润洗3次后,每孔加入100μl的0.5mg·ml-1的噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,mtt)的无酚红dmem溶液后,避光孵育4h。每孔小心移去75μl的溶液后,加入50μl的二甲基亚砜(dimethylsulfoxide,dmso),充分溶解紫色晶体甲臜后,使用酶标仪检测520nm处的吸收值,该吸收值指示细胞的活性(琥珀酸脱氢酶)。细胞相对活性的计算公式如下:
在24孔板中每孔种入500μl的新鲜羊血红细胞(redbloodcells,rbcs)液,再分别加入500μl浓度相对应的mcc的pbs溶液、实施例7制得的amb&dox@mcc的pbs溶液和等量的药物的pbs溶液。另外,加入500μl的pbs溶液作为无溶血毒性样本(阴性),加入500μl的超纯水作为完全溶血样本(阳性)。孵育2小时后,将孔板中的溶液转移至1.5ml的离心管中以1000×g离心20分钟,取上清100μl加至96孔板中,使用酶标仪检测540nm处的吸收值,该吸收值指示血红细胞的溶血强度,计算公式如下:
结合图3可知,甘露糖受体高表达的raw264.7细胞和甘露糖受体低表达的hek293细胞分别0-20μg·ml-1的胶束单体mcc孵育48小时后,均表现出较高的细胞活力(>97%);血红细胞分别同游离的两性霉素b和阿霉素、amb&dox@mcc、mcc孵育2小时后,均表现出较低的溶血程度(<1%)。
实施例11药物组合物的靶向效果
将raw264.7和hek293细胞悬液稀释至5×105ml-1后,再按每孔2ml种入12孔板。孵育6小时贴壁后,向竞争孔中加入甘露糖的pbs溶液至终浓度为1mm以封闭甘露糖受体。孵育1小时后,加入实施例7制得的amb&dox@mcc的pbs溶液至终浓度为20μg·ml-1。孵育3小时后,移去孔中溶液,用pbs溶液轻柔地润洗3次后,加入100μl的胰酶孵育3分钟,再加入900μl的pbs溶液终止消化。收集细胞后转移至1.5ml的离心管中以300×g离心3分钟,更换pbs溶液后再复悬,重复3次,以洗去细胞外的胶束粒子。使用流式(fluorescence-activatedcellsorter,facs)细胞仪的fl-2通道检测细胞中阿霉素,即amb&dox@mcc的含量。
结合图4可知,在无预处理条件下,甘露糖受体高表达的raw264.7细胞的胞内平均阿霉素荧光强度显著(p<0.001)高于甘露糖受体低表达的hek293细胞,即raw264.7细胞跨膜转运amb&dox@mcc的能力显著高于hek293细胞;预先用1mm甘露糖的pbs溶液孵育1小时后,甘露糖受体高表达的raw264.7细胞的胞内平均阿霉素荧光强度显著(p<0.001)低于无预处理组,即甘露糖孵育可以有效降低raw264.7细胞摄取amb&dox@mcc的能力。
实施例12药物组合物在治疗利什曼病中的应用
所制备药物组合物(纳米胶束)经表征和安全性测定后,用于利什曼病治疗效率检测:在12孔板中预先种入细胞爬片,将raw264.7细胞悬液稀释至1×105ml-1后,再按每孔2ml种入孔板。孵育6小时贴壁后,移去孔中溶液,再按每孔2ml种入预先稀释至1×106ml-1的l.donovani原虫前鞭毛体(promastigote)悬液。孵育18小时,待l.donovani感染raw264.7细胞后,移去孔中溶液,用pbs溶液轻柔地润洗3次后,分别加入不同浓度的amb&dox@mcc的pbs溶液、amb@mcc的pbs溶液、dox@mcc的pbs溶液、脂质体两性霉素b和游离阿霉素(ambisome+dox)组合的pbs溶液、脂质体两性霉素b(ambisome)的pbs溶液、游离阿霉素(dox)的pbs溶液;其中,组合用药时,两性霉素b和阿霉素的质量比均为1.42:1。孵育4小时后,移去孔中溶液,用pbs溶液轻柔地润洗3次后,加入完全培养基,继续培养44小时后,移去孔中溶液,用pbs溶液轻柔地润洗3次后,加入4%多聚甲醛溶液固定细胞。孵育30分钟后,移去孔中固定液,用pbs溶液轻柔地润洗3次后,抠出细胞爬片,倒扣在滴有细胞核荧光染料dapi的甘油溶液的载玻片上。在爬片边缘刷一层指甲油封片后,使用激光共聚焦显微镜在63倍物镜(油镜)下观察计数每20个细胞中含有的l.donovani原虫的数量,并据此使用originlab软件绘制出剂量效应曲线(dose-responsecurve),计算出50%和80%抑制浓度等值并作分析对比。
同时,分别选取对照组和amb&dox@mcc组的样本,利用激光共聚焦显微镜的焦点合成(focusstacking,z-stack)技术,拍摄raw264.7细胞的三维结构,并作切片分析对比。
在量效曲线和抑制率柱状图中(图5),amb&dox@mcc的药效最强,其次两个分别是amb@mcc、脂质体两性霉素b和阿霉素组合,最后是临床上使用的脂质体两性霉素b;虽然单独使用游离阿霉素或dox@mcc时,阿霉素的药效较低,但将其与两性霉素b组合用药时,药物之间产生了显著的协同作用(ic50,p<0.05;ic80,p<0.001);同时,组合使用两性霉素b和阿霉素时,由于纳米材料的靶向药物输送促进了药物组合的跨膜运输,amb&dox@mcc的效果显著(ic50&80,p<0.001)低于脂质体两性霉素b和游离阿霉素的组合。
从三维切片照片中可以看出,无处理组的raw264.7细胞中有较多的l.donovani原虫,而amb&dox@mcc的治疗可以完全清除raw264.7细胞中的l.donovani原虫。
- 还没有人留言评论。精彩留言会获得点赞!