一种川续断皂苷VI的神经保护作用在抑郁症治疗中的应用的制作方法
本发明涉及药物应用领域,具体涉及一种川续断皂苷vi的的神经保护作用在抑郁症治疗中的应用。
背景技术:
抑郁症(depression)是一种以抑郁心境为主要表现的疾病,通常表现为情绪障碍,以情绪低落、兴趣或乐趣缺乏、持续性疲劳为主要特征,具有高复发率、高致残率、高自杀率和低识别率、低就诊率、低治疗率的特点,预测到2020年,抑郁症将成为仅次于癌症的威胁人类健康的第二大致残因素,因此,抑郁症的治疗及预防对于提高人民身体健康及生活质量至关重要。
抑郁症的病因:①从中医的角度来看,认为肝气虚,即肝气中的阳气虚弱,故不能引起激动,兴奋及促进作用,导致出现以情绪,意志症状为主要表现特征的阳虚症状。肾为肝之母,由于肾阳不足,导致肝气不能升发,而引起疏泄失常,气机郁结,使得情志抑郁症状更为严重。这就说明了不是所有的症状都是由于肝气郁结所导致,而肾阳不足引起肝气亏虚进而导致肝气郁结,所以阳气的虚弱才为抑郁症的根本病因[3]。②从遗传学角度来看,抑郁症是一种具有高度遗传性的精神疾病,因其高度遗传性的特征,所以家族里有抑郁症病史的人群,特别是一级亲属,这样的人群患抑郁症的机率往往比一般人要大得多。据有关报道,家族中有患抑郁症的人群患病率是普通人群的10倍甚至是30倍。并且血缘关系越近其患病率就越高[4]。③从神经递质研究方面来看,目前公认的说法是,诱发抑郁症的重要影响因素之一是单胺类递质系统[5]。单胺类递质系统主要包括多巴胺系统、(da)5-羟色胺系统(5-ht)和去甲肾上腺素系统(ne)。研究认为,在抑郁症的发生、发展及治疗过程中,脑内的单胺类递质能起到十分关键的作用。并且在抑郁行为发生时,脑干的单胺神经核亦可参与其中,这是因为5-ht能参与到抑制自主活动中,与ne系统共同起到抑制自主活动的作用。此外,氨基酸类神经递质系统也有可能参与抑郁行为,抑郁症的发病可能与γ-氨基丁酸(gaba)、谷氨酸及其受体的相互作用密切相关,这有可能会成为情感性精神障碍药物研究的新热点。近年来,脑肠肽(脑内神经肽)理论以及血清素-去甲肾上腺素-糖皮质激素链理论也受到了人们的广泛关注。例如,crespi通过研究发现,脑肠肽功能的下降可能导致抑郁症的发生。在抑郁症、精神分裂症、焦虑症发病时导致患者出现情绪障碍的重要介质可能有神经肽及其受体。总之,抑郁症的发病机制可涉及到单胺类神经递质及诸多的神经肽,还包括氨基酸类神经递质[4]。④从神经生化方面来看,研究发现,抑郁症的发病机制可能与神经活性类固醇水平失衡、腺苷及其受体相互作用改变及雌激素水平异常降低等多种神经生化因素有关。列如其中神经活性类固醇和精神病性障碍、抑郁症和焦虑症等有着极其密切的联系,通过减少糖皮质激素作用于神经元的毒性作用,增强中枢gaba神经元的功能来发挥其对神经元的保护进而起到抗抑郁的作用[4]。⑤从社会心理学来看,抑郁症的发生、发展及治疗过程都与个体的人格特征、家庭环境、应激性生活事件、社会支持、应对方式等社会心理因素息息相关。在人格与抑郁症相关性的研究过程中发现,抑郁症的发生和发展是建立在一定的人格基础之上的,不同人格特质的人对于抑郁症的发病几率相差是很大的,如具有神经质和精神质的人格的人群在抑郁症的发生、发展中呈现正相关,具外向性格人格的人群在抑郁症的发生、发展中呈现负相关[6-7]。
抑郁症的治疗现状:目前对于抑郁症的治疗,是以药物治疗、心理治疗、联合治疗及物理治疗为主的治疗方式[8]。以药物来治疗抑郁症,一般可以分为三个阶段,其具体为急性治疗、继续治疗和维持治疗三种治疗方式。药物治疗对于大部分的急性抑郁症状疗效较好,且治疗效果大致相似,但是其副作用大小程度有所不同。在心理治疗方面,对于急性期过后的患者,使用认知行为疗法和正念训练对抑郁症的治疗有比较好的效果,尤其是对病情缓解阶段出现的问题更加有效[9]。在联合治疗中,目前使用较多的是心理治疗与药物治疗的联合治疗,通过两者各自优点的结合其疗效比单独的药物治疗效果要更好。在常见的物理疗法中,潘能荣、杨小男等[10]的研究认为抽搐电休克疗法是一种安全有效的,值得推广的治疗抑郁症方法,虽然能够降低和减少抑郁症患者的住院率及住院时间,但其不足之处也比较多,比如伴随嗜睡、肌肉疼痛及恶心等症状,更严重者甚至会造成轻度的记忆损害。而通过重复经颅磁刺激的研究也显示,每日作用于左侧前额叶皮层的rtms治疗也安全有效,其可以提高患者心境状态,减轻患者的抑郁症状,其结合药物治疗可以有效地治疗难治性抑郁症[11]。即便如此,rtms也存在着使用费用昂贵、操作困难以及可能会引起抽搐等不足之处[12]。
抑郁症的炎症假说,抑郁症的临床一线抗抑郁药主要是基于单胺假说的药物,通过对单胺递质的调节发挥抗抑郁作用,尽管疗效肯定,但普遍存在起效延迟、有效率低、不良反应多等诸多缺憾,单胺假说也不能解释抑郁症的全部现象。因此,近年来除单胺假说外的其它假说越来越受到重视,如炎症假说,炎症假说认为应激刺激引发炎症过程,最终导致抑郁症的发生[13]。
炎症可能参与抑郁症病理生理过程的假说最早是由smith于1991年提出的[14],这一假说也陆续得到了大量研究结果的支持,包括:①非抑郁症的癌症患者服用前炎症细胞因子后,经常出现一些足以满足抑郁症诊断标准的症状,一旦停止服用前炎症细胞因子,这些症状即可消失[15]。所谓前炎症细胞因子(proinflammatorycytokine)是能够促进炎症发生的一类细胞因子,属于促炎症细胞因子类,主要包括肿瘤坏死因子α(tumornecrosisfactor-α,tnf-α)、白细胞介素1(interleukin-1,il-1)、il-6、il-8等;②抑郁症患者血液和脑脊液中炎症生物标志物和前炎症因子水平升高[18-21];③前炎症因子可引起5-ht水平的改变[16];④前炎症因子可解释抑郁症中的下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,hpa)轴功能亢进[17];⑤抑郁症患者存在前炎症因子多态性,使其对炎症反应的易感性增加[18];⑥前炎症因子水平的变化可预测抑郁症的临床病程进展[19];⑦抑郁症与炎症介导的疾病有更高的共患病率[20]等。炎症假说认为:应激刺激引发炎症过程,进而使5-ht系统和hpa轴的正常生理功能发生异常改变,最终导致抑郁症的发生。那么,炎症过程是如何参与抑郁症的发病过程的呢?研究发现,其机制可能包括如下几方面:①氧化应激和一氧化氮(nitricoxide,no)应激途径[21];②色氨酸代谢产物(tryptophancatabolite,trycat)途径[22];③ω-3多不饱和脂肪酸(ω-3polyunsaturatedfattyacids,pufas)减少[23];④神经退行性改变和神经元再生减少[24]等。
神经炎症是指神经系统和免疫系统之间的相互作用。在血脑屏障存在的影响下,神经系统一直处于一个免疫隔绝的状态。外周炎症是如何影响到发生在脑内的抑郁症的呢?研究发现,抑郁症患者尸检发现整个前炎症因子网络mrna水平上调,tnf-α和il-1β等前炎症因子虽然是在外周免疫细胞产生的,而且不能以扩散的方式通过血脑屏障,但却能通过以下方式进入中枢神经系统,促进中枢神经系统细胞因子的合成:①进入血脑屏障有缺损的脑区或者通过内皮细胞转运体主动转运入中枢神经系统;②促进血脑屏障内皮细胞产生前列腺素(prostaglandin,pg)e2,pge2可通过激活小胶质细胞和星形胶质细胞进而激活神经元;③通过细胞因子受体影响与之相联系的迷走神经等神经传入信号,告知中枢神经系统存在系统性炎症[18],进而激活下丘脑等脑区参与发病过程,激活脑血管周围的巨噬细胞和内皮细胞,促进前炎症因子的释放。小胶质细胞是最早对外周炎症信号给予应答的细胞,启动包括细胞因子、趋化因子、活性氧和活性氮等炎症级联反应。然后是星形胶质细胞被激活,进一步放大炎症信号,il-1、il-6、tnf-α、ifn-α,γ可诱导生成ido,使色氨酸减少、喹啉酸增多,进而使神经营养因子减少、谷氨酸兴奋性神经毒性增强[19]。基于这些现象产生了两种神经炎症假说:第一种是炎症和神经退行性变假说[21],这一假说认为炎症引发的神经毒性和神经退行性变是抑郁症的发病原因之一;第二种假说与第一种假说基本相似,只是强调了心理应激的始动因素,认为应激导致神经元微损伤,伴发神经元再生和神经营养因子释放减少以及神经炎症活性增强,最终导致抑郁症状的出现[25]。
最新研究指出在组织损伤时,神经膜周围的纤维母细胞、巨噬细胞、树突状细胞和内皮细胞可被激活,产生使诱导循环中的免疫细胞进入神经系统引发免疫反应或炎性损伤的细胞因子、一氧化碳、趋化因子等免疫物质,主要途径有补体、免疫细胞和胶质细胞等补体系统,这些补体系统的激活是慢性神经炎症机制中的重要环节。神经系统中多种细胞可以表达补体成分和补体受体,补体因子h(complementfactorh,cfh)是补体激活系统中重要的调节因子,研究发现抑郁症患者外周血中cfh蛋白水平显著低于正常健康人,cfh基因rs1061170位点与抑郁症具有显著性关联,eqtl分析结果显示该位点显著影响脑内下橄榄核和枕叶皮质内cfh基因表达,预示cfh可能与抑郁症有关[26]。
一项囊括了18个临床研究的最新数据,其中包括了多名有自杀抑郁症患者,无自杀抑郁症患者和健康人的荟萃分析结果显示,在有自杀抑郁症患者外周血和脑组织中il-1β和il-6的水平显著高于无自杀抑郁症患者。通过体外实验,显示外周血单核细胞il-2的生成有自杀抑郁症患者显著低于无自杀抑郁症患者。正常对照者脑脊液内il-8水平显著高于有自杀抑郁症患者。一些研究证据也提示il-1β、il-6升高以及小胶质细胞增生和单核细胞增多与自杀行为都有关系。在药理学研究中,很多抗抑郁药物都显现出一定的抗炎作用,于是间接证明炎性反应是抑郁症的潜在病理机制[27]。
抗抑郁药具有抗炎效应:①抗抑郁药对炎症介质的影响,目前已有大量临床研究表明,抗抑郁药能够抑制外周血中炎症介质水平的升高,而抗抑郁药对脑脊液和尸检脑组织中炎症介质水平影响的报道则相对较少,palhagen等报道ssri类抗抑郁药西酞普兰(citalopram)对于抑郁症患者脑脊液中il-6水平的增加没有影响[28]。大量动物实验表明抗抑郁药能减轻炎症反应。在外周,氯米帕明(clomipramine)和丙咪嗪(imipramine)能够抑制淋巴细胞释放il-1β和tnf-α,西酞普兰能够抑制激活的单核细胞释放il-1β和tnf-α,舍曲林(sertraline)和帕罗西汀(paroxetine)可显著减少t淋巴细胞释放tnf-α;在中枢神经系统,地昔帕明(desipramine)能减少lps诱导的大鼠皮层组织tnf-α、il-1β、诱导型一氧化氮合酶(induciblenitricoxidesynthase,inos)和核转录因子(nuclearfactorκb,nf-κb)水平的升高,帕罗西汀能阻断ifn-α诱导的下丘脑il-1β水平的升高[29]。②抗抑郁药对激活的小胶质细胞的影响,小胶质细胞在中枢免疫功能中是扮演着执行者的角色,同时也是中枢炎性细胞因子的主要分泌细胞。实现免疫系统与中枢神经系统之间交互作用的重要手段就是炎性细胞因子的释放。研究表明,小胶质细胞的激活及炎症细胞因子的释放受到包括trpv1在内的多种膜表面受体的调节[30]。目前虽然尚无直接的证据表明小胶质细胞参与了抑郁症的发病过程,但有研究表明,自杀的抑郁症患者脑中小胶质细胞增生显著,而且心理应激可通过升高糖皮质激素水平促进小胶质细胞的增殖,而各种抗抑郁药可显著抑制多种刺激诱发的小胶质细胞活性增强[31]。例如,氟西汀(fluoxetine)可显著减少脑缺血导致的小胶质细胞增生,抑制lps刺激引起的大鼠原代小胶质细胞tnf-α、il-1β、环氧化酶2(cyclooxygenase-2,cox-2)、no和inosmrna水平的升高和nf-κb的激活;帕罗西汀和舍曲林能抑制ifn-γ诱导的6-3细胞(小鼠小胶质细胞)产生tnf-α和no,降低ca2+升高的水平[32];地昔帕明能抑制lps诱导的小胶质细胞增生[33];氯米帕明和丙咪嗪可显著减少lps刺激引起的bv2细胞(小鼠小胶质细胞)分泌tnf-α、il-1β和no,抑制nf-κb信号通路活性[34];在培养的混合胶质细胞上,吗氯贝胺(moclobemide)能够剂量依赖性的减少lps诱导的il-1β和tnf-α的释放以及nf-κb的激活[35];文拉法辛(venlafaxine)在混合胶质细胞上也表现出抗炎症效应,能够抑制lps诱导的tnf-α和no的释放[36]。
③抗抑郁药对激活的星形胶质细胞的影响,研究发现,抑郁症患者前额皮质区星形胶质细胞数量显著减少。此外,在抑郁症患者和长期应激的树鼩上发现海马脑区的星形胶质细胞数量也显著减少[26]。口服给予氟西汀28天则可显著逆转长期应激所导致的星形胶质细胞数量的减少[26],也能增加大鼠海马脑区星形胶质细胞神经营养蛋白s100β的表达水平[24]。阿米替林(amitriptyline)能增加星形胶质细胞源性神经营养因子(glialcellline-derivedneurotrophicfactor,gdnf)的表达[28],而这种作用可能是抗抑郁药所特有的,因为抗精神病药和抗焦虑药均不能诱导gdnf的释放[33]。gdnf则可进一步抑制tnf-α和il-1β的释放以及nf-κb的激活[26]。此外,慢性应激可导致星形胶质细胞缝隙连接结构和功能受损,而氟西汀和度洛西汀则可显著逆转这些改变[22]。
抗炎药的抗抑郁效应:①tnf-α拮抗剂,最著名的报道是tyring等人在研究tnf-α拮抗剂依那西普(entanercept)对银屑病的治疗作用时,偶然发现依那西普还能够改善患者的抑郁症状,与安慰剂组相比可显著降低抑郁评分,并且其抗抑郁效应不依赖于与其治疗银屑病的作用[15]。tnf-α单克隆抗体英利昔单抗(infliximab)在进行抗炎治疗的患者身上也表现出了显著的抗抑郁作用[18],但这种作用只在tnf-α和c反应蛋白(c-reactiveprotein,crp)等炎症标志物水平显著升高的情况下才表现出来,而在这些炎症标志物处于正常水平时则并未表现出显著的抗抑郁作用[24]。此外,tnf-α拮抗剂在治疗过程中还可能增加患者感染的风险[17]。②非甾体抗炎药,非甾体抗炎药乙酰水杨酸(acetyl-salicylicacid,asa)可通过不可逆抑制剂环氧酶-1(cyclo-oxygen-ase,cox-1)和cox-2,减少前列腺素和血栓素,进而降低tnf-α和il-6的水平[24]。研究表明,asa不仅单独应用具有抗抑郁作用,而且与ssri类抗抑郁药合用可增强ssri的疗效,缩短起效时间[28]。此外,asa和他汀类药物也可降低抑郁症的患病风险。尽管asa治疗抑郁症的作用目前尚无定论,但从已有的研究和正在进行的研究来看,asa很有希望成为抑郁症的治疗药物或辅助治疗药物。cox-2抑制剂塞来考昔(celecoxib)作为辅助治疗药物可增强氟西汀、瑞波西汀(reboxetine)等一线抗抑郁药的疗效,改善抑郁所致的认知功能障,而塞来考昔单独应用则无显著的抗抑郁作用[35]。但是,也有研究发现塞来考昔能加剧神经炎症,增加心血管疾病的患病风险,不建议作为抗抑郁药的辅助治疗药物,因此塞来考昔的抗抑郁辅助治疗作用仍有待进一步的研究。③四环类抗生素,四环类抗生素米诺环素(minocycline)具有抗炎、抗氧化应激、神经保护等作用,可通过多种途径发挥抗抑郁作用,能够显著减少lps诱导的抑郁样行为,改善抑郁所致的认知功能障碍,而且与锂制剂的效应相似,因此可能对双相抑郁的患者有效。目前,将米诺环素作为治疗单相抑郁(nct01574742)和双相抑郁(nct01429272,nct01514422,nct01403662)辅助治疗药物的临床试验正在进行中。此外,另一种四环类抗生素多西环素(doxycycline)也表现出显著改善lps诱导的小鼠抑郁行为的效应[36]。
中药活性成分抗抑郁的效应,①ω-3多不饱和脂肪酸,ω-3多不饱和脂肪酸是一类人体无法从头合成的不饱和脂肪酸,它可通过与花生四烯酸(arachidonicacid,aa)竞争结合cox酶降低pge2水平,减少前炎症因子的产生,从而发挥抗炎作用[37]。大量的临床、临床前和流行病学研究表明,ω-3多不饱和脂肪酸抗抑郁作用显著,而且患者的耐受性好。此外,ω-3多不饱和脂肪酸作为辅助治疗药物也能增强一线抗抑郁药的疗效[38]。②姜黄素,姜黄根茎提取成分姜黄素具有抗炎、抗氧化应激的效应,因此一直以来主要用于补充替代疗法。近些年研究表明,姜黄素可通过抑制nf-κb激活和前炎症因子释放、减轻氧化应激损伤、稳定hpa轴功能活性发挥抗抑郁作用[39]。然而,目前尚缺乏姜黄素抗抑郁作用的临床试验报道,因此有关姜黄素的抗抑郁疗效和治疗剂量还有待进一步的研究。③丹酚酸b,研究表明,丹酚酸b在强迫游泳、糖水偏好及悬尾实验中都表现出抗抑郁的特性,同时不影响自主活动及体重变化,表明丹酚酸b是安全有效的。与此同时,丹酚酸b能够减少应激诱导的细胞凋亡,减少小胶质细胞介导的神经炎症;相关性分析结果显示小胶质细胞的激活与海马及皮层的细胞凋亡呈正相关。体外实验结果显示40μm丹酚酸b能够直接抑制原代小胶质的促炎性激活;同时能够减少促炎性细胞因子诱导的新生神经元凋亡。这些结果表明丹酚酸b通过抑制小胶质细胞介导的神经炎症来减少神经元凋亡,从而起到抗抑郁的作用[40]。
川续断皂苷vi的抗抑郁前景:川续断为川续断科(dipsacaceae)川续断属(dipsacus)植物川续断(c.y.chengett.m.ai.)的根,又名川断。而川续断科川续断属植物全世界共30种,中国川续断属共18种,其中还包括了2变种,其中10种和2变种可供药用,而分布最广的物种就要数日本续断和川续断,目前在中国市场供药用的主要是川续断的干燥根,其性微温,味苦、辛、归肝、肾经[41]。在《神农本草经》中将其列为上品,具有补肝肾、强筋骨、续折伤、止崩漏、安胎等功效,可用于腰膝酸软、肢节痿痹、跌打损伤、损筋折股、胎动漏红、血崩下血以及遗精、带下、痈疽疮肿等症的治疗[42]。在近年来人们对于川续断化学成分、药理作用和临床应用等方面的研究愈来愈深入。川续断的化学成分比较复杂,主要含有的化学成分有挥发油类、生物碱类、环烯醚萜类和三萜皂苷类等四类[43]。
川续断皂苷ⅵ(aspersionⅵ)又名木通皂苷d,也有文献称其为续断皂苷c。川续断皂苷ⅵ是从川续断科川续断属植物川续断的根中提取分离出的一种三萜皂苷类化合物,为中国传统中草药川续断的主要活性成分。有研究表明通过川续断皂苷ⅵ抑制炎症发生途径,能有效的降低阿尔采末病的发病率。在由双侧脑室注射aβ1-42诱导的sd大鼠的学习和认知功能障碍模型中,aβ诱导的星形胶质细胞和小胶质细胞的激活会受到川续断皂苷ⅵ显著抑制,胶质细胞也会减少释放细胞因子和炎症因子,如肿瘤坏死因子α(tnf-α)、白细胞介素6(il-6)及环氧合酶-2(cox-2)的表达,可抑制炎症反应的发生。当川续断皂苷ⅵ剂量为90mg·kg-1和270mg·kg-1时iκb激酶(ikk)和蛋白激酶b(akt)磷酸化水平皆可得到有效降低,进而抑制核因子(空白fab)的激活和核转移过程,抑制炎症反应的发生[44]。
lps诱导啮齿动物抑郁样行为:抑郁症的非临床研究目前来说主要以在动物中建立模型的方式进行研究为主。而lps模型是通过注射来自大肠杆菌的脂多糖(lps)来引起机体的免疫应激,从而诱导小鼠产生包括抑郁样行为在内的疾病行为的模型。lps在众多与炎症相关的研究中作为免疫激活剂与细胞因子诱导剂使用。外周注射lps能通过tlr4(tollike受体4)激活机体的先天免疫系统,并迅速地引起如l-1β,tnf-a,il-6等促炎性细胞因子的释放。由于注射方式的不同会引起中枢和外周的免疫反应存在着先后的差异。腹腔注射主要是引起外周免疫反应后在激活中枢,而侧脑室注射能直接诱导较为持久的中枢免疫反应。按照研究目的不同所使用的剂量也不同,如6mg/kg的高剂量用于研究败血症,而0.83mg/kg是常用于建立抑郁样模型的剂量。腹腔注射0.83mg/kglps后,动物会由于机体处于强烈的免疫状态而表现出诸多病态行为,包括产生自发性疼痛、糖水偏好下降、体重下降、饮食减少、活动性下降等诸多病态行为。这些行为与人类的抑郁症行为有着较高的表面效度,结构效度,预测效度,也就是有着症状相似性,病理相似性,疗效相似性较高的特征,即受lps诱导的小鼠表现出的这种病态行为综合征在行为表现上与抑郁症相似,如糖水偏好下降,饮食减少,体重降低,毛发杂乱无光泽,在悬尾实验与强迫游泳实验中求生欲望降低等。在临床研究中,志愿者注射lps后同样能诱导出类似于抑郁症的症状。而以上这些特征也使得lps模型作为常用的抑郁症模型之一。不过这种lps模型也存在着一定的局限性。其诱导的病态行为综合征在实质上是机体以清除病原体或危险信号源为主要目的,伴随着发热,神经内分泌紊乱的免疫防御机制。它是一种由炎症所引发急性症状,这与抑郁症的周期长,作用机制复杂的特点并不相符[30]。而由于本次实验是探索川续断皂苷vi的神经保护作用在抑郁症治疗中的发展前景,所以选择lps模型作为抑郁症模型是符合的。
随着社会的发展,诱使抑郁症发病的刺激因素愈来愈多,抑郁症已经成为我们生活中的常见病和易发病,也是一种难治愈的疾病。大量研究结果让我们相信炎症是抑郁症的重要病因之一,然而如果炎症过程的确在抑郁症的病因病理机制中发挥重要作用,那么仍然有许多问题有待解决。比如外周炎症的改善是否也会减轻中枢系统的炎症反应以及炎症标志物与抑郁症患者的脑功能变化是否存在量效关系等。抑郁症的炎症假说不仅为我们理解抑郁症的躯体症状和精神症状之间的鸿沟架起了桥梁,也为提高临床一线抗抑郁药的疗效和抗抑郁药的研发提供了新的思路和分子靶点。而川续断皂苷vi作为中草药川续断的主要活性成分,其在神经保护,心肌保护等方面都有良好的药理活性。而神经炎症导致的神经损伤被认为是抑郁症的病因之一。所以探索川续断皂苷vi的神经保护作用在治疗抑郁症中的作用具有广阔的发展前景。
技术实现要素:
本发明的目的是为了解决背景技术中的问题,提供一种川续断皂苷vi的的神经保护作用在抑郁症治疗中的应用。
本发明所述川续断皂苷ⅵ在m1型小胶质细胞形态学中的应用。
本发明所述川续断皂苷ⅵ在抑制m1型小胶质细胞介导的炎症反应中的应用。
本发明所述川续断皂苷vi在抑制海马和皮层小胶质细胞激活中的应用。
本发明所述川续断皂苷vi在抑制lps诱导的神经炎症中的应用。
本发明所述川续断皂苷vi在改善lps诱导的抑郁样行为中的应用。
本发明还可将川续断皂苷vi加入药学上可接受的辅料制备成药学上可接受的制剂后在抑郁症治疗中的应用。
本发明所述制剂为颗粒剂、胶囊剂、散剂、片剂、丸剂、注射制剂、冻干粉针剂等剂型。
本发明所述的药学上可接受的辅料没有限定,可以是崩解剂、填充剂、润滑剂、抗氧化剂、粘合剂、表面活性剂或矫味剂等本领域常用辅料中的一种或几种。
现有技术的问题及本发明有益效果:
1、现有技术的问题:
(1)药物治疗对于大部分的急性抑郁症状疗效较好,且治疗效果大致相似,但是其副作用大小程度有所不同。在常见的物理疗法中,潘能荣、杨小男等[10]的研究认为抽搐电休克疗法是一种安全有效的,值得推广的治疗抑郁症方法,虽然能够降低和减少抑郁症患者的住院率及住院时间,但其不足之处也比较多,比如伴随嗜睡、肌肉疼痛及恶心等症状,更严重者甚至会造成轻度的记忆损害。而通过重复经颅磁刺激的研究也显示,每日作用于左侧前额叶皮层的rtms治疗也安全有效,其可以提高患者心境状态,减轻患者的抑郁症状,其结合药物治疗可以有效地治疗难治性抑郁症[11]。即便如此,rtms也存在着使用费用昂贵、操作困难以及可能会引起抽搐等不足之处[12]。
(2)抗炎药的抗抑郁效应:tnf-α拮抗剂,tnf-α单克隆抗体英利昔单抗(infliximab)在进行抗炎治疗的患者身上也表现出了显著的抗抑郁作用[18],但这种作用只在tnf-α和c反应蛋白(c-reactiveprotein,crp)等炎症标志物水平显著升高的情况下才表现出来,而在这些炎症标志物处于正常水平时则并未表现出显著的抗抑郁作用[24]。此外,tnf-α拮抗剂在治疗过程中还可能增加患者感染的风险[17]。
(3)非甾体抗炎药:cox-2抑制剂塞来考昔(celecoxib)作为辅助治疗药物可增强氟西汀、瑞波西汀(reboxetine)等一线抗抑郁药的疗效,改善抑郁所致的认知功能障,而塞来考昔单独应用则无显著的抗抑郁作用[35]。但是,也有研究发现塞来考昔能加剧神经炎症,增加心血管疾病的患病风险,不建议作为抗抑郁药的辅助治疗药物,因此塞来考昔的抗抑郁辅助治疗作用仍有待进一步的研究。
(4)中药活性成分抗抑郁的效应,主要有ω-3多不饱和脂肪酸、姜黄素、丹酚酸b作为抗抑郁药物,但是川续断皂苷vi的的神经保护作用在抑郁症治疗中的应用并未见相关研究。
2、本发明的有益效果
(1)川续断皂苷vi作为中草药川续断的主要活性成分,其在神经保护,心肌保护等方面都有良好的药理活性。而神经炎症导致的神经损伤被认为是抑郁症的病因之一。所以探索川续断皂苷vi的神经保护作用在治疗抑郁症中的作用具有广阔的发展前景。
(2)本发明通过研究显示aspⅵ的抗抑郁效果在实验动物表现出稳定有效性,其抗抑郁效果与抑制小胶质细胞活化及中枢炎症反应,并最终保护神经发生有关。
(3)通过研究表明,小胶质细胞的激活及炎症细胞因子的释放受到包括trpv1在内的多种膜表面受体的调节。小胶质细胞的激活通常会伴随着炎症因子的变化,特别在lps刺激后的小胶质细胞往往会有大量的促炎性细胞因子产生(如il-1β、inos、tnf-α、il-6等),此时的小胶质细胞通常被称为经典激活的小胶质细胞,也叫m1型小胶质细胞。本研究用lps处理体外培养的小胶质细胞,诱导小胶质细胞向m1表型极化,并用不同浓度的川续断皂苷vi干预激活的小胶质细胞,结果发现100μm和200μm的川续断皂苷vi干预组与lps模型组相比,显著抑制小胶质细胞的胞体膨大,吞噬溶酶体增加,并抑制il-1β、inos、tnf-α、il-6的表达。表明川续断皂苷vi能显著抑制小胶质细胞的激活,从而改善小胶质细胞介导的炎症反应。
(4)本研究通过结合动物行为学和生物化学两大部分实验,从现象到机制探讨了aspⅵ对lps抑郁模型小鼠的抗抑郁效果,并进一步探究aspⅵ的抗抑郁效果与海马及皮层小胶质细胞活化、中枢炎症反应以及神经发生的关系。实验结果表明:
①在体重、强迫游泳及悬尾实验中,40mg/kgaspⅵ预处理组表现出显著的抗抑郁效果;
②aspⅵ预处理组显著抑制了lps小鼠大脑海马及皮层组织中小胶质细胞的活化水平和中枢炎症反应。
附图说明
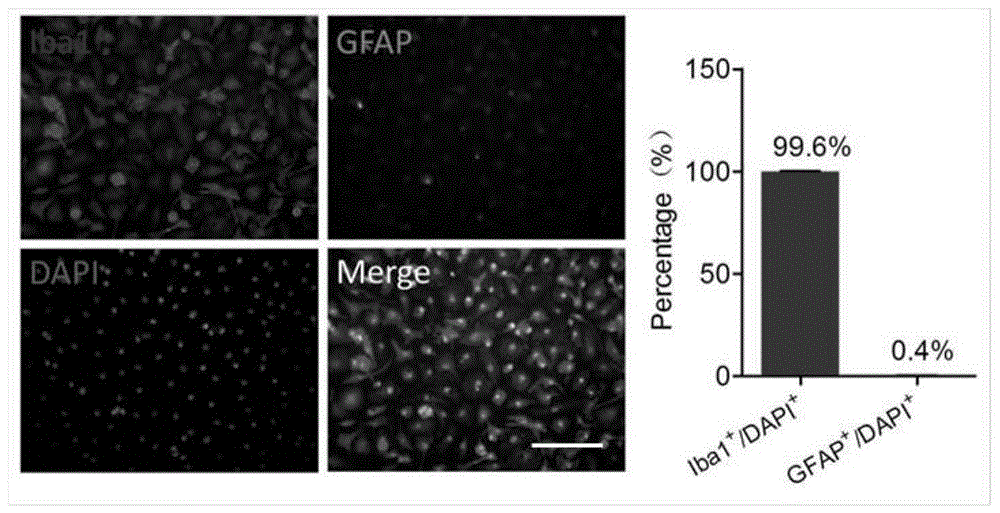
图1小胶质细胞纯度统计图[小胶质细胞用iba1抗体标记,星形胶质细胞用gfap抗体标记,细胞核用dapi标记,标尺:50μm]。
图2m1型小胶质细胞形态学受川续断皂苷vi影响的差异[(a)小胶质细胞免疫荧光染色图,cd68标记吞噬溶酶体(绿色),iba1标记小胶质细胞(红色),dapi标记细胞核(蓝色),merge表示三者叠加(橘黄色);(b)和(c)小胶质细胞cd68及iba1阳性面积统计图,cd68和iba1阳性染色的面积用imagej软件进行统计,统计结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,***p<0.005vscontrol;##p<0.01,###p<0.005vslps;n=4-5,标尺:25μm]。
图3m1型小胶质细胞介导的炎症性细胞因子在川续断皂苷vi处理后的差异性表达[(a)-(d)原代培养的小胶质细胞内的促炎性细胞因子(il-1β、inos、tnf-α、il-6)mrna表达水平,结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,**p<0.01,***p<0.005vscontrol;;#p<0.05,##p<0.01,###p<0.005vslps;n=4-5]。
图4川续断皂苷vi对小鼠海马小胶质细胞的激活的影响[(a)和(b)qpcr检测小胶质细胞激活的表型标志,小胶质细胞的表型标志主要检测小鼠海马的cd11b和iba1;(c)小胶质细胞免疫荧光染色图,iba1标记小胶质细胞(红色);(d)和(e)小胶质细胞iba1阳性面积及小胶质细胞分枝的统计图,iba1阳性染色的面积用imagej软件进行统计,统计结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,***p<0.005vscontrol;##p<0.01,###p<0.005vslps;n=4-5,标尺:25μm]。
图5川续断皂苷vi对小鼠皮层小胶质细胞的激活的影响[(a)和(b)qpcr检测皮层小胶质细胞激活的表型标志,小胶质细胞的表型标志主要检测小鼠皮层的cd11b和iba1;(c)小胶质细胞免疫荧光染色图,iba1标记小胶质细胞(红色);(d)和(e)小胶质细胞iba1阳性面积及小胶质细胞分枝的统计图,iba1阳性染色的面积用imagej软件进行统计,统计结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,***p<0.005vscontrol;##p<0.01,###p<0.005vslps;n=4-5,标尺:25μm]。
图6海马中由lps诱导的炎症性细胞因子在川续断皂苷vi处理后的差异性表达[(a)-(d)川续断皂苷vi干预下的炎症小鼠的促炎性细胞因子(il-1β、inos、tnf-α、il-6)mrna表达水平,结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,**p<0.01,***p<0.005vscontrol;;#p<0.05,##p<0.01,###p<0.005vslps;n=4-5]。
图7皮层中lps诱导的炎症性细胞因子在川续断皂苷vi处理后的差异性表达[(a)-(d)川续断皂苷vi干预下的炎症小鼠的促炎性细胞因子(il-1β、inos、tnf-α、il-6)mrna表达水平,结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,**p<0.01,***p<0.005vscontrol;;#p<0.05,##p<0.01,###p<0.005vslps;n=4-5]。
图8强迫游泳实验[(a)强迫游泳实验的示意图;(b)川续断皂苷vi干预下的炎症小鼠在强迫游泳测试中的潜伏期统计图;(c)川续断皂苷vi干预下的炎症小鼠在强迫游泳测试中的不动时间统计图。结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,**p<0.01,***p<0.005vscontrol;;#p<0.05,##p<0.01vslps;n=8-12]。
图9悬尾实验[(d)悬尾实验的示意图;(e)川续断皂苷vi干预下的炎症小鼠在悬尾测试中的潜伏期统计图;(f)川续断皂苷vi干预下的炎症小鼠在悬尾测试中的不动时间统计图。结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,**p<0.01,***p<0.005vscontrol;;#p<0.05,##p<0.01,###p<0.005vslps;n=8-10]。
图10川续断皂苷vi和lps对小鼠食物消耗的影响[(a)川续断皂苷vi干预下的炎症小鼠对食物消耗量的影响;(b)川续断皂苷vi干预下的炎症小鼠相对食物消耗量的百分比变化统计图]。
图11川续断皂苷vi和lps对小鼠体重的影响[(c)川续断皂苷vi干预下的炎症小鼠体重的影响;(d)川续断皂苷vi干预下的炎症小鼠相对体重的百分比变化统计图]。
图12川续断皂苷vi和lps对小鼠自主活动的影响[(a)旷场实验的示意图;(b)软件记录不同处理的小鼠在旷场中的活动轨迹热谱图;(c)川续断皂苷vi干预下的炎症小鼠在旷场实验中的不动时间统计图。(d)川续断皂苷vi干预下的炎症小鼠在旷场实验中的运动时间统计图;(e)川续断皂苷vi干预下的炎症小鼠在旷场实验中的在中心的持续时间统计图;(f)川续断皂苷vi干预下的炎症小鼠在旷场实验中的运动距离统计图;结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,**p<0.01,***p<0.005vscontrol;;#p<0.05,##p<0.01vslps;n=8-12]。
图13高架十字实验[(a)高架十字迷宫实验的示意图;(b)软件记录不同处理的小鼠在高架十字迷宫的活动轨迹热谱图;(c)川续断皂苷vi干预下的炎症小鼠在高架十字迷宫中对开臂的的探头次数。(d)川续断皂苷vi干预下的炎症小鼠在高架十字迷宫中进入开臂的次数的百分比统计图;(e)川续断皂苷vi干预下的炎症小鼠在高架十字迷宫中进入开臂的时间的百分比统计图;结果用graphpad软件进行作图,并作显著性差异分析,分析方法采用单因素方差分析的lsdposthoc,**p<0.01,***p<0.005vscontrol;;#p<0.05,##p<0.01vslps;n=8-12]。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1:取川续断皂苷vi断作为原料药,加入1/20的淀粉,制粒,得颗粒剂。
实施例2:取川续断皂苷vi作为原料药,加入1/20的淀粉,混匀,装入胶囊,得胶囊剂。
实施例3:取川续断皂苷vi作为原料药,加入及1/20的糊精混合均匀,干燥,制成丸剂。
实施例4:取川续断皂苷vi作为原料药,加入1/15的淀粉,制粒,压片,制成片剂。
实施例5:取川续断皂苷vi作为原料药,加入12倍量的注射用水,浸泡6-8小时,过滤,灭菌,得注射剂。
实施例6:取川续断皂苷vi作为原料药,加入13倍量的注射用水,浸泡6-8小时,过滤,冻干,得冻干粉剂。
实施例7川续断皂苷ⅵ抑制m1型小胶质细胞介导的炎症反应
1引言
川续断皂苷vi又名木通皂苷d,是中国传统中草药川续断的主要活性成分。川续断皂苷vi的药理作用广泛,其在神经保护、心肌保护、抗细胞凋亡、镇痛等方面的药理活性引起了学者的广泛关注,但是,到目前为止川续断皂苷vi的神经保护机制还不清楚。大量研究表明小胶质细胞的促炎性(m1型)激活通常会造成神经损伤,该过程与许多神经退行性疾病相关。本研究旨在探索川续断皂苷vi对m1型小胶质的抑制作用,以期为研究川续断皂苷vi的神经保护机制奠定基础。
2实验方法
2.1实验动物
出生后0-3天的c57bl/6j乳鼠(买自湖南省长沙市天勤生物技术有限公司)。
2.2实验试剂
lps(sigma,美国),川续断皂苷vi(四川生工有限公司),蛋白裂解液(北京索莱宝生物科技有限公司),bca试剂盒(武汉博士德生物工程有限公司),elisa试剂盒(武汉博士德生物工程有限公司),反转录试剂盒(takara宝生物公司),胰蛋白酶,上下游引物(生工生物有限公司),胎牛血清(gibico)dmem-f12完全培养基(gibico),驴血清(gibico),dapi(cellsignalingtechnology,inc),trizol(takara宝生物公司),iba-1(abcam),gfap(cellsignalingtechnology,inc),cd68(abcam),荧光酶(takara宝生物公司)。
2.3实验仪器
c1000touchpcr仪(bio-rad),te200-s倒置荧光显微镜(nikon),sim-f124制冰机(sanyo),el104电子分析天平(梅特勒科学仪器公司),h荧光酶标仪,centrifuge5810r冷冻离心机(eppendorf),upt-ⅱ-20t超纯水机(西安优普仪器设备有限公司),7500realtimepcrsystem(美国应用生物系统公司),dw-40l508医用低温保存箱(青岛海尔特种电器有限公司)。
2.3原代小胶质细胞培养
0-3天c57/bl6乳鼠,脊椎脱臼法处死,浸入75%酒精3-5s,对乳鼠进行消毒,从颈部上方插入剪刀,剪至眼部,两边均剪开。取出全脑放入无菌pbs中,移除小脑和嗅球,用尖镊子剥离脑膜。用移液枪吹打组织块,使其尽可能小块,后转入50ml离心管800g离心5min,离心完毕保留沉淀,遗弃上清,操作尽量小心避免摇晃沉淀。然后加入5ml胰蛋白酶,放入37℃恒温水浴锅消化3-5min,期间应一直震荡,直至有胶状物开始出现,此时加入与等体积内含10%胎牛血清的dmem-f12完全培养基,以此终止消化,加入后吹打多次。将70μm细胞筛放置在新的50ml离心管管口,用移液枪将终止消化之后的细胞悬液移至滤膜上,过滤液体后1200g离心10min。弃上清,可以清楚观察到的底部沉淀即为细胞,加入一定量的无菌pbs洗涤,用移液枪吹打沉淀,至其溶解,再次1200g离心10min。弃上清液,加入小胶质细胞培养基(45mldmem、5mlfbs、100μl双抗)10-15ml,吹成单个细胞。最后用电动枪将细胞加入细胞培养的方瓶中,注意方瓶的放置方向,切勿将大肚移液管放置太过深入,以防止污染细胞。24h后,更换小胶质细胞培养基,培养两周后用于后续实验。混合培养的胶质细胞14天后用震荡分离法分离纯化小胶质细胞。
2.4药物处理
将纯化好的小胶质细胞培养在24孔板里,并分别用10μm、50μm、100μm、200μm的川续断皂苷vi预处理小胶质细胞30min,然后加入100ng/ml的lps诱导m1型小胶质细胞,24h后进行q-pcr分析和形态学鉴定。
2.5q-pcr检测炎症因子表达
每孔细胞中加入1mltrizol,用5ml注射器抽打细胞,直至无块状物存在,室温放置5min。加入200μl三氯甲烷,剧烈震荡促使组织中的蛋白被完全抽提,室温静置5min,12000g,4℃离心15min,需注意放管方向。吸取上清液转移至新的1.5ml离心管中,上层清液即为rna,宁缺毋滥,切不可吸到下部沉淀,后加入与上清液等体积的异丙醇,震荡混匀,15-30℃孵育10min,沉淀rna,12000g,4℃离心10min。用移液枪吸干上清液,可见底部有白色沉淀,加入75%depc处理过的乙醇500μl,上下剧烈震荡,混合样品,务必使白色沉淀悬浮于液体中,7500g,4℃离心5min,期间不可使rna完全干燥,否则会极大降低其可溶性。弃上清,打开管盖,放入4℃冰箱,风干后加入30μldepc处理的水,放入-80℃保存,勿保存至冰箱门口。提取的rna,使用takara公司提供的反转录试剂盒,严格按照实验说明书步骤进行。首先,200μldepc浸泡过的ep管依次加入5×gdnaeraserbuffer(2μl)、gdnaeraser(1μl)、totalrna(1μg),最后加rnasefreedh2o至总体积10μl,混合均匀,离心使混合液沉积于ep管底部,42℃加热2min。然后,依次加入reactionsolutionfromstep1(10μl)、5×primescriptbuffe2(forrealtime)(4μl)、primescriptrtenzymemix1(1μl)、rtprimemix(1μl)、rnasefreedh2o(4μl),得到20μl体系混合液,再次混匀离心,30℃孵育15min,85℃加热5s终止反应。从所得cdna样品中取1μl,加入5μlmastermix和上下游引物各1μl,加depc水至10μl体系。混匀后放入7500realtimepcrsystem中,在95℃预变性2s,70℃退火5s,并延伸,该过程重复35个循环,每个样品3个重复。内参基因为β-actin,相关基因的表达按照2-δδct的方法计算。
2.6免疫组织化学染色
将载玻片浸泡在酒精里,过火消毒后铺在24孔板的底部,将分离的小胶质细胞培养在载玻片上,药物处理24h之后,用4%的pfa固定细胞30min,用pbs洗3遍后在4℃保存。保存好的细胞爬片,室温放置5min,用pbs清洗3次,5min/次,最后一次彻底吸干残留液体,用0.5%tritonx-100通透清洗15min,用10%,再用pbs清洗3次,5min/次。使用pbs配制的10%驴血清,室温封闭脑片2h,加入一抗4℃孵育过夜。次日,脑片放置室温10min,用pbs清洗3次,5min/次,避光孵育二抗2h,后用pbs清洗脑片3次,每次5min。最后加入dapi着色细胞核,镜检观察脑片。
2.7统计学分析
所有图表制作及统计学分析均采用graghpadprism软件,所有数据的表示方法都是mean±sem,分析方法为one-wayanova中的bonnferoniposthoc检验,p小于0.05表示有显著性差异。
3结果
3.1川续断皂苷vi对m1型小胶质细胞形态学的影响
本研究培养了原代的小胶质细胞用于神经炎症研究,小胶质细胞从小鼠的大脑中被分离出来,在细胞培养板中进行培养。小胶质细胞的纯化采用震荡分离的方法,小胶质细胞的纯度用免疫组织化学检测的方式,iba1标记小胶质细胞,gfap标记星形胶质细胞,dapi标记细胞核,检测结果如图1所示,99.6%的细胞为小胶质细胞,只有0.4%的细胞为星形胶质细胞。研究中,小胶质细胞纯度通常达到95%以上即可用于实验研究,所以本研究纯化的小胶质细胞纯度较高,可用于后续研究。
通过培养原代的小胶质细胞,并用lps处理来激活体外培养的小胶质细胞,建立小胶质细胞的炎症模型,并用不同浓度的川续断皂苷vi进行药物干预。免疫组织化学染色结果如图2所示,与空白组相比,lps模型组中小胶质细胞膨大,表面积增加,分支减少,激活程度较高。cd68作为小胶质细胞激活的标志物,主要用于标记小胶质细胞的吞噬溶酶体,该溶酶体在小胶质细胞激活的过程中会随着小胶质细胞激活程度的的增加而逐渐膨大。lps处理后,cd68阳性染色的面积显著增大(p<0.005),表明小胶质细胞被显著激活。用不同的川续断皂苷vi干预激活的小胶质细胞后,分别统计cd68阳性染色的面积及小胶质细胞的面积变化,统计结果表明,10μm的川续断皂苷vi干预组与lps模型组相比,在cd68阳性染色的面积上无统计学差异(p>0.05),在小胶质细胞的面积上也无显著性差异(p>0.05)。50μm的川续断皂苷vi干预组与lps模型组相比,显著减少cd68阳性染色的面积(p<0.01),在小胶质细胞的面积上虽然有减少,但无统计学差异(p>0.05)。100μm的川续断皂苷vi干预组与lps模型组相比,显著减少cd68阳性染色的面积(p<0.005),在小胶质细胞的面积上虽然有减少,但无统计学差异(p>0.05)。200μm的川续断皂苷vi干预组与lps模型组相比,显著减少cd68阳性染色的面积(p<0.005),同时也显著减少小胶质细胞的相对面积(p<0.005)。
3.2川续断皂苷vi抑制m1型小胶质细胞介导的炎症反应
小胶质细胞的激活通常会伴随着炎症因子的变化,特别在lps刺激后的小胶质细胞往往会有大量的促炎性细胞因子产生(如il-1β、inos、tnf-α、il-6等),此时的小胶质细胞通常被称为经典激活的小胶质细胞,也叫m1型小胶质细胞。本研究用lps处理体外培养的小胶质细胞,诱导小胶质细胞向m1型激活,小胶质细胞的激活表型用q-pcr检测炎症性细胞因子的表达,检测结果如图3所示,与空白组相比,lps模型组中il-1β、inos、tnf-α、il-6几个促炎性细胞因子含量明显升高(均为p<0.05);表明lps能够成功诱导小胶质细胞向m1表型激活,该炎症模型可用于后续的药物干预研究。
用不同浓度的川续断皂苷vi干预激活的小胶质细胞后,分别检测il-1β、inos、tnf-α、il-6的基因表达变化,统计结果表明,10μm的川续断皂苷vi干预组与lps模型组相比,在il-1β、inos、tnf-α、il-6的mrna表达水平上均无统计学差异(p>0.05),在小胶质细胞的面积上也无显著性差异(p>0.05)。50μm的川续断皂苷vi干预组与lps模型组相比,显著减少il-1β和il-6的mrna表达水平(p<0.05),inos、tnf-α的mrna表达水平虽然有减少,但无统计学差异(p>0.05)。在小胶质细胞的面积上虽然有减少,但无统计学差异(p>0.05)。100μm和200μm的川续断皂苷vi干预组与lps模型组相比,显著减少il-1β、inos、tnf-α、il-6的mrna表达水平(p<0.05)。
4.总结
小胶质细胞是存在于大脑里的免疫细胞,小胶质细胞在中枢免疫功能中是扮演着执行者的角色,同时也是中枢炎性细胞因子的主要分泌细胞。实现免疫系统与中枢神经系统之间交互作用的重要手段就是炎性细胞因子的释放。研究表明,小胶质细胞的激活及炎症细胞因子的释放受到包括trpv1在内的多种膜表面受体的调节。小胶质细胞的激活通常会伴随着炎症因子的变化,特别在lps刺激后的小胶质细胞往往会有大量的促炎性细胞因子产生(如il-1β、inos、tnf-α、il-6等),此时的小胶质细胞通常被称为经典激活的小胶质细胞,也叫m1型小胶质细胞。本研究用lps处理体外培养的小胶质细胞,诱导小胶质细胞向m1表型极化,并用不同浓度的川续断皂苷vi干预激活的小胶质细胞,结果发现100μm和200μm的川续断皂苷vi干预组与lps模型组相比,显著抑制小胶质细胞的胞体膨大,吞噬溶酶体增加,并抑制il-1β、inos、tnf-α、il-6的表达。表明川续断皂苷vi能显著抑制小胶质细胞的激活,从而改善小胶质细胞介导的炎症反应。
实施例8:川续断皂苷ⅵ在抑制神经炎症及其对抑郁症的改善
1引言
抑郁症又称抑郁障碍,是心境障碍的主要类型。临床可见心境低落与其处境不相称,情绪的消沉可以从闷闷不乐到悲痛欲绝,自卑抑郁,甚至悲观厌世,可有自杀企图或行为。随着社会竞争的日趋激烈,来自学习和工作或家庭的持续不断的压力,导致抑郁症的发病率呈逐年增加趋势,且发病年龄日渐年轻化。目前,抑郁症已经跻身为世界第四大疾病类型,初步估计,到2020年可能成为第二大疾病。然而,目前的抗抑郁药物疗效不是十分理想,不仅治疗周期长,而且对部分患者没有效果,同时会有较强的副作用。因此开发一种安全有效的抗抑郁药物是当下亟待解决的问题。
川续断皂苷vi是中国传统中草药川续断的主要活性成分。川续断皂苷vi的药理作用广泛,其在神经保护、心肌保护、抗细胞凋亡、镇痛等方面的药理活性引起了学者的广泛关注。神经炎症导致的神经损伤被认为是抑郁症病因之一。本实验旨在探索川续断皂苷vi的神经保护作用在抗抑郁中的意义及其作用机制。
2实验方法
2.1实验动物
本研究所用的实验动物为7周龄c57/bl6雄性小鼠(买自湖南省长沙市天勤生物技术有限公司)。实验动物日常饲养条件均一致,包括:照明时间与黑暗时间均为12小时(早上7点开灯,晚上7点关灯),25±1℃室温,75%空气湿度,标准饲料与饮用水,单笼饲养,动物活动自由,适应两周后开始用于实验研究。在整个实验过程中,严格遵守相关法律以及动物伦理委员会的相关规定,符合动物行为规范。
2.2实验试剂
lps,川续断皂苷vi,蛋白裂解液,bca试剂盒(武汉博士德生物工程有限公司),elisa试剂盒(武汉博士德生物工程有限公司),反转录试剂盒(takara宝生物公司),上下游引物(生工生物有限公司),胰蛋白酶,胎牛血清,dmem-f12完全培养基,驴血清,dapi(cellsignalingtechnology,inc),trizol(takara宝生物公司),iba-1(abcam),gfap(cellsignalingtechnology,inc),cd68(abcam),荧光酶(takara宝生物公司)。
2.3实验仪器
c1000touchpcr仪(bio-rad),荧光显微镜,sim-f124制冰机(sanyo),el104电子分析天平(梅特勒科学仪器公司),酶标仪,centrifuge5810r冷冻离心机(eppendorf),upt-ⅱ-20t超纯水机(西安优普仪器设备有限公司),7500realtimepcrsystem(美国应用生物系统公司),dw-40l508医用低温保存箱(青岛海尔特种电器有限公司),小鼠活动实验箱(成都泰盟软件公司)
2.3建立抑郁症炎症模型和药物干预
7周龄的小鼠在新环境中适应一周后开始实验。对照组腹腔内注射10mg生理盐水,实验组腹腔内注射10mg的lps,药物干预组分别在注射lps前给予10mg/kg、20mg/kg、40mg/kg和80mg/kg的川续断皂苷vi。在注射后24h检测其行为学变化。
2.4行为学检测
2.4.1高架十字迷宫
实验开始时将小鼠从中央格面向闭合臂放入迷宫,记录5分钟内的活动情况。观察指标包括:开放臂进入次数(必须有两只前瓜进入臂内),开放臂停留时间,闭合臂进入次数,闭合臂停留时间。计算开放臂停留时间比例,开放臂进入次数比例,高架十字迷宫中总进入次数。实验完成后将小鼠取出,将两臂清理干净,喷洒酒精除去气味。
2.4.2旷场实验
小鼠旷场实验在安静的环境下进行。将动物放入旷场反应箱(长50cm×宽50cm×高30cm)底面中心,同时进行摄像和计时。观察一定时间后停止摄像5min。根据计算机软件设计不同可观察的参数不同,如单位时间内动物在中央格停留时间,某一肢体越过的格子数为水平得分(crossing),后肢站立次数为垂直得分(rearing),修饰次数,尿便次数;运动速度,运动距离,休息时间,沿边运动距离,中央运动距离等。且考虑到小鼠对气味的敏感性,所以每一次实验结束,记录完毕后,必须将实验仪器清洗干净,避免实验鼠受到前一只小鼠气味影响。2.4.3强迫游泳测试(fst)
实验进行的前一天需对每只小鼠进行预实验,小鼠放至于水深12cm、水温22±1℃、21×12cm玻璃烧杯中,进行10min游泳实验。第二天正式实验,所有实验小鼠维持游泳6min,通过数码相机录像记录整个实验过程。此后,使用双盲法统计小鼠6min内后4min的绝望不动时间和6min内第一次放弃挣扎的时间。
2.4.4悬尾实验(tst)
将实验小鼠尾巴尖端用胶带固定悬挂在离地30cm高处,每只实验小鼠需间隔一定的距离,每两只鼠中间用黑色纸板间隔,实验持续6min,用数码相机记录6min实验过程,然后通过双盲法统计小鼠6min内一动不动的时间和第一次放弃挣扎的时间。
2.4.5小鼠食物消耗测试
实验开始时,给药后,给予每组每只小鼠同体积,同重量的食物。24h后,分别检测每只小鼠食物消耗情况,记录。
2.4.6小鼠体重变化测试
实验开始时,检测每组每只小鼠体重,记录。给药24h后,分别检测每只小鼠体重变化情况,记录。
2.5取脑方法
2.5.1灌注取脑
小鼠麻醉后立即将其用针头固定在泡沫板上(用针头插住四肢)。用镊子扯起胸部皮肤,另一只手用剪刀剪开胸腔的皮肤和肋骨,暴露出心脏和肝脏。将注射针头插入小鼠左心室,同时将小鼠肝脏减掉,以使血液流出。灌注生理盐水,时间维持在10min左右,血液排除后四肢、肝脏和舌头会变白。待小鼠四肢、肝脏和舌头变白之后,用4%pfa灌流固定,当pfa流至大脑处可能会使小鼠尾巴略有反射现象(有时可能没有),此时可将灌流速度下调,以使固定更加充分。整个pfa灌流时间约为20min。(固定原理:多聚甲醛可以使蛋白质交联)将导管始端从pfa中拿出,待管中液体流尽后,将心脏上的针头拔下,如果固定的较好,可发现小鼠眼球呈现白色。将托盘中的血液倒至废液桶内,并准备下一步的取脑操作。取脑及脱水:剪开头部皮肤,露出白色头盖骨。将延髓上包被的软骨剪开,除去多余的结缔组织。需要注意的时,眼睛要由剪刀剪下,不能够直接扯下来,因为眼睛后部连着视神经,如果扯的话有可能会损坏视交叉上核等其他脑部组织。将头盖骨小心剥开,露出白色的脑部,在剥嗅球部位时要格外小心,必要的话可以先将嗅球前部的碎骨留着待进一步固定之后再去除。将头盖骨剥开后,将脑下部连接的神经逐条剪短(可看到视神经交叉),待全部剪断后将脑整个剥离出来,将剥离出来的脑浸泡在4%pfa中,过夜固定。将pfa液换为30%蔗糖进行脱水(防止冷冻切片时形成冰晶和孔洞),初始脱水时脑会浮在蔗糖上,待完全脱水后脑会沉底。此时可将脑放入-20℃冰箱保存。
2.5.2脱颈取脑
断头后,剪去颅骨表面的皮肤和肌肉组织,用剪刀垂直深入插入顶骨后缘,向两侧搬开顶骨,暴露两侧大脑半球,然后用止血钳小心去除多余的颞骨和额骨,暴露脑组织。用剪刀将脑干小脑侧颅神经和硬脑膜剪开,后用小药勺撬起脑部,剪去颅底三叉神经和视神经,轻轻舀出整个脑部,并分别分离出海马和皮层,此时可将脑放入-80℃冰箱保存。
2.6q-pcr检测基因表达
分离出各个组的小鼠的海马和皮层,放置在无菌的1.5ml的离心管中,每管中加入1mltrizol,用5ml注射器抽打细胞,直至无块状物存在,室温放置5min。加入200μl三氯甲烷,剧烈震荡促使组织中的蛋白被完全抽提,室温静置5min,12000g,4℃离心15min,需注意放管方向。吸取上清液转移至新的1.5ml离心管中,上层清液即为rna,宁缺毋滥,切不可吸到下部沉淀,后加入与上清液等体积的异丙醇,震荡混匀,15-30℃孵育10min,沉淀rna,12000g,4℃离心10min。用移液枪吸干上清液,可见底部有白色沉淀,加入75%depc处理过的乙醇500μl,上下剧烈震荡,混合样品,务必使白色沉淀悬浮于液体中,7500g,4℃离心5min,期间不可使rna完全干燥,否则会极大降低其可溶性。弃上清,打开管盖,放入4℃冰箱,风干后加入30μldepc处理的水,放入-80℃保存,勿保存至冰箱门口。提取的rna,使用takara公司提供的反转录试剂盒,严格按照实验说明书步骤进行。首先,200μldepc浸泡过的ep管依次加入5×gdnaeraserbuffer(2μl)、gdnaeraser(1μl)、totalrna(1μg),最后加rnasefreedh2o至总体积10μl,混合均匀,离心使混合液沉积于ep管底部,42℃加热2min。然后,依次加入reactionsolutionfromstep1(10μl)、5×primescriptbuffe2(forrealtime)(4μl)、primescriptrtenzymemix1(1μl)、rtprimemix(1μl)、rnasefreedh2o(4μl),得到20μl体系混合液,再次混匀离心,30℃孵育15min,85℃加热5s终止反应。从所得cdna样品中取1μl,加入5μlmastermix和上下游引物各1μl,加depc水至10μl体系。混匀后放入cfx96荧光定量实时pcr仪中,在98℃预变性2s,70℃退火5s,并延伸,该过程重复35个循环,每个样品3个重复。内参基因为β-actin,相关基因的表达按照2-δδct的计算方法。
2.7免疫组织化学染色
小鼠使用1%的戊巴比妥麻醉(50mg/kg.i.p.)麻醉,用4%多聚甲醛(0.1m磷酸盐缓冲液配置,pbs)进行灌注10min,取出小鼠全脑放入4%多聚甲醛中进行后固定48小时,再放入30%蔗糖里脱水48小时。冰冻切片为30μm,4℃保存。保存好的脑片,室温放置5min,用pbs清洗3次,5min/次,最后一次彻底吸干残留液体,用0.5%tritonx-100通透清洗15min,用10%,再用pbs清洗3次,5min/次。使用pbs配制的10%驴血清,室温封闭脑片2h,加入一抗4℃孵育过夜。次日,脑片放置室温10min,用pbs清洗3次,5min/次,避光孵育二抗2h,后用pbs清洗脑片3次,每次5min。最后加入dapi着色细胞核,镜检观察脑片。
2.8统计学分析
所有图表制作及统计学分析均采用graghpadprism软件,所有数据的表示方法都是mean±sem,分析方法为one-wayanova中的lsdposthoc检验,p小于0.05表示有显著性差异。
3结果
3.1川续断皂苷vi抑制小鼠海马和皮层小胶质细胞的激活
通过给小鼠腹腔注射lps来建立神经炎症的动物模型,并用不同浓度的川续断皂苷vi进行药物干预。本能研究首先用qpcr检测小胶质细胞激活的表型标志,小胶质细胞的表型标志主要检测小鼠海马的cd11b和iba1的mrna水平,检测结果如图4a和4b所示,lps处理的小鼠中,海马的cd11b和iba1的mrna水平显著升高(p<0.01);用不同浓度的川续断皂苷vi干预正常小鼠,并不影响小鼠海马的cd11b和iba1的基因表达(p>0.05);10mg/kg的川续断皂苷vi干预组与lps模型组相比,在cd11b和iba1的基因表达上无统计学差异(p>0.05);20mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少iba1的基因表达水平(p<0.05),对cd11b的基因表达虽然有减少,但无统计学差异(p>0.05);40mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少iba1的基因表达水平(p<0.05),对cd11b的基因表达虽然有减少,但无统计学差异(p>0.05);80mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少cd11b的基因表达(p<0.05),同时也显著减少iba1的基因表达(p<0.005)。
小胶质细胞的形态检测采用免疫组织化学染色,结果4c-4e所示,与空白组相比,lps模型组中海马的小胶质细胞膨大,分枝减少,激活程度较高。通过统计小胶质细胞的相对面积和分枝发现,lps处理后,海马中iba1阳性染色的面积显著增大(p<0.05),同时小胶质细胞的分枝显著减少(p<0.05),表明小胶质细胞被显著激活。用不同的川续断皂苷vi干预激活后,分别统计海马中iba1阳性染色的面积及小胶质细胞的分枝变化,统计结果表明,用不同浓度的川续断皂苷vi干预正常小鼠,并不影响小鼠海马的iba1阳性染色的面积和小胶质细胞的分枝数目;10mg/kg的川续断皂苷vi干预组与lps模型组相比,在海马的iba1阳性染色的面积上无统计学差异(p>0.05),在小胶质细胞的分枝数量上也无显著性差异(p>0.05)。20mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少海马的iba1阳性染色的面积(p<0.05),在小胶质细胞的分枝数目上虽然有增加,但无统计学差异(p>0.05)。40mg/kg和80mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少海马的iba1阳性染色的面积(p<0.05),同时也显著增加了小胶质细胞的分枝数目(p<0.005)。
除了检测小鼠的海马区外,本研究还检测了小鼠大脑皮层的小胶质细胞的表型标志,主要检测cd11b和iba1的mrna水平,检测结果如图5a和5b所示,lps处理的小鼠中,皮层的cd11b和iba1的mrna水平显著升高(p<0.01);用不同浓度的川续断皂苷vi干预正常小鼠,并不影响小鼠皮层的cd11b和iba1的基因表达(p>0.05);10mg/kg的川续断皂苷vi干预组与lps模型组相比,在皮层中的cd11b和iba1的基因表达上无统计学差异(p>0.05);20mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少皮层的iba1的基因表达水平(p<0.05),对cd11b的基因表达虽然有减少,但无统计学差异(p>0.05);40mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少皮层iba1的基因表达水平(p<0.05),对cd11b的基因表达虽然有减少,但无统计学差异(p>0.05);80mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少皮层cd11b的基因表达(p<0.05),同时也显著减少iba1的基因表达(p<0.005)。
皮层区小胶质细胞的形态检测采用免疫组织化学染色,结果5c-5e所示,与空白组相比,lps模型组中皮层的小胶质细胞膨大,分枝减少,激活程度较高。通过统计小胶质细胞的相对面积和分枝发现,lps处理后,海马中iba1阳性染色的面积显著增大(p<0.05),同时小胶质细胞的分枝显著减少(p<0.05),表明皮层的小胶质细胞被显著激活。用不同的川续断皂苷vi干预激活后,分别统计皮层中iba1阳性染色的面积及小胶质细胞的分枝变化,统计结果表明,用不同浓度的川续断皂苷vi干预正常小鼠,并不影响小鼠皮层的iba1阳性染色的面积和小胶质细胞的分枝数目;10mg/kg的川续断皂苷vi干预组与lps模型组相比,在皮层的iba1阳性染色的面积上无统计学差异(p>0.05),在小胶质细胞的分枝数量上也无显著性差异(p>0.05)。20mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少皮层的iba1阳性染色的面积(p<0.05),在小胶质细胞的分枝数目上虽然有增加,但无统计学差异(p>0.05)。40mg/kg和80mg/kg的川续断皂苷vi干预组与lps模型组相比,显著减少皮层的iba1阳性染色的面积(p<0.05),同时也显著增加了小胶质细胞的分枝数目(p<0.005)。
3.2川续断皂苷vi抑制lps诱导的神经炎症
在发现川续断皂苷vi能够抑制lps诱导的小胶质细胞的激活后,本研究进一步检测川续断皂苷vi对lps诱导的神经炎症的影响,用q-pcr检测海马区炎症性细胞因子的表达,检测结果如图6所示,与空白组相比,lps模型组中il-1β、inos、tnf-α、il-6几个促炎性细胞因子含量明显升高(均为p<0.05);表明lps能够成功诱导小胶质细胞向m1表型激活,该炎症模型可用于后续的药物干预研究。用不同浓度的川续断皂苷vi干预激后,在海马区分别检测il-1β、inos、tnf-α、il-6的基因表达变化,统计结果表明,用不同浓度的川续断皂苷vi干预正常小鼠,并不影响小鼠海马的il-1β、inos、tnf-α、il-6细胞因子的表达;10mg/kg的川续断皂苷vi干预组与lps模型组相比,在il-1β和il-6的mrna表达水平上均无统计学差异(p>0.05),但能显著抑制inos和tnf-α的基因表达(p<0.05)。20mg/kg、40mg/kg和80mg/kg的川续断皂苷vi干预组与lps模型组相比,均能显著减少il-1β、inos和tnf-α的mrna表达水平(p<0.05),只有80mg/kg的川续断皂苷vi能显著抑制il-6的mrna表达水平(p<0.05)。
用q-pcr检测小鼠大脑皮层区炎症性细胞因子的表达,其结果与在海马区检测的结果相似,但在炎性因子的表达倍数上,皮层区的变化比海马区更显著。检测结果如图7所示,与空白组相比,lps模型组中il-1β、inos、tnf-α、il-6几个促炎性细胞因子含量明显升高(均为p<0.05);表明lps能够成功诱导小胶质细胞向m1表型激活,该炎症模型可用于后续的药物干预研究。用不同浓度的川续断皂苷vi干预激后,在皮层区分别检测il-1β、inos、tnf-α、il-6的基因表达变化,统计结果表明,用不同浓度的川续断皂苷vi干预正常小鼠,并不影响小鼠皮层的il-1β、inos、tnf-α、il-6细胞因子的表达;10mg/kg的川续断皂苷vi干预组与lps模型组相比,在皮层区的il-1β和il-6的mrna表达水平上均无统计学差异(p>0.05),但能显著抑制inos和tnf-α的基因表达(p<0.05)。20mg/kg、40mg/kg和80mg/kg的川续断皂苷vi干预组与lps模型组相比,均能显著减少il-1β、inos和tnf-α的mrna表达水平(p<0.05),只有80mg/kg的川续断皂苷vi能显著抑制皮层区il-6的mrna表达水平(p<0.05)。3.3川续断皂苷vi改善lps诱导的抑郁样行为3.3.1强迫游泳实验结果
强迫游泳实验数据分析显示:与空白组相比,lps模型组小鼠强迫游泳潜伏期缩短,累计不动时间延长(p<0.05);与lps模型组比较,同时给予川续断皂苷ⅵ干预后,小鼠强迫游泳潜伏期延长,累计不动时间缩短,其中40mg/kg剂量组效果最好(p<0.05)(见图8)。
3.3.2悬尾实验结果
悬尾实验数据分析结果表明:与空白组相比,lps模型组小鼠潜伏期缩短,累计不动时间明显延长(p<0.05);与lps模型组比较,同时给予川续断皂苷ⅵ干预后,小鼠潜伏期显著延长,累计不动时间明显减小,其中20mg/kg、40mg/kg、80mg/kg三个剂量组效果均较好(p<0.05)(见图9)。
3.3.3小鼠食物变化结果
单因素方差分析结果表明:与空白组相比,lps模型组食物消耗量显著减少(p<0.05)(图10)。
3.3.4小鼠体重变化结果
单因素方差分析结果表明:与空白组相比,lps模型组体重降低(p<0.05);与lps模型组比较,同时给予川续断皂苷ⅵ干预后,小鼠体重明显上升(p<0.05)(见图11)。
3.4川续断皂苷vi对lps诱导小鼠焦虑样行为的影响
3.4.1自主活动测试结果
自主活动测试数据分析结果表明:lps模型组较空白组相比,小鼠在自主活动箱中5min内的静止时间增多,而运动时间、中心时间,总运动距离均明显减少(p<0.05)(图12)。
3.4.2高架十字迷宫实验测试结果
高架十字迷宫实验数据分析结果表明:lps模型组较空白组相比,小鼠进入开臂的次数显著减少(p<0.05),而对于开闭进入次数的百分比以及开臂进入时间无明显影响(p>0.05)(见图13)。
总结:
抑郁症是常见的精神障碍性疾病,具有高复发率、高致残率、高自杀率和低识别率、低就诊率、低治疗率的特点,已成为导致全球疾病负担主要因素。但由于其具有很强的异质性,该疾病的病因及其发病机制目前还不清楚,故目前临床缺乏安全有效的抗抑郁治疗手段和治疗药物。近年来,研究发现自杀的抑郁症患者脑中小胶质细胞增生显著,小胶质细胞活化后释放细胞因子,细胞因子可导致神经发生障碍,而神经发生率的高低被认为与抑郁症直接相关。有研究表明,在由双侧脑室注射aβ1-42诱导的sd大鼠的学习和认知功能障碍模型中,aβ诱导的星形胶质细胞和小胶质细胞的激活会受到川续断皂苷ⅵ显著抑制,胶质细胞也会减少释放细胞因子和炎症因子,如肿瘤坏死因子α(tnf-α)、白细胞介素6(il-6)及环氧合酶-2(cox-2)的表达,可抑制炎症反应的发生。
本研究通过结合动物行为学和生物化学两大部分实验,从现象到机制探讨了aspⅵ对lps抑郁模型小鼠的抗抑郁效果,并进一步探究aspⅵ的抗抑郁效果与海马及皮层小胶质细胞活化、中枢炎症反应以及神经发生的关系。实验结果表明:1.在体重、强迫游泳及悬尾实验中,40mg/kgaspⅵ预处理组表现出显著的抗抑郁效果;2.aspⅵ预处理组显著抑制了lps小鼠大脑海马及皮层组织中小胶质细胞的活化水平和中枢炎症反应。提示aspⅵ的抗抑郁效果在实验动物表现出稳定有效性,其抗抑郁效果与抑制小胶质细胞活化及中枢炎症反应,并最终保护神经发生有关。
参考文献
[1]王睿,黄树明.抑郁症发病机制研究进展[j].医学研究生学报,2014,27(12):1332-1336.
[2]杨敏,康洪钧,戴晓畅.抑郁症的发病机制与治疗进展[j].四川生理科学杂志,2015,37(03):146-150.
[3]刘欢,王海军,高明周,乔明琦.基于抑郁症临床诊断标准的病机探讨[j].中华中医药杂志,2016,31(07):2499-2501.
[4]朱敏.浅谈抑郁症的病因学研究进展[j].当代医药论丛,2015,13(09):158-159.
[5]杨坤,谢光荣,贺达仁.抑郁症病因学研究及其哲学思考[j].临床心身疾病杂志,2006(05):395-398.
[6]冯晓源,刘含秋.功能磁共振成像在中国的研究现状[j].中国医学计算机成像杂志,2004(05):292-298.
[7]李林艳,徐建.抑郁症治疗进展[j].河南中医,2012,32(12):1720-1722.
[8]张少丽,石少波.抑郁症治疗的研究进展[j].精神医学杂志,2008(02):156-160.
[9]王希林.对抑郁症患者的心理治疗[j].中国心理卫生杂志,1997(03):50-51.
[10]潘能荣,杨小男,张承安,梅其一.电休克治疗对抑郁症的疗效研究[j].临床精神医学杂志,2005(02):75-77.
[11]郑会蓉,张丽,赵巍峰,邹娟,傅锦华,李凌江.青年难治性抑郁症患者重复经颅磁刺激治疗研究[j].中国临床心理学杂志,2010,18(01):44-46.
[12]张大山,史慧颖,刘威,邱江,范丰慧.经颅直流电刺激在抑郁症治疗中的应用[j].心理科学进展,2015,23(10):1789-1798.
[13]马春燕,张晨.抑郁症神经炎症机制研究进展[j].中国医药导报,2017,14(14):33-35.
[14]barbarasbeltz,michaelftlusty,jeannelbenton,etal.omega-3fattyacidsupregulateadultneurogenesis[j].neuroscilett,2007,415(2):154-158.
[15]kouwei,dirkluchtman,songcai.eicosapentaenoicacid(epa)increasescellviabilityandexpressionofneurotrophinreceptorsinretinoicacidandbrain-derivedneurotrophicfactordifferentiatedsh-sy5ycells[j].eurjnutr,2008,47(2):104-113.
[16]michaelmaes,razyirmyia,jensnoraberg,etal.theinflammatory&neurodegenerative(i&nd)hypothesisofdepression:leadsforfutureresearchandnewdrugdevelopmentsindepression[j].metabbraindis,2009,24(1):27-53.
[17]campbells,macqueeng.anupdateonregionalbrainvolumedifferencesassociatedwithmooddisorders[j].curropinpsychiatry,2006,19(1):25-33.
[18]sheltonrc,claibornej,sidoryk-wegrzynowiczm,etal.alteredexpressionofgenesinvolvedininflammationandapoptosisinfrontalcortexinmajordepression[j].molpsychiatry,2011,16(7):751-762.
[19]williamabanks.blood-brainbarriertransportofcytokines:amechanismforneuropathology[j].currpharmdes,2005,11(8):973-984.
[20]nicolaspturrin,sergerivest.unravelingthemoleculardetailsinvolvedintheintimatelinkbetweentheimmuneandneuroendocrinesystems[j].expbiolmed(maywood),2004,229(10):996-1006.
[21]lisaegoehler,ronpagaykema,michaelkhansen,etal.vagalimmune-to-braincommunication:avisceralchemosensorypathway[j].autonneurosci,2000,85(1-3):49-59.
[22]andrewhmiller,vladimirmaletic,charleslraison.inflammationanditsdis空白tents:theroleofcytokinesinthepathophysiologyofmajordepression[j].biolpsychiatry,2009,65(9):732-741.
[23]karenwager-smith,athinamarkou.depression:arepairresponsetostress-inducedneuronalmicrodamagethatcangradeintoachronicneuroinflammatory空白dition?[j].neuroscibiobehavrev,2011,35(3):742-764.
[24]sadayukihashioka,patricklmcgeer,akiramonji,etal.anti-inflammatoryeffectsofantidepressants:possibilitiesforpreventivesagainstalzheimer’sdisease[j].centnervsystagentsmedchem,2009,9(1):12-19.
[25]gunterkenis,michaelmaes.effectsofantidepressantsontheproductionofcytokines[j].intjneuropsychopharmacol,2002,5(4):401-412.
[26]svenpalhagen,qihong-shi,bjornmartensson,etal.monoamines,bdnf,il-6andcorticosteroneincsfinpatientswithparkinson’sdiseaseandmajordepression[j].jneurol,2010,257(4):524-532.
[27]xiazhen-lei,josephwdepierre,lennartnassberger.tricyclicantidepressantsinhibitil-6,il-1betaandtnf-alphareleaseinhumanbloodmonocytesandil-2andinterferongammaintcells[j].immunopharmacology,1996,34(1):27-37.
[28]rossjtynan,judithweidenhofer,madeleinehinwood,etal.acomparativeexaminationoftheanti-inflammatoryeffectsofssriandsnriantidepressantsonlpsstimulatedmicroglia[j].brainbehavimmun,2012,26(3):469-479.
[29]josejaviermiguel-hidalgo,christiebaucom,ginnydilley,etal.glialfibrillaryacidicproteinimmunoreactivityintheprefrontalcortexdistinguishesyoungerfromolderadultsinmajordepressivedisorder[j].biolpsychiatry,2000,48(8):861-873.
[30]颜弯.瞬时性离子通道trpv1在lps诱导的抑郁样行为的炎症应答机制研究[d].电子科技大学,2018.
[31]sixiao-hong,josejaviermiguel-hidalgo,gillino’dwyer,etal.age-dependentreductionsinthelevelofglialfibrillaryacidicproteinintheprefrontalcortexinmajordepression[j].neuropsychopharmacol,2004,29(11):2088-2096.
[32]czehboldizsar,mariasimon,barthelschmelting,etal.astroglialplasticityinthehippocampusisaffectedbychronicpsychosocialstressand空白comitantfluoxetinetreatment[j].neuropsychopharmacol,2006,31(8):1616-1626.
[33]radmilamanev,tolgauz,harimanev.fluoxetineincreasesthe空白tentofneurotrophicproteins100betaintherathippocampus[j].eurjpharmacol,2001,420(2-3):r1-r2.
[34]kazuehisaoka,minorutakebayashi,mamitsuchioka,etal.antidepressantsincreaseglialcellline-derivedneurotrophicfactorproductionthroughmonoamine-independentactivationofproteintyrosinekinaseandextracellularsignal-regulatedkinaseinglialcells[j].jpharmacolexpther,2007,321(1):148-157.
[35]kazuehisaoka,akiranishida,tetsuzokoda,etal.antidepressantdrugtreatmentsinduceglialcellline-derivedneurotrophicfactor(gdnf)synthesisandreleaseinratc6glioblastomacells[j].jneurochem,2001,79(1):25-34.
[36]zhangdei-kui,hefu-qian,litue-ke,etal.glial-derivedneurotrophicfactorregulatesintestinalepithelialbarrierfunctionandinflammationandistherapeuticformurinecolitis[j].jpathol,2010,222(2):213-222.
[37]sunjian-dong,liuyan,yuanyu-he,etal.gapjunctiondysfunctionintheprefrontalcortexinducesdepressive-likebehaviorsinrats[j].neuropsychopharmacol,2012,37(5):1305-1320.
[38]franciscojmonje,maureencabatic,isabelladivisch,etal.空白stantdarknessinducesil-6-dependentdepressionlikebehaviorthroughthenf-kappabsignalingpathway[j].jneurosci,2011,31(25):9075-9083.
[39]jawookkoo,scootjrusso,deverouxferguson,etal.nuclearfactor-kappabisacriticalmediatorofstress-impairedneurogenesisanddepressivebehavior[j].procnatlacadsciusa,2010,107(6):2669-2674.
[40]张静.丹酚酸b通过减少神经元凋亡以改善抑郁样行为的研究[d].电子科技大学,2017.
[41]吴帅,刘二伟,张祎,韩立峰,刘虹.川续断中化学成分的研究[j].天津中医药大学学报,2010,29(03):147-150.
[42]高秀芝,马鲁豫,金艳霞,张琳,田景奎.川续断化学成分及药理作用研究进展[j].亚太传统医药,2010,6(07):142-146.
[43]程志安,吴燕峰,黄智清,曾志勇,谢文峰,罗懿明,萧劲夫,刘尚礼.续断对成骨细胞增殖、分化、凋亡和细胞周期的影响[j].中医正骨,2004(12):1-3+65.
[44]李广润,宫丽丽,吕亚丽,刘丽宏.川续断皂苷ⅵ药理作用研究进展[j].中国新药与临床杂志,2014,33(07):477-480.
- 还没有人留言评论。精彩留言会获得点赞!