肿瘤微环境与氧化还原逐级响应性纳米递药系统的制备方法及应用与流程
本发明涉及一种负载顺铂的肿瘤微环境与氧化还原逐级响应性纳米递药系统的制备方法,该类纳米递药系统可用于肿瘤的治疗。
背景技术:
顺铂(cisplatin,cis-diamminedichloroplatinum(ii),cddp)是经美国fda批准上市的铂类抗肿瘤化疗药物,是目前治疗多种实体瘤的一线治疗药物,在临床治疗中显示了较好的抗肿瘤效果。顺铂进入细胞后,通过交联dna,抑制dna的复制而引发肿瘤细胞的凋亡和坏死。由于顺铂抑制dna复制作用是非特异性的,因此顺铂具有较强的全身毒副作用,如肾损害,神经毒性,骨髓毒性,贫血等,其严重的毒副反应和易产生肿瘤耐药限制了其在临床的广泛应用。因此,对顺铂进行药物化学和制剂学改造,提高其治疗效果,并降低毒副作用具有重要的临床应用价值。
抗肿瘤纳米递送系统能够避免间歇给药的血药浓度峰谷变化,并通过改变药物体内分布提高选择性和抗肿瘤效果,减少药物对肿瘤外组织的毒副作用,已经成为顺铂研发领域的热点之一。但是目前报道的顺铂纳米递药系统大多具有铂负载量低、载体材料用量大,纳米粒易被机体血液循环中网状内皮系统(res)清除、难以到达肿瘤部位,药物释放可控性差等问题。
已有研究证实,纳米递药系统的聚乙二醇(peg)化可以“掩盖”纳米粒不受宿主免疫系统的影响,降低免疫原性和抗原性,并通过减少血液循环中网状内皮系统巨噬细胞的识别和清除来延长其循环时间,增加纳米递药系统借助epr效应向肿瘤组织的不断蓄积,增强药物对肿瘤部位的靶向性。但传统peg修饰纳米粒引起血液循环中巨噬细胞摄取减少的同时,也同样导致肿瘤组织中肿瘤细胞对纳米粒摄取的减少,阻碍药物进入细胞发挥药理作用,抗肿瘤作用得到一定程度的消弱。而且,一般的单端聚乙二醇(peg)化修饰,无法有效压缩纳米递药系统的粒径,肿瘤靶部位有效累积能力较差[biomacromolecules,2017,18,1342-1349]。因此,采用有效的聚乙二醇(peg)化修饰方法、适时对递药系统的聚乙二醇修饰进行脱除,对其效应发挥具有重要意义。
聚乙烯亚胺(pei)是一类阳离子聚合物,其结构中含有大量的氨基基团,易于化学修饰,可实现药物的高负载化,且pei特有的“质子海绵效应”有利于纳米递送载体从溶酶体中逃逸,将药物释放至细胞质中,降低溶酶体对药物的降解,从而提高其治疗效果。本课题组前期以聚乙烯亚胺为骨架,利用其丰富的氨基基团实现了顺铂的高负载,得到含有氧化还原响应性二硫键的顺铂高分子前体药物。该顺铂高分子前体药物可利用谷胱甘肽(gsh)在细胞内外浓度的巨大差异,使其在细胞外环境里保持稳定,在肿瘤细胞内高gsh环境中发生断裂释放顺铂,实现药物在肿瘤细胞内的快速释放,产生刺激响应特性。
因此,本发明采用富含氨基可修饰基团的聚乙烯亚胺(pei)为骨架,选用含有氧化还原响应性二硫键的胱胺为原料将顺铂高负载于pei上得到顺铂高分子前体药物。并在此基础上,设计双重逐级响应性递药系统,选用双端醛基化peg与顺铂高分子前体药物进行交联修饰,使得醛基化peg的醛基与bpei的氨基反应形成具有酸敏特性的席夫碱(schiffbase)连接键,避免常规单端聚乙二醇化修饰引起的粒径增大,构建得到外壳peg交联修饰的具有肿瘤微环境与氧化还原响应性的顺铂递药系统。由于peg的屏蔽作用,该递药体系在正常组织中(ph7.4)不易解离也不易被巨噬细胞摄取,到达肿瘤部位后,在肿瘤部位特异性微环境中(ph5.5~6.8,肿瘤部位由于在有氧或者无氧条件下高速糖酵解产生的大量乳酸使其细胞外ph呈微酸性)席夫碱酸敏连接键首先断裂,顺铂递药系统中外壳peg脱除并恢复其入胞作用,入胞后在肿瘤细胞内高gsh环境中二硫键发生氧化还原响应性触发断裂并释放顺铂,保证了顺铂递药系统的有效摄取入胞和药物在肿瘤内的响应释放,从而更好地发挥抗肿瘤治疗作用。
技术实现要素:
本发明的目的是提供一种肿瘤微环境与氧化还原逐级响应性顺铂纳米递药系统的制备方法及应用,能够高负载顺铂药物,该类递药系统利用聚乙烯亚胺的丰富氨基和含二硫键的胱胺构建顺铂高分子前体药物,可以显著增加顺铂的负载量和氧化还原响应性释药。在此基础上,选用双端醛基化peg与顺铂高分子前体药物进行交联,使得醛基化peg的醛基与聚乙烯亚胺的氨基反应形成具有酸敏特性的席夫碱(schiffbase)连接键,构建得到具有肿瘤微环境与氧化还原响应性的顺铂纳米递药系统,为抗肿瘤药物的研究提供新思路。
本发明以聚乙烯亚胺为骨架,选用含有氧化还原响应性二硫键的胱胺与丁二酸酐反应后与顺铂络合得到顺铂配合物。所得顺铂配合物与聚乙烯亚胺的丰富氨基共价结合得到高负载量的顺铂高分子前体药物,顺铂的负载量可达32.66%。选用双端醛基化peg与顺铂高分子前体药物进行交联,使得醛基化peg的醛基与聚乙烯亚胺的氨基反应形成具有酸敏特性的席夫碱(schiffbase)连接键,构建得到具有肿瘤微环境与氧化还原响应性的顺铂递药系统,通过活性评价得到高效低毒的顺铂类抗肿瘤药物。
一种肿瘤微环境与氧化还原逐级响应性顺铂纳米递药系统的制备方法,具体包括以下步骤:
(1)顺铂在37℃避光条件下搅拌至完全溶解于ⅲ级超纯水后冷却至室温,加入相应摩尔配比的硝酸银后室温避光搅拌48h,离心两次(5000rpm,1h/次),用0.1μm水系滤器对上清液进行过滤得到水化顺铂溶液(3mg·ml-1)备用。胱胺二盐酸盐室温下溶于甲醇中,与一定量的三乙胺在冰浴条件(0℃~4℃)下搅拌30min后,加入相应比例的丁二酸酐的1,4-二氧六环溶液室温下搅拌反应1.5h,减压蒸除有机相,加入相应量的0.3%na2co3水溶液,用乙醚萃取3次得到胱胺-丁二酸钠水溶液。将上述胱胺-丁二酸钠水溶液按照一定比例缓慢滴加到水化顺铂溶液中,室温避光搅拌48h后将反应液浓缩,采用截留分子量为100的透析袋透析纯化(ⅲ级超纯水中透析3次,每2h换水一次)后冷冻干燥得到顺铂配合物。
(2)将特定配比的羰基二咪唑与顺铂配合物水溶液(7.73mg·ml-1)在一定温度下搅拌反应,而后按照相应接枝比例与一定分子量的聚乙烯亚胺继续搅拌反应。反应结束后采用截留分子量为7000的透析袋透析纯化(ⅲ级超纯水中透析4次,每2h换水一次)后冷冻干燥得到顺铂高分子前体药物。
(3)将一定量的10mg·ml-1双端醛基化peg水溶液和1mg·ml-1顺铂高分子前体药物水溶液混合均匀,特定温度下避光搅拌反应一定时间。上述反应液采用截留分子量为50000的透析袋透析后,得到肿瘤微环境与氧化还原逐级响应性顺铂纳米递药系统。
在具体制备过程中,步骤(1)中,硝酸银与顺铂的摩尔比为1:2~2:1,胱胺二盐酸盐、三乙胺与丁二酸酐的摩尔比为1:2:0.5~1:20:2,碳酸钠与胱胺二盐酸盐的摩尔比为1:1~5:1,胱胺-丁二酸钠与水化顺铂的摩尔比为1:2~2:1。
在步骤(2)中,羰基二咪唑与顺铂配合物的摩尔比为1:0.5~5:1,反应温度为20℃~50℃,反应时间为0.5~5h。所用聚乙烯亚胺为直链聚乙烯亚胺(lpei)或支化聚乙烯亚胺(bpei),分子量范围600~50kda,顺铂配合物与聚乙烯亚胺上氨基的摩尔比为1:50~1:1,反应温度为0℃~100℃,反应时间为5~48h。
在步骤(3)中,所用双端醛基化peg中peg分子量范围200~50kda,双端醛基化peg和顺铂高分子前体药物的投料质量比为1:100~5:1,温度为4℃~100℃,搅拌反应时间为0.1~120h。
上述肿瘤微环境与氧化还原逐级响应性顺铂纳米递药系统活性评价实验结果表明,与临床使用的传统化疗药物顺铂相比,该类递药系统可实现肿瘤微环境和氧化还原响应性逐级释药,在发挥有效抗肿瘤作用的同时,可极大降低顺铂的毒副作用,具有良好的临床应用前景。
附图说明
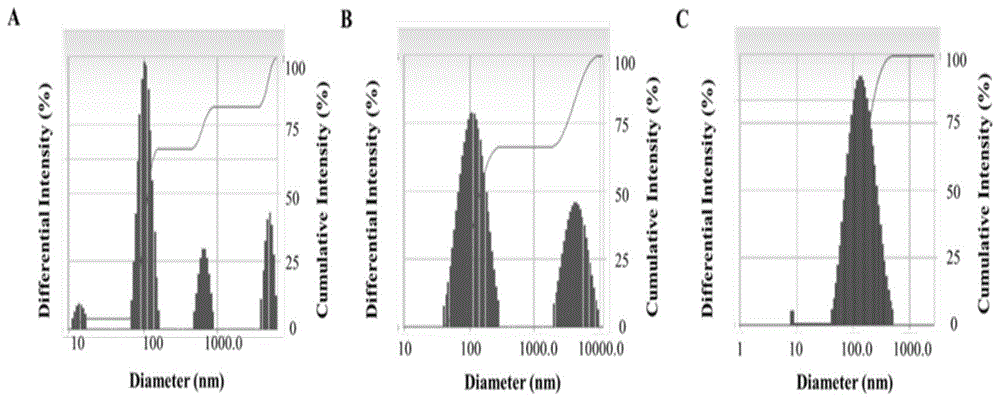
图1是交联反应24h(a),48h(b),72h(c)所得peg-(bpei-ss-pt)纳米粒的粒径分布图。
图2是peg-(bpei-ss-pt)纳米粒的稳定性。
图3是peg-(bpei-ss-pt)纳米粒在不同媒介条件下的体外释药曲线图。
图4是peg-(bpei-ss-pt)纳米递药系统不同ph条件下体外细胞球穿透实验。
图5(a)裸鼠肿瘤体积变化图。n=4,
具体实施方式
下面通过实施例对本发明的具体实施方式作进一步描述。以下所述的具体实施例,对本发明解决的技术问题、技术方案进行了进一步详细说明。所应理解的是,以下所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
实施例1顺铂配合物的制备
称取顺铂675.0mg(2.23mmol)加入225mlⅲ级超纯水中,在37℃避光条件下搅拌至完全溶解后冷却至室温,加入758.2mg(4.45mmol)硝酸银,继续在室温避光条件下搅拌反应48h。反应结束后将反应液离心2次(5000rpm,每次1h),取上清液,用0.1μm水系滤器进行过滤得到水化顺铂溶液。
胱胺二盐酸盐499.4mg(2.18mmol)于室温条件下溶解于24.6ml甲醇中。在冰浴条件下,向胱胺二盐酸盐的甲醇溶液中加入三乙胺445.7mg(4.36mmol)并搅拌30min。称取丁二酸酐202.4mg(1.98mmol)于室温条件下溶解于36.97ml无水1,4-二氧六环中,将上述溶液加至胱胺二盐酸盐的甲醇溶液中,同时撤去冰浴,室温搅拌反应1.5h。反应结束后将反应液旋转蒸发除去有机溶剂,加入0.3%na2co3水溶液77ml,用乙醚萃取3次,每次萃取所用乙醚的体积为150ml,收集水相,旋转蒸发除去残余乙醚得到胱胺-丁二酸钠溶液。
将77ml胱胺-丁二酸钠溶液缓慢滴加到200ml水化顺铂溶液中,室温避光搅拌反应48h。反应结束后将反应液减压浓缩至约10ml,转移至截留分子量为100的透析袋中,于3000mlⅲ级超纯水中透析3次,每2h换水一次,透析完成后冷冻干燥得到黄色粉末状顺铂配合物。
顺铂配合物的ir和1hnmr解析结果如下:ir(kbr):3387,3194,3082,2943,1636,1543,1396,1150,1049,636cm-1。1hnmr(400mhz,d2o):δ2.46-2.48(6h,m),2.85(t,2h,j=6.4hz),3.17-3.23(2h,m),3.52(t,2h,j=6.4hz)ppm。经红外和核磁共振氢谱鉴定,所得产物与目标产物结构一致。
实施例2顺铂高分子前体药物bpei-ss-pt的制备
称取支化聚乙烯亚胺(bpei)48.8mg(2μmol)溶于5mlⅲ级超纯水中,60℃超声15min至完全溶解,得到无色澄清的bpei水溶液;顺铂配合物77.3mg(143μmol)溶于10mlⅲ级超纯水中,室温下搅拌至完全溶解,得到黄色澄清透明的顺铂配合物水溶液。向顺铂配合物水溶液中加入羰基二咪唑25.6mg(158μmol),在冰浴条件下搅拌1h后撤除冰浴,待反应液恢复室温后向反应液中加入bpei水溶液,室温避光搅拌反应24h。反应结束后将反应液转移至截留分子量为7000的透析袋中,于2000mlⅲ级超纯水中透析4次,每2h换水一次。透析完成后冷冻干燥得到黄色固体bpei-ss-pt。
产物红外图谱解析结果如下:ir(kbr):3564,2962,1717,1636,1558,1508,1458,1339,1026,806,706cm-1。经红外图谱鉴定,所得产物与目标产物结构一致。经电感耦合等离子体质谱(icp-ms)测定可知bpei-ss-pt中顺铂的负载量为32.66%。
实施例3两端醛基化peg2000材料peg-dialde的制备
将387.2mg(2.5mmol)对醛基苯甲酸置于50ml二氯甲烷中,室温搅拌下加入721.8mg(3.75mmol)edci,待反应液澄清透明后在冰浴下加入9.4mg(75μmol)dmap继续搅拌0.5h。去冰浴恢复到室温后加入1g(2.5mmol)peg2000,继续搅拌反应1h。将反应液减压浓缩至5ml,用饱和氯化钠水溶液洗涤5次,加入无水硫酸钠放置过夜。过滤,滤液中加入10倍体积的冰乙醚,4℃放置6h后,抽滤。所得粗产物用二氯甲烷溶解-冰乙醚沉淀方法再纯化2次后,将所得固体于20℃真空干燥12h。将产物溶于ⅲ级超纯水中,透析后(截留分子量为1000)冷冻干燥得到产物。计算其产率并测定熔点,采用核磁共振氢谱和红外光谱对其结构进行表征。
实验结果:对醛基苯甲酸与peg在二氯甲烷中共价连接得到两端醛基化peg2000产物283.1mg,产率为26.8%,经精密熔点测定仪测得熔点为51.0℃-51.4℃。ir(kbr):3433,2885,1716,1701,1465,1342,1280,1149,964,840cm-1。1hnmr(400mhz,d2o):δ10.00(s,2h),8.19(d,j=7.6hz,4h),8.02(d,j=7.6hz,4h),4.56-4.52(m,4h),3.91-3.84(m,4h),3.84-3.28(m,182h)。经红外和核磁共振氢谱鉴定,所得产物与文献报道结构一致[biomaterials,2017,147,53-67]。
实施例4肿瘤微环境与氧化还原逐级响应性顺铂递药系统peg-(bpei-ss-pt)的制备及表征
以两端醛基化peg-dialde和bpei-ss-pt质量比1:9进行交联为例。量取1mg·ml-1bpei-ss-pt高分子前体药物水溶液50ml在50℃条件下避光超声1h。称取醛基化peg200010.0mg加ⅲ级超纯水1ml振荡溶解成澄清透明的溶液,即得到浓度为10mg·ml-1的醛基化peg2000水溶液。按照质量比吸取相应体积的醛基化peg水溶液,加入到bpei-ss-pt的水溶液中,避光常温搅拌24h,48h,72h,用截留分子量50000da的透析袋,在ⅲ级超纯水中避光常温搅拌快速透析2h,于4℃冰箱中储存。
采用电感耦合等离子体质谱(icp-ms)测定纳米粒中铂的含量。用激光粒度测定仪分别测定交联24h,48h,72h制得的peg-(bpei-ss-pt)纳米粒的粒径、pdi和zeta电位,以探究不同交联时间对peg-(bpei-ss-pt)纳米粒的影响。并采用透射电镜、扫描电镜对peg交联纳米粒进行形态学考查。
实验结果:peg-dialde与bpei-ss-pt经过24h,48h,72h交联反应得到的交联纳米粒的粒径、pdi和zeta电位测定实验结果如表1所示,结果表明peg-dialde与bpei-ss-pt高分子前体药物交联72h得到的粒径为135.8±7.1nm,分散系数pdi为0.292±0.007,粒径分布范围较窄(<0.3),符合肿瘤治疗的纳米递送系统要求。纳米递送系统的zeta电位为13.1±1.9mv,纳米粒荷正电。比较不同时间点形成的纳米粒的峰形,如图1所示,相比于24h和48h,72h形成的纳米粒的粒径为正态分布的单一峰型,粒径分布较窄,最终选择72h作为制备肿瘤微环境与氧化还原逐级响应性顺铂递药系统交联反应时间。经计算知交联纳米递药系统peg-(bpei-ss-pt)中顺铂的负载量为21.74%。
表1peg-(bpei-ss-pt)纳米粒的粒径、pdi和zeta电位
实施例5peg-(bpei-ss-pt)纳米粒的稳定性研究
将上述所得优化的peg-(bpei-ss-pt)纳米粒储存于4℃,用激光粒度测定仪测定其粒径,观测纳米粒放置不同时间后的粒径变化情况,以研究其稳定性。
实验结果:稳定性研究结果(如图2)表明,纳米粒在28d后的粒径相对变化较小,在4℃储存条件下,稳定性较好。
实施例6peg-(bpei-ss-pt)纳米粒的肿瘤微环境敏感与氧化还原特性研究
通过考察体外模拟肿瘤微环境与肿瘤细胞内外还原性水平(10mmgsh和10μmgsh)中递药系统的ph敏感和氧化还原敏感性,验证所构建纳米递药系统肿瘤微环境与氧化还原逐级响应特性。
1.不同ph条件下peg-(bpei-ss-pt)纳米粒的核磁氢谱测定
取550μl重水于4ml离心管中溶解等量的peg交联纳米粒冻干粉三份,使其完全溶解后,分别用少量氯化氘和氘氧化钠调节其中两份peg交联纳米粒溶液的ph为6.5和7.4,另一份仅用重水直接溶解,将样品转移到核磁管中做核磁共振氢谱测定。
2.不同媒介下peg-(bpei-ss-pt)递药系统的释药特性研究
模拟体内以及肿瘤组织微环境,将制备好的peg-(bpei-ss-pt)纳米粒水溶液50μl加入ⅲ级超纯水定容至2ml并将其装入透析袋(截留分子量3500da,外液为ph7.4,10μmgsh的pbs溶液),于水浴37℃条件下孵育。孵育4h后将外液调节为ph6.5,10μmgsh的pbs溶液。在此条件继续孵育4h后,将外液调节为ph7.4,10mmgsh条件下,在37℃水浴中孵育。在设定的释药时间点0.5h,1h,2h,4h,6h,8h,12h,24h,48h从透析袋中取出2ml释药外液,然后加入2ml的新鲜透析介质,用icp-ms测得pt的含量,计算药物的累积释药量,考察其肿瘤微环境ph和氧化还原响应特性。
实验结果:不同ph条件下peg-(bpei-ss-pt)纳米粒的核磁氢谱检测结果表明,仅用重水溶解和调节ph为7.4的peg交联纳米粒未观测醛基特征峰,而在ph6.5溶解介质中出现9.95ppm的醛基峰。即在肿瘤部位微酸性条件下peg-(bpei-ss-pt)中席夫碱连接键可断裂,peg外壳脱除,有利于纳米粒的进一步摄取入胞,发挥有效的抗肿瘤作用。
不同媒介条件下体外释药结果显示,在血液循环和正常细胞外环境(ph7.4,10μmgsh)条件下,peg-(bpei-ss-pt)纳米粒的peg外壳未能脱除,且二硫键对低浓度的gsh响应不明显,释药速度和释药量较低(图3)。而在肿瘤微环境(ph6.5,10μmgsh)条件下,peg-(bpei-ss-pt)纳米粒中的席夫碱连接键ph敏感断裂,peg外壳脱除,释药量仍然较低,但是当脱除peg外壳的纳米粒入胞后,即在模拟肿瘤细胞内(ph7.4,10mmgsh)条件下,释药量迅速增加,实现pt的二硫键断裂响应释放。上述结果表明peg-(bpei-ss-pt)纳米递送系统具有较好的肿瘤微环境与氧化还原逐级响应特性,能够在肿瘤微环境脱除peg水溶性外壳,增加纳米粒的摄取入胞同时,在细胞内高gsh浓度条件下响应释放药物,以便达到高效的抗肿瘤作用。
实施例7肿瘤微环境与氧化还原逐级响应性顺铂纳米递药系统peg-(bpei-ss-pt)的体外肿瘤细胞球穿透行为研究
将抗肿瘤药物有效递送至肿瘤深层组织内,是提高和改善药物作用发挥的关键。研究表明,单层细胞培养不能完全代表体内肿瘤,因为它们在细胞异质性、营养物质、氧梯度、细胞-细胞相互作用、基质沉积和基因表达谱等方面均存在差异,从而体内外会产生不同的药物反应,使得体外-体内药物评价的相关性差。与单层细胞培养相比,肿瘤细胞球更能代表真实肿瘤条件的体外模型。本实验采用液滴重叠法构建a549细胞球用于肿瘤细胞球穿透行为研究,具体方法如下:
称取0.3g琼脂糖于50ml烧杯中,再加入15mlrpmi培养液(2.0%)。将烧杯用铝箔或盖子密封,于121℃高压灭菌锅中灭菌20分钟,待温度降至约90℃时,取出灭菌的琼脂糖溶液转移至无菌超净工作台中。为了避免琼脂糖冷却固化,种板全程中将含有琼脂糖的烧杯放置于预热至70℃的水浴槽中。在48孔细胞培养板(平底)的每孔中加入100μl琼脂糖(若少于100μl会无法完全覆盖细胞板底),铺在板子中的琼脂糖在几秒钟之内即凝固。100μl琼脂糖层易产生适当的凹面,有利于细胞悬液的聚集,易形成细胞球。将琼脂糖细胞板冷却到室温,密封放置于饭盒中,在制备后可于4℃避光可放置10天左右。
为在适宜的时间里制备直径为400μm的细胞球,将a549单细胞悬浮液稀释至密度为250,500,1000,1500,2000,3000个细胞/每孔,细胞悬液体积为400μl接种于琼脂糖凝胶板。接种完成后,将板子放置于37℃,5%的细胞培养箱中培养观察,每两天换一次液,沿孔壁边缘用200μl的移液枪缓慢将液体移除,避免将生成的细胞球吸走,再沿孔壁缓慢轻柔地将新鲜培养液加入。每天对各孔的细胞球生长情况进行观察,选择合适的细胞密度,用于后续的实验。
peg-(bpei-ss-pt)-cy5荧光纳米粒的制备按照荧光材料接枝质量比为5%对peg-(bpei-ss-pt)交联纳米粒进行荧光标记。按照3000个细胞/每孔的密度将a549单细胞悬浮液400μl接种于琼脂糖凝胶板,每两天换一次液,待培养至第10天时,即可生成肉眼可见的细胞球,分别将细胞球外环境ph调整为6.5和7.4,按照pt浓度为2μg/ml给药,与细胞球孵育4h后,缓慢沿着孔壁将培养液移除,用pbs缓慢沿孔壁洗涤细胞球2次,每孔加入400μl4%多聚甲醛固定液,于室温条件下固定30min,移除固定液,pbs洗涤2遍后,加入0.5μg/mldapi细胞染色液(dapi原液浓度为5μg/ml,采用甲醇稀释10倍)于室温染色40min,移除染色液,将细胞球转移至4ml离心管中,采用37℃的pbs洗涤细胞球表面,待细胞球自然沉降后,吸除上清液,重复3次。将底部的细胞球悬浮液分散于共聚焦培养皿的中部,密闭晾干后,用甘油封片。采用激光共聚焦显微镜下断层扫描观察纳米粒在不同ph条件下的穿透能力。
实验结果:peg-(bpei-ss-pt)纳米粒的体外肿瘤细胞球穿透行为研究结果表明(图4),在生理条件ph7.4条件下,peg-(bpei-ss-pt)纳米粒的外壳未能脱除,水溶性外壳阻碍纳米粒的摄取入胞与转运,随着激光共聚焦断层扫描的深度增加,荧光强度逐渐减弱,纳米粒未能有效穿透至细胞球中。而在肿瘤微环境ph6.5条件下,ph敏感的席夫碱连接键断裂,peg外壳脱除,纳米粒入胞能力恢复,随着断层扫描深度增加,仍然能够观测到强的荧光,药物可穿透进入到细胞球的内部。体外肿瘤细胞球穿透实验结果表明纳米粒具有肿瘤微环境响应特性,在微酸性的条件下,能够脱除peg水溶性外壳,细胞球穿透和药物转运能力增加,从而达到有效的抗肿瘤作用,为体内药物评价提供依据。
实施例8peg-(bpei-ss-pt)纳米递药系统体内抗肿瘤效果评价
选取6~8周龄的balb/c裸鼠作为实验模型,将100μl人非小细胞肺癌细胞a549(密度为2×107个/ml)接种于小鼠右后背部皮下,待小鼠皮下肿瘤体积长至100mm3时进行给药。将接种皮下瘤的balb/c裸鼠分为3组(每组4只),分别给予溶媒、顺铂阳性对照药物以及peg-(bpei-ss-pt)纳米粒,以尾静脉注射的方式给药。阳性对照药物顺铂的给药剂量为3mg/kg,peg-(bpei-ss-pt)的给药剂量与游离药物顺铂的pt量相同,每间隔2天给药一次,共给药3次。小鼠的肿瘤体积和体重每2天测量一次。小鼠肿瘤的长宽采用数字游标卡尺进行测量,肿瘤体积的计算公式为v=(a×b2)/2,a为肿瘤的最长直径,b为肿瘤的最短直径。在给药后观察第20天时,终止实验,处死小鼠,收集肿瘤组织并固定在4%多聚甲醛中,石蜡包埋,加工成5mm厚的切片。石蜡切片脱蜡复水后进行he染色,同时对肿瘤组织切片进行免疫荧光和免疫组织化学染色,采用tunel试剂盒检测肿瘤组织中凋亡细胞数,采用相关抗原对凋亡通路相关蛋白caspase3以及细胞核增殖相关抗原ki67的表达量进行测定。
实验结果:peg-(bpei-ss-pt)纳米递药系统体内抗肿瘤活性实验表明(图5),在给药后20天时,未做治疗的空白对照组(control组)小鼠的平均肿瘤体积已接近2000mm3,而阳性药物顺铂组(cisplatin组)和peg-(bpei-ss-pt)纳米粒组小鼠的肿瘤体积均得到有效的抑制,纳米递药系统能达到与临床使用药物顺铂等效或更好的体内抗肿瘤活性(如图5a)。图5b结果表明,给药后阳性药物顺铂组小鼠的体重明显下降,而相比于顺铂组,所构建的肿瘤微环境与氧化还原逐级响应性顺铂纳米递药系统peg-(bpei-ss-pt)对小鼠的体重影响较小,毒副作用明显降低。免疫荧光染色tunel的结果表明(图5c),相比于对照组与游离药物组,peg-(bpei-ss-pt)纳米递送系统能够引起更多的细胞凋亡,而且免疫组织化学染色caspase3结果表明,相比于对照组与游离药物组,纳米递送系统peg-(bpei-ss-pt)组中caspase3的活性较高。细胞增殖相关抗原标记物ki67染色结果表明,相比于对照组,顺铂组和纳米粒组中细胞增值能力均得到有效抑制。
本发明所构建的顺铂纳米递药系统peg-(bpei-ss-pt)能够实现肿瘤部位微环境与细胞内氧化还原逐级响应释药,可保证顺铂递药系统的有效摄取和药物在肿瘤内的响应释放,从而更好地发挥其抗肿瘤作用,对化疗药物顺铂的新剂型研究具有重要的指导意义,具有良好的临床治疗应用前景。
- 还没有人留言评论。精彩留言会获得点赞!