JQ1与Erlotinib组合物在制备治疗肝癌药物中应用和治疗肝癌药物
jq1与erlotinib组合物在制备治疗肝癌药物中应用和治疗肝癌药物
技术领域
1.本发明仅涉及用本申请描述的bet bromodomain抑制剂jq1与egfr抑制剂erlotinib的组合物在治疗携带egfr突变的肝癌的方法,来达到治疗肝癌的目的,属于细胞生物学和医疗技术领域。
背景技术:
2.近年来,肝癌已成为威胁人类健康的最常见恶性肿瘤之一,其发病率位居癌症发病的第6位,而死亡率位于第3位。在我国,肝癌具有较高发病率和死亡率,肝癌患者占全球患者的55%,已严重影响人民的健康和生活。
3.大量研究表明肿瘤的发生和发展与基因的突变及表达密切相关。肿瘤的致病因子通过损伤细胞dna,诱导细胞基因发生突变以及导致细胞基因表达紊乱,改变细胞蛋白和代谢水平,从而使细胞癌变。肝癌的发生是一个复杂的过程,外界或内在因素导致肝细胞发生遗传性的基因改变,使细胞生长、增殖异常,导致肿瘤的形成。研究表明肝癌的发生和发展与多种癌基因和抑癌基因的遗传改变相关。其中,与肝癌发生发展相关的相关的癌基因主要有ras、c-myc、c-erbb-2、c-fos、bcl-2、p53、p16等。另外,肿瘤发生发展相关信号通路的异常活化,像egfr-mapk-erk、pi3k-akt和wnt/β-catenin信号通路等,都可能与肝癌发生密切相关。
4.myc是癌基因中的核蛋白类转录因子,是调控多种生长信号通路的关键因子,在70%的肿瘤中存在突变或过表达,与癌症的发生和发展紧密相关。myc与max蛋白形成异源二聚体后,特异性识别并结合到基因启动子区,调控基因转录。myc调控多种蛋白基因的转录,包括细胞周期、生长、代谢等相关蛋白的基因转录,在细胞增殖、分化、转移等多方面起重要的调控作用。因此,myc蛋白过表达使细胞增殖迅速,最终导致细胞异常而癌变。肝癌的发生和发展与myc的表达密切相关,myc是肝癌恶性转化过程中的关键调节因子,研究表明,肝组织特异性myc转基因小鼠能够直接引起肝癌的发生(78,79)。tcga数据库分析显示,肝癌myc基因的扩增达到20%以上(图1)。临床研究发现,myc蛋白在肝癌组织中的表达水平显著(p<0.05)高于癌旁肝组织中。另外,myc基因的扩增与肝癌术后患者复发和整体存活率偏低负相关(77)。因此myc及其调控机制已成为肝癌靶向治疗的主要靶点。bet bromodomain抑制剂可以通过阻断myc蛋白表达抑制肿瘤生长,并已被报道应用于多种肿瘤治疗研究。但将jq1应用于肝癌治疗的研究却鲜有报道。
[0005][0006][0007]
在肿瘤细胞中,多种信号通路都可能调控细胞中myc蛋白的水平。比如pi3k-akt,mapk-erk信号通路等都可以通过转录或翻译后修饰两方面调控myc蛋白水平。其中,mapk-erk信号通路被生长因子或细胞因子激活后进入细胞核,可以调控核内的转录因子myc的表达与磷酸化,另外,p-erk能够对fbw7进行磷酸化而促进其发生自身泛素化降解,从而抑制myc蛋白的泛素化降解。因此,mapk-erk信号通路的激活可能对细胞jq1的耐药性有重要调控作用。
[0008]
造成靶向治疗耐药的因素主要来于靶基因的突变或表达的改变。其中,egfr基因的突变是产生耐药的主要原因。多种受体酪氨酸激酶,其中主要的表皮生长因子受体家族(egfrs)等可激活mapk-erk信号转导途径,是调控mapk-erk信号通路的主要上游信号因子,磷酸化的egfr能与生长因子受体结合蛋白grb2复合物结合,激活ras-raf-mapk信号,从而增强erk磷酸化,调控细胞增殖、分化、侵袭、凋亡等生物学功能。
[0009]
因此,联合使用myc抑制剂和egfr抑制剂在egfr突变的肝癌细胞中有很大的临床应用前景。为研究药物联合治疗肿瘤的新方法,为提高肿瘤临床药物治疗效果寻找突破点。
[0010]
目前关于本发明中提到的组合物在治疗肝癌的药物中的应用尚未报道。
技术实现要素:
[0011]
本发明涉及治疗肝癌,尤其是egfr突变的肝癌的药物组合的新发现,目的是提供bet bromodomain抑制剂jq1和egfr抑制剂erlotinib的共同作用的组合物对肝癌肿瘤细胞的抑制作用,从而达到协同治疗肝癌的效果。
[0012]
所述化合物a为bet bromodomain抑制剂jq1,其化合物结构式为(a);所述化合物b为egfr抑制剂erlotinib,其其化合物结构式为(b)。jq1药物使用浓度为50mg/kg;erlotinib药物使用浓度为50mg/kg。组合物中化合物ⅰ与化合物ⅱ的质量比为1:1至1:2
[0013][0014]
实验表明,本发明中所述的组合物相对于单独使用化合物ⅰ或者化合物ⅱ,可在体内和体外有效地抑制egfr突变肝癌细胞的增殖、克隆形成以及抑制细胞的存活率,因此可以用于制备治疗egfr突变的肿瘤的药物。
[0015]
将bet bromodomain抑制剂jq1与egfr抑制剂erlotinib混合使用,能够有效抑制肝癌细胞的增殖,克隆形成以及转移等效果。联合使用两者,对肝癌肿瘤生长的抑制效果明显提高,可用于egfr突变的肝癌的的治疗
附图说明
[0016]
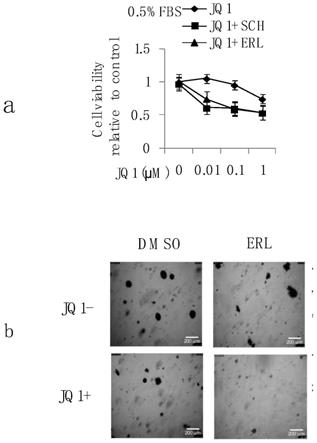
图1jq1和egfr抑制剂联用作用后抑制肝癌细胞活性与增殖。(a)细胞活力分析(b)细胞克隆拍照与数量分析。
[0017]
图2jq1和erl药物作用后引起细胞凋亡。
[0018]
图3jq1和egfr抑制剂联用抑制小鼠肝癌肿瘤的生长。(a)肿瘤体积比较和瘤体照片。(b)jq1和erl药物作用后小鼠肿瘤的重量检测。
具体实施方式
[0019]
现结合实例,对本发明做进一步说明。实例仅限于说明本发明,而非对本发明的限定。
[0020]
实例1
[0021]
bet bromodomain抑制剂jq1和egfr抑制剂erlotinib的溶液制备。
[0022]
myc抑制剂jq1和egfr抑制剂erlotinib分别用dmso溶解制备成储存液浓度为10mm。jq1加培养液液稀释至1μm,erlotinib加培养液稀释至1μm作为工作浓度;
[0023]
实例2
[0024]
jq1和egfr抑制剂联用作用后有效抑制egfr突变肝癌细胞活性与增殖。
[0025]
播种3
×
104细胞,用培养液梯度稀释jq1至1μm,0.1μm,0.01μm后联合培养液稀释的浓度为1μm的erlotinib混合后37度培养egfr突变肝癌细胞48小时,用cell titer glo方法及用克隆形成实验进行细胞毒性分析检测然后进行显著性(t-test)分析。其结果如图1
所示,egfr抑制剂erlotinib与jq1联合使用,较相同浓度的jq1单独处理组,能有效抑制肿瘤细胞的活性和增殖,肝癌细胞克隆形成数量有明显降低。
[0026]
实例3 jq1和erl药物作用后引起egfr突变肝癌细胞凋亡。
[0027]
播种3
×
105细胞,向细胞中加入培养液稀释的1μm的jq1联合1μm的erlotinib37度培养处理egfr突变肝癌细胞48小时,加入10ul annexin v-fitc和5ul pi染料,避光孵育10min,使用流式细胞仪检测细胞凋亡。其结果如图2所示,egfr抑制剂erlotinib与jq1联合使用,较较相同浓度的jq1和erlotinib单独处理组,能有效引起大量细胞发生凋亡。
[0028]
实例4 jq1和egfr抑制剂联用有效抑制小鼠肝癌肿瘤的生长
[0029]
将mhcc97-h细胞消化后收集计数后,用pbs重悬稀释到细胞浓度5
×
107cells/ml pbs。吸取100ul基质胶与100ul细胞液混合,冰上保存。以皮下注射的方式种植到裸鼠上。待小鼠成瘤后,将小鼠分为4组,每组5只,分为对照组,jq1(50mg/kg)给药组,erl(50mg/kg)给药组和jq1(50mg/kg)与erl(50mg/kg)联合给药组。通过腹腔给药,每隔一天给药一次。记录裸鼠体重。每隔一天用游标卡尺对肿瘤的长、宽进行测量。运用体积公式:v=π/6*长*宽2计算小鼠肿瘤体积。绘制小鼠肿瘤变化曲线。其结果如图3所示,相对不用药或者jq1、erl单独用药,两种药物的联合使用明显抑制了小鼠肿瘤的生长。联合用药组肿瘤的大小和重量都明显小于其他未用药组和单独用药组。
[0030]
通过上述实验表明,使用myc抑制剂jq1和egfr抑制剂erlotinib在有egfr突变的细胞中可以有效的抑制肿瘤细胞增殖,肿瘤细胞克隆形成及抑制细胞存活率。因此,这两种抑制剂的联合使用为抗癌药物的开发提供了候选方案,在有egfr突变的肿瘤中有很大的临床应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1