可标靶VEGFR2与VEGFR3的双功能抗体的制作方法
可标靶vegfr2与vegfr3的双功能抗体
[0001]
相关申请的交叉引用
[0002]
本申请要求于2018年3月20日提交的美国临时申请62/645,437的优先权,其全部内容通过引用合并于此。
背景技术:
[0003]
在肿瘤的发展过程中,血管新生与淋巴管新生是必要的,并且与其是否为恶性肿瘤具高度的相关性。其生物活性都取决于血管内皮生长因子(vascular endothelial growth factor,vegf)与其相对应的受体(vascular endothelial growth factor receptor,vegfr)结合,可进而使受体二聚体化并产生自身磷酸化反应而活化下游讯号,以增进细胞增生、细胞迁移、血管通透性及新生血管存活。olsson等人的研究文献(olsson et al.,nat rev mol cell biol,2006.7(5):p.359-71.)指出,vegf-a、vegf-c为负责血管新生与淋巴管新生的主要vegf配体,于先前的临床前研究亦揭示,若阻断效应子(effector)与vegfr2或vegfr3结合,可有效抑制肿瘤生长。然而,参见相关文献(mukherji,s.k.,ajnr am j neuroradiol,2010.31(2):p.235-6;bagri,a.,et al.,trends mol med,2010.16(3):p.122-32),使用单株抗体bevacizumab(avastin)阻断vegf-a来进行肿瘤治疗时,仅于一些癌症中可达到延迟进展和延长存活的疗效。导致此恶性肿瘤临床实验失败的主要原因为,无法减缓可做为癌细胞扩散到淋巴结和远处部位途径的淋巴管的生长,因此,淋巴管新生的选择性抑制剂可与血管新生抑制剂互补,进而达到抑制癌症的效果,然而目前都还没有相关的临床应用。
[0004]
目前,已经开发了三种阻断vegfr讯号活化的策略,除了上述的bevacizumab因具抑制细胞生长机制,可做为抗血管新生配体之外,还有aflibercept,为一种可结合vegf的嵌合诱饵受体,目前正在进行进阶性的临床试验(ellis,l.m.,semin oncol,2006.33(5suppl 10):p.s1-7;及holash,j.,et al.,proc natl acad sci u s a,2002.99(17):p.11393-8)。第二类抑制剂属于小分子,例如ptk787、sutent、sorafinib、zactima、recentin等,可抑制vegfr的细胞内酪胺酸激酶(tyrosine kinase)活性(wedge,s.r.,et al.,cancer res,2002.62(16):p.4645-55;wedge,s.r.,et al.,cancer res,2005.65(10):p.4389-400;wood,j.m.,et al.,cancer res,2000.60(8):p.2178-89;mendel,d.b.,et al.,clin cancer res,2003.9(1):p.327-37;及wilhelm,s.m.,et al.,cancer res,2004.64(19):p.7099-109)。其他为使用大分子的疗法,像是ramucirumab(cryamza)和cdp-791,也可用于阻断vegf-a与vegfr-2之间的交互作用(krupitskaya,y.and h.a.wakelee,curropininvestig drugs,2009.10(6):p.597-605;and lu,d.,et al.,j biol chem,2003.278(44):p.43496-507),这些药剂皆具有选择性且耐受性良好,对于抑制正常器官中vegf的表现,通常也不具有太大的副作用。
[0005]
vegf受体(vegf receptor,vegfr)是一更广泛的受体酪胺酸激酶家族,主要由vegfr1、2、3组成,也分别被称为flt-1、kdr、flt-4。此家族成员的结构和功能性结构域(domain)具有高度相似性,皆含有7个于细胞外可与配体结合的类免疫球蛋白
(immunoglobin-like)结构域,1个可供细胞表面嵌合(cell-surface docking)的穿膜结构域,与1个可使受体自体磷酸化(trans-autophosphorylation)的双重酪胺酸激酶结构域。例如vegf-a、胎盘生长因子(placental growth factor)等配体,是透过与类免疫球蛋白结构域2、3与vegfr结合,结构域2为主要的结合部分,结构域3则决定产生结合的特异性(christinger,h.w.,et al.,j biol chem,2004.279(11):p.10382-8;fuh,g.,et al.,j biol chem,1998.273(18):p.11197-204)。相反的,类免疫球蛋白结构域4-6则参与受体复合物的二聚化。
[0006]
理论上,在发生受体二聚化与转磷酸化(transphosphorylation)时,才能持续活化下游的讯息传递路径,因此可以透过抑制配体与受体的结合或阻断二聚化发生,来抑制由受体参与而产生的促进血管新生或淋巴管新生活性。
[0007]
值得注意的是,透过阻断二聚化的发生以抑制vegfr-2讯号传递,不仅能防止vegfr2与vegfr3的同质二聚化(homodimerization),还能干扰vegfr2/vegfr3的异质二聚化(heterodimerization),因此,透过抑制vegr2与vegfr3所参与的讯号传递路径,以达到抑制肿瘤生长与肿瘤扩散的这种策略是为一种具潜力的新机制。
技术实现要素:
[0008]
于一方面,本发明揭示了一种单离的抗体,该单离抗体包含重链互补决定区cdr1、cdr2、cdr3与轻链互补决定区cdr1、cdr2、cdr3,其重链互补决定区是来自具有序列seq id no:1或3的重链可变区序列,轻链互补决定区来自具有序列seq id no:2或4的轻链可变区序列,该抗体可与血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,vegfr2)与vegfr3特异性结合。
[0009]
于部分实施例中,重链cdr1、cdr2、cdr3来自seq id no:1,轻链cdr1、cdr2、cdr3来自seq id no:2,且该抗体可包括一与seq id no:1的序列具有至少80%(例如80%、85%、90%、95%、96%、97%、98%、99%或100%)同一性的重链可变区相同;及一与seq id no:2的序列具有至少80%(例如80%、85%、90%、95%、96%、97%、98%、99%或100%)同一性的轻链可变区。
[0010]
于一些实施例中,重链cdr1具有seq id no:5或8的序列,重链cdr2具有seq id no:6或9的序列,重链cdr3具有seq id no:7的序列,且其中轻链cdr1、cdr2、cdr3分别具有seq id no:10、11、12的序列。
[0011]
于本发明部分实施例中,重链cdr1、cdr2、cdr3来自seq id no:3,而且轻链cdr1、cdr2、cdr3来自seq id no:4。该抗体可包括一与seq id no:3的序列具有至少80%(例如80%、85%、90%、95%、96%、97%、98%、99%或100%)同一性的重链可变区的序列,至少有80%与相同(例如80%、85%、90%、95%、96%、97%、98%、99%或100%);及一与seq id no:4的序列具有至少80%(例如80%、85%、90%、95%、96%、97%、98%、99%或100%)同一性的轻链可变区。
[0012]
于其他实施例中,重链cdr1具有seq id no:13或16的序列,重链cdr2具有seq id no:14或17的序列,重链cdr3具有seq id no:15的序列,且其中轻链cdr1、cdr2、cdr3分别具有seq id no:18、19、20的序列。
[0013]
于部分实施例中,该抗体包含一fc区、一fab片段、一fab
’
片段、一f(ab)
’
2片段,一
单链抗体、一scfv多聚体、一单价抗体、一多特异性抗体或一嵌合抗体。于部分实施例中,该抗体为一人源化抗体。
[0014]
另一方面,本发明提供一种医药组合物,其包含本发明所揭示的抗体和医药学上可接受的载体。
[0015]
在另一方面,本发明亦揭示一种抗体复合体(conjugate),其包含本发明所揭示的抗体与其他分子(例如一小分子药物、一细胞标靶部分、一细胞毒杀剂、一多胜肽、一核酸分子、一可检测标记或聚合物)。
[0016]
在一方面,本发明揭示一种抑制vegfr2和/或vegfr3的同质二聚化或vegfr2和vegfr3的异质二聚化的方法,该方法包括使用本发明所揭示的抗体与细胞接触。
[0017]
在一方面,本发明揭示一种抑制细胞中vegfr2和/或vegfr3讯息传递路径的方法,包含使该细胞与本发明所揭示的单离抗体接触。
[0018]
另一方面,本发明揭示一种可用于有需要的个体,抑制其血管新生和/或淋巴管新生的方法,包含对该个体施用一有效量本发明所揭示的抗体。
[0019]
在另一方面,本发明揭示一种可用于有需要的个体,治疗其实质固态瘤的方法,包含对该个体施用一有效量本发明所揭示的该抗体。于部分实施例中,该实质固态瘤选自膀胱癌、乳癌、子宫颈癌、大肠癌、直肠癌、肾癌、肝癌、皮肤癌、间皮瘤、肺癌、口腔癌、卵巢癌、胰脏癌、前列腺癌、肉瘤、甲状腺癌;该方法可进一步包含向该个体施用另一种治疗剂。
[0020]
于一方面,本发明揭示一种可用于检测生物样品中vegfr2和/或vegfr3或其片段的方法,包含使该抗体与该样品接触反应;测定抗体与vegfr2和/或vegfr3或其片段之间的特异性结合。
[0021]
图式与以下描述将详细阐述本发明一个或多个实施例,本发明的其他特征、目的、优点,可通过以下说明书内容、图式与申请专利范围的阐明而更为清楚。
附图说明
[0022]
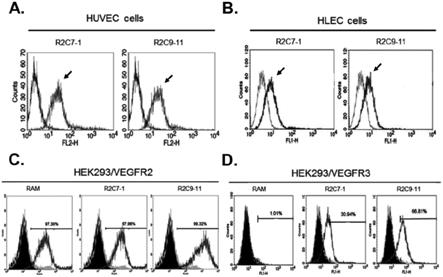
图1为流式细胞仪直方图组,显示分别使用单株抗体(monoclonal antibodies,mabs)r2c7-1与r2c9-11辨识vegfr2与vegfr3,图1a与1b分别为初代人类脐静脉内皮细胞(human umbilical vein endothelial cells,huvec)与人类淋巴管内皮细胞(human lymphatic endothelial cells,hlec),使用其第3到第6子代的初代细胞进行实验;图1c与图1d分别为过度表达vegfr2与vegfr3的hek293t细胞(hek293t/vegfr2,hek293t/vegfr3),如图所示,hek293t细胞可稳定的被转染人类vegfr2或vegfr3基因,并使用可分别针对vegfr2或vegfr3的抗体(abcam9530,r&d54703)于bd facsjazz
tm
细胞分选仪,免疫筛选出具高度表达vegfr2或vegfr3的转染子(transfectants),接着将全部的初代细胞或转染子(1x105细胞/反应)以r2c7-1或r2c9-11(10μg/ml;箭头)进行染色,同时以igg2a同种型抗体(ctl)做为阴性控制组,而以ramucirumab(ram)(10μg/ml)为vegfr2的阳性控制组,除此之外,仅被染上二级抗体的细胞将视为背景值,而染色呈阳性的细胞则以总细胞的百分比方式呈现(图1c、1d;最上部)。
[0023]
图2为阻断vegfr2与vegfr3的受体二聚化的墨点图与统计图,图2a为共免疫沉淀的结果。将具有高vegfr3表现量与低vegfr2表现量的红白血病细胞hel92.1.7(1x10
10
细胞/反应),给予r2c7-1、r2c9-11或ramucirumab(20μg/ml;ram)处理,或是未经任何处理,并以
igg2a同种型抗体(ctl)为阴性控制组,于37℃下处理24小时后,细胞再经胰蛋白酶处理与离心,并以1%(w/v)的多聚甲醛固定并用甘胺酸溶液中和,最后用pbs洗涤。于经离心而取得的可溶性片段中加入25μg针对vegfr2的抗体(abcam9530),并于室温下培养2小时。与抗体接合的蛋白质复合物可透过protein a/g进行免疫沉淀(immunoprecipitated,ip),并对hel92.1.7细胞的vegfr3进行免疫墨点(immune-blotted,wb,图左),而全可溶性片段以vegfr3和β-肌动蛋白特异性抗体进行免疫探测以达标准化。相同的,为了沉淀vegfr3并对vegfr2做墨点分析,将hek293t/vegfr2细胞经带有vegfr3的质体进行转染(图右)。于转染24小时后,将转染细胞给予r2c7-1、r2c9-11或ramucirumab(20μg/ml)处理,或是未经任何处理,并继续以前述方式进行免疫沉淀。图2b为邻位连接分析法(proximity ligation assay,pla)的结果图,通过pla检测单株抗体r2c7-1与r2c9-11(各10μg/ml)抑制vegfr2和/或vegfr3受体二聚化的抑制效果。人类淋巴内皮细胞(human lymphatic endothelial cell;hlec)接种并培养于含有r2c7-1、r2c9-11或ramucirumab(ram)的无血清培养基中16小时,随后以vegf-a
165
或vegf-c刺激细胞。每个实验皆进行三重复,根据代表图显示其荧光产物的存在,来证明vegfr2和/或vegfr3的同质或异质二聚化为紧密接近(<40nm)。细胞核以dapi染色,其荧光讯号是使用image j analysis于荧光显微镜下以40x放大倍率进行形象化与量化,数据结果皆以平均值
±
s.d.值表示,表示于未经抗体处理的细胞中(ctl)所占的百分比,此外,经同种型对照(igg2a)处理的细胞亦做为另一控制组,而细胞未经任何刺激的,或细胞以vegf-a
165
或vegf-c刺激的分别用空白、双交叉或灰色条表示。使用t-test计算有经抗体处理的细胞与未经抗体处理的细胞间的统计学上显着差异,*表示p<0.05。
[0024]
图3显示vegfr2抗体对于人类脐静脉内皮细胞(huvec)与人类淋巴管内皮细胞(hlec)的阻断效果。图3a,huvec细胞培养于egm-2,并且不给予任何补充物与vegf,让细胞饥饿8小时,之后经胰蛋白酶处理后,将细胞悬浮于含有10μg/ml ramucirumab、r2c7-1、r2c9-11或同种型控制组的抗体(igg2a)的培养基中,并接种至已用基质胶包被的孔盘上,之后于37℃下使用2μg/ml vegf-a
165
刺激细胞10小时,上述每个实验皆为三重复;图3b,类似上述步骤,一样将hlec培养于饥饿状态下,并同样以上述抗体进行预处理,且于37℃下给予2μg/ml vegf-c刺激细胞4小时。实验结果皆以影像方式撷取,并使用image j的angiogenesis analyzer定量管网(tube meshes)数目、主要接合(master junction)、管的长度、小管区域,数据相较于控制组(igg2a)以百分比表示(平均值
±
s.d.值,三重复),*、**、***分别表示p<0.05、p<0.01、p<0.001。
[0025]
图4显示各种vegfr2抗体于3d血管新生模型中的抑制效果。内皮细胞(huvec与hlec)以cfse荧光来标记,并于37℃下培养于ultra-low 96孔盘中48小时,以形成细胞球体(cell spheroids)。之后,透过离心将细胞球体转移并附着至经基质胶包被的孔盘上培养30分钟,再将附着的细胞球体培养于含有10μg/ml r2c7-1、r2c9-11、ramucirumab(ram)或同种型控制组抗体(ctl)的培养基中,并使用光学和荧光显微镜观察与拍摄细胞球体核心的形状,培养第7天后所撷取的图像为huvev、hlec的最终图像,荧光强度皆由nis-ar软件进行分析,总面积与总发光强度中减去细胞球体核心可得到发芽纤维(sprouting fibrin)的面积与发光强度,发芽区域(sprouting area,图4a)与其荧光强度(图4b)的数据皆以平均值
±
s.d.值的百分比值呈现,并以t-test测定各种vegfr2抗体与ctl抗体之间的统计学上显着差异,***表示<0.001。
[0026]
图5显示各种vegfr2抗体于体内抑制血管新生与淋巴管新生的抑制效果。将huvec(1x106)/wi38(2x 105)的细胞,或hlec(1x106)/wi38(2x 105)的细胞混合物悬浮于200μl的冰冷基质胶中,接着使用具备24英吋针头的冰冷注射器,将该细胞混合物分别皮下接种于nod-scid小鼠的左右两腹侧。于细胞接种后隔天,开始进行每周两次的静脉注射,小鼠分别给予10mg/kg剂量的r2c7-1、r2c9-11、ramucirumab(ram)或控制组抗体igg2a(ctl)并持续4周。之后切下小鼠腹侧已聚合的基质胶,以10%福尔马林固定隔夜,并包埋于石蜡后切为5μm厚的组织切片,接着使用双重染色的方法进行免疫组织化学染色分析,使用具人类α-平滑肌肌动蛋白(α-sma)特异性的抗体以针对wi38、人类cd31抗体辨别huvec、hlec,后续使用nis-ar软件分析与定量呈aec染剂阳性的血管或淋巴管的数量,数据以百分比方式(平均值
±
s.d.值)呈现,以比较三个独立实验与对照组之间的差异,且各个vegfr2抗体与ctl抗体间的统计学上显着差异皆经过t-test计算而得,*、**、***分别表示p<0.05、p<0.01、p<0.001。
[0027]
图6显示小鼠经vegfr2抗体处理后,大、小血管的比率差异。将基质胶/huvec细胞混合物(1x106细胞/500μl基质胶栓)经皮下接种的方式接种至nod-scid小鼠的腹部中线处。于接种后第7、14、21、28天,透过腹腔注射的方式给予小鼠10mg/kg剂量的igg1 ctl、ramucirumab(ram)、igg2a ctl、r2c7-1、r2c9-11,并于第35天牺牲小鼠,该组织基质胶以10%福尔马林固定24小时,包埋于石蜡并切为5μm厚的组织切片,再以抗人类cd31(hcd31)抗体进行免疫组织化学染色来辨别huvec细胞的血管形成,以分析抗体于体内抑制血管新生的效果。使用显微镜测量呈hcd31阳性的血管直径,并分成直径小于50μm与大于50μm两组,再接着定量两组中的血管数量,左侧图组显示经各种不同抗体处理过后,于直径大于50μm组别中血管数目/总血管数的比例;右侧图组显示经各种不同抗体处理过后,于直径小于50μm组别中血管数目/总血管数的比例,两次独立实验的数据皆以平均值
±
s.d.值呈现,各个vegfr2抗体与其相对应的ctl抗体间的统计学上显着差异皆经过t-test计算而得,*、**分别表示p<0.05、p<0.01。
[0028]
图7显示各种vegfr2抗体的抗体依赖性细胞毒性(antibody-dependent cytotoxicity,adcc)。图7a为vegfr2与vegfr3的表现程度,如箭头所示,分别使用具vegfr2特异性的抗体(abcam9530)或具vegfr3特异性的抗体(r&d54703)进行hel92.1.7细胞染色,受体的表现程度百分比是经由与呈现同种型控制组抗体(ctl)染色的细胞相比而得;图式7b表示其抗体依赖性细胞毒性,hel92.1.7细胞(5x104/每孔,25μl)接种到96孔盘,并接着加入25μl/每孔的所设定浓度的r2c7-1、r2c9-11或ramucirumab(ram),并于37℃下培养15分钟。另外,使用pbmc分离试剂套组(mybiosource)采集nod-scid小鼠的周边血单核细胞(peripheral blood mononuclear cell,pbmc),并将其以4.0x106细胞/ml的浓度悬浮于含有4%幼兔血清的rpmi1640培养基中,之后将50μl的pbmc效应物与孔中的目标hel92.1.7细胞以4:1的比例混合,再加入prestoblue
tm
,最后将细胞混合物于37℃下培养20小时,后续透过测定其荧光强度(560nm/590nm)来鉴定细胞活力。
[0029]
图8显示各种vegfr2抗体抑制肿瘤生长的能力。使用流式细胞分选仪(beckman coulter cytoflex s),分离出具有vegfr3高表现量的hel92.1.7细胞(即为图8a中的vegfr3-h,其占比于全族群中大于95%),及呈vegfr3低表现量的hel92.1.7细胞(即为图8b中的vegfr3-l,其占比于全族群中小于5%),并进行细胞扩增。分别将高表现量与低表现量
的细胞透过皮下注射的方式,注射至同一小鼠背侧的右侧与左侧(1x106/小鼠),于肿瘤接种后第7天,以5只小鼠为一组,每组分别给予5mg/kg剂量的特定抗体处理(ram、r2c7-1、r2c9-11),每周给予两次,共持续25天,同种型控制组igg2a(ctl)也以同样步骤进行,每周皆测量每只小鼠的肿瘤大小两次,于小鼠牺牲后测量其平均肿瘤大小(图8a与图8b中的小图),不同抗体处理组与对照组的组间差异由t-test分析,*、**分别表示p<0.05、p<0.01。
[0030]
图9显示不同vegfr2单株抗体合并使用下的抑制肿瘤生长能力。将hel92.3.1细胞经皮下接种方式,接种至nod-scid小鼠(1x106/小鼠),如图所示,10只小鼠为一组,共6组,于接种7天后,透过静脉注射分别给予r2c7-1、r2c9-11、ram(每只小鼠剂量皆为5mg/kg),或是ram(5mg/kg)再加佐r2c7-1、r2c9-11(5mg/kg)其中一种的组合,每周两次,共持续35天,于只施以单种vegfr2抗体的小鼠,另给予同样剂量的igg2a同种型控制组抗体(ctl),使每只小鼠体内的抗体总量皆为10mg/kg。使用修改过的椭圆型公式:[肿瘤体积=1/2(长度
×
宽度2)](tomayko mm,reynolds cp.,1989)计算每只小鼠的肿瘤体积,数据皆以平均值
±
s.d.值表示肿瘤大小的平均值(如小图),vegfr2抗体与ctl抗体间的统计学上显着差异经由t-test计算,*、**、***分别表示p<0.05、p<0.01、p<0.001。
[0031]
图10显示r2c7-1、r2c9-11抗体于vegfr2上的结合表位(binding epitopes)特征。将表现vegfr2(293t/vegfr2)的hek293t细胞,以每孔1x106细胞/100μl的浓度接种于96孔盘中,并于37℃下隔夜培养。另外,使用标准elisa程序,测定r2c7-1、r2c9-11抗体与细胞结合的最佳浓度,并将最佳浓度的r2c7-1、r2c9-11单株抗体(分别为200μg/ml、50μg/ml)与所设定剂量的vegfr2抗原的单个类免疫球蛋白结构域(r2-igds)结合。将经戊二醛固定并洗涤的293t/vegfr2细胞,与被结合的抗体于37℃下共培养30分钟,后续使用带有hrp的山羊-抗-小鼠igg抗体探测被结合的抗体,接着添加abts呈色,并以spectramax微量盘式分析仪于od
405
下测量吸光值。数据皆以平均值
±
s.d.值表示同种型控制组(ctl)三重复实验的百分比,r2c7-1与r2c9-11于vegfr2抗原上的潜在辨识表位位置(分别为上图与下图)由图中横跨igd6与igd7的黑线所示。
[0032]
图11显示于vegfr3抗原上测定其与r2c7-1、r2c9-11抗体的结合表位。图11a为细胞型竞争性elisa结果图,先将表现vegfr3(293t/vegfr3)的hek293t细胞涂覆于96孔盘上。依前述,测得r2c7-1、r2c9-11单株抗体的最佳浓度(数据未示)。将最佳浓度的r2c7-1、r2c9-11单株抗体与所设定剂量的vegfr3抗原的单个类免疫球蛋白结构域(r3-igds)结合。使用带有hrp的二级抗体探测被结合的抗体,接着添加abts显色,并以spectramax微量盘式分析仪于od
405
下测量吸光值,数据皆以平均值
±
s.d.值表示相较于同种型控制组(ctl)的三重复实验的百分比,r2c7-1与r2c9-11于vegfr3抗原上的潜在表位位置(分别为上图与下图)由图中横跨igd6的黑线所示。图11b为原态胶体电泳(native gel electrophoresis)结果图,先制备全部的细胞外结构域(r3-igd1-7)、结构域3-4(r3-igd3-4)、结构域6-7(r3-igd6-7)的构体,并以大肠杆菌表达,之后使用anti-myc亲合纯化系统进行纯化,使用anti-myc抗体做为探针,进行标准的西方墨点法,检测每种重组蛋白的纯度与分子量(左图),另外,进行原态胶体电泳,检测r2c7-1、r2c9-11和vegfr3经截短的抗原间的结合情形,以确认r2c7-1、r2c9-11单株抗体的表位(分别为中图与右图)。
具体实施方式
[0033]
本发明揭示可特异性标靶血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,vegfr2)与血管内皮生长因子受体-3(vegfr3)的双功能抗体,该抗体可抑制vegfr2、vegfr3各自的同质二聚化或彼此间的异质二聚化,但不影响与其配体的结合,因此可调节vegfr2与vegfr3的讯息传递路径,并抑制血管新生与淋巴管新生。
[0034]
于部分实施例中,抗体的重链互补决定区(complementary determining region,cdr)cdr1、cdr2、cdr3来自具有seq id no:1或3的重链可变区序列,且其轻链互补决定区cdr1、cdr2、cdr3来自具有序列seq id no:2或4的重链可变区序列。
[0035]
于一些实施例中,其重链cdr1可具有seq id no:5、8、13或16的序列;重链cdr2可具有seq id no:6、9、14或17的序列;重链cdr3可具有seq id no:7或15的序列;轻链cdr1可具有seq id no:10或18的序列;轻链cdr2可具有seq id no:11或19的序列;轻链cdr3可具有seq id no:12或20的序列。
[0036]
于部分实施例中,该抗体与位在vegfr2的igd6、igd7结构域内的表位,及vegfr3的igd6结构域内的表位结合,该表位可以是具结构性的。
[0037]
本文所述的名词“抗体”包括具有抗原结合能力的各种抗体结构,包含单株抗体、多株抗体、全长抗体或其片段、含有fc区的抗体、fab片段、fab
’
片段、f(ab
’
)2片段、单链抗体、scfv多聚体、单价抗体、多价抗体、人源化抗体、嵌合抗体,但不限于上述种类。
[0038]
抗体亦可与另一种分子接合,例如:小分子药物、另一种蛋白质或胜肽、可检测的标记、聚合物或碳水化合物。
[0039]
因本发明揭示了该抗体序列与其cdrs,本领域具通常知识者可通过使用本发明的方法或本领域已知技术,例如重组方法,以多种形式制备抗-vegfr2/抗-vegfr3抗体。
[0040]
另外,本发明亦揭示编码该抗体或其组成份的分离核酸分子(例如:表达载体),举例来说,该分离核酸分子可为一个可编码seq id no:1-20中任一序列的核酸分子,本发明还揭示含有该核酸分子的宿主细胞,该核酸分子与宿主细胞可用于产生抗体。
[0041]
本发明所揭示的抗体可用于阻断vegfr2和/或vegfr3的同质二聚化或vegfr2、vegfr3的异质二聚化、阻断vegfr2和/或vegfr3的讯息传递或是抑制血管新生和/或淋巴管新生。该抗体亦可用于免疫试验中(如elisa),以检测样品中是否含有vegfr2和/或vegfr3或其片段,该抗体可结合并侦测含有igd6-igd7结构域的vegfr2或vegfr3片段。
[0042]
此外,该抗体可用于治疗实质固态瘤,像是膀胱癌、乳癌、子宫颈癌、大肠癌、直肠癌、肾癌、肝癌、皮肤癌、间皮瘤、肺癌、口腔癌、卵巢癌、胰脏癌、前列腺癌、肉瘤、甲状腺癌。
[0043]
本文的“样品”可以是任何生物性样品,像是体液样品、血液样品、细胞样品、尿液样品、唾液样品或组织样品。
[0044]
本发明所揭示的抗体可制备成适用于各种给药途径的医药组成物,像是透过静脉内、关节内、结膜、颅内、腹腔内、胸腔内、肌肉内、脊髓鞘内或皮下给药等方式,该医药组成物可以是水溶液或是冻干制剂,且可包含医药上可接受的载体,像是缓冲液、赋形剂、稳定剂或防腐剂;该医药组成物可包含其他可与该抗体共同作用的活性成份,像是另一种治疗剂或佐剂。
[0045]
以下的具体实施例仅用以说明本发明,且非以任何方式限制本发明所公开的其余部分,且基于本案所揭示的内容,本领域具通常知识者无需进一步详细说明即可充分利用
本发明,本文所引述的公开文件皆完整的以参考文献的方式并入本发明。
[0046]
假设,可标定vegfr-2的类免疫球蛋白结构域4-7结构域的治疗用抗体可于不受配体影响的情况下达到治疗性效果,且可视为被标定的vegfr-2讯息传递活化的辨别模式。以下将叙述可标靶vegfr-2的治疗性抗体r2c7-1、r2c9-11的制备,以及其于体外和体内模拟血管新生和淋巴管新生模型系统中的抑制效果。
[0047]
制备可阻断vegf-r2/-r3二聚化的双功能抗体
[0048]
vegfr2和/或vegfr3的受体二聚化,是活化其下游讯息传递路径,以进行其特定配体的生物活性功能的必要条件,已有文献指出,vegf-a和vegf-c可导致vegfr2的同质二聚化,或其与vegfr3的异质二聚化。因此,假设若以vegfr2上的二聚化区域为标靶,可能可以有效阻断以vegfr2和/或vegfr3受体媒介的讯息传递活化,进而抑制vegfr-a和vegfr-c所诱导的疾病机制,像是血管新生、淋巴管新生、肿瘤转移、糖尿病相关视网膜病变和类风湿性关节炎的血管炎等。
[0049]
为了检验该假说,因而建构一个带有vegfr2二聚化区域的序列,也就是其类免疫球蛋白结构域4至7(igd4-7)序列的质体,并送至大肠杆菌表达系统中表达,之后使用his-tag亲和性管柱纯化得到重组蛋白,且将此重组蛋白免疫接种至小鼠身上,再将小鼠的脾脏细胞与sp2/0-ag14骨髓瘤细胞融合,以产生融合瘤库(hybridoma library)。最初,选择两株融合瘤细胞株(r2c7与r2c9)进行后续试验,因为其对huvec细胞具有高亲和性且有明显抑制管形成的效果,为了确保两株融合瘤各自为单一群体,两株融合瘤都经限数稀释方法挑选,并将最终得到的融合瘤细胞株命名为r2c7-1与r2c9-11,后续亦针对此两株抗体的功能进行检验,包括其物理性质也详细表征。
[0050]
双标靶vegfr2与vegfr3
[0051]
为了检验新开发的单株抗体r2c7-1、r2c9-11的结合特异性,使用huvec细胞与表现vegfr2的hek293t细胞(hek293t/vegfr)做为实验模型,结果显示两株抗体皆对huvec细胞表现的vegfr2具有相当的亲和力(图1a、1c)。为进一步确定r2c7-1、r2c9-11的结合亲和力,hek293t细胞被稳定转染编码人类vegfr2或其空载体(hek293t/vc)的质体,并同时使用一种临床上使用的vegfr2抗体—ramucirumab检测其vegfr2的表现量。流式细胞仪结果显示,本发明新开发的单株抗体和ramucirumab两者结合vegfr2的能力相当,亦检验r2c7-1、r2c9-11抗体对hek293t/vc转染子的结合特异性,结果显示只有痕迹染色(trace staining),该结果也使用一种商业上可获得的针对vegfr2的抗体abcam9530进一步确认(数据未显示)。
[0052]
r2c7-1与r2c9-11单株抗体也具有与人类淋巴管内皮细胞(hlec)与表现vegfr3的hek293t细胞结合的亲和力,流式细胞仪分析结果亦显示该新开发的单株抗体针对hlecs具有独特的亲和力(如图1b)。由于先前文献已揭示hlec细胞上表现了一定量的vegfr2(参见dellinger et al.,2013,plos one 8(9):e74686.),因此设计可表现vegfr3的hek293t细胞(hek293t/vegfr3)用以确认r2c7-1、r2c9-11与vegfr3的结合特异性,并使用市售的vegfr3抗体r&d54703来检测hek293t/vegfr3上的vegfr3表现程度(数据未显示),透过流式细胞仪分析结果,清楚的显示两种抗体与ramucirumab不同,此两种抗体都能够与vegfr3结合(如图1d),且两者相比之下,单株抗体r2c9-11较r2c7-1可更佳的与vegfr3结合。数据显示该新开发的单株抗体具有与vegfr2和vegfr3结合的双结合能力,亦表示其可能具有抑制
血管新生与淋巴管新生的双功能。
[0053]
抑制因配体而产生的受体二聚化
[0054]
为检测若先使用r2c7-1和r2c9-11单株抗体进行预处理是否能防止vegfr2和vegfr3间的异质二聚化,因此使用具有高vegfr3表现量与低vegfr2表现量的hel92.1.7细胞株和同时表现vegfr2与vegfr3的hek293t细胞株(hek293t/vegf-r2/-r3)做为实验模型。不论是使用共免疫沉淀技术(co-immunoprecipitation,ip)于hel92.1.7细胞中沉淀vegfr2并对vegfr3进行墨点分析或于hek293t/vegf-r2/-r3转染子细胞中沉淀vegfr3并对vegfr2进行分析,结果皆清楚显示r2c7-1和r2c9-11单株抗体较ramuciruman具有更佳的抑制受体异质二聚化的能力,尤其是r2c9-11(如图2a)。
[0055]
为了进一步检测新开发的单株抗体是否具有抑制因vegf-a与vegf-c而产生的同质和/或异质二聚化的能力,因此使用hlec细胞株进行邻位连接分析法(proximity ligation assay,pla)测试。细胞培养于无血清培养基中,并经r2c7-1、r2c9-11、ramucirumab或同种型控制组抗体(igg2a)预处理,接着以vegf-a
165
或vegf-c刺激细胞,并以受体彼此间的距离判定vegfr2与vegfr3间是否有同质和/或异质二聚化的形成,若小于40nm即判定为二聚化。相较于未经刺激的细胞或经igg2a预处理的对照组,结果显示r2c7-1、r2c9-11单株抗体具有与ramucirumab相当的抑制因vegf-a
165
和vegf-c而产生的受体二聚化的能力(如图2b)。综上所述,虽然新开发的抗体具有与ramucirumab相当的阻断因vegf-a和vegf-c而产生的受体二聚化的能力,但新开发的抗体比ramucirumab具有更佳的抑制异质二聚化的效果。
[0056]
vegfr2和vegfr3下游讯息传递的衰减
[0057]
于受体产生因配体所导致的二聚化后,必然会因配体的生物活性功能而发生受体自身磷酸化和下游讯息传递路径的活化。为了检测阻断受体二聚化是否足以减弱其下游讯息传递路径的活化,先以r2c7-1、r2c9-11或其同种型控制组(igg2a)等单株抗体预处理处于饥饿状态的huvec细胞,并以经ramucirumab预处理的细胞做为控制组,接着细胞会分别接受vegf-a165处理、血清刺激或无任何处理。
[0058]
针对vegfr2的自身磷酸化与其下游讯息传递分子(如fak p38mapk)进行西方墨点法分析,结果显示不论是新开发的单株抗体或ramucirumab皆能抑制受体二聚化,进而有效的抑制vegfr2的活化,特别是其y1054残基上的酪胺酸磷酸化,虽然r2c7-1的抑制效果比ramucirumab稍弱一点(数据未显示)。
[0059]
与ramucirumab所诱导的p38mark去磷酸化不同,r2c7-1单株抗体并没对p38mark的活化产生任何效果,反而是有效的使fak的活化失活。另外,与ramucirumab相比,r2c9-11则同样具有抑制p38mapk活性的效果(数据未显示)。于hlec细胞中,两株新开发的抗体对于因vegf-a而诱导的讯息传递具有类似的效果,皆可抑制vegfr2与vegfr3的自身磷酸化(数据未显示),但相反的,只有r2c9-11能有效的抑制因vegf-c而活化的讯息传递路径,进而抑制vegfr3的活性(数据未显示)。
[0060]
综上所述,虽然r2c7-1与r2c9-11于阻断vegfr2的讯息传递路径的机制不同,但两者都具有双重阻断的特性,可阻断vegfr2与vegfr3的受体媒介的讯息传递活化。
[0061]
阻断2维(2d)空间与3维(3d)空间的管形成
[0062]
为检验新开发抗体所具备的减弱vegf-a、vegf-c诱导的讯息传递功能是否能调节
huvec、hlec细胞的生物行为,因此进行了2d空间的管形成试验。先将huvec与hlec细胞接种于涂有基质胶且缺乏vegfs与任何营养补充物的孔盘上,经ramucirumab、r2c7-1、r2c9-11或同种型控制组抗体(igg2a)预处理后,给予vegf-a或vegf-c刺激10小时,再进行影像撷取,接着使用image j的血管新生分析仪进行管网(tube meshes)、主要管段(master segments)的总数定量,其结果显示,相比于ramucirumab抑制因vegf-a或vegf-c诱导的血管生成的能力,r2c9-11具有较佳或相当的抑制效果(如图3),然而相较之下,r2c7-1单株抗体的抑制效果较弱。
[0063]
为进一步检验其于3d空间中抑制发芽纤维(sprouting fibrin)形成的效果,将huvec、hlec细胞接种于含有cfse荧光染剂的超低平板(ultra-low plate)上以形成细胞球体,之后转移制涂有基质胶的孔盘上,以含有r2c7-1、r2c9-11、ramucirumab或同种型控制组抗体(igg2a)的培养基培养7天。使用nis-ar软件进行发芽区域与荧光强度的分析,结果显示,与控制组细胞相比,所有的抗体皆显示显著性的抑制发芽纤维生成的能力(p<0.001,如图4a、4b),且值得注意的是,该新开发的抗体皆比ramucirumab具有更佳的抑制效果,综合以上,r2c7-1与r2c9-11单株抗体具有不同的抑制血管、淋巴管新生的能力,其差异取决于所使用的实验模型。
[0064]
体内由外被细胞所诱导的淋巴管新生
[0065]
部分文献已证明外被细胞(pericyte)于血管新生和淋巴管新生中扮演重要的角色(ozerdem u,2006,ophthalmic res.2006;38(5):251-4),因此为了检测以wi38纤维母细胞作为外被细胞是否可促进体内淋巴管新生,使用hlec细胞作为实验模型并进行基质胶栓试验,将hlec/wi38细胞混合后植入冰冷的基质胶中,接着将基质胶经皮下接种至nod-scid小鼠的腹侧,并分别于两周或四周后将已聚合的基质胶切除,且固定、包埋至石蜡中。后续进行免疫组织化学染色分析,使用可针对人类α-小肌肉肌动蛋白(α-small muscle actin,sma)与cd31的特异性抗体进行双重染色,且分别以3,3
’-
diaminobenzidine(dab)、3-amino-9-ethylcarbazole(aec)呈色,以分析组织中基质胶内的人类wi38与hlec细胞。结果显示,于接种两周后,可见被人类sma特异性抗体所标定出的wi38细胞浸润于小鼠组织中新生成的血管,早于可被人类cd31特异性抗体所标记的新生人类淋巴血管;于接种四周后,则可见hlec细胞从右下方移动至左上方,以形成更大的淋巴管(数据未显示),以上的数据可证实外被细胞确实于淋巴管新生中扮演重要的角色。
[0066]
减少体内血管新生和淋巴管新生
[0067]
使用与上述相同的实验模型,将huvec或hlec细胞与wi38先混合后植入基质胶中,再将基质胶经皮下接种至nod-scid小鼠,接着将给予小鼠每周两次的ramucirumab、r2c7-1、r2c9-11或控制组抗体处理,共持续四周。使用nis-ar软件定量经aec部分或完全染色的管,结果显示相较于控制组,经r2c7-1或r2c9-11处理的小鼠的新生血管数量有显著性的减少,且效果比ramucirumab更好,尤其是在淋巴管新生的部分(如图5),效果更佳。
[0068]
此外,也进一步测定血管尺寸的比例,结果显示给予r2c7-1、r2c9-11或ramucirumab处理的小鼠,其血管管径大于50μm的比例显著性的下降,然而相反的,其血管管径小于50μm的比例则显著性的上升(如图6)。以上现象亦也同时出现于使用hlec细胞的淋巴管新生实验模型上,其结果也显示相较于ramucirumab,经给予r2c7-1和r2c9-11处理可更有效的抑制淋巴管的生成(数据未显示),因此,以上结果显示相较于ramucirumab,该
可双重标靶vegfr2与vegfr3的新开发抗体可提供更佳的抑制血管新生与抑制淋巴管新生效果。
[0069]
体内和体外的抗体依赖性的肿瘤细胞毒性
[0070]
由于该新开发的抗体可特异性的标靶vegfr3,因此进一步检测其对表现vegfr3的细胞是否具有细胞毒性。于本实施例中使用hel92.1.7细胞株,首先,先检测其vegfr2与vegfr3的表现情形,透过流式细胞仪可确认其具高表现量(~95%)的vegfr3与低表现量(~5%)的vegfr2(如图7a),接着从nod-scid小鼠体内分离出周边血单核细胞(peripheral blood mononuclear cells,pbmcs),以进行抗体依赖性的细胞毒性试验(adcc)。其结果显示,所有测试的抗体(包括ramucirumab)于含有pbncs与2%婴儿血清的情况下,都明显具有杀死hel92.1.7肿瘤细胞的能力,甚至当抗体浓度低至只有0.125μg/ml的情况下,也具有此效果(如图7b)。
[0071]
以下,将进一步透过nod-scid小鼠的异种移植肿瘤来检验抗体的抑制肿瘤能力,具vegfr3高表现量(~95%)或低表现量(~5%)的细胞被分选出来并扩增,分别接种至小鼠的左侧或右侧,于肿瘤接种7天后,开始给予小鼠每周两次的r2c7-1、r2c9-11、ramucirumab或igg控制组抗体,共持续25天。结果显示,该新开发的抗体对于不论是具高或低表现vegfr3的肿瘤皆具有与ramucirumab相当的治疗效果(如图8)。综上所述,r2c7-1与r2c9-11除了具有抑制血管新生与淋巴管新生的双功能,还可触发adcc的毒杀效果,进而抑制表现vegfr3的肿瘤生长,并且于25天的疗程当中,具有与ramucirumab相当的治疗效果。
[0072]
新开发的抗体与ramucirumab的合并疗法
[0073]
为进一步检测若合并使用新开发的抗体与ramucirumab是否能提供更好的抑制肿瘤能力,以带有hel92.1.7肿瘤细胞的小鼠做为实验模型(每组10只),分别单独给予r2c7-1、r2c9-11或ramucirumab或其组合。于小鼠接受接种七天后,每周给予两次抗体处理,共持续35天(总剂量为10mg/kg)。结果显示,与单独给予r2c7-1或r2c9-11的处理组相比,合并给予r2c7-1或r2c9-11与ramucirumab并不会有更好的肿瘤抑制的治疗效果,反而单独给予r2c9-11处理是所有抗体处理组中,呈现最佳治疗效果的组别(如图9所示)。因此,以上数据显示,标靶表现vegfr3的肿瘤细胞(如hel92.1.7),不但可降低其细胞存活,在有婴儿血清中活化的补体的情况下,还可以因被抗体标靶后而产生细胞毒性。
[0074]
确认新开发抗体上的表位
[0075]
为确认r2c7-1与r2c9-11所识别的表位,进行细胞型竞争性elisa(enzyme-linked immunosorbent assay)试验。将hek293t/vegfr2转染细胞贴附于96孔盘上并固定(5x104细胞/孔)。使用标准elisa程序,测定r2c7-1与r2c9-11抗体与细胞结合的最佳浓度,及对数期的最高浓度(数据未显示)。接着,使用特定剂量的vegfr2抗原的单个类免疫球蛋白结构域(r2-igds)吸收最佳浓度的抗体,以竞争其结合表位。结果显示,r2c7-1与r2c9-11的主要识别的表位介于igd6与igd7之间,但两抗体间有些微的差异,r2c7-1比r2c9-11对igd6具有更强的结合能力(如图10)。为了进一步确定该新开发抗体的表位,因此对其进行丙胺酸扫描诱变试验(alanine scanning mutagenesis),显示vegfr2的igd6至igd7之间任何的胺基酸改变,都会影响两种抗体对其辨识的结合能力(数据未显示)。以上结果表示,本发明的新开发抗体所识别的表位应为结构性表位。
[0076]
使用上述相同方法来测定vegfr3上抗体结合的表位,以hek293t/vegfr3转染细胞
做为结合对象,用来测定抗体对vegfr3结合的最佳浓度(数据未显示)。接着,使用特定剂量的vegfr3抗原的单个类免疫球蛋白结构域(r3-igds)吸收最佳浓度的抗体,以竞争其结合表位。结果显示,r2c7-1与r2c9-11的主要识别的表位位于vegfr3的igd6,而非igd7(如图11a)。为进一步确认此结果,针对不同的重组igd蛋白进行原态胶体电泳的西方墨点法,由于先前文献已指出vegfr3受体于生物合成过程中,igd5会经蛋白水解反应而被切除(参见pajusola k et al.,1994,oncogene.9(12):3545-55),而且于本实施例中,也并未于细胞型elisa中显示其具有竞争性(如图11a),因此后续只使用e.coli系统合成igd1-7、igd3-4、igd6-7等片段。于非还原胶体电泳后,使用r2c7-1、r2c9-11抗体来免疫探测该纯化的蛋白质,进而显示该抗体对igd6-7有高度的结合能力,但对igd3-4却无此现象(如图11b)。综上所述,此些数据皆显示vegfr2与vegfr3上,r2c7-1与r2c9-11结合的表位都位于igd6-7,且vegfr3蛋白上的识别位特定的位于igd6。
[0077]
互补决定区(complementarity-determining regions,cdrs)和结合亲和力
[0078]
为确定抗体的互补决定区,使用kabat、chothia系统来确立r2c7-1和r2c9-11抗体的可变区(variable regions)。首先,为了确定分泌两个抗体的融合瘤为单株细胞,将细胞经过连续两次的连续稀释来筛选细胞,并使用5
’-
race或具特异性的5'-/3
’-
igg退化性引子,复制出带有抗体序列的基因片段,参见表1。从该新开发抗体中复制出的互补决定区系列示于表2。r2c7-1与r2c9-11两者经由kabat、chothia系统定义的重链cdr1(cdr-h1)与cdr2(cdr-h2)胺基酸序列,结果有很大的不同,但于其重链cdr3(cdr-h3)则无分别。至于其轻链的cdr,两系统所鉴定出来的结果显示两抗体并无差异。综上所述,虽然r2c7-1和r2c9-11对于vegfr2、vegfr3的igd6-7结构域都具有结合潜力,但有可能是因为r2c7-1和r2c9-11之间的cdr胺基酸序列有差异,因此才导致两抗体对于vegfr2、vegfr3上有不同的结合表位。
[0079]
表1、vegfr2单株抗体的序列
[0080][0081][0082]
表2、vegfr2单株抗体的互补决定区
endothelial cells,lecs)购买自promocell(heidelberg germany),并依照其制造者指示,培养于内皮细胞培养基mv(promocell)。
[0092]
(2)融合瘤的产生
[0093]
于两周内,使用血管内皮生长因子受体2(vegfr2)的人类重组免疫球蛋白(immunoglobin,ig)结构域4-7来腹腔免疫balb/c小鼠共3次。使用基因特异性的引子与人类vegfr2 cdna做为模板,透过pcr编码出带有vegfr2的细胞外结构域4-7的基因,并复制到pgex-kg载体中,最后所产生的质体经由直接定序确认后,命名为pgex-vegfr2-ed ig d4-7。该编码的蛋白质是被表现于大肠杆菌表现系统,并经glutathione-conjugated sepharose beads(sigma-aldrich;st.louis,mo)进行纯化,相关方法可见下文所述的「基因构筑和表达」。采集小鼠的血清并使用间接型的elisa检测是否有抗vegfr2抗体的存在,在侦测到高程度的抗体力价(>1:3000稀释)后,会再对小鼠进行最后一次的ip注射增强,给予不含freund
’
s佐剂的25μg重组抗原,于最后一次增强的五天后,牺牲小鼠及采集其脾脏细胞,并使用改良式的融合瘤技术(apiratmateekul,n.,p.phunpae,and w.kasinrerk,cytotechnology,2009.60(1-3):p.53.)将脾脏细胞与骨髓瘤细胞融合。简述之,使用50%聚乙二醇4000(peg 4000;sigma-aldrich,st.louis,mo)将脾脏细胞(7x107个细胞)与2x10
7 sp2/0-ag14细胞(atcc crl-1581tm)以标准的融合瘤技术进行融合,经hat培养基(sigma-aldrich)筛选后,使用标准的间接型elisa分析从含有融合瘤的孔中获得的培养物上清液,而于450nm(od
450nm
)下,光密度值≥0.60的融合瘤判定为阳性,并将的以限数稀释技术进行单细胞的复制。使用鼠单株抗体同种型试剂组(thermo scientific pierce,rockford,il)测定被分泌出的小鼠单株抗体的种型。
[0094]
(3)抗体的纯化
[0095]
使用融合瘤无血清培养基(gibco)于无血清的情况下培养可生产抗vegfr2单株抗体的融合瘤,并使用toyopearl af-rprotein a(griesheim,germany)进行亲和层析法从培养物的上清液中纯化出单株抗体,经冰冷的pbs(10x bed volume)清洗过后,被protein a磁珠纯化的抗体经elution缓冲液(r2c7-1的为50mm glycine-hcl,ph 3.0;r2c9-11的为50mm glycine-hcl/150mm nacl,ph 3.0)溶析出该抗体,每1ml溶析的流份(fraction)收集于含有100μl中和缓冲液(1m tris-hcl,ph 8.0/1.5m nacl/1mm edta)的管中,并分别经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)和间接elisa测定纯度与活性,该单株抗体的浓度则由bradford蛋白质测定法(bio-rad,hercules,ca),并于4℃下使用pbs进行透析过夜,最后所得的抗vegfr2抗体储存于-80℃以备后续使用。
[0096]
(4)管生成试验
[0097]
先将培养用孔盘以冰冷的基质胶(80μl/孔;bd biosciences,san jose,ca)进行包被,并于37℃下培养30分钟以形成凝胶。lecs与huvecs先于缺乏vegfs和其他补充剂的情况下,培养于egm-2中饥饿8小时,接着经胰蛋白酶处理后,将细胞再悬浮于含有ramucirumab(5μg/ml;eli lilly,indianapolis,in)、抗vegfr2单株抗体(20μg/ml;r2c7-1或r2c9-11)的培养基中,并添加2μg/ml的vegf-a165(cys156ser)或vegf-c(r&d;mckinley place,ne),接着于37℃下将lec或huvec接种至预先包被好的孔盘上培养,分别培养4小时或10小时。使用nikon digital slight ds-u3系统(tokyo,japan)拍摄孔盘的全影像,并透过image j的angiogenesis analyzer进行分支节点、管网、管长的总数定量,数据皆为三重
复并以平均值
±
s.d.值呈现。
[0098]
(5)流式细胞仪分析
[0099]
使用磷酸盐缓冲生理盐水(pbs)冲洗细胞,并溶于以pbs为基底的edta中,再经离心分离收集细胞,并于4℃将细胞培养在含有1%牛血清蛋白的pbs中1小时,以阻断其产生非特异性的结合,后续经pbs冲洗后,再于4℃下,以2μg/ml的抗vegfr2单株抗体(r2c7-1或r2c9-11)、ramucirumab(eli lilly,indianapolis,in)或同种型控制组免疫球蛋白g(igg)处理表现vegfr2的huvec或hek293t细胞(1x105/反应)1小时。为了检测vegfr3的表现,先以vegfr3抗体(santa cruz,dallas,tx)或控制组的兔子igg的抗体(abcam,burlingame,ca)为免疫探针,侦测表现vegfr3的lec或hek293t细胞,后续经含1%bsa的pbs充分冲洗后,以各自相对应的二级抗体,分别为4μg/ml带有pe的山羊抗小鼠igg(biolegend)、带有fitc的驴抗兔子igg(abcam)或带有pe的小鼠抗人igg(biolegend),于4℃下染色细胞1小时,接着再冲洗一次细胞,并重新悬浮于含1%多聚甲醛、1%bsa的pbs中,并使用bd facscalibur
tm
流式细胞仪(becton dickinson,franklin lakes,nj)分析细胞表面上vegfr2和vegfr3的表现情形。
[0100]
(6)原位邻位连接分析法(in situ proximity ligation assay,pla)
[0101]
依照制造商的使用说明,使用duolink in-situ pla试剂组(sigma-aldrich,st.louis,mo)检测抗vegfr2单株抗体(r2c7-1、r2c9-11)阻断vegfr2与vegfr3的同质/异质二聚化的效果。简言之,lecs接种于8孔的细胞培养用玻片,并培养于含有r2c7-1、r2c9-11或ramucirumab(eli lilly)的无血清培养基中16小时,接着于分别使用vegf-c(500ng/ml共15分钟)、vegf-c(cys156ser)(2μg/ml共10分钟)或vegf-a165(50ng/ml共5分钟)刺激细胞后,以pbs冲洗细胞,并以4%多聚甲醛固定15分钟,再以阻隔缓冲液(blocking buffer,sigma-aldrich)于室温下作用30分钟,后续进行细胞染色,以2μg/ml市售的抗vegfr2或vegfr3(santa cruz,dallas tx)抗体染色做为控制组,并添加可与特定寡核甘酸(pla探针)连接的各自相对应的物种特异性二级抗体,透过加入含有连接酶(sigma-aldrich)的溶液(最终浓度为1单位/μl)于37℃下作用30分钟已完成pla探针的连接反应,并将连接完成的pla探针于37下与含有聚合酶(sigma-aldrich)的溶液(浓度为10单位/μl)作用100分钟,以扩增讯号,之后以缓冲液b(sigma-aldrich)冲洗,再以dapi染出玻片上的细胞核,然后以duolink in-situ mounting medium(sigma-aldrich)将玻片封片,另外,使用同种型的igg做为控制组,以上染色的荧光讯号(或点)皆以metamorph offline软件进行影片成像与分析。
[0102]
(7)共免疫沉淀分析(co-immunoprecipitation)
[0103]
为检测抗vegfr2抗体对vegf-c所诱导的受体二聚化是否具有抑制作用,先将lec细胞接种于直径6公分的培养皿上,直到细胞长至70-80%满,接着将细胞冲洗干净后,培养于含有20μg/ml抗体(r2c7-1、r2c9-11或同种型控制组抗体)的无血清培养基中16小时,随后,将细胞分为以vegf-c(500ng/ml)刺激15分钟,或无使用vegf-c处理,然后先以冰冷的pbs冲洗两次,再使用ripa缓冲液(20mm tris-hcl(ph 7.5)/150mm nacl/1mm na2edta/1mm egta/1%np-40/1%sodium deoxycholate/2.5mm sodium pyrophosphate/1mmβ-glycerophosphate/1mm na3vo4/1μg/ml leupeptin)收集细胞。于免疫沉淀试验,裂解物(1mg/样品)先使用protein-a/g-agarose磁珠(thermo fisher;waltham,ma)进行预处理,
以最小化其他非特异性的结合,之后再与抗vegfr3抗体(1μg/样品,santa crus)共培养,以连续旋转方式于4℃隔夜培养,免疫沉淀的蛋白质以天然的聚丙烯酰胺胶体电泳的方式分离,并以市售的vegfr3抗体(santa crus)进行免疫墨点,再使用ecl西方墨点系统(thermo scientific)进行呈色,如下所述。
[0104]
(8)原态胶体电泳
[0105]
使用原态胶体电泳(page)测量vegfr2与vegfr3的受体二聚化状态,首先细胞先饥饿培养于含有20μg/ml的r2c7-1或r2c9-11的无血清培养基16小时,并分别以ramucirumab、同种型控制组抗体为阳性对照与阴性对照组,接着以vegf-c(500ng/ml)刺激细胞15分钟后,以低渗透裂解缓冲液(20mm tris-hcl,ph 7.4、10mm nacl、1mm pmsf)收集细胞,将等量的蛋白质样品与4x天然样品缓冲液(400mm tris-hcl,ph7.5、40%glycerol、0.02%bromophenol blue)混合,再利用预先制作好的page胶(bio-rad)进行原态胶体电泳,并透过抗vegfr2、抗vegfr3或抗p-vegfr3抗体(santa cruz、santa cruz、cell applications;san diego,ca)检测vegfrs的二聚化和磷酸化状态。
[0106]
(9)西方墨点分析
[0107]
使用裂解缓冲液(20mm tris-hcl ph 8.0/2mm edta/1mm na3vo4/10%glycerol/1%triton x-100/protease)并加入磷酸酶抑制剂混合物(sigma-aldrich)或ripa缓冲液裂解细胞,以得蛋白质裂解物。huvec与lec细胞于处理前一天先接种,huvec细胞先添加抗vegfr2抗体,如r2c7-1或r2c9-11,于培养基中(5,10,20μg/ml),并于37℃下处理10分钟,后续再以20ng/ml的vegf-a165(r&d)刺激huvec,而lec细胞则先与r2c7-1或r2c9-11抗体(20μg/ml)预培养,再以vegf-c(500ng/ml共15分钟),vegf-c(cys156ser)(2μg/ml共10分钟)or vegf-a165(50ng/ml共5分钟)(r&d)刺激,之后以ripa缓称液收集细胞,并分别以ramucirumab(5μg/ml;eli lilly)与同种型控制组igg(r2c7-1与r2c9-11使用小鼠igg(biolegend);rabbit igg for vegfr3抗体使用兔子igg(abcam))为阳性对照组与阴性对照组,萃取得到的蛋白质浓度以bradford蛋白质测定试验(bio-rad)测量,并取同量的总蛋白质(50μg/样品)以12%十二烷基硫酸钠聚丙烯酰胺凝胶(bio-rad)进行电泳分离,再将蛋白质转移到硝酸纤维素膜上(hybondtm-p;amersham biosciences,piscataway,nj),经阻隔缓冲液(3%bsa/0.1%tween-20in tbs)于常温进行组隔作用两小时后,该膜再与抗vegfr2(santa cruz)、抗vegfr3(santa cruz)、抗p-vegfr3(tyr1230/1231)(cell applications)、抗p-fak、抗p-p38erk(cell signaling;danvers,ma)、抗β-actin(milliporesigma;burlington,ma)或抗tubulin的初级抗体于4℃隔夜培养,后续再与各自对应的带有辣根过氧化物酶(horseradish peroxidase,hrp)二级抗体培养,并使用supersignal west pico化学发光(chemiluminescence)(thermo scientific)使有产生免疫反应的蛋白质呈色,并以x放射线底片(fuju;tokyo,japan)检测信号。
[0108]
(10)细胞型竞争性elisa
[0109]
使用细胞型的竞争性elisa测定抗vegfr2抗体r2c7-1、r2c9-11的抗体表位。先将表现vegfr2或vegfr3的hek293t细胞以每孔50000细胞/100μl的浓度接种于96孔盘上,并以37℃进行隔夜培养,经充分冲洗后,使用含1%戊二醛的pbs溶液固定细胞,并以含0.1%tween-20的pbs溶液(pbst)冲洗三次,接着以含3%bsa的pbs溶液于37℃处理细胞30分钟,以避免产生非特异性的结合,另一方面,r2c7-1、r2c9-11抗体(8μg/孔盘)被指定剂量(0.2,
1.0,5.0μg/孔盘)的vegfr2或vegfr3重组蛋白的单个类球蛋白结构域(igd4、d5、d6、d7)于37℃下吸收,共处理30分钟,之后再将表现vegfr2或vegfr3的细胞与该经过预吸收的r2c7-1或r2c9-11抗体于37℃共培养1小时,并以大量的pbst冲洗3次,最后使用带有hrp的山羊抗小鼠igg为探针,于37℃下作用1小时以侦测结合的抗体,接着加入abts呈色(37℃,处理30分钟),并以spectramax m5 microplate reader(molecular device;san jose,ca)于od
405
下测量。
[0110]
(11)基因构筑与表达
[0111]
将vegfr2的细胞外球蛋白(ig)结构域构筑至pgex-4t-1质体(ge healthcare;chicago,il)中,并于胜任大肠杆菌细胞系统中表现重组蛋白。该vegfr2的细胞外球蛋白结构域与其次级结构域(subdomain)6、7的基因(nm_002253.2)是以质体ex-i0114-lv205(genecopoeia;rockville,md)为模板,使用基因特异性引子进行pcr制造而成,并以bamh1、xhol(neb;ipswich,ma)进行限制性消化再复制至pgex-4t-1载体(ge healthcare;chicago,il),且分别命名为vegfr2-ed ig d1-7、d6-7。再将基因构体于42℃下以热休克方式处理40秒,以将其转型至jm109细胞(promega;madison,wi),并于lb琼脂上以ampicillin(50μg/ml)筛选,再以标准菌落pcr和基因定序确认具抗生素抗性细胞中的插入基因,阳性细胞培养于含有ampicillin的lb培养基中,以1mm的iptg(sigma-aldrich)于37℃处理3小时,诱导细胞表达蛋白质,后续沉淀细胞,打散悬浮于冰冷的裂解缓冲液(10mm tris-hcl ph8.0/0.15m nacl/1mm edta)并添加100μg/ml的溶菌酶、10mm的pmsf、5单位的benzonase(sigma-aldrich),经音波震动处理后,以10000xg离心30分钟获得可溶性片段,并以带有glutathione的sepharose磁珠(sigma-aldrich)纯化出gst标记的重组蛋白,再以10mm的还原态glutathione溶析出蛋白质与pbs透析过夜,最后以sds-page测定重组蛋白的纯度。
[0112]
为了于真核细胞中表达vegfr3的细胞外结构域基因,将欲插入的基因复制至pcmv6-xl6-myc载体(origene;rockville,md)以表达该蛋白质。简言之,以pcmv6-xl6-vegfr3(来自j.l.su博士)为模板,使用基因特异性引子进行pcr而扩增得vegfr3的细胞外ig结构域与其次级结构域的基因(nm_002020.4)。于限制性消化后,将插入片断转殖至pcmv6-xl6(origene;rockville,md)的ecor1与xbal位点中,再转型至dh5α细胞(thermo scientific)以放大基因,并以直接定序的方式确定所得的vegfr3-ed ig d1-7、d3-4、d6-7-myc质体。
[0113]
为了表达和纯化由上述质体所编码的重组蛋白,将其以turofect转染试剂(thermo scientific)转染至hek293细胞,步骤皆参照产品说明书指示,并使用anti-myc antibody-mobilized管柱纯化出编码的蛋白质,再经native page novex bis-tris gel system(invitrogen;carlsbad,ca)溶于原态page胶体中,然后于硝酸纤维素膜上进行免疫墨点。另外,为了检测vegfr2抗体的交叉反应,再使用r2c7-1或r2c9-11抗体为探针针测墨迹,并以山羊抗小鼠igg-hrp(santa cruz)抗体检测,接着以supersignal west pico chemiluminescence(thermo scientific)使讯号呈色。
[0114]
其他实施例
[0115]
本说明书中公开的所有技术特征可以任意组合方式组合,本说明书中公开的每个技术特征可以由相同、等同或类似目的的替代技术特征取代,因此,除非另有明确说明,否则所公开的每个技术特征仅为一系列相同或类似技术特征的实施例。
[0116]
根据以上叙述,本领域具通常知识人士可轻易了解所述的实施例中的基本特征,并且于不脱离其精神和范围的情况下,可对实施例进行各种改变和修改,使其能适用于各种用途与条件,因此,其他实施例也应落于本案权利要求范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1