治疗巨细胞动脉炎的制作方法
治疗巨细胞动脉炎
1.相关申请的交叉引用
2.本技术要求于2019年8月6日提交的美国临时专利申请序列号62/883,378和于2019年7月30日提交的国际申请pct/us2019/44231的权益和优先权,其要求以下美国临时申请序列号的优先权:于2018年11月9日提交的62/758,127;于2018年12月19日提交的62/782,194;和于2019年1月28日提交的62/797,813,其各自的内容并入本文中。
3.以引用方式并入序列表
4.2019年11月4日创建且大小为3.77kb的名为“kpl
‑
034wo2_sl_st25.txt”的文本文件的内容在此整体以引用方式并入。
背景技术:
5.巨细胞动脉炎(gca)被认为是原发性全身性血管炎的最常见形式。所述疾病的特征在于倾向于颈动脉颅支的中大血管的炎症。据估计,这种疾病在美国的发病率为~75,000至150,000。风险因素包括年龄、性别、种族和地理区域、家族史以及与其它疾病和健康病状,例如风湿性多肌痛的关联。如果不治疗,gca可导致失明,可引起主动脉神经炎和中风,并且可能是致命的。
6.疾病的病因尚不清楚。目前的患者护理包括在疑似诊断后对患者进行类固醇治疗。普遍接受的gca疾病管理过程是高剂量皮质类固醇治疗,通常从40
‑
60毫克/天的口服强的松(prednisone)开始。尽管对一些患者有效,许多人不能够停用皮质类固醇,因为随着剂量的减少,其继续经历疾病发作,并且鉴于类固醇相关的并发症,需要保留类固醇的治疗方案。因此,所述领域存在需要解决的大量未满足的医疗需求。
技术实现要素:
7.本发明尤其提供了治疗gca的方法。在一个方面,本发明基于对粒细胞集落刺激因子在疾病的病理生理学中的作用的最新理解。本发明提供一种治疗巨细胞动脉炎(gca)的方法,其包括向需要治疗的受试者施用包含粒细胞
‑
巨噬细胞集落刺激因子(gm
‑
csf)拮抗剂的组合物。如本文所用,“gm
‑
csf拮抗剂”是指与gm
‑
csf或其受体(gm
‑
csfr)相互作用以减少或阻断(部分或完全)将由gm
‑
csf与其同源受体的结合引起的信号转导的抑制剂、化合物、肽、多肽、蛋白质或抗体。在一些实施方案中,gm
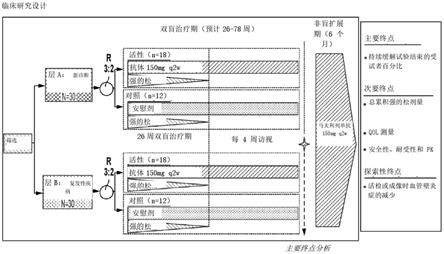
‑
csf拮抗剂是抗gm
‑
csf抗体。在一些实施方案中,gm
‑
csf拮抗剂是粒细胞
‑
巨噬细胞集落刺激因子受体α(gm
‑
csfrα)拮抗剂。gm
‑
csf受体拮抗剂是对人类gm
‑
csfrα具有特异性的抗体。抗gm
‑
csfrα抗体是人类或人源化抗体。
8.在一些实施方案中,抗gm
‑
csfrα抗体是马夫利列单抗(mavrilimumab)。马夫利列单抗和其变体的分离和特征描述于先前的申请中,例如wo2007/110631,其以引用的方式完全并入。在一些实施方案中,抗gm
‑
csfrα抗体包含由seq id no:6定义的轻链互补决定区1(lcdr1)、由seq id no:7定义的轻链互补决定区2(lcdr2)和由seq id no:8定义的轻链互补决定区3(lcdr3)以及由seq id no:3定义的重链互补决定区1(hcdr1)、由seq id no:4定
义的重链互补决定区2(hcdr2)和由seq id no:5定义的重链互补决定区3(hcdr3)。
9.在一些实施方案中,抗体是如前述专利申请中所描述的抗gm
‑
csfrα抗体的变体。在一个实施方案中,抗gm
‑
csfrα抗体包含具有与seq id no:2至少90%一致的氨基酸序列的轻链可变区和具有与seq id no:1至少90%一致的氨基酸序列的重链可变区。在一个实施方案中,轻链可变区具有示出于seq id no:2中的氨基酸序列;并且重链可变区具有示出于seq id no:1中的氨基酸序列。
10.在一个实施方案中,本发明的方法治疗年龄在50与85岁之间的患者的gca。在一个实施方案中,巨细胞动脉炎是新发性疾病。在另一实施方案中,巨细胞动脉炎是复发性疾病。在另一实施方案中,巨细胞动脉炎是难治性疾病。
11.在一些实施方案中,抗gm
‑
csfrα抗体与包括免疫调节药物,例如甲氨蝶呤或皮质类固醇及其组合的其它药物同时施用,并且任选地在用抗gm
‑
csfrα单克隆抗体治疗之后停用一种或多种此类伴随药物。在一个实施方案中,抗gm
‑
csfrα抗体疗法与皮质类固醇共施用。在一些实施方案中,皮质类固醇是强的松。在一些实施方案中,在开始抗gm
‑
csfrα单克隆抗体疗法后,受试者被施用抗gm
‑
csfrα抗体疗法以及类固醇减量,即受试者逐渐停用皮质类固醇共施用。在一些实施方案中,受试者的成功降低类固醇共施用或停用类固醇共施用是抗gm
‑
csfrα抗体疗法的功效的量度。在一些实施方案中,(1)降低或停用受试者的类固醇共施用(类固醇锥减量)和(2)在不存在一种或多种症状复发的情况下维持患者的临床稳定性的两个方面是抗gm
‑
csfrα抗体疗法的功效的量度。
12.在一些实施方案中,用抗gm
‑
csfrα抗体治疗受试者导致减轻或改善与gca相关的至少一种疾病症状,或减缓或停止其进展。在一些实施方案中,治疗导致预防与gca相关的疾病症状。与gca相关的症状包括发烧、疲劳、体重减轻、头痛、颞压痛和颌跛行;短暂性单眼视力减退(tmvl)和前部缺血性视神经病变(aion)、主动脉瘤和血管炎。在一个实施方案中,疾病的生物标志物是≥1mg/dl的血清炎症标志物crp。在一个实施方案中,疾病的生物标志物是≥30mm/小时的esr。在一个实施方案中,抗gm
‑
csfrα抗体的施用导致降低血清炎症标志物crp<1mg/dl和/或esr≤30mm/小时。在一个实施方案中,施用抗gm
‑
csfrα抗体导致降低血清炎症标志物至crp<1mg/dl和/或esr≤30mm/小时达26周或更多周。
13.在一些实施方案中,治疗导致消除与gca相关的疾病症状。在一些实施方案中,治疗减少动脉炎症和/或降低与gca病变相关的基因的表达。在一些实施方案中,降低的与gca病变相关的基因的表达导致选自以下的蛋白质和/或信使rna(mrna)的表达降低:gm
‑
csf、gm
‑
csfrα、jak2、il
‑
6、cd83、pu.1、hla
‑
dra、cd3e、tnfα、il
‑
1β或其组合。因此,在一些实施方案中,治疗降低了gm
‑
csf的表达。在一些实施方案中,治疗降低了gm
‑
csfrα的表达。在一些实施方案中,治疗降低了jak2的表达。在一些实施方案中,治疗降低了il
‑
6的表达。在一些实施方案中,治疗降低了cd83的表达。在一些实施方案中,治疗降低了pu.1的表达。在一些实施方案中,治疗降低了hla
‑
dra的表达。在一些实施方案中,治疗降低了cd3e的表达。在一些实施方案中,治疗降低了tnfα的表达。在一些实施方案中,治疗降低了il
‑
1β的表达。
14.在一些实施方案中,治疗导致浸润巨噬细胞减少或消除、血管外膜中的t细胞减少、颞动脉血管滋养管中的gm
‑
csfrα表达降低、炎症浸润的密度降低和/或血管壁重塑减少或稳定。在一些实施方案中,治疗导致动脉壁中对于gm
‑
csf或inf
‑
γ呈阳性的细胞减少。在一些实施方案中,治疗导致动脉壁中对于gm
‑
csf呈阳性的细胞减少。在一些实施方案中,治
疗导致动脉壁中对于inf
‑
γ呈阳性的细胞减少。在一些实施方案中,治疗导致动脉壁中对于gm
‑
csf和inf
‑
γ呈阳性的细胞减少。
15.在一些实施方案中,治疗使基因表达水平正常化,与未患有gca的受试者相当。在一些实施方案中,治疗使与干扰素信号传导、il
‑
6信号传导和/或gm
‑
csf信号传导相关的基因的基因表达水平正常化。在一些实施方案中,治疗使与选自以下的干扰素信号传导相关的基因的基因表达水平正常化:inf
‑
γ、inf
‑
αr1、inf
‑
γr1、inf
‑
γr2、ifi30、ifi35、prkcd、b2m、ifnar1、ciita、ptpn2、ptpn11、irf1、ifr5、irf8、gbp1、gbp5、stat1、stat2、fcγr1a/b、icam1、vcam1、tyk2、cd44、ip6k2、ddx58、ptpn6或其组合。在一些实施方案中,治疗使与选自以下的il
‑
6信号传导相关的基因的基因表达水平正常化:ptpn11、tyk2、stat1、il
‑
11ra、il
‑
6或其组合。在一些实施方案中,治疗使与选自以下的gm
‑
csf信号传导相关的基因的基因表达水平正常化:il
‑
2rb、il
‑
2rg、gm
‑
csfrα、jak3、stat5a、syk、ptpn11、hck、fyn、inpp5d、blnk、ptpn6或其组合。
16.在一些实施方案中,共施用的皮质类固醇的剂量在用gm
‑
csf拮抗剂治疗的过程中逐渐减量。在一些实施方案中,类固醇减量分散在26周的时间段内。在一些实施方案中,类固醇减量分散在52周的时间段内。在一些实施方案中,类固醇减量分散在26周与52周之间的任何时间段的时间段内。
17.在一个实施方案中,以约150mg的剂量施用包含抗gm
‑
csfrα抗体的组合物。在一些实施方案中,以约150mg的剂量施用包含抗gm
‑
csfrα抗体的组合物。在一些实施方案中,皮下施用包含抗gm
‑
csfrα抗体的组合物。在一些实施方案中,静脉内施用包含抗gc
‑
csfrα抗体的组合物。在一些实施方案中,每两周一次施用包含抗gm
‑
csfrα抗体的组合物。在一些实施方案中,每周一次施用包含抗gm
‑
csfrα抗体的组合物。在一些实施方案中,通过静脉内或皮下施用,以150mg的剂量一周一次施用马夫利列单抗。在一些实施方案中,通过静脉内或皮下施用,以150mg的剂量每两周一次施用马夫利列单抗。
18.在一些实施方案中,用于治疗gca的抗gm
‑
csfrα抗体的治疗有效剂量等于或大于0.1mg/kg、0.3mg/kg、0.5mg/kg、0.7mg/kg、1mg/kg、1.25mg/kg、1.5mg/kg、1.75mg/kg、2mg/kg、5mg/kg、7.5mg/kg或10mg/kg。
19.在一些实施方案中,通过皮下施用递送0.5
‑
2.5mg/kg的治疗有效剂量。
20.在一些实施方案中,一周一次施用治疗有效剂量。在一些实施方案中,一周两次施用治疗有效剂量。在一些实施方案中,每两周一次施用治疗有效剂量。
21.在一些实施方案中,受试者被共施用另外的治疗剂。在一些实施方案中,另外的治疗剂是皮质类固醇。在一些实施方案中,皮质类固醇是强的松。在一些实施方案中,另外的治疗剂是在26周内逐渐减量的共施用的皮质类固醇。
22.在一些实施方案中,施用包含抗gm
‑
csfrα抗体的组合物将血清炎症标志物crp降低至<1mg/dl。在一些实施方案中,施用包含抗gm
‑
csfrα抗体的组合物降低esr至≤30mm/小时。在一些实施例中,施用包含抗gm
‑
csfrα抗体的组合物导致与gca相关的症状持续缓解。在一些实施方案中,施用包含抗gm
‑
csfrα抗体的组合物导致患者实现与gca相关的症状的持续缓解持续约26周。在一些实施方案中,施用包含抗gm
‑
csfrα抗体的组合物导致患者实现与gca相关的症状的持续缓解达26周。
23.在一些实施方案中,在共施用的皮质类固醇减少的情况下持续所述缓解。在一些
实施方案中,在基本上无皮质类固醇的情况下实现持续缓解。在一些实施方案中,在无皮质类固醇的情况下实现持续缓解。
24.应当理解,如上所描述的所有实施方案均适用于本发明的所有方面。
附图说明
25.附图仅用于说明的目的,而非限制。
26.图1是示出目前由执业医师遵循的gca治疗算法的图。
27.图2是描绘使用实例1中描述的抗gm
‑
csfrα抗体(在图形图示中命名为抗体)的本文描述的gca临床研究设计的图形图示。
28.图3描绘了针对在gca患者中使用抗gm
‑
csfrα抗体(在图形图示中命名为抗体)的功效和安全性的2期、随机、双盲、安慰剂对照的多中心临床研究的设计的图形图示。
29.图4描绘了相对于来自患有巨细胞动脉炎(gca+)的受试者或未患有巨细胞动脉炎的对照受试者(对照)的所培养颞动脉活检中的管家基因的pu.1mrna的mrna表达水平。
30.图5描绘了相对于来自患有巨细胞动脉炎(gca+)的受试者或未患有巨细胞动脉炎的对照受试者(对照)的所培养颞动脉活检中的管家基因的cd83 mrna的mrna表达水平。
31.图6a和6b描绘了示出与从未患有gca的受试者获得的颞动脉相比,从患有gca的受试者的颞动脉获得的所选基因表达水平的图。数据显示,与未患有gca(空心柱)的受试者相比,gm
‑
csf
‑
和t
h
1相关基因的表达在患有gca(阴影柱)的受试者中增加。
32.图7a和7b描绘了相对于来自患有巨细胞动脉炎(gca)的受试者或未患有巨细胞动脉炎的对照受试者(对照)的所培养颞动脉活检中的管家基因的gusb的gm
‑
csf(图7a)和gm
‑
csf
‑
受体α(gm
‑
csfrα)(图7b)的mrna表达水平。图7c描绘了相对于来自患有巨细胞动脉炎(gca+)的受试者或未患有巨细胞动脉炎的对照受试者(对照)的所培养颞动脉活检中的管家基因gusb的干扰素
‑
γ的mrna表达水平。
33.图8a是显示了与未患有gca的受试者相比,用于评定马夫利列单抗对从gca患者获得的动脉的基因表达的影响的颞动脉培养模型的综合性示意图。图8b显示了从暴露于马夫利列单抗或安慰剂的患有gca的受试者的所培养颞动脉获得的数据。对于gca和对照动脉两者,将每个血管分成两个切片;一个切片用马夫利列单抗治疗,并且另一个切片用安慰剂治疗。图8b显示了用马夫利列单抗培养gca动脉导致cd83、pu.1、hla
‑
dra、cd3ε、tnfα和cxcl10的表达降低。来源于相同患者样品的数据点通过线连接。
34.图9a显示了体内用igg对照抗体或抗gm
‑
csfr
‑
gm
‑
csfrα抗体治疗的发炎的移植人类动脉中cd3
+
t细胞的免疫组织化学(ihc)染色。
35.图9b描绘了显示了通过计数每高倍视野(hpf)的cd3
+
细胞测量的t细胞浸润的密度的图。
36.图10是定量用igg对照抗体或抗gm
‑
csfrα抗体治疗的发炎动脉中的微血管数目和内膜层厚度的图。
37.图11是来自用igg对照抗体或抗gm
‑
csfrα抗体治疗的发炎动脉的基因表达热图。每行表示基因,并且每列表示小鼠。表达水平从0缩放至4。“n”指示不明显。
38.定义
39.为了使本发明更容易理解,首先在下文定义了某些术语。下述术语和其它术语的
另外定义阐述在整个说明书中。本文所引用的用于描述本发明的背景技术并提供关于其实施的附加细节的出版物和其它参考材料以引用方式并入本文。
40.氨基酸:如本文所用,术语“氨基酸”在其最广泛的意义上是指可以并入多肽链中的任何化合物和/或物质。在一些实施方案中,氨基酸具有一般结构h2n
–
c(h)(r)
–
cooh。在一些实施方案中,氨基酸是天然存在的氨基酸。在一些实施方案中,氨基酸是合成氨基酸;在一些实施方案中,氨基酸是d
‑
氨基酸;在一些实施方案中,氨基酸是l
‑
氨基酸。“标准氨基酸”是指在天然存在的肽中通常发现的二十种标准l
‑
氨基酸中的任一种。“非标准氨基酸”是指除标准氨基酸以外的任何氨基酸,无论其是合成制备的还是从天然来源获得的。如本文所用,“合成氨基酸”涵盖化学修饰的氨基酸,包括但不限于盐、氨基酸衍生物(例如酰胺)和/或取代物。包括肽中的羧基末端和/或氨基末端氨基酸的氨基酸可以通过甲基化、酰胺化、乙酰化、保护基和/或使用其它化学基团的取代来修饰,这些化学基团可以改变肽的循环半衰期,而不会不利地影响其活性。氨基酸可以参与二硫键。氨基酸可包含一种或多种翻译后修饰,其例如与一种或多种化学实体(例如,甲基基团、乙酸根基团、乙酰基基团、磷酸根基团、甲酰基部分、类异戊二烯基团、硫酸根基团、聚乙二醇部分、脂质部分、碳水化合物部分和生物素部分等)缔合。术语“氨基酸”与“氨基酸残基”可互换使用,并且可以指游离氨基酸和/或肽的氨基酸残基。无论所述术语是指游离氨基酸还是肽的残基,从使用所述术语的上下文将是显而易见的。
41.改善:如本文所用,术语“改善”意指受试者的状态的预防、减轻或缓和或状态的改善。改善包括但不要求疾病病状的完全恢复或完全预防。在一些实施方案中,改善包括增加相关疾病组织中缺乏的相关蛋白质或其活性的水平。
42.大约或约:如本文所用,当应用于一个或多个所关注值时,术语“大约”或“约”是指与所述参考值类似的值。在某些实施方案中,除非另有说明或从上下文中另外显而易见(除非此数字将超过可能值的100%),否则术语“大约”或“约”是指处于所陈述值任一方向(大于或小于)的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小的一系列值。
43.递送:如本文所用,术语“递送”涵盖局部递送和全身递送。
44.半衰期:如本文所用,术语“半衰期”是例如氨基酸或蛋白质的浓度或活性的量下降到在一个时间段开始时测量的其值的一半所需的时间。
45.改善、增加或减少:如本文所用,术语“改善”、“增加”或“减少”或语法等效物表示相对于基线测量值,例如在开始本文所描述的治疗之前同一个体的测量值,或在没有本文所描述的治疗的情况下对照受试者(或多个对照受试者),例如施用安慰剂受试者的测量值的值。“对照受试者”是患有与所治疗受试者相同形式的疾病的受试者,其年龄与所治疗受试者大约相同。
46.中和:如本文所用,中和意指中和抗体所结合的蛋白质的生物活性的减少或抑制,在这种情况下为gm
‑
csf或gm
‑
csfr,例如gm
‑
csfr与gm
‑
csfrα的结合的减少或抑制,或通过gm
‑
csfrα的信号传导的减少或抑制,例如,如通过gm
‑
csfrα介导的反应所测量。生物活性的降低或抑制可以是部分的或总的。抗体中和gm
‑
csf或gm
‑
csfr的程度被称为其中和效力。
47.患者:如本文所用,术语“患者”是指可例如出于实验目的、诊断目的、预防目的、美容目的和/或治疗目的向其施用所提供的组合物的任何生物体。典型的患者包括动物(例
如,哺乳动物,例如小鼠、大鼠、兔、非人类灵长类和/或人类)。在一些实施方案中,患者是人类。人类包括包括出生前和出生后的形态。
48.药学上可接受的:如本文所用,术语“药学上可接受的”是指在合理的医学判断范围内,适于与人类和动物的组织接触使用而无过度毒性、刺激、过敏反应或其它问题或并发症,与合理的益处/风险比相称的物质。
49.基本一致性:短语“基本一致性”在本文中用于指氨基酸序列或核酸序列之间的比较。如本领域普通技术人员将理解,如果两个序列在对应位置含有相同残基,则通常认为其是“基本一致的”。如本领域中众所周知的,可以使用多种算法中的任何一种来比较氨基酸或核酸序列,所述算法包括商业计算机程序中可用的那些算法,例如用于核苷酸序列的blas tn和用于氨基酸序列的blastp、空位blast和psi
‑
blast。此类示例性程序描述于altschul等人,basic local alignment search tool,j mal.biol.,215(3):403
‑
410,1990;altschul等人,methods in enzymology;altschul等人,nucleic acids res.25:3389
‑
3402,1997;baxevanis等人,bioinformatics:a practical guide to the analysis of genes and proteins,wiley,1998;以及misener等人(编),bioinformatics methods and protocols(methods in molecular biology,第132卷),humana press,1999中。除了标识一致的序列外,以上提到的程序通常还提供对一致性程度的指示。在一些实施方案中,如果在有关残基段上两个序列至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的对应残基是一致的,则认为这两个序列基本上一致。在一些实施方案中,有关段是完整序列。在一些实施方案中,有关段是至少10个、15个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个、90个、95个、100个、125个、150个、175个、200个、225个、250个、275个、300个、325个、350个、375个、400个、425个、450个、475个、500个或更多个残基。
50.适用于皮下递送:如本文所用,涉及本发明的药物组合物的短语“适用于皮下递送”或“用于皮下递送的制剂”通常是指此类组合物的稳定性、粘度、耐受性和溶解性,以及此类组合物将其中所含的有效量的抗体递送到递送靶点的能力。
51.受试者:如本文所用,术语“受试者”是指人类或任何非人类动物(例如,小鼠、大鼠、兔、狗、猫、牛、猪、绵羊、马或灵长类动物)。人类包括包括出生前和出生后的形态。在许多实施方案中,受试者是人类。受试者可以是患者,该患者是指向医疗提供者提出进行疾病诊断或治疗的人类。术语“受试者”在本文中可与“个体”或“患者”互换使用。受试者可以患有疾病或病症或对疾病或病症敏感,但是可以或可以不显示出疾病或病症的症状。
52.基本上:如本文所用,术语“基本上”是指表现出全部或接近全部范围或程度的目标特征或性质的定性条件。生物学领域的普通技术人员将理解,生物学和化学现象很少(如果曾经有)完成和/或继续完成或达到或避免绝对结果。因此,在本文中使用术语“基本上”来捕获许多生物学和化学现象中固有的潜在完整性缺失。
53.全身分布或递送:如本文所用,术语“全身分布”、“全身递送”或语法上的等效物是指影响整个身体或整个生物体的递送或分布机制或方法。通常,全身分布或递送经由身体的循环系统(例如,血液)完成。与“局部分布或递送”的定义形成对比。
54.靶组织:如本文所用,术语“靶组织”是指受待治疗的疾病或病症影响的任何组织。在一些实施方案中,靶组织包括展示疾病相关病理学、症状或特征的那些组织。
55.治疗有效量:如本文所用,术语治疗剂的“治疗有效量”是指当施用于患有疾病、病症和/或病状或对疾病、病症和/或病状敏感的受试者时,足以治疗、诊断、预防和/或延迟疾病、病症和/或病状的症状的发作的量。本领域的普通技术人员将认识到,通常通过包含至少一个单位剂量的给药方案来施用治疗有效量。
56.治疗:如本文所用,术语“治疗”是指用于使特定疾病、病症和/或病状的一种或多种症状或特征部分或完全缓解、改善、减轻,抑制、预防、延迟其发作,降低其严重性和/或降低其发病率的任何方法。为了降低发展与疾病关联的病理的风险,可以向未表现出疾病体征和/或仅表现出疾病早期体征的受试者施用治疗。
具体实施方式
57.本发明尤其提供了用于治疗巨细胞动脉炎(gca)的方法。所述方法包括相对于对照,在足以改善、稳定或减少gca的一种或多种症状的治疗期内,以治疗有效剂量和一定的施用间隔向需要治疗的受试者施用gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα或抗gm
‑
csf抗体)的步骤。如在此施用的情形下使用的对照是在施用抗体之前的时间的症状状态。
58.在以下部分中详细描述了本发明的各个方面。部分的使用并不意在限制本发明。每个部分可以适用于本发明的任何方面。在本技术中,除非另有说明,否则“或”的使用意指“和/或”。
59.巨细胞动脉炎
60.巨细胞动脉炎(gca)是一种针对维持生命的组织,特别是血管的自身炎症/自体免疫疾病。由t细胞和巨噬细胞驱动的异常免疫反应导致血管壁的破坏并且诱导不适应的修复机制,所述不适应的修复机制最终引起血管闭塞和器官缺血。病理表现发生在主动脉及其第2至第5分支中,包括供应视神经的血管。gca的特征在于血管炎症和单核细胞、巨噬细胞的浸润以及聚集成巨细胞,所述巨细胞中是巨噬细胞的多核融合体。其是一种大中型动脉的炎性疾病,其引起头痛、缺血性视力丧失和颌骨和其它肌肉核动(dejaco c等人,nat rev rheumatol.2017,13(10):578
‑
592)。如果不治疗,gca可导致单眼或双眼失明、主动脉瘤、心肌梗塞,并且很少地导致中风和死亡(weyand cm和gorenzy jj.,n engl j med.2014,371(1):50
‑
7)。gca呈现广泛且可变范围的体征和症状(weyand和goronzy,2014)。早期临床体征和症状包括新发作的头痛、突然发作的视觉障碍、颌跛行、发热、疲劳、体重减轻、短暂的单眼视力丧失(tmvl)和前缺血性视神经病变(aion)。通常基于临床体征和症状暂时进行诊断,然后通过彩色多普勒超声(cdus)或通过颞动脉活检(tab)确认(dejaco c等人ann rheum dis.2018年1月22日数字对象识别码:10.1136/annrheumdis
‑
2017
‑
212649)。在美国(us),开发gca的终生风险在女性中估计为大约百分之一并且在男性中估计为0.5%(crowson cs等人,arthritis rheum.2011年3月,63(3):633
‑
9)。gca一般影响50岁以上的成人,其中女性与男性的不平衡为3:1(weyand和goronzy,2014)。在50岁以上的群体中,所报道的已证实的gca的发病率在地理上显著不同,并且在欧盟(eu)中为每100,000名个体中24
‑
200人并且在us为每100,000名个体中24
‑
278人(salvarani c等人arthritis rheum 2004,51:264
‑
8;lawrence rc等人arthritis rheum.2008,58:26
‑
35;lee ji等人clinic rev allergy immunol 2008,35:88
‑
95)。
61.当前治疗模式包括在诊断患者的gca后施用类固醇。图1示出了当前的gca治疗算
法,医生对呈现不复杂疾病情况的患者遵循所述算法(图1的左侧),以及当患者呈现晚期症状,例如视力丧失时遵循的算法(图1的右侧)。糖皮质激素是治疗的主要部分,因为其使炎症标志物正常化。一般来说,在大多数患者中注意到对类固醇疗法的较高反应,在治疗的前几天内改善明显。然而,许多患者接受这种疗法的长疗程以防止疾病发作,并且长期使用与显著且严重的副作用相关,所述副作用包括青光眼、体液保留、高血压、情绪变化、记忆变化、其它心理影响、体重增加和糖尿病(roberts j和clifford a,ther adv chronic dis.2017年4月,8(4
‑
5):69
‑
7)。显著比例(~50%)的患者遭遇疾病复发或更多的慢性疾病,并且需要高剂量强的松持续数年来控制症状。虽然对一些患者有效,但很多时候患者由于随着剂量降低而继续经历疾病发作而无法停用皮质类固醇(dejaco等人,2017;salvarani等人,2012)(deng等人,circulation.2010年2月23日;121(7):906
–
915)。在随访106名在4.5至10.1年内患有gcs的患者中的一个研究组中,68名患者(64%)在皮质类固醇停用期间或之后经历了至少一次复发,并且38名患者(36%)经历了两次或更多次复发(alba ma等人medicine(baltimore).2014;93(5):194
‑
201)。研究表明,尽管进行了长期高剂量类固醇质量,仍有一部分患者继续出现视觉症状。根据另一项研究,在活检前未接受皮质类固醇的患者中,31%(89/286)的患者的颞动脉活检结果呈阳性,而在活检前接受皮质类固醇的患者中,35%(86/249)的患者的颞动脉活检结果呈阳性(p=0.4;差异的95%置信区间,
‑
4.7%至11.5%)(achkar等人ann intern med.1994年6月15日;120(12):987
‑
92)。这些数据表明类固醇不影响所有患者的潜在疾病过程。
62.疾病的病因学在很长一段时间内未得到充分了解,主要是因为缺乏关于血管壁损伤机制的信息。然而,致病事件的线索可能源自对组织浸润细胞的功能的了解。gca中的动脉损伤与肉芽肿的形成有关,所述肉芽肿主要由活化的巨噬细胞、浸润的t细胞构成,使得血管病变被发现是t细胞依赖性的。在scid小鼠中的实验证据表明,糖皮质激素治疗抑制t细胞介导的病理学,但不足以抑制组织浸润巨噬细胞功能。巨噬细胞构成通过gm
‑
csf信号传导产生和维持的关键细胞类型,并且因此可以解释为什么许多患者需要长期慢性治疗并且无法停用皮质类固醇(brack a等人j clin invest.1997,99(12):2842
‑
50)。在受体处阻断gm
‑
csf信号传导可通过减少由慢性血管炎症引起的长期后遗症和减少类固醇依赖性来为这些患者提供额外益处。(托珠单抗(tocilizumab))(一种白介素
‑
6受体抑制剂)最近在us和欧洲获得了gca与皮质类固醇减量一起使用的上市批准;然而,在26周皮质类固醇减量后,略低于50%的患者在52周内未能实现对托珠单抗的持续缓解(stone jh等人n engl j med.2017;377(15):1494
‑
1495)。因此,对于用于治疗患有gca的患者的改进的治疗选项,仍然存在未满足的需求。
63.gm
‑
csf生物学
64.gm
‑
csf是i型促炎性细胞因子,其增强广泛范围的造血细胞类型的存活和增殖。其是一种生长因子,首先被鉴定为髓样细胞(例如嗜中性粒细胞、嗜碱性粒细胞、嗜酸细胞、单核细胞和巨噬细胞)(wicks ip和roberts aw.nat rev rheumatol.2016,12(1):37
‑
48)。使用不同方法的研究证实,随着gm
‑
csf过表达,病理变化几乎总是随之而来(hamilton ja等人,growth factors.2004,22(4):225
‑
31)。gm
‑
csf通过血管的活化内皮增强髓样细胞的运输,并且还可以在炎症期间促成血管中的单核细胞和巨噬细胞累积。gm
‑
csf还促进炎症组织中的单核细胞和巨噬细胞以及常驻组织巨噬细胞的活化、分化、存活和增殖。其通过促进
浸润性单核细胞分化为m1巨噬细胞和单核细胞衍生的树突状细胞(modc)来调节炎症组织中的抗原呈递细胞的表型。此外,通过巨噬细胞和modc结合其它细胞因子(例如il
‑
6和il
‑
1)产生il
‑
23调节了t细胞分化。
65.与m
‑
csf(巨噬细胞集落刺激因子)一起,gm
‑
csf调节巨噬细胞的数量和功能,所述巨噬细胞转变成组织细胞和多核巨细胞的,其是gca的血管病变中的关键效应细胞。由gm
‑
csf活化的巨噬细胞获得一系列效应子功能,所有这些效应子功能都将其鉴定为炎性巨噬细胞。gm
‑
csf活化的巨噬细胞产生促炎性细胞因子,包括tnf、il
‑
1β、il
‑
6、il
‑
23和il
‑
12以及趋化因子,例如ccl5、ccl22和ccl24,其将t细胞和其它炎性细胞募集到组织微环境中。这些发现为在gca中拮抗此信号传导途径提供了坚实的原理。
66.gm
‑
csf受体是造血素受体超家族的成员。其为异源二聚体,由α和β亚基组成。α亚基对gm
‑
csf具有高度特异性,而β亚基与其它细胞因子受体,包括il
‑
3和il
‑
5共享。这反映在β受体亚基的更广泛组织分布中。α亚基gm
‑
csfrα主要表达于髓样细胞和非造血细胞,例如嗜中性粒细胞、巨噬细胞、嗜酸细胞、树突状细胞、内皮细胞和呼吸上皮细胞上。全长gm
‑
csfrα是属于i型细胞因子受体家族的400个氨基酸i型膜糖蛋白,并且由22个氨基酸信号肽(位置1
‑
22)、298个氨基酸胞外结构域(位置23
‑
320)、来自位置321
‑
345的跨膜结构域和短55个氨基酸细胞内结构域组成。裂解信号肽以提供作为378个氨基酸蛋白的gm
‑
csfrα的成熟形式。人类和鼠类gm
‑
csfr的互补dna(cdna)克隆α是可用的,并且在蛋白质水平上,受体亚基具有36%一致性。gm
‑
csf能够以相对较低的亲和力与α单独的亚基(kd 1
‑
5nm)结合,但不是所有都与单独的亚基结合。然而,α和亚基的产生高亲和力配体
‑
受体复合物(kd~100pm)。gm
‑
csf信号传导通过其与gm
‑
csfrα链的初始结合发生,并且随后与较大亚基交联共同链以产生高亲和力相互作用,所述高亲和力相互作用使jak
‑
stat途径磷酸化。这种相互作用还能够通过酪氨酸磷酸化和map激酶途径的活化进行信号传导。
67.在病理上,已显示gm
‑
csf在加剧炎症、呼吸和自身免疫疾病中起作用。因此,使gm
‑
csf结合于gm
‑
csfrα是治疗通过gm
‑
csfr介导的疾病和病症的治疗方法。因此,本发明涉及抑制人类gm
‑
csf与gm
‑
csfrα的结合,和/或抑制由gm
‑
csf配体与受体结合产生的信号传导的结合成员,例如结合人类gm
‑
csf或gm
‑
csfrα的结合成员(例如,抗体)。在配体结合时,gm
‑
csfr触发多个下游信号传导途径的刺激,包括jak2/stat5、mapk途径和pi3k途径;所有这些都与髓样细胞的活化和分化有关。结合成员可以是通过gm
‑
csfr的gm
‑
csf信号传导的可逆抑制剂。
68.处理
69.本发明的一个方面提供了针对gca的治疗方法,所述治疗方法通过以有效剂量间隔向有需要的受试者施用有效剂量的gm
‑
csf拮抗剂(例如,gm
‑
csfrα拮抗剂)持续有效时间段。在一些实施方案中,gm
‑
csf拮抗剂是治疗性抗gm
‑
csf单克隆抗体。抗gm
‑
csf单克隆抗体描述于05
‑
17
‑
2006提交的国际申请pct/ep2006/004696(其公开为wo2006/122797)及于国际申请pct/ep2016/076225(其公开为wo2017/076804)中,其在此以引用的方式整体并入。在一些实施方案中,gm
‑
csfrα拮抗剂是抗gm
‑
csfrα单克隆抗体。抗gm
‑
csfrα单克隆抗体描述于03
‑
27
‑
2007提交的国际申请pct/gb2007/001108(其公开为wo2007/110631)、10
‑
10
‑
2010提交的ep申请120770487、03
‑
27
‑
2007提交的美国申请11/692,008、09
‑
25
‑
2008提交的美国申请12/294,616、07
‑
12
‑
2013提交的美国申请13/941,409、11/30/2010提交的美国申
请14/753,792、10
‑
10
‑
2012提交的国际申请pct/ep2012/070074(其公开为wo/2013/053767)、05
‑
18
‑
2015提交的国际申请pct/ep2015/060902(其公开为wo2015/177097)、以及05
‑
23
‑
2017提交的国际申请pct/ep2017/062479中,其均以全文引用的方式并入本文中。在一些实施方案中,抗gm
‑
csfrα单克隆抗体是马夫利列单抗。wo2007/110631报道了抗gm
‑
csfrα抗体马夫利列单抗及其变体的分离和表征,其共享以高效力中和gm
‑
csfrα的生物活性的能力。这些抗体的功能特性被认为至少部分地可归因于人类gm
‑
csfrα的位置226至230处的tyr
‑
leu
‑
asp
‑
phe
‑
gln基序的结合,从而抑制gm
‑
csfrα与其配体gm
‑
csf之间的缔合。马夫利列单抗是一种人类igg4单克隆抗体,其被设计成通过靶向gm
‑
csfrα来调节巨噬细胞活化、分化和存活。其是gm
‑
csfrα的生物活性的强效中和剂,并且被证实通过结合gm
‑
csfrα对ra患者的滑膜关节内的白细胞发挥治疗效果,从而使得细胞存活和活化减少。迄今为止,已在针对类风湿性关节炎(ra)的ii期临床试验中确立了用于体内使用的gm
‑
csfrα抗体马夫利列单抗的安全性特性。
70.gca患者可以分为两类:患有新发性疾病的患者和患有复发性疾病的患者。在第一类别中,gca的初始诊断在治疗开始后6周内进行。诊断可以通过westergren红细胞沉降率(esr)进行,其中esr>30mm/小时;或血清c
‑
反应蛋白(crp)水平为≥1mg/dl。其它症状可包括gca的颅症状(新发作的局部头痛、头皮或颞动脉触痛、缺血相关的视力丧失或以其它方式无法解释的在咀嚼时的口腔或下颚疼痛、颌跛行或四肢跛行、pmr的症状(定义为与炎性早晨僵相关的肩部和/或腰带疼痛)。可以通过tab或超声波执行更肯定的诊断。另外,通过血管造影或横截面成像研究(例如主动脉或其它大血管的mri,ct/cta或pet
‑
ct)发现了大血管血管炎的证据。复发组的特征在于在距治疗开始超过6周(>6周)的时间点诊断gca。根据临床预期,患者可表征为自疾病诊断以来没有缓解(难治性非缓解)。复发类别患者的子集在治疗开始时可能经历或没有表现出gca的症状(在第一个小时内crp<1.0或esr<20mm的gca症状的缓解)。
71.在一个实施方案中,根据本发明的方法包括通过施用治疗有效量的gm
‑
csf拮抗剂,例如抗gm
‑
csfrα单克隆抗体(例如,马夫利列单抗)或抗gm
‑
csf单克隆抗体(例如,纳米鲁单抗(namilumab)、奥替利单抗(otilimab)瑾司鲁单抗(gimsilumab)、伦齐鲁单抗(lenzilumab)或tjm
‑
2)来治疗患有新发作病gca的受试者。在一个实施例中,根据本发明的方法包括通过施用治疗有效量的gm
‑
csf拮抗剂,例如抗gm
‑
csfrα单克隆抗体(例如,马夫利列单抗)或抗gm
‑
csf单克隆抗体(例如,纳米鲁单抗、奥替利单抗、瑾司鲁单抗、伦齐鲁单抗或tjm
‑
2)来治疗患有复发性gca的受试者。在一个实施方案中,根据本发明的方法包括通过施用治疗有效量的gm
‑
csf拮抗剂,例如抗gm
‑
csfrα单克隆抗体(例如,马夫利列单抗)或抗gm
‑
csf单克隆抗体(例如,纳米鲁单抗、奥替利单抗、瑾司鲁单抗、伦齐鲁单抗或tjm
‑
2)来治疗患有复发性gca的受试者。根据本发明的方法包括相对于对照在足以改善、稳定或减少gca的一种或多种体征和/或症状的治疗期内,以一定的剂量间隔用有效剂量的马夫利列单抗治疗受试者。如本文使用的,术语“治疗(treat)”或“治疗(treatment)”是指改善与疾病或病症相关的一种或多种体征和/或症状,预防或延迟疾病或病症的一种或多种体征和/或症状的发作或进展,和/或减轻疾病或病症的一种或多种体征和/或症状的严重程度或频率。
72.在某些实施方案中,施用治疗有效量的gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα单克隆抗
体或抗gm
‑
csf单克隆抗体)也可与其它药物同时治疗,包括免疫调节药物,例如甲氨蝶呤或皮质类固醇和其组合、皮质类固醇和其组合,并且任选地在用gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα单克隆抗体或抗gm
‑
csf单克隆抗体)治疗后停用一种或多种此类伴随药物。在一些实施方案中,在开始gm
‑
csf拮抗剂疗法(例如,抗gm
‑
csfrα单克隆抗体疗法或抗gm
‑
csf单克隆抗体疗法)后,使受试者逐渐停用皮质类固醇。在一个实施方案中,皮质类固醇是强的松。在另一实施方案中,皮质类固醇是甲基强的松龙。
73.gm
‑
csf拮抗剂治疗(例如,抗gm
‑
csfrα治疗或抗gm
‑
csf治疗)可通过注射(例如,皮下、静脉内、动脉内、关节内、腹膜内或肌内)、通过吸入、通过囊内途径(滴注至膀胱内)或局部(例如眼内、鼻内、直肠、伤口、皮肤上)给予。治疗可通过脉冲输注施用,尤其是在抑制剂剂量减少的情况下。施用途径可通过治疗的物理化学特征、通过疾病的特殊考虑或通过对优化功效或最小化副作用的要求来确定。在一些实施方案中,抗gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα单克隆抗体或抗gm
‑
csf单克隆抗体)的皮下注射可以在上臂、大腿的前表面、腹部的下部、上背部或臀部的上部区域中执行。在一些实施方案中,旋转注射部位。
74.在某些实施方案中,治疗导致减少或消除与gca相关的症状。在一些实施方案中,治疗减少动脉炎症和/或降低与gca病变相关的基因的表达。因此,在某些实施方案中,治疗导致gm
‑
csf、gm
‑
csfrα、jak2、il
‑
6、cd83、pu.1、hla
‑
dra、cd3e、tnfα、il
‑
1或其组合中的一种或多种的蛋白质和/或rna表达。在一些实施方案中,治疗导致减少或消除浸润巨噬细胞。在另一实施方案中,治疗减少血管外膜中的t细胞。在一个实施方案中,治疗导致降低颞动脉血管滋养管中的gm
‑
csfrα表达。在一些实施方案中,炎症浸润的密度被抑制和/或血管壁重塑(例如,内膜增生、管腔狭窄和组织缺血)被消退、改善、稳定或减少。在一个实施方案中,治疗导致动脉壁中对于gm
‑
csf或inf
‑
γ呈阳性的细胞减少。在其它实施方案中,治疗使与干扰素信号传导、il
‑
6信号传导或gm
‑
csf信号传导相关的一种或多种基因的基因表达水平,或改善其基因表达水平(即,患有gca的受试者与未患有gca的受试者之间的表达水平)正常化。与干扰素信号传导相关的基因包括但不限于inf
‑
γ、inf
‑
αr1、inf
‑
γr1、inf
‑
γr2、ifi30、ifi35、prkcd、b2m、ifnar1、ciita、ptpn2、ptpn11、irf1、ifr5、irf8、gbp1、gbp5、stat1、stat2、fcγr1a/b、icam1、vcam1、tyk2、cd44、ip6k2、ddx58和ptpn6。与il
‑
6信号传导相关的基因包括但不限于ptpn11、tyk2、stat1、il
‑
11ra和il
‑
6。与gm
‑
csf信号传导相关的基因包括但不限于il
‑
2rb、il
‑
2rg、gm
‑
csfrα、jak3、stat5a、syk、ptpn11、hck、fyn、inpp5d、blnk和ptpn6。
75.剂量
76.用于治疗gca的gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体或抗gm
‑
csf单克隆抗体)的治疗有效剂量可以各种剂量出现。在一些实施方案中,治疗有效剂量等于或大于0.1mg/kg、0.3mg/kg、0.5mg/kg、0.7mg/kg、1mg/kg、1.25mg/kg、1.5mg/kg、1.75mg/kg、2mg/kg、2.5mg/kg、3.5mg/kg、4mg/kg或5mg/kg或10mg/kg。
77.在一些实施方案中,治疗有效剂量为大约0.1
‑
10mg/kg、大约0.2
‑
10mg/kg、大约0.3
‑
10mg/kg、大约0.4
‑
10mg/kg、大约0.5
‑
10mg/kg、大约0.6
‑
10mg/kg、大约0.7
‑
10mg/kg、大约0.8
‑
10mg/kg、大约0.9
‑
10mg/kg、大约1
‑
10mg/kg、大约2
‑
10mg/kg、大约3
‑
10mg/kg、大约5
‑
10mg/kg,或其间的任何范围。在一些实施方案中,大约0.3
‑
5mg/kg、或大约0.3
‑
4mg/kg、或大约0.3
‑
3mg/kg。在一些实施方案中,治疗有效剂量是大约0.5
‑
2.5mg/kg。
78.在一些实施方案中,施用包括初始推注或负荷剂量,然后是至少一种维持剂量。在一些实施方案中,初始推注或负荷剂量大于至少一种维持剂量。在一些实施方案中,初始推注或负荷剂量的剂量比至少一种维持剂量的剂量大至少一倍、两倍、三倍、四倍或五倍。在一些实施方案中,初始推注或负荷剂量的剂量比至少一种维持剂量的剂量大两倍。
79.在一些实施方案中,固定剂量用作初始冲击剂量或负荷剂量和/或维持剂量。合适的固定剂量可以等于或大于约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约155mg、约160mg、约165mg、约170mg、约175mg、约180mg、约185mg、约190mg、约195mg、约200mg、约210mg、约220mg、约225mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg或约400mg。在某些实施方案中,用作初始剂量和/或维持剂量的固定剂量为30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、145mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、210mg、220mg、225mg、230mg、240mg、250mg、260mg、270mg、280mg、290mg、300mg、310mg、320mg、330mg、340mg、350mg、360mg、370mg、380mg、390mg或400mg。在一些实施方案中,合适的固定剂量范围介于50
‑
500mg、100
‑
400mg、150
‑
400mg、200
‑
400mg、250
‑
400mg、300
‑
350mg、320
‑
400mg或350
‑
400mg。在一些实施方案中,合适的维持剂量是150mg。在一些实施方案中,在单个注射器中提供合适的固定剂量。合适的固定剂量可以单次注射或多次注射施用(例如,皮下或静脉内)。
80.在一些实施方案中,用有效剂量的gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体或抗gm
‑
csf单克隆抗体)进行的治疗伴随皮质类固醇治疗。在用gm
‑
csf拮抗剂疗法(例如,抗gm
‑
csfrα抗体疗法或抗gm
‑
csf单克隆抗体疗法)治疗之前,患者可能服用皮质类固醇。伴随的类固醇剂量可包含约25mg、或约30mg、或约40mg、或约50mg、或约60mg、或约70mg、或约80mg、或约100mg、或约110mg、或约120mg、或约125mg强的松。在一些实施方案中,伴随剂量为25mg、或30mg、或40mg、或50mg、或60mg、或70mg、或80mg、或100mg、或110mg、或120mg、或125mg强的松。
81.施用间隔
82.在治疗gca时gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体或抗gm
‑
csf单克隆抗体)的施用间隔可在不同的持续时间发生。在本发明的一些实施方案中,施用间隔是每天。在一些实施方案中,施用间隔是每隔一天。在一些实施方案中,施用间隔是一周多次。在一些实施方案中,施用间隔是每周一次。在一些实施方案中,施用间隔是每两周一次。在一些实施方案中,施用间隔是每三周一次。在一些实施方案中,施用间隔是每四周一次。在一些实施方案中,施用间隔是每五周一次。
83.治疗期
84.gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体或抗gm
‑
csf单克隆抗体)对gca的治疗期可在持续时间方面不同。在一些实施方案中,治疗期是至少一个月。在一些实施方案中,治疗期是至少两个月。在一些实施方案中,治疗期是至少三个月。在一些实施方案中,治疗期是至少六个月。在一些实施方案中,治疗期是至少九个月。在一些实施方案中,治疗期是至少
一年。在一些实施方案中,治疗期是约20周。在一些实施方案中,治疗期是约21周、或约22周、或约23周、或约24周、或约25周、或约26周、或约27周、约28周、或约29周、或约30周、或约31周、或约32周、或约33周、或约34周、或约35周、或约36周、或约37周、或约38周、或约39周、或约40周、或约41周、或约42周、或约43周、或约44周、或约45周、或约46周、或约47周、或约48周、或约49周、或约50周、或约51周、或约52周。在一些实施方案中,治疗期是约26周。在一个实施方案中,治疗期是26周。在一个实施方案中,治疗期是52周。在一些实施方案中,治疗期是21周、或22周、或23周、或24周、或25周、26周、27周、28周、29周或30周、或31周、或32周、或33周、或34周、或35周、36周、37周、38周、39周、或40周、或41周、或42周、或43周、或44周、或45周、46周、47周、48周、49周、或50周、或51周、或52周。在一个实施方案中,治疗期是26周。在一个实施方案中,治疗期是52周。在一些实施方案中,治疗期是至少两年。在一些实施方案中,治疗期在受试者的整个生命中持续。
85.药代动力学和药效动力学
86.患有特应性皮炎的受试者的血清中抗gm
‑
csfrα抗体浓度
‑
时间曲线的评估可直接通过测量全身性血清抗gm
‑
csfrα抗体浓度
‑
时间曲线进行评估。通常,通过定期对所治疗受试者的血液进行采样来评估抗gm
‑
csfrα抗体药代动力学和药效动力学曲线。以下标准缩写用于表示相关的药代动力学参数。
87.c
max
最大浓度
88.t
max
达到最大浓度的时间
89.auc0‑
t
从零时间到最后可测量浓度的浓度
‑
时间曲线下面积(auc),使用用于渐升浓度的线性梯形法则和用于渐降浓度的对数法则来计算
90.auc0‑
∞
从时间零到无穷大的auc,使用以下公式计算:
[0091][0092]
其中c
t
是最后可测量浓度,而λ
z
是表观终末消除速率常数,其中
[0093]
λ
z
表观终末消除速率常数,其中λ
z
是终末阶段对数浓度相对于时间曲线的线性回归斜率的量级
[0094]
t
1/2
表观终末消除半衰期(只要有可能),其中
[0095]
t
1/2
=自然对数(ln)(2)/λ
z
[0096]
cl清除率
[0097]
vd分布体积(仅iv剂量)
[0098]
vd/f表观分布体积(仅sc剂量)
[0099]
通常,在pk分析中使用相对于开始抗gm
‑
csfrα抗体施用的实际血液样品收集时间。举例来说,通常在抗gm
‑
csfrα抗体施用前的15或30分钟内(施用前基线或时间0)并在施用后的第1个小时、第4个小时、第8个小时或第12个小时或第1天(24小时)、第2天、第3天、第4天、第5天、第6天、第7天、第10天、第14天、第17天、第21天、第24天、第28天、第31天、第38天、第45天、第52天、第60天、第70天或第90天收集血液样品。
[0100]
可使用多种方法来测量血清中的抗gm
‑
csfrα抗体浓度。作为非限制性实例,使用酶联免疫吸附测定(elisa)方法。
[0101]
可以在治疗期间的任何阶段,例如在第1天、第2天、第3天、第4天、第5天、第6天、第
1周、第2周、第3周、第4周、第5周、第6周、第7周、第8周、第9周、第10周、第11周、第12周、第13周、第14周、第15周、第16周、第17周、第18周、第19周、第20周、第21周、第22周、第23周、第24周或以后评估药代动力学参数。在一些实施方案中,可以在治疗期间的第1个月、第2个月、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第10个月、第11个月、第12个月、第13个月、第14个月、第15个月、第16个月、第17个月、第18个月、第19个月、第20个月、第21个月、第22个月、第23个月、第24个月或以后评价药代动力学参数。
[0102]
不良反应
[0103]
马夫利列单抗(cam
‑
3001)完成了针对类风湿性关节炎(ra)的ii期临床试验,并且进行了长期安全性研究,这报道于10
‑
10
‑
2012提交的国际申请pct/ep2012/070074(wo 2013/053767)和pct/ep2015/060902(wo2015177097)中,两者均以引用的方式并入本文中。在这两种情况下,药物的耐受性良好。
[0104]
在一些实施方案中,以高达150mg的剂量施用gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体或抗gm
‑
csf抗体抗体)以至多约150周的延伸,在受试者中没有产生严重不利影响。在一些实施方案中,以高达150mg的剂量施用gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体或抗gm
‑
csf抗体抗体)持续至多52周不会导致严重感染或无生严重感染。在一些实施方案中,施用gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体或抗gm
‑
csf单克隆抗体)不会导致不良的肺功能或血液功能。基于来自临床试验的数据,类似百分比的肺ae发生在活性和安慰剂组上。不存在肺泡蛋白病(pap)或提示pap的病例。报道了两例肺炎病例:(i)在安慰剂组中,呈现伴有胸腔积液的非严重感染,和(ii)在30mg剂量组中,呈现严重感染。不存在其它严重感染。由于胆石症但无其它临床上有意义的实验室异常,在一例病例中,alt>3x uln且bili>2x uln。未报道过敏反应。观察到两种导致停药的超敏ae(药物超敏30mg和血管性水肿150mg)。
[0105]
gm
‑
csf拮抗剂
[0106]
任何gm
‑
csf拮抗剂都可用于实践本发明。gm
‑
csf拮抗剂可通过阻断gm
‑
csf与gm
‑
csf受体α或gm
‑
csf受体β的相互作用,或通过阻断这些蛋白质的异源二聚体的形成来起作用,并且因此阻止gm
‑
csf结合和/或信号传导,从而减少细胞因子的产生和/或单核细胞和巨噬细胞的活化。因此,根据本发明的gm
‑
csf拮抗剂可以是gm
‑
csf或一个或多个gm
‑
csfr受体(即,gm
‑
csfrα或gm
‑
csfrβ)的结合剂(例如,抗体或化合物),或能够以影响gm
‑
csf生物活性的方式干扰这些相互作用的试剂。在本文中,提及gm
‑
csf拮抗剂可以视为意指gm
‑
csf或其受体中的一种的拮抗剂。
[0107]
抗gm
‑
csf抗体
[0108]
在一些实施方案中,本发明提供的发明性组合物和方法用于将抗gm
‑
csf抗体或其片段递送到需要的受试者。施用这些方法的抗gm
‑
csf抗体可以是igg亚类抗体,在一些实施方案中是igg1、igg2或igg4亚类抗体。抗gm
‑
csf抗体可以是单克隆抗体。在本发明的某些实施方案中,抗gm
‑
csf抗体是马夫利列单抗。在一些实施方案中,抗gm
‑
csf抗体是奥替利单抗。在一些实施方案中,抗gm
‑
csf抗体是瑾司鲁单抗。在一些实施方案中,抗gm
‑
csf抗体是伦齐鲁单抗。在一些实施方案中,抗gm
‑
csf抗体是tjm
‑
2。
[0109]
抗gm
‑
csf受体α(gm
‑
csfrα)抗体
[0110]
在一些实施方案中,本发明提供的发明性组合物和方法用于将抗gm
‑
csfrα抗体递送到需要的受试者。在本发明的某些实施方案中,抗gm
‑
csfrα抗体是马夫利列单抗。马夫利
列单抗的分离和表征描述于wo2007/110631和wo2013/053767中,两者均以全文引用的方式完全并入。马夫利列单抗是特异性抑制gm
‑
csfrα介导的信号传导,即gm
‑
csf活化的细胞信号传导的人类igg4单克隆抗体。在某些实施方案中,抗体由两条轻链和两条重链构成。重链可变结构域(vh)包含seq id no:1中标示的氨基酸序列。重链可变结构域(vl)包含seq id no:2中标示的氨基酸序列。重链和轻链各自包括以下布置中的互补决定区(cdr)和构架区:
[0111]
fr1
‑
cdr1
‑
fr2
‑
cdr2
‑
fr3
‑
cdr3
‑
fr4
[0112]
马夫利列单抗抗体重链包含cdr:hcdr1、hcdr2、hcdr3,如分别由seq id no:3、4和5中的氨基酸序列所鉴定。轻链包含cdr:lcdr1、lcdr2、lcdr3,如分别由seq id no:6、7和8中的氨基酸序列所鉴定。
[0113]
抗gm
‑
csfrα重链可变结构域氨基酸序列
[0114]
qvqlvqsgaevkkpgasvkvsckvsgytltelsihwvrqapgkglewm
[0115]
ggfdpeeneivyaqrfqgrvtmtedtstdtaymelsslrsedtavyycaivgsfspltlglwgqgtmvtvss(seq id no:1)
[0116]
抗gm
‑
csfrα轻链可变结构域氨基酸序列
[0117]
qsvltqppsvsgapgqrvtisctgsgsnigapydvswyqqlpgtapklliyhnnkrpsgvpdrfsgsksgtsaslaitglqaedeadyycatveaglsgsvfgggtkltvl(seq id no:2)
[0118]
抗gm
‑
csfra重链可变结构域cdr1(hcdr1)氨基酸序列
[0119]
elsih(seq id no:3)
[0120]
抗gm
‑
csfrα重链可变结构域cdr2(hcdr2)氨基酸序列
[0121]
gfdpeeneivyaqrfqg(seq id no:4)
[0122]
抗gm
‑
csfrα重链可变结构域cdr3(hcdr3)氨基酸序列
[0123]
vgsfspltlgl(seq id no:5)
[0124]
抗gm
‑
csfrα重链可变结构域cdr 1(lcdr1)氨基酸序列
[0125]
tgsgsnigapydvs(seq id no:6)
[0126]
抗gm
‑
csfrα轻链可变结构域cdr 2(lcdr2)氨基酸序列
[0127]
hnnkrps(seq id no:7)
[0128]
抗gm
‑
csfra轻链可变结构域cdr3(lcdr3)氨基酸序列
[0129]
atveaglsgsv(seq id no:8)
[0130]
在一些实施方案中,用于gca治疗的抗gm
‑
csfrα抗体是马夫利列单抗的变体,其选自申请αwo2007/11063和wo2013053767中所公开的gm
‑
csf结合成员,所述申请以全文引用的方式并入。
[0131]
在一些实施方案中,用于gca治疗的抗gm
‑
csfrα抗体包含与以下序列中的一个或多个具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多一致性的cdr氨基酸序列:seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7和seq id no:8。
[0132]
在一些实施方案中,抗gm
‑
csfrα抗体包含具有与seq id no:2至少90%一致的氨基酸序列的轻链可变结构域和具有与seq id no:1至少90%一致的氨基酸序列的重链可变结构域。在本发明的一些实施方案中,抗gm
‑
csfrα抗体具有与seq id no:2具有至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、
98%、99%或更多一致性的轻链可变结构域氨基酸序列和与seq id no:1具有至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多一致性的重链可变结构域氨基酸序列。在本发明的一些实施方案中,抗gm
‑
csfrα抗体包含具有示出于seq id no:2中的氨基酸序列的轻链可变结构域和具有示出于seq id no:1中的氨基酸序列的重链可变结构域。在本发明的一些实施方案中,抗gm
‑
csfrα抗体的重链恒定区包含衍生自igg4抗体的ch1、铰链和ch2结构域,这些结构域融合到衍生自igg1抗体的ch3结构域。在本发明的一些实施方案中,抗gm
‑
csfrα抗体的重链恒定区是以下或衍生自以下:igg1、igg2或igg4重链恒定区。在本发明的一些实施方案中,抗gm
‑
csfrα体的轻链恒定区是以下或衍生自以下:λ或κ轻链恒定区。
[0133]
在一些实施方案中,抗gm
‑
csfrα抑制剂是马夫利列单抗抗体的片段。在一些实施方案中,抑制剂包含单链可变片段(scfv),其包含seq id no:3、4、5、6、7或8的cdr序列中的至少任一个。在一些实施方案中,抑制剂是融合分子,其包含seq id no:3、4、5、6、7或8的cdr序列中的至少任一个。在一些实施方案中,抗gm
‑
csfrα抑制剂序列是双特异性抗体,其包含seq id no:3、4、5、6、7或8的cdr序列中的至少一个。
[0134]
药物组合物
[0135]
在一个方面,本发明提供一种药物组合物,其包含抗gm
‑
csf抗体(例如,抗gm
‑
csfrα抗体)的药物组合物,所述药物组合物是预期用于sc施用的液体产品。在一些实施方案中,是储存在2℃至8℃(36℃至46
°
f)下的药物组合物。在一个实施方案中,药物在50mm乙酸钠、70mm氯化钠、4%(重量/体积[w/v])海藻糖二水合物、0.05%(w/v)聚山梨醇酯80,ph 5.8中以150mg/ml配制。在一些实施方案中,药物产品以无菌液体的形式在预填充的注射器中以1.0ml的标称填充体积供应,用特氟隆表面(teflon
‑
faced)的弹性体塞子塞住,并且配有针套、柱塞杆和伸出的手指凸缘。每个注射器含有150mg(标称)活性研究用产品。
[0136]
实施例
[0137]
尽管已经根据某些实施方案具体描述了本发明的某些方法,但是以下实施例仅用于说明本发明的方法,而无意于限制本发明。
[0138]
实施例1:用抗gm
‑
csfrα抗体治疗巨细胞动脉炎
[0139]
本实施例中的研究被设计成评估抗gm
‑
csfrα抗体在用gca治疗受试者中的功效。
[0140]
研究设计
[0141]
在这种示例性的随机、双盲、安慰剂对照的研究设计中,将抗gm
‑
csfrα抗体(马夫利列单抗)与26周的类固醇减量共施用于临床诊断患有gca(早发和复发/难治性)的受试者,以便评价马夫利列单抗的功效和安全性。在图2中概述研究设计。研究由以下组成:筛选期(至多6周)、受试者将接受设盲的马夫利列单抗或安慰剂的双盲安慰剂对照期、直到最后一个受试者达到26周时间点并且已经分析了26周时间点的结果的26周皮质类固醇减量,以及另外26周的非盲扩展期(ole)。
[0142]
研究的探索目标包括评估相对于基线,在第26周时(在同意的受试者中)活检或成像时血管壁炎症的减少,并且评估血液药效学(pd)生物标志物与临床反应评定之间的关联。在第12周和第26周以及每6个月进行超声波测试。
[0143]
允许受试者在研究入选前接受类固醇(强的松或等效物)。受试者根据gca的当前护理标准(soc)实践接受伴随药物。在研究期间,此类药物包括低剂量阿司匹林(aspirin)
(每个soc允许的剂量)、泮托拉唑(pantoprazole)(每天40mg)、钙(每天1000mg)、胆钙化醇(每天800u)和静脉内(iv)伊班膦酸盐(每3个月3mg)。
[0144]
受试者接受皮下(sc)马夫利列单抗或安慰剂,以及共施用的口服强的松,所述口服强的松在至多26周内逐渐减量,除非受试者经历gca发作。在发作后,受试者保持处于设盲治疗,并且类固醇的剂量增加,或任选地,在发作后,受试者停止研究药物,施用soc,并且在研究的其余部分随访受试者。
[0145]
受试者接受马夫利列单抗或安慰剂持续最少26周(除非受试者过早前停止治疗)。向所有受试者提供另外6个月的非盲马夫利列单抗扩展期。
[0146]
安全性测量包括不良事件和临床实验室分析(包括化学、血液学、尿液分析、肝谱、脂质板、血红蛋白a1c[hba1c]和抗药物抗体)、生命体征测量、心电图(ecg)和体检结果。
[0147]
药物制剂
[0148]
马夫利列单抗
[0149]
马夫利列单抗是预期用于sc施用的液体产品。其必须储存在2℃至8℃(36℃至46
°
f)下。马夫利列单抗在50mm乙酸钠、70mm氯化钠、4%海藻糖二水合物、0.05%(重量/体积[w/v])聚山梨醇酯80,ph 5.8中以150mg/ml配制。研究用产品以无菌液体的形式在预填充的注射器中以1.0ml的标称填充体积供应,用特氟隆表面的弹性体塞子塞住,并且配有针套、柱塞杆和伸出的手指凸缘。每个注射器含有150mg(标称)活性研究用产品。
[0150]
安慰剂
[0151]
马夫利列单抗安慰剂是预期用于sc施用的液体产品。其必须储存在2℃至8℃(36℃至46
°
f)下。马夫利列单抗安慰剂在50mm乙酸钠、70mm氯化钠、4%海藻糖二水合物、0.05%(w/v)聚山梨醇酯80,ph 5.8中配制。安慰剂以无菌液体的形式在预填充的注射器中以1.0ml的标称填充体积供应,用特氟隆表面的弹性体塞子塞住,并且配有针套、柱塞杆和伸出的手指凸缘。
[0152]
强的松
[0153]
强的松片剂usp可用于口服施用,含有1mg、或2.5mg、5mg、10mg、20mg或50mg强的松usp。每片片剂含有下列非活性成分:乳糖一水合物、硬脂酸镁、微晶纤维素、预胶化淀粉、羧甲基淀粉钠和硬脂酸(1mg、2.5mg和5mg)。
[0154]
研究治疗
[0155]
在双盲期间,除了方案特异性皮质类固醇减量之外,受试者每2周通过sc注射接受设盲的马夫利列单抗150mg或安慰剂。
[0156]
在第0天时,口服强的松以20mg/天至60mg/天(含)的剂量开始,这取决于受试者先前的类固醇治疗、疾病状态和研究者酌情决定。强的松剂量随后在随后26周内根据表1中所示的以下减量时间表逐渐减量(在不存在gca发作的情况下),其中受试者在不同的点处进入减量,这取决于在第0天时的其强的松剂量。
[0157]
治疗持续时间可根据每个受试者入选的时间而不同,其中第一入选受试者接受治疗的时间比稍后入选的受试者长。到所有受试者完成26周的治疗并分析26周结果时,一些受试者(在招募过程早期入选的受试者)将接受设盲的马夫利列单抗或安慰剂持续大约21个月。取决于26周分析的结果,向所有受试者提供另外6个月的非盲马夫利列单抗。因此,大约总治疗持续时间将长达27个月。
[0158]
表1:强的松逐渐减量时间表
[0159]
[0160][0161]
受试者纳入标准
[0162]
受试者的年龄在50与85岁之间(包括两者之间),其能够提供书面知情同意书。
[0163]
新发病的gca患者子集被分类为在研究开始的第0天的6周内已诊断,并且活动性疾病状态的特征在于:
[0164]
(a)红血球沉降率(esr)大于30mm/小时的westergre方法,或血液crp≥水平1mg/dl,以及:
[0165]
(b)以下中的至少一种:
[0166]
i)gca的明确颅骨症状(新发作的局部头痛、头皮或颞动脉触痛、缺血相关的视力丧失或以其它方式无法解释的在咀嚼时的口腔或下颚疼痛)
[0167]
ii)gca的明确颅外症状,例如四肢跛行
[0168]
iii)pmr的症状,其定义为与炎性晨僵相关的肩部和/或腰带疼痛;
[0169]
(c)和以下中的至少一种:
[0170]
i.tab或超声显示gca的特征
[0171]
ii.利用造影术或横断面成像研究(例如主动脉或其它大血管的mri、ct/cta或pet
‑
ct)的大血管血管炎的证据
[0172]
复发的gca患者子集被分类为在研究开始的第0天前已被诊断超过6周,并且表征为
[0173]
1.a)临床体征和症状,westergren esr>30mm/小时或crp>1mg/dl;或
[0174]
b)自从根据临床预期诊断出疾病以来,没有缓解(难治性非缓解)
[0175]
2.在第0天时gca的缓解(在第一小时内,gca症状的缓解且crp<1.0或esr<20mm),使得受试者可安全地参加研究并遵守方案定义的程序,包括以方案指定的起始剂量(即≤60mg/天)开始强的松减量。
[0176]
3.筛选时,受试者接受或能够接受高达60mg/天的口服强的松以用于治疗活性gca。
[0177]
4.在受试者使用甲氨蝶呤的情况下,如果在第0天前6周以上开始,则允许高达
25mg/周的口服或肠胃外甲氨蝶呤,并且应在患者达到缓解后稳定或减少,并且打算停止使用。
[0178]
5.取决于研究员的决定,受试者愿意接受抗血小板疗法。
[0179]
6.取决于研究员的决定,受试者愿意接受皮质类固醇诱导的骨缺乏/骨质疏松症的预防治疗。
[0180]
女性受试者是绝经后的,其定义为月经停止后至少12个月(无替代医学原因),或在记录的子宫切除术、双侧输卵管切除术、双侧卵巢切除术或输卵管结扎后永久不育,或有受试者确认的输精管切除术男性伴侣,或非妊娠、非哺乳期,并同意从筛查访视至最终研究药物给药后12周使用有效的避孕方法(即激素避孕药、iud或双屏障方法,例如避孕套加隔膜或隔膜加杀精子剂或避孕套加杀精子剂)。
[0181]
男性受试者必须有记录的输精管切除术,或者必须同意从第0天直到安全性随访期,与具有生育能力的伴侣一起使用双屏障避孕方法(例如避孕套加隔膜或隔膜加杀精子剂或避孕套加杀精子剂)或使用避孕套加激素避孕药或避孕套加iud。男性同意从第0天直到安全性随访,不捐献精子。
[0182]
研究评定
[0183]
通过静脉穿刺或套管插入术收集血液样品,并且使用经过验证的分析程序测定抗gm
‑
csfrα抗体的血清浓度。所有统计分析均使用version 9.4或更高版本进行。所有临床研究数据将呈现于受试者数据列表中。描述性统计量包括受试者数量(n)、平均值、标准差(sd)、第一四分位数(q1)、中值、第三四分位数(q3)、连续变量的最小和最大,以及分类和序变量的频率和百分比。列出描述性统计量(视情况而定,算术平均值、标准差、最小值、中值、最大值、几何平均值和几何变异系数),并汇总抗gm
‑
csfrα抗体的血清浓度和pk参数。
[0184]
在剂量组之间检查抗gm
‑
csfrα抗体剂量比例。使用功率模型方法或适当时使用方差分析(anova)模型,对auc0‑
∞
、auc0‑
t
和c
max
估计值测试剂量比例。
[0185]
在研究期间中还进行了以下临床反应评定。功效测量由以下进行:
[0186]
‑
临床实验室分析(例如,crp、esr)
[0187]
‑
临床gca评定,包括例如11点疼痛数值等级量表(nrs)和慢性疾病疗法的功能评定(facit[疲劳])
[0188]
‑
成像研究(如适用),包括超声波、mri、ct/cta、pet
‑
ct、tab(如适用)
[0189]
‑
生活质量(qol)问卷(例如,eq
‑
5d、健康调查简表[sf
‑
36])
[0190]
研究的主要终点分析是评估马夫利列单抗与安慰剂联合26周类固醇减量在新发作或复发/难治性gca患者中维持26周持续缓解的功效。持续缓解定义为从双盲治疗开始至第26周及之后不存在发作(如上文定义)。主要终点是26周双盲基础期(从双盲治疗开始到26周期内首次发作的时间)内的缓解持续时间。在所述期间没有经历发作的受试者在第26周访视时被审查。在26周的双盲期期间,在经历发作前退出或失去随访的受试者在末次可用访视时被审查。汇总了每个治疗组在26周的双盲期期间保持缓解、发作并且在发作之前失去随访的受试者的数量和百分比。缓解的持续时间由使用kaplan
‑
meier方法计算的第25、50(中位数)和75百分位数进行概述,以估计每个治疗组的生存函数。还将计算百分位数的95%置信区间(ci)。对数秩检验用于比较马夫利列单抗和安慰剂的缓解持续时间(测试生存缓解曲线的相等性)。显示了26周时缓解的kaplan
‑
meier估计值以及治疗组的对应
95%ci。为描述治疗作用的量级,基于以治疗和随机化分层作为协变量的cox比例
‑
风险模型计算马夫利列单抗相较于安慰剂的风险比和相应的95%ci。对mitt群体执行持续缓解的初步分析,并且将对pp群体重复进行敏感性分析。
[0191]
作为次要功效终点,使用上述相同方法分析整个双盲治疗期期间的缓解持续时间。在双盲治疗期间未经历发作的受试者在双盲治疗期的最后一次访视时被审查。在双盲治疗期间的任何时间,在经历发作前退出或失去随访的受试者在末次可用访视时被审查。在患有新发作和复发/难治性gca的受试者中,研究的次要目标是:
[0192]
‑
评估马夫利列单抗相比于安慰剂对累积皮质类固醇剂量的影响。
[0193]
‑
评估马夫利列单抗相比于安慰剂对健康相关的生活质量(hrqol)的影响。
[0194]
‑
评估马夫利列单抗的安全性和耐受性。
[0195]
‑
评估马夫利列单抗的药代动力学(pk)。
[0196]
‑
医院焦虑抑郁量表(hads)是用于检测焦虑和抑郁状态的通用likert量表。问卷中的14个项目包括与焦虑相关的7个和与抑郁相关的7个。问卷中的每个项目的评分量表为0至3,其中每个参数的可能总得分在0与21之间。
[0197]
其它次要功效终点包括以下二分终点,其按治疗组进行描述性分析。使用cochran
‑
mantel
‑
haensze测试对照对于随机分层执行治疗比较:第26周时具有正常esr的受试者百分比
[0198]
·
随机治疗结束时具有正常esr的受试者百分比
[0199]
·
第26周时具有正常crp的受试者百分比
[0200]
·
随机治疗结束时具有正常crp的受试者百分比
[0201]
按治疗组描述性分析以下连续次要功效终点。适当时,分析将包括治疗平均值差异的双侧95%ci:
[0202]
·
至类固醇剂量为零的时间
[0203]
·
第26周和双盲治疗期结束时的累积类固醇剂量
[0204]
·
临床gca评定(包括nrs和facit)随时间推移的变化
[0205]
·
生活质量随时间推移的变化
[0206]
相同的方法用于以下探索性终点:
[0207]
·
在第26周时,活检(在同意的受试者中)或成像时血管壁炎症减少
[0208]
在研究过程中,所有不良事件和严重不良事件均会得到随访,直至解决。如果怀疑发作/复发,研究员需咨询合同研究组织(cro)指定的医学专家,以审核和协调诊断检查的要素。发作/复发定义为在第一个小时内crp从正常再增加至1mg/dl或更大和/或esr从小于20mm再增加至30mm或更大,和由研究员归因于新的、恶化的或复发性gca的以下体征或症状中的至少一种:
[0209]
颅骨症状:
[0210]
‑
头皮或颞动脉的新的或复发性头痛或疼痛或触痛
[0211]
‑
视觉体征/症状,例如缺血性视网膜病变、视神经病变、复视、一时性黑蒙等。
[0212]
‑
舌头、咬肌的新的或复发的跛行,或恶化的颞动脉体征和症状
[0213]
‑
研究者认为与gca相关的短暂性缺血性发作(tia)或中风
[0214]
颅外症状:
[0215]
‑
典型的pmr样症状,其定义为与炎性晨僵相关的肩部和/或腰带疼痛;
[0216]
‑
末梢循环(即四肢中的一个)中的新的或复发的跛行
[0217]
‑
通过主动脉或其它大血管的mri、ct/cta或pet
‑
ct或通过颞动脉的超声波检测到的新的或恶化的血管造影异常。
[0218]
支持性结果可包括研究者认为与恶化的gca有关的其它症状,例如持续的温度超过38℃持续1周以上的每天反复发热、慢性贫血或无法解释的体重减轻。
[0219]
与研究者诊断发作/复发有关的诊断检查的所有要素(即主要临床终点)均应由cro指定的医学专家进行审查并立即输入电子病例报告表(ecrf)中。
[0220]
如果出现颅骨症状或缺血相关的视力丧失,或如果存在新发作的大血管血管炎(例如,锁骨下动脉)的明确证据,则将发作/复发定义为严重。在归因于pmr的所有其它情况下,血管或其它症状应被视为轻微。
[0221]
发作病例根据研究员的判断和护理标准(soc)进行治疗,以确保受试者得到最佳护理。一般来讲,受试者应继续接受分配的马夫利列单抗或安慰剂,并且还应接受增加剂量的共施用的强的松,如研究者所确定,一般高达60mg/天。用于治疗gca发作的所有伴随药物的剂量必须输入到ecrf中。如果发作,尤其是严重发作,需要高于强的松60mg/天的皮质类固醇剂量,则根据研究员的判断,允许类固醇逃逸疗法(即强的松的剂量>60mg/天或同等剂量,或iv皮质类固醇),直到达到临床缓解。
[0222]
测试抗gm
‑
csfrα抗体在gca中的功效和安全性的2期、随机、双盲、安慰剂对照研究
[0223]
设计了一项全球性、多中心、2期、随机、安慰剂对照验证
‑
概念研究,以评估在26周皮质类固醇(cs)减量的情况下抗gm
‑
csfrα抗体(马夫利列单抗)在gca受试者中的功效和安全性。具有明确的gca的体征和/或症状(颅骨/颅外)、红细胞沉降率>30mm/小时或c反应蛋白≥1mg/dl,并且通过颞动脉活检或成像对gca进行诊断的大约60名年龄在50
‑
85岁之间的受试者将根据新发作或复发/难治性疾病进行分层,并且随机(3:2比率)每两周皮下施用150mg抗gm
‑
csfrα抗体或安慰剂。受试者接受马夫利列单抗或安慰剂达26周(除非受试者过早停止治疗)。
[0224]
主要功效终点是gca发作时间(如上定义)。次要终点包括达到0mg/天的cs剂量的时间、第26周时和清除安全性随访结束时的累积cs剂量、临床gca评定的变化和生活质量的变化。安全性测量包括不良事件的发生率、临床实验室变量和肺部监测。图3展示了研究的示意性概要。上文提供了终点的详细描述。
[0225]
实施例2:颞动脉活检巨细胞动脉活检中的gm
‑
csf途径标记
[0226]
利用了颞动脉活检的两个独立来源。首先,分析gca(n=18)和对照(n=5)活检的5种mrna转录物,其代表t
h
1、t
h
17和gm
‑
csf信号传导(rnascope;rs)。对代表性t
h
1、t
h
17和gm
‑
csf相关mrna转录物的rs图像执行半定量评分。对于gm
‑
csf
‑
和t
h1‑
相关的转录物的子集,获得另外的gca和对照活检且通过rt
‑
pcr进行分析(在实例3中进一步描述)。获得另外的gca(n=3)和对照(n=3)活检,并且通过免疫荧光检测gm
‑
csf和gm
‑
csfrα蛋白质水平,并且通过共聚焦显微镜检查进行分析。
[0227]
与对照相比,gm
‑
csf和gm
‑
csfrαmrna的表达以及表达gm
‑
csf信号传导
‑
和t
h1‑
相关的基因显示在gca活检中上调。t
h
17相关的基因未升高(数据未显示),可能是由于伴随的皮质类固醇治疗。如图4所示,与对照(rs、rt
‑
pcr)相比,在gca活检中增加pu.1(gm
‑
csf信号
传导下游的转录因子)。通过免疫组织化学染色,在gca动脉中也观察到,与对照动脉相比,定位于细胞核的pu.1蛋白质的水平增加(指示这种转录因子的活化)(数据未示出)。如图5中所示,cd83 mrna在gca活检中相对于对照(rs、rt
‑
pcr)也上调。在来自gca阳性受试者的活检中和来自gca阴性(对照)受试者的活检中,确定了跨越所有三层颞动脉血管壁的gm
‑
csf
‑
和t
h1‑
相关的基因(rs)的表达水平。如图6a中所示,gm
‑
csf相关基因的mrna水平在gca活检(阴影柱)中相比于对照活检(空心柱)上调。如图6b中所示,在gca活检(阴影柱)中相比于对照活检(空心柱)上调了t
h1‑
相关基因的mrna水平
[0228]
实施例3:通过rt
‑
pcr和免疫荧光分析来自巨细胞动脉活检的gm
‑
csf和gm
‑
csf受体表达分析
[0229]
在此示例性研究中,在gca患者样品中相对于对照样品研究gm
‑
csf mrna、gm
‑
csfrαmrna和inf
‑
γmrna在颞动脉活检中的表达水平。
[0230]
巨细胞动脉炎被理解为主要为单核细胞和巨噬细胞相关疾病,并且gca病理学可能与gm
‑
csf和其受体的较高表达相关。gm
‑
csf信号传导帮助诱导单核细胞
‑
巨噬细胞趋化和活化。inf
‑
γ是由th1细胞系产生的标记细胞因子,并且已通过促进簇化和细胞间粘附而牵涉多核巨细胞形成。在以下描述的研究中测量gm
‑
csf、gm
‑
csf受体α(gm
‑
csfrα和inf
‑
γ转录物的表达。
[0231]
将来自gca患者(n=10)或对照受试者(无疾病的受试者)的冷冻人类颞动脉切片在trizol中均质化(n=10),并且使用常规方法提取rna。使用随机六聚体引发存档试剂盒(pplied biosystems,foster city,ca)将mrna反转录为cdna。使用taqman探针(applied biosystems)执行实时聚合酶链反应(rt
‑
pcr),所述探针特定用于检测gm
‑
csf、gm
‑
csfrα、inf
‑
γ和gusb。使用比较性δct方法将gm
‑
csf、gm
‑
csfrα或inf
‑
γ基因表达针对每个样品的内源对照gusb的表达标准化,并且相对于gusb表达以相对单位表达。
[0232]
如图7a和7b中所示,gm
‑
csf和gm
‑
csfrα表达在gca样品中相对于对照显著更高。这些数据支持gm
‑
csf途径在gca病理学中起重要作用,并且表明本发明的受体拮抗剂抑制gm
‑
csf途径可以积极影响疾病结果。类似地,如图7c中所示,inf
‑
γ表达相对于对照样品在gca样品中升高。
[0233]
进行从gca患者和未患有gca的对照受试者获得的颞叶动脉的免疫荧光分析,以评定gm
‑
csf和gm
‑
csfrα的存在和位置。从免疫荧光分析获得的数据显示,gm
‑
csfα在非炎症对照活检以及gca动脉中的腔内皮上表达,但与对照相比,在gca动脉中的表达升高。虽然在对照动脉中几乎不存在gm
‑
csf,但其在gca动脉的发炎动脉壁上广泛表达。数据进一步指示gm
‑
csf和gm
‑
csfrα均存在于gca病变中。此外,免疫荧光分析揭示了在发炎的gca动脉的培养基层附近存在对于gm
‑
csf和cd68标志物均为阳性的浸润巨噬细胞。
[0234]
通过独立分析技术来证实gca患者的颞动脉中的gm
‑
csf和t
h
1途径的活化。此外,通过血管壁中pu.1的表达增加来证明病变组织中的活性gm
‑
csf信号传导。这些数据涉及gca病理生理学中的gm
‑
csf途径,并且通过将gm
‑
csfrα拮抗剂(例如马夫利列单抗)施用于需要治疗的患者。
[0235]
实施例4:暴露于马夫利列单抗后的gca动脉基因表达
[0236]
分离、切片来自患有gca的受试者和来自为患有gca(对照)的受试者的颞动脉,包埋于人工基底膜(matrigel)中,并且在存在安慰剂或哺乳动物的情况下培养。已建立的方
案用于颞动脉细胞培养,并且在corbera
‑
bellalta等人,ann rheum dis.,2014:73:616
‑
623中详细描述,其内容以全文引用的方式并入本文。描绘所用的颞动脉培养条件的示意图呈现于图8a中。
[0237]
如上所描述,将分离的动脉在存在安慰剂或马夫利列单抗的情况下培养5天的时期。在培养期之后,对动脉进行处理以进行mrna表达分析。用马夫利列单抗进行的离体gca动脉培养物的治疗抑制了在gca中展示为升高的炎性基因的表达,包括cd3ε、cd83、hla
‑
dr、tnfα和cxcl10(响应于inf
‑
γ分泌的趋化因子),从而指示马夫利列单抗对与gca病理生理相关的基因的生物效应。(图8b)。这些数据清楚地指示,马夫利列单抗降低与gca相关的基因的表达。
[0238]
实施例5:植入gca小鼠嵌合体模型的人类颞动脉活检
[0239]
人类动脉
‑
nsg小鼠嵌合体模型用于评估抗gm
‑
csfrα抗体(马夫利列单抗)抑制血管炎动脉中发生的血管炎症和重塑的功效。本实施例中所用的人类动脉nsg小鼠嵌合体模型先前在zhang等人,circulation,2018:137(18):1934
‑
1948中详细描述。简言之,将正常的颞动脉或腋下动脉植入nsg免疫缺陷小鼠中。随后将来自gca患者的pbmc过继地转移到嵌合小鼠中。大约7
‑
10天后,移植的人类动脉血管炎明显,组织浸润细胞遍布血管壁病变。来自外植体人类动脉的组织切片显示密集的细胞浸润。如果来自正常人类对照的pbmc被转移,则未观察到血管炎。有趣的是,当向此类嵌合小鼠施用50μg重组gm
‑
csf(rgm
‑
csf)时,动脉中的组织炎症加剧。在rgm
‑
csf注射后,组织存活的t细胞的数量翻倍。炎性细胞密度的增加伴随il
‑
1β、il
‑
6和ifn
‑
γ的组织基因表达的平行增加。
[0240]
实施例6:抗gm
‑
csfrα抗体在治疗gca中的体内功效
[0241]
在本实施例中,在上述人类动脉
‑
nsg小鼠嵌合体模型中评估gm
‑
csf拮抗剂马夫利列单抗治疗gca的体内功效。对于每组小鼠,在已建立的血管炎期间(gca pbmc的过继转移后第7天)腹膜内施用对照igg抗体或抗gm
‑
csfrα抗体。在此实验中,嵌合小鼠中的血管炎仅通过从gca患者的pmbc的过继转移来诱导;未向小鼠施用rgm
‑
csf。在第7天时治疗嵌合小鼠模拟稳态血管炎的治疗。在每个实验中,使小鼠植入有来自相同动脉的区段,并且接受来自相同患者的pmbc的过继转移,使得血管炎在每个治疗组中相当。在1周治疗后,收获动脉并通过免疫组织化学和转录组分析检查。
[0242]
如图9a中所描绘,cd3
+
t细胞的免疫组织化学染色显示,与施用igg对照抗体的小鼠相比,组织浸润cd3
+
t细胞在施用抗gm
‑
csfrα抗体的小鼠中显著减少。还通过列举炎症动脉组织中的t细胞计数来检查t细胞消减效应。如图9b中所示,与igg对照治疗的小鼠相比,抗gm
‑
csfrα抗体治疗的小鼠中每个高倍视野的组织保留t细胞的数目低约50%(具有p<0.001的统计显著性)。这些数据显示,与同种型抗体阴性对照组相比,用抗gm
‑
csfrα抗体治疗嵌合小鼠显示出较强的抗炎作用。
[0243]
当受gca影响时,大中型动脉形成密集的微血管网络,导致新血管生成。动脉中的t细胞也促进内膜增生,这是通过动脉的内膜(最内的)层的厚度来测量的。如图10中所示,与对照igg治疗的小鼠相比,抗gm
‑
csfrα治疗的小鼠中的微血管的数量显著减少。此外,与施用igg对照抗体的小鼠相比,内膜厚度测量值在施用抗gm
‑
csfrα抗体的小鼠中下降约40%(具有p<0.001的统计显著性)。这些结果表明,用抗gm
‑
csfrα治疗的小鼠中的炎性浸润的密度被抑制,并且壁重塑过程被抑制。
[0244]
接下来,评估igg对照
‑
或抗gm
‑
csfrα
‑
治疗的小鼠的动脉组织中的基因表达谱,并且将其绘制为热图,其中行表示基因,并且列表示小鼠。图11显示了与抗gm
‑
csfrα治疗的小鼠相比,igg对照治疗的小鼠中用于促炎性细胞因子的组织转录组显著升高。举例来说,il
‑
1β、il
‑
6和ifn
‑
γ的组织基因表达在用抗gm
‑
csfrα抗体治疗的小鼠中显著降低。ifn
‑
γ在用抗gm
‑
csfrα抗体治疗的小鼠中的表达降低对于治疗gca具有特别的意义,因为其是由th1细胞系(具有血管生成潜力的细胞系)产生的标记细胞因子,并且已通过促进簇化和细胞间粘附而牵涉多核巨细胞的形成。此外,产生ifn
‑
γ的th1细胞对糖皮质激素疗法相对无反应,并且在类固醇治疗的患者中持续存在,并且ifn
‑
γ的过度产生被认为是疾病慢性中的关键机制。这些结果示出,抗gm
‑
csfrα抗体可抑制炎症动脉中的先天性和适应性免疫反应。
[0245]
总的来说,这些体内数据表明,gm
‑
csf拮抗剂(例如,抗gm
‑
csfrα抗体)的施用可用于治疗血管炎症、内膜增生和新血管生成,其是gca病理学的关键方面。
[0246]
等效物
[0247]
本领域的技术人员将认识到,或仅仅使用常规实验就能够确定本文描述的本发明的具体实施方案的许多等同形式。本发明的范围并非旨在限于以上说明书,而是如以下权利要求书中所述。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1