芦荟提取物在制备防治猪流行性腹泻的药物中的应用的制作方法
本发明涉及生物技术应用领域,尤其涉及天然植物提取物在制备防治猪流行性腹泻的药物中的应用。
背景技术:
猪流行性腹泻(porcineepidemicdiarrhea,ped)是一种猪的急性、高度传染性疾病,其病原猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)为具有囊膜的单股正链rna病毒,属于α冠状病毒属(alphacoronavirus)(kocherhansr,bridgena,ackermannm,etal.2001.completionoftheporcineepidemicdiarrhoeacoronavirus(pedv)genomesequence[j].virusgenes,23(2):137-144.)。pedv可引起新生仔猪出现腹泻、脱水、呕吐,且病死率高。
近年来,ped在世界范围内广泛流行,中国、美国、韩国、加拿大等国家相继暴发疫情,严重危害全球养猪业的发展。我国有29个省市自治区发生并流行ped,可导致新生仔猪死亡率高达100%,给我国养猪业造成了巨大的经济损失。
目前,对该病的防控以疫苗免疫防控为主。疫苗免疫是以直接免疫仔猪为主,疫苗免疫是通过诱导黏膜免疫来保护肠道上皮细胞(wangd,fangl,xiaos.2016.porcineepidemicdiarrheainchina[j].virusres,226:7-13.)。对于新生仔猪和哺乳期仔猪而言,疫苗免疫存在两个问题:其一,血清呈pedv抗体阳性的母猪,乳汁中的母源抗体会影响口服活疫苗诱导的保护效果;其二,pedv疫苗是通过黏膜免疫发挥作用,但ped的高发群体是黏膜免疫系统未发育完全的新生仔猪和哺乳期仔猪,导致pedv的疫苗免疫效果并不理想。
目前除疫苗免疫外,化学合成药物、激素、抗生素等也被用来缓解腹泻症状。此外,植物成分具有无药物残留、无污染的优点,成为目前比较热门的抗病毒研究方向。如刘衍芬等在《黑龙江畜牧兽医》(2016,18:155-158+298)发表了题为《中药复方对人工感染猪流行性腹泻病毒仔猪的治疗效果研究》的文章,又如兰新财等在《中兽医医药杂志》(2015,02:55-56.)发表了题为《复方中药口服液对仔猪腹泻治疗作用研究》的文章,再如尹宝英在《黑龙江畜牧兽医》(2014(22):99-100.)上发表了题为《自拟中药复方治疗猪流行性腹泻效果研究》的文章。以上研究表明,复方中药能有效治疗pedv引起的腹泻,且在体外试验被证明有显著抗病毒效果。
中药复方虽具有治疗猪流行性腹泻效果,但需要多种中草药配伍使用,成分复杂,制备步骤繁琐。
技术实现要素:
有鉴于此,本发明针对中药复方成分复杂、制备步骤繁琐等问题,提供一种成分单一的具有抑制猪流行性腹泻病毒作用的植物提取物,可用于治疗猪流行性腹泻及相关药物。
芦荟提取物在制备防治猪流行性腹泻的药物中的应用。
所述芦荟提取物通过以下方法制备:芦荟地上部分通过水煮成膏状,或通过水、醇提后冷冻干燥、粉碎后得粉状物。
芦荟提取物的主要有效成分包括:芦荟多糖(葡聚糖、葡甘聚糖等)、蒽醌类化合物(如芦荟素、芦荟大黄素、大黄酚以及芦荟皂草苷等等)。文献报道芦荟提取物具有以下功能:
(1)杀菌和消炎
芦荟中的蒽酮类化合物大多具有杀菌、抑菌、消炎、解毒、促进伤口愈合等作用,能有效地消除粉刺、痤疮,在临床上用于治疗多种炎症,疗效显著。
(2)健胃和缓泻
芦荟具有健胃和缓泻功效,主要是因为芦荟含有芦荟大黄素苷、芦荟宁、芦荟咪酊等有效成分.具有健胃和缓泻功能,起着增进食欲和大肠缓泻作用。主要作用部位在大肠,可用于治疗便秘。
(3)抗癌
研究发现,芦荟中含有的黏稠物质——芦荟凝胶具有很强的抗癌作用。我国在芦荟抗肿瘤研究发现,芦荟醇提取物及芦荟苦素能明显提高机体免疫功能,临床应用芦荟治疗肝癌肝癌、胃癌等。
(4)美容
芦荟含有的芦荟素具有多方面美化皮肤的效能,在保湿、消炎、抑菌、止痒、抗过敏、软化皮肤、防粉刺、抑汗防臭等方面具有一定的作用,对紫外线有强烈的吸收作用,防止皮肤灼伤。
(5)增强机体免疫改善亚健康状态
芦荟多糖可调节机体免疫水平,表现在可提高自身免疫抗病菌。芦荟素、多糖能强化心脏功能,促进血液循环,软化硬化的动脉,降低胆固醇值,扩张毛细血管,使血压正常化,对动脉硬化和高血压有一定的预防和治疗作用。
正因为有以上功能,芦荟提取物的应用很广泛。但综合国内外研究,均未见报道芦荟提取物的防治猪流行性腹泻药效及其药物。
本发明芦荟提取物在制备防治猪流行性腹泻的药物中的应用,使用芦荟提取物可以抑制猪流行性腹泻病毒,成分单一简单,制备方法成熟,原材料广泛。芦荟提取物为纯植物提取物,无毒副作用,可以改善机体的先天性免疫抗病毒功能和直接杀死病毒,进而防治猪流行性腹泻。
附图说明
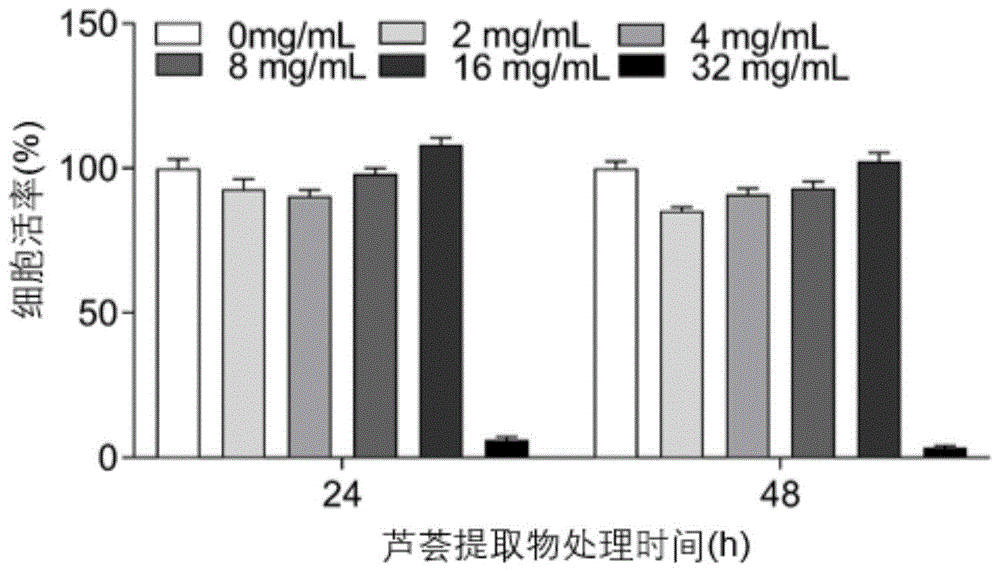
图1是芦荟提取物(ae)对vero细胞活性影响结果。
图2是不同浓度的芦荟提取物(ae)抑制pedv-n蛋白在vero细胞中表达的ifa结果。
图3是不同浓度的芦荟提取物(ae)于不同时间点抑制pedv-n蛋白在vero细胞中表达的wb结果。
图4是不同浓度的芦荟提取物(ae)处理不同时间后用病毒滴度检测法检测pedv滴度结果。
图5是芦荟提取物对ipec-j2细胞活性影响结果。
图6是不同浓度的芦荟提取物(ae)抑制pedv-n蛋白在ipec-j2细胞中表达的ifa结果。
图7是不同浓度的芦荟提取物(ae)于不同时间点抑制pedv-n蛋白在ipec-j2细胞中表达的wb结果。
图8是不同浓度的芦荟提取物(ae)处理不同时间后用病毒滴度检测法检测pedv滴度结果。
具体实施方式
下面结合实施例对本发明作进一步详细的描述。
本发明实施例中使用的芦荟提取物通过cobble和coats热处理法方法制得。本发明中的芦荟提取物也可以用任何现有技术中公开的制备芦荟提取物的方法制得或市售芦荟提取物。
本发明中使用的试验方法为本领域常规技术方法,使用的实验试剂、细胞等,为市售获得,或按照本领域常规方法配置得到。
实施例1芦荟提取物对vero细胞毒性试验和抑制pedv在vero细胞中增殖的试验
1.1芦荟提取物(ae)对vero细胞毒性检测试验
在96孔板中接种6×105cells/ml的细胞悬液(100μl/孔),留一列不接种细胞。于37℃、5%co2条件下培养至细胞完全汇合。吸去培养基,pbs洗3遍,芦荟提取物用dmem稀释为不同浓度,加入到96孔板(100μl/孔),每个稀释浓度8个重复。于37℃、5%co2条件下培养24h、48h后吸去药液,pbs洗3遍,用dmem配置10%cck-8溶液加到96孔板(100μl/孔),于37℃、5%co2条件下孵育1h,用酶标仪测定吸光值(λ=450nm)并计算不同浓度药液处理24h和48h后的细胞活率。
结果如图1所示,芦荟提取物对vero细胞的最大安全浓度为16mg/ml(n=8)。
1.2ifa测定在vero细胞经不同浓度芦荟提取物(ae)处理后pedv-n蛋白荧光的强弱
1.在12孔细胞培养板中按6×105cells/ml细胞浓度接种1ml细胞悬液,接种6个孔,于37℃、5%co2条件下培养至细胞完全汇合。
2.弃去12孔板中的培养基用pbs洗3遍,在6个种有细胞的孔中分别加入芦荟提取物浓度为0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、2mg/ml、4mg/ml、8mg/ml、16mg/ml的dmem培养基处理1h,弃去处理液,再分别加入含有pedv(moi=0.2)的对应浓度的芦荟提取物处理液,第一个芦荟提取物为0mg/ml孔作为阴性对照不接毒,处理1h后弃去处理液,pbs洗3遍,再分别加入不含pedv的对应浓度的芦荟提取物处理液,于37℃、5%co2条件培养24h。
3.弃去处理液,用pbst洗3遍,每次5min,加入4℃预冷的4%多聚甲醛,每孔500μl,室温孵育15min。
4.用pbst洗3遍,每次5min,加入0.4%的tritonx-100溶液,室温孵育10-20min。
5.用pbst洗3遍,每次5min,加入3%的bsa,每孔500μl,室温孵育1h。
6.用pbst洗3遍,每次5min,将1d11一抗用含1%bsa的pbst溶液仪1:1000的比例稀释,每孔300μl,37℃孵育1h。
7.回收1d11一抗稀释液,用pbst洗3遍,每次5min,将fitc荧光二抗用pbst以1:500的比例稀释,每孔300μl,37℃避光孵育1h。
8.在避光条件下,用pbst洗3遍,每次5min,将dapi荧光染料用pbst以1:1000的比例稀释,每孔300μl,37℃避光孵育7min。
9.在避光条件下,用pbst洗5-7遍,每孔补加500μlpbst,用荧光显微镜观察荧光强弱并拍照。
结果如图2所示,使用间接免疫荧光法(ifa)检测经芦荟提取物处理后pedv病毒增殖情况,药物处理24h后随着药物浓度升高针对pedv-n蛋白的特异性荧光逐渐减少。
1.3wb检测在vero细胞经不同浓度芦荟提取物处理后pedv-n蛋白条带的有无
1.在3块12孔细胞培养板中按6×105cells/ml细胞浓度接种1ml细胞悬液,每块12孔板接种6个孔,于37℃、5%co2条件下培养至细胞完全汇合。
2.弃去12孔板中的培养基用pbs洗3遍,在6个种有细胞的孔中分别加入芦荟提取物浓度为0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、2mg/ml、4mg/ml、8mg/ml、16mg/ml的dmem培养基处理1h,弃去处理液,再分别加入含有pedv(moi=0.2)的芦荟提取物处理液,第一个芦荟提取物为0mg/ml孔作为阴性对照不接毒,处理1h后弃去处理液,pbs洗3遍,再分别加入不含pedv的对应浓度的芦荟提取物处理液,于37℃、5%co2条件分别培养12h、24h、48h。
3.弃去处理液,pbs洗3遍,每孔加入100μlripa裂解液(弱),于冰上裂解10min,将细胞沉淀吹打混匀后分别转移到1.5ml的无菌ep管中,向每管加入25μl5×samplebuffer,涡旋振荡5s,100℃水浴10min,12000r/min离心1min。
4.用12孔、10%的预制胶进行电泳,上样顺序为:pbs、marker、0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、2mg/ml、4mg/ml、8mg/ml、16mg/ml、pbs,用150v的电压电泳40-60min。
5.根据目的蛋白pedv-n蛋白(55kda)和内参蛋白gapdh(35kda)的大小,将胶上下分别从25kda和75kda切开,左右分别从pbs泳道切开,切好的胶转入预冷的转膜液。
6.将剪好的pvdf膜在预冷的甲醇中浸泡1min,转入预冷的转膜液,将剪好的滤纸浸泡在预冷的转膜液中。
7.装配转膜夹板,装配顺序为:黑色面(负极)-海绵-滤纸-蛋白胶-pvdf膜-滤纸-海绵-白色面(正极),装配好后用干净的试管或玻璃棒赶去气泡,将装配好的夹板置于转印槽中完全浸没在转印液中。将转印槽置于冰浴中,100v/300ma,1h。
8.转印结束后将pvdf膜取出,用tbst洗5min,置于3%的bsa封闭液中,4℃封闭过夜。
9.倒去封闭液,用pbst洗3遍,每次5min,置于摇床上60r/min,将膜取出用干净的保鲜膜包好,从45kdamarker处将膜剪开,将45-75kda蛋白所在的膜置于用含1%bsa的tbst稀释的pedv-n多抗溶液中(稀释比例1:1000),将25-45kda蛋白所在的膜置于用1%bsa的tbst稀释的gapdh单抗溶液中(稀释比例1:1000),置于摇床上,20r/min,室温孵育1h。
10.分别回收pedv-n多抗稀释液和gapdh单抗稀释液,将膜用pbst洗3遍,每次5min,置于摇床上60r/min,将两张膜置于用tbst稀释好的hrp标记的羊抗鼠igg二抗溶液中(稀释比例1:8000),置于摇床上,20r/min,室温孵育1h。
11.回收二抗稀释液,将膜用tbst洗3遍,每次5min,置于摇床上60r/min,将膜浸泡于tbst中,避光条件下配制ecl显色液,使用凝胶扫描系统显影拍照。
结果如图3所示,使用蛋白免疫印迹法(wb)检测经芦荟提取物处理后pedv病毒增殖情况,药物分别处理12h、24h、48h后对应pedv-n蛋白大小的条带颜色随着药物浓度的升高逐渐减弱。
1.4用病毒滴度检测法检测在vero细胞经不同浓度芦荟提取物处理后pedv的滴度
1.在3块12孔细胞培养板中按6×105cells/ml细胞浓度每孔接种1ml细胞,每块12孔板接种4个孔,于37℃、5%co2条件下培养至细胞完全汇合。
2.弃去12孔板中的培养基用pbs洗3遍,在4个种有细胞的孔中分别加入芦荟提取物浓度为0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、8mg/ml、16mg/ml的dmem培养基处理1h,弃去处理液,再分别加入含有pedv(moi=0.2)的芦荟提取物处理液,第一个芦荟提取物为0mg/ml孔作为阴性对照不接毒,处理1h后弃去处理液,pbs洗3遍,再分别加入不含pedv的对应浓度的芦荟提取物处理液,于37℃、5%co2条件分别培养12h、24h、48h。
3.按时间点收样,将不同时间点的12孔板用封口膜封好,于-80℃冻融3次,将冻融后的培养物分装于无菌的1.5mlep管中,于-80℃保存。
4.按6×105cells/ml细胞浓度种96孔板,每孔100μl,于37℃、5%co2条件下培养至细胞完全汇合,将细胞长好的96孔板用pbs洗3遍,将收集的样品按10倍稀释5个梯度,每个梯度4个重复,将稀释好的样品加入对应的细胞孔中,每孔100μl,于37℃、5%co2条件下培养5-7d。
5.在显微镜下观察记录每个稀释梯度的病变孔数,计算不同时间点,不同浓度芦荟提取物处理后的pedv的活病毒粒子数。
结果如图4所示,使用病毒滴度测定分别检测经芦荟提取物处理后pedv病毒增殖情况,相同条件处理后病毒滴度测定结果显示,药物达到一定浓度后pedv滴度降到0pfu/ml(n=4)。
实施例2芦荟提取物对ipec-j2细胞毒性试验和抑制pedv在ipec-j2细胞中增殖的试验
2.1芦荟提取物(ae)对ipec-j2细胞毒性检测试验
在96孔板中接种6×105cells/ml的细胞悬液(100μl/孔),留一列不接种细胞。于37℃、5%co2条件下培养至细胞完全汇合。吸去培养基,pbs洗3遍,待测药物(芦荟提取物(ae))用dmem稀释为不同浓度,加入到96孔板(100μl/孔),每个稀释浓度8个重复。于37℃、5%co2条件下培养24h、48h后吸去药液,pbs洗3遍,用dmem配置10%cck-8溶液加到96孔板(100μl/孔),于37℃、5%co2条件下孵育1h,用酶标仪测定吸光值(λ=450nm)并计算不同浓度药液处理24h和48h后的细胞活率。
结果如图5所示,芦荟提取物对ipec-j2细胞的最大安全浓度为16mg/ml(n=8)。
2.2ifa测定在ipec-j2细胞经不同浓度芦荟提取物处理后pedv-n蛋白荧光的强弱
1.在12孔细胞培养板中按6×105cells/ml细胞浓度每孔接种1ml细胞悬液,接种5个孔,于37℃、5%co2条件下培养至细胞完全汇合。
2.弃去12孔板中的培养基用pbs洗3遍,在5个种有细胞的孔中分别加入芦荟提取物浓度为0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、4mg/ml、8mg/ml、16mg/ml的dmem培养基处理1h,弃去处理液,再分别加入含有pedv(moi=0.4)的芦荟提取物处理液,第一个芦荟提取物为0mg/ml孔作为阴性对照不接毒,处理1h后弃去处理液,pbs洗3遍,再分别加入不含pedv的对应浓度的芦荟提取物处理液,于37℃、5%co2条件培养24h。
3.弃去处理液,用pbst洗3遍,每次5min,加入4℃预冷的4%多聚甲醛,每孔500μl,室温孵育15min。
4.用pbst洗3遍,每次5min,加入0.4%的tritonx-100溶液,室温孵育10-20min。
5.用pbst洗3遍,每次5min,加入3%的bsa,每孔500μl,室温孵育1h。
6.用pbst洗3遍,每次5min,将1d11一抗用含1%bsa的pbst溶液仪1:1000的比例稀释,每孔300μl,37℃孵育1h。
7.回收1d11一抗稀释液,用pbst洗3遍,每次5min,将cy3荧光二抗用pbst以1:500的比例稀释,每孔300μl,37℃避光孵育1h。
8.在避光条件下,用pbst洗3遍,每次5min,将dapi荧光染料用pbst以1:1000的比例稀释,每孔300μl,37℃避光孵育7min。
9.在避光条件下,用pbst洗5-7遍,每孔补加500μlpbst,用荧光显微镜观察荧光强弱并拍照。
结果如图6所示,使用间接免疫荧光法(ifa)检测经芦荟提取物处理后pedv病毒增殖情况,药物处理24h后随着药物浓度升高针对pedv-n蛋白的特异性荧光逐渐减少。
2.3wb检测在ipec-j2细胞经不同浓度芦荟提取物处理后pedv-n蛋白条带的有无
1.在3块12孔细胞培养板中按6×105cells/ml细胞浓度每孔接种1ml细胞悬液,每块12孔板接种5个孔,于37℃、5%co2条件下培养至细胞完全汇合。
2.弃去12孔板中的培养基用pbs洗3遍,在5个种有细胞的孔中分别加入芦荟提取物浓度为0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、4mg/ml、8mg/ml、16mg/ml的dmem培养基处理1h,弃去处理液,再分别加入含有pedv(moi=0.4)的芦荟提取物处理液,第一个芦荟提取物为0mg/ml孔作为阴性对照不接毒,处理1h后弃去处理液,pbs洗3遍,再分别加入不含pedv的对应浓度的芦荟提取物处理液,于37℃、5%co2条件分别培养12h、24h、48h。
3.弃去处理液,pbs洗3遍,每孔加入100μlripa裂解液(弱),于冰上裂解10min,将细胞沉淀吹打混匀后分别转移到1.5ml的无菌ep管中,向每管加入25μl5×samplebuffer,涡旋振荡5s,100℃水浴10min,12000r/min离心1min。
4.用12孔、10%的预制胶进行电泳,上样顺序为:pbs、marker、0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、4mg/ml、8mg/ml、16mg/ml、pbs,用150v的电压电泳40-60min。
5.根据目的蛋白pedv-n蛋白(55kda)和内参蛋白gapdh(35kda)的大小,将胶上下分别从25kda和75kda切开,左右分别从pbs泳道切开,切好的胶转入预冷的转膜液。
6.将剪好的pvdf膜在预冷的甲醇中浸泡1min,转入预冷的转膜液,将剪好的滤纸浸泡在预冷的转膜液中。
7.装配转膜夹板,装配顺序为:黑色面(负极)-海绵-滤纸-蛋白胶-pvdf膜-滤纸-海绵-白色面(正极),装配好后用干净的试管或玻璃棒赶去气泡,将装配好的夹板置于转印槽中完全浸没在转印液中。将转印槽置于冰浴中,100v/300ma,1h。
8.转印结束后将pvdf膜取出,用tbst洗5min,置于3%的bsa封闭液中,4℃封闭过夜。
9.倒去封闭液,用tbst洗3遍,每次5min,置于摇床上60r/min,将膜取出用干净的保鲜膜包好,从45kdamarker处将膜剪开,将45-75kda蛋白所在的膜置于用含1%bsa的tbst稀释的pedv-n多抗溶液中(稀释比例1:1000),将25-45kda蛋白所在的膜置于用1%bsa的tbst稀释的gapdh单抗溶液中(稀释比例1:1000),置于摇床上,20r/min,室温孵育1h。
10.分别回收pedv-n多抗稀释液和gapdh单抗稀释液,将膜用tbst洗3遍,每次5min,置于摇床上60r/min,将两张膜置于用tbst稀释好的hrp标记的羊抗鼠igg二抗溶液中(稀释比例1:8000),置于摇床上,20r/min,室温孵育1h。
11.回收二抗稀释液,将膜用tbst洗3遍,每次5min,置于摇床上60r/min,将膜浸泡于tbst中,避光条件下配制ecl显色液,使用凝胶扫描系统显影拍照。
结果如图7所示,使用蛋白免疫印迹法(wb)检测经芦荟提取物处理后pedv病毒增殖情况,药物分别处理12h、24h、48h后对应pedv-n蛋白大小的条带颜色随着药物浓度的升高逐渐减弱。
3.4用病毒滴度检测法检测在ipec-j2细胞经不同浓度芦荟提取物处理后pedv的滴度
1.在3块12孔细胞培养板中按6×105cells/ml细胞浓度每孔接种1ml细胞,每块12孔板接种5个孔,于37℃、5%co2条件下培养至细胞完全汇合。
2.弃去12孔板中的培养基用pbs洗3遍,在6个种有细胞的孔中分别加入芦荟提取物浓度为0mg/ml(阴性对照组)、0mg/ml(阳性对照组)、4mg/ml、8mg/ml、16mg/ml的dmem培养基处理1h,弃去处理液,再分别加入含有pedv(moi=0.4)的芦荟提取物处理液,第一个芦荟提取物为0mg/ml孔作为阴性对照不接毒,处理1h后弃去处理液,pbs洗3遍,再分别加入不含pedv的对应浓度的芦荟提取物处理液,于37℃、5%co2条件分别培养12h、24h、48h。
3.按时间点收样,将不同时间点的12孔板用封口膜封好,于-80℃冻融3次,将冻融后的培养物分装于无菌的1.5mlep管中,于-80℃保存。
4.按6×105cells/ml细胞浓度种96孔板,每孔100μl,于37℃、5%co2条件下培养至细胞完全汇合,将细胞长好的96孔板用pbs洗3遍,将收集的样品按10倍稀释5个梯度,每个梯度4个重复,将稀释好的样品加入对应的细胞孔中,每孔100μl,于37℃、5%co2条件下培养5-7d。
5.在显微镜下观察记录每个稀释梯度的病变孔数,计算不同时间点,不同浓度芦荟提取物处理后的pedv的滴度。
结果如图8所示,使用病毒滴度测定分别检测经芦荟提取物处理后pedv病毒增殖情况,相同条件处理后病毒滴度测定结果显示,药物达到一定浓度后pedv滴度降到0pfu/ml(n=4)。
本发明芦荟提取物的新用途,可以用于抑制囊膜病毒pedv的复制,用芦荟提取物可以防治pedv感染引起的猪流行性腹泻,进而在制备防治pedv感染引起的猪流行性腹泻药物中应用。
芦荟提取物制剂和pedv混合后接种到vero和ipec-j2细胞中,待出现细胞病变后使用间接免疫荧光法(ifa)、蛋白免疫印迹法(wb)和病毒滴度测定法检测,结果显示,芦荟提取物能够有效抑制pedv在vero细胞和ipec-j2细胞中的增殖,且具有剂量依赖效应,高剂量条件下(16mg/ml)可完全抑制pedv的增殖。
以上所述实施例仅表达了本发明的诸多实施方式中的少数,虽然其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!