靛玉红衍生物在制备他克莫司或环孢素的增效剂药物中的用途的制作方法
本发明涉及制药领域,特别涉及靛玉红衍生物在制备他克莫司或环孢素的增效剂药物中的用途。
背景技术:
靛蓝是青黛的主要成分,研究证明对肝药酶表达有调控作用。suy等从靛蓝中提取到其有效成分--靛玉红[suy,chengx,tanyh,etal.synthesisofadualfunctionalanti-mdrtumoragentphii-7withelucidationsofanti-tumoreffectsandmechanisms[j].plosone,2012,7(3):e32782]。phii-7是以靛玉红为模板合成的衍生物,其结构式为
在前期的研究中发现,它可调节细胞表面abcb1的表达,揭示核受体蛋白对abcb1的激活作用,体内外实验已经证明在有效剂量下对正常细胞毒性较低。
他克莫司(fk506)是目前临床最常用的免疫抑制剂,因其免疫抑制作用强,不良反应较少,临床中逐渐取代环孢素成为免疫系统疾病如肾病综合征、器官移植术后防治排斥反应的一线药物。然而该药物治疗窗窄,个体差异大,导致糖尿病等并发症的风险影响移植肾的长期存活,同时价格昂贵且需长期坚持服用。
他克莫司主要经肝脏及小肠的p450氧化酶(cyp3a4和cyp3a5)代谢,是糖蛋白p-gp的底物。周红等研究发现[周红,张菁,伍三兰,等.五酯胶囊对心脏移植受者全血他克莫司浓度的影响[j].医药导报,2017,36(02):158-162],五酯胶囊对他克莫司的药动学有影响,与fk506联用能明显提高志愿者和移植受者的fk506血药浓度及生物利用度。同时可改善肝功能和降低不良反应发生率,而发挥作用的是五酯胶囊中所含的五味子木脂素,五味子木脂素能抑制cyp3a活性,同时也是p-gp抑制剂。而五味子甲素(sch-a)是五味子木脂素中的主要成分,其通过介导cyp3a酶的代谢对他克莫司起增效作用。
尽管五酯胶囊对他克莫司的治疗效果有一定的增强作用,但由于其是一个中药组合物才,成分复杂,作用靶点不明确,而小分子化合物具有结构简单、成分单一,便于在临床应用时精确计算剂量的优点。因此,需要寻找一种小分子化合物来作为他克莫司的增效剂药物。
技术实现要素:
本发明的一个方面,是针对现有技术中缺少他克莫司或环孢素的小分子增效剂药物,提供了靛玉红衍生物在制备他克莫司或环孢素的增效剂药物中的用途。
在本说明书中,所述靛玉红衍生物的代号为phii-7。
本发明提供的技术方案为:
靛玉红衍生物在制备他克莫司或环孢素的增效剂药物中的用途,所述靛玉红衍生物的结构式如式1所示,
式1中
作为优选,在本发明的实施方式中,所述增效剂为提高所述他克莫司或环孢素的治疗效果的制剂。
更优选地,上述提高所述他克莫司或环孢素的治疗效果为提高他克莫司或环孢素的峰浓度、药时曲线下面积或药物清除率。
在本发明的实施方式中,发明人通过大鼠体内动物实验研究phii-7对他克莫司药代动力学的影响,8只大鼠随机分为对照组和实验组,每组四只,灌胃给药,两组大鼠于给药前和给药后不同时间点经大鼠颈静脉穿刺采血,测定fk506血药浓度,计算fk506主要药动学参数;采用mtt法检测phii-7、五味子甲素(schisandraa,sch-a)对人肝癌细胞株hepg2和结肠癌细胞株ls174t的ic50值;实时荧光定量pcr和免疫印迹法检测phii-7、sch-a对pxr/cyp3a4/3a5/abcb1基因的mrna和蛋白表达水平的影响;构建稳定转染cyp3a5/abcb1启动子的双荧光素酶报告基因,探索phii-7通过pxr对cyp3a5/abcb1启动子活性的调节作用。结果表明,与对照组比较,实验组药-时曲线下面积(auc0-t)、药物清除率(cl)明显增加(p<0.05);phii-7对hepg2和ls174t细胞的ic50分别为(17.82±1.33)和(7.17±0.37)umol·l-1,sch-a对hepg2和ls174t细胞的ic50分别为(40.38±4.1)和(44.1±1.94)umol·l-1;hepg2和ls174t细胞经phii-7和sch-a处理后,pxr、cyp3a4/3a5和abcb1基因的mrna和蛋白表达均显著降低,呈剂量依赖性与时间依赖性,且差异具有统计学意义(p<0.05);经phii-7处理转染h-pxr细胞可降低利福平诱导的cyp3a5、abcb1表达,且呈浓度依赖性。phii-7可提高fk506cmax、auc0-t、cl,表明phii-7是通过pxr-cyp3a5/abcb1信号通路调节fk506的代谢与转运,进而增加fk506疗效。
作为免疫抑制剂他克莫司或环孢素的增效剂,本发明所述靛玉红衍生物(其结构式如式1所示)在制备多种情形下的辅助药物中具有广泛应用,例如但不限于,制备患者经器官移植或造血干细胞移植后所服用的辅助药物,制备治疗肾病综合征的辅助药物,等。
患者在经器官移植或造血干细胞移植后通常需要服用免疫抑制剂,最常用的免疫抑制剂为他克莫司或环孢素,因此靛玉红衍生物可以作为上述免疫抑制剂的增效剂辅助免疫抑制剂的治疗。
上述靛玉红衍生物可以为任意合适的衍生物、水合物、药用盐等形式。作为优选,在本发明的实施方式中,所述靛玉红衍生物可以为其可药用盐、可药用酸加成盐或其氢溴酸盐的形式。
上述他克莫司或环孢素的增效剂药物可以为任意合适的剂型,包括但不限于,例如,片剂、胶囊剂、口服制剂、微胶囊剂、注射剂或颗粒剂。
本发明的另一个方面,是提供了一种他克莫司或环孢素的增效剂制品,所述增效剂制品包含:如式1所示的靛玉红衍生物;其他他克莫司或环孢素的增效剂药物。
为了增强靛玉红衍生物的效果,可以和其他他克莫司或环孢素的增效剂药物联用。作为优选,所述其他他克莫司或环孢素的增效剂药物为五酯胶囊。
本发明的有益效果为:
本发明首次对靛玉红衍生物phⅱ-7对他克莫司的增效作用及其分子机制进行系统的阐述:我们拟首先通过体内实验明确phⅱ-7对大鼠体内他克莫司药代动力学参数的影响,进而通过大鼠原代肝脏及小肠细胞,小肠上皮细胞模型、肝细胞模型及提取得到的肝微粒体等在细胞水平探索phⅱ-7对上述细胞cyp3a5/abcb1等蛋白的调节作用;最终通过构建cyp3a5/abcb1启动子双荧光素酶载体,探索phⅱ-7对pxr/cyp3a5/abcb1信号通路网络作用及调节的系统机制,为今后开发新的他克莫司增效剂提供依据。
与目前临床广泛使用的他克莫司增效剂五酯胶囊相比,靛玉红衍生物phⅱ-7作为小分子化合物具有结构简单、成分单一,便于在临床应用时精确计算剂量,具有较好的开发前景。
附图说明
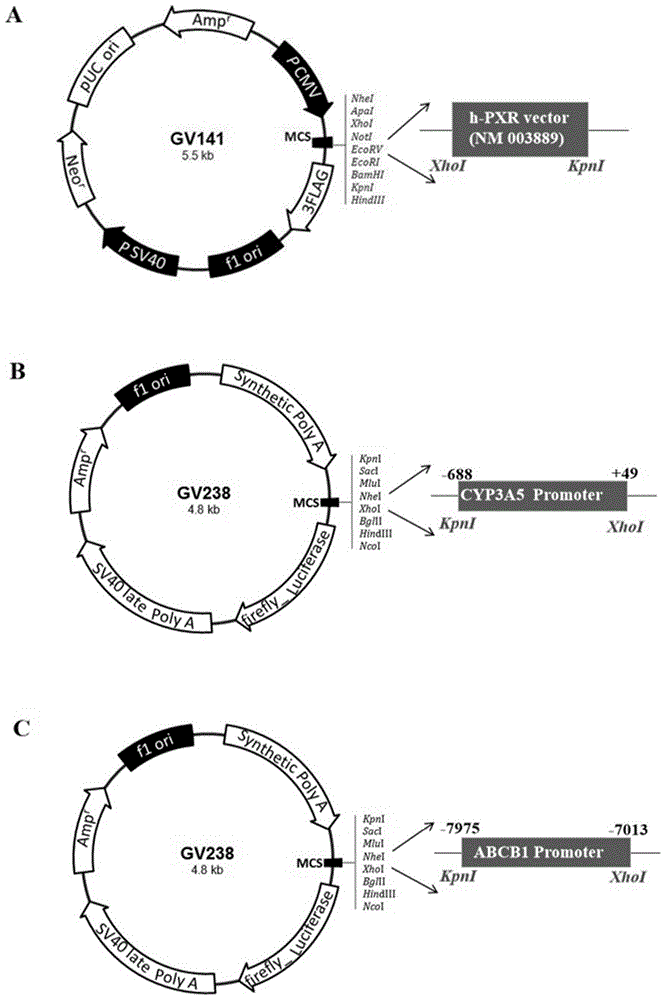
图1为质粒结构示意图,其中,a为克隆位点是xhoi/kpni的h-pxr质粒,b为克隆位点是kpni/xhoi的cyp3a5质粒;c为克隆位点是kpni/xhoi的abcb1质粒。
图2为fk506、phii-7、fk506+sch-a和fk506+phii-7四组大鼠中,fk506的血药浓度-时间曲线(
图3为phii-7和sch-a对hepg2和ls174t的效果图,sch-a作为阳性对照,其中,(a)不同浓度的phii-7作用于hepg2细胞24小时,(b)不同浓度的sch-a作用于hepg2细胞24小时,(c)不同浓度的phii-7作用于ls174t细胞24小时,(d)不同浓度的sch-a作用于ls174t细胞24小时;
图4为phii-7和五味子甲素sch-a对hepg2和ls174t中不同基因的影响图,其中,(a)不同浓度的phii-7作用于hepg2细胞24小时,(b)18μmol·l-1的phii-7作用于hepg2细胞24小时或72小时,(c)不同浓度的sch-a作用于hepg2细胞24小时,(d)40μmol·l-1的sch-a作用于hepg2细胞24小时或72小时,(e)不同浓度的phii-7作用于ls174t细胞24小时,(f)7μmol·l-1的phii-7作用于ls174t细胞24小时或48小时,(g)不同浓度的sch-a作用于ls174t细胞24小时,(h)44μmol·l-1的sch-a作用于ls174t细胞24小时或48小时,*p<0.05vs对照组,**p<0.01vs对照组;
图5为phii-7和五味子甲素sch-a对hepg2和ls174t中不同蛋白质的影响图,其中,(a)不同浓度的phii-7作用于hepg2细胞24小时,(b)18μmol·l-1的phii-7作用于hepg2细胞24小时或72小时,(c)不同浓度的sch-a作用于hepg2细胞24小时,(d)40μmol·l-1的sch-a作用于hepg2细胞24小时或72小时,(e)不同浓度的phii-7作用于ls174t细胞24小时,(f)7μmol·l-1的phii-7作用于ls174t细胞24小时或48小时,(g)不同浓度的sch-a作用于ls174t细胞24小时,(h)44μmol·l-1的sch-a作用于ls174t细胞24小时或48小时;
图6为phii-7对在转染了报告基因的细胞中,cyp3a5或abcb1启动子的转录活性的影像图,其中,hepg2细胞已被转染了编码人pxr的编码区载体,同时转染含有gv238-cyp3a5-mcs-luc报告基因(a)或gv238-abcb1-mcs-luc报告基因(b)载体,将该细胞用含有或不含有phii-7(1、9和18μmol·l-1)或ktz(25和50μmol·l-1)的空白对照(0.1%dmso)或rif(10μmol·l-1)处理24小时;ls174t细胞已被转染了编码人pxr的编码区载体,同时转染含有gv238-cyp3a5-mcs-luc报告基因(c)或gv238-abcb1-mcs-luc报告基因(d)载体,将该细胞用含有或不含有phii-7(1、3.5和7μmol·l-1)或ktz(25和50μmol·l-1)的空白对照(0.1%dmso)或rif(10μmol·l-1)处理24小时;然后检测荧光素酶活性;结果表明,靛玉红衍生物可降低核受体pxr诱导的cyp3a5或abcb1启动子转录活性,并减弱利福平诱导的cyp3a5或abcb1启动子转录活性的升高(均呈浓度依赖,随着靛玉红衍生物浓度的升高启动子转录活性逐渐降低),*p<0.05表明与对照组(n=3)相比,具有统计学上的显著效果。
具体实施方式
本发明公开了靛玉红衍生物在制备他克莫司或环孢素的增效剂药物中的用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。需要特别指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明,并且相关人员明显能在不脱离本发明内容、精神和范围的基础上对本文所述内容进行改动或适当变更与组合,来实现和应用本发明技术。
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。
为了使本领域的技术人员更好地理解本发明的技术方案,下面结合具体实施例对本发明作进一步的详细说明。
实验材料及仪器
1、实验动物
sd大鼠,清洁级,雄性,体质量(294.9±22.7)g,常州卡文斯实验动物有限公司提供,动物使用许可证号:scxk(苏)2016-0010。
2、药物
phii-7可根据申请号为94107957.0或200910068766.2的发明专利中的记载进行合成。原药用dmso溶解,配制成50mmol·l-1贮存液,sch-a购自中国药品检验所,原药用dmso溶解,配制成20mmol·l-1贮存液,分装后-20℃贮存备用,溶解后药物溶液中dmso的终浓度<1%。fk506购自上海麦克林生化科技有限公司,原药用55%peg400+25%丙二醇+20%水溶解成所需溶度使用。
3、培养基
dmem高糖培养基和胎牛血清购自gibco公司。
4、其他试剂
mtt、维拉帕米、利福平、酮康唑均购自sigma公司;bca定量试剂盒购自南京诺唯赞生物科技有限公司;双荧光素酶(lef)检测试剂购自美国promega公司;lipofectaminetm2000脂质体购自abm公司;rna提取试剂购自axygen公司;逆转录试剂盒和荧光定量pcr(q-pcr)试剂均购自日本takara公司;质粒提取试剂盒购自北京天根生化科技有限公司;兔抗人β-actin、abcb1、cyp3a4、cyp3a5的单克隆抗体均购自abcam公司;鼠抗人pxr的单克隆抗体购自proteitech公司;hrp标记的山羊抗兔igg抗体和山羊抗鼠ige抗体购自北京中杉金桥公司;β-actin、pxr、abcb1、cyp3a4、cyp3a5引物均由华大基因公司合成;pcdna-hpxr、abcb1-mcs、cyp3a5-mcs荧光素酶报告基因、海肾荧光素酶prl-tk质粒均购自上海吉凯公司。
5、细胞株及细胞培养
人肝癌细胞株hepg2和结肠癌细胞株ls174t均购自上海富衡细胞库。于10%胎牛血清高糖dmem培养基中,5%co2,37℃孵箱孵育。
6、实验仪器
高效液相色谱仪(美国,安捷伦公司);qt-2a涡旋混合器(上海,琪特分析仪器有限公司产品);co2细胞培养箱(德国,heraeus);倒置显微镜(日本,olypus);酶标仪(美国,clinibio);q-pcr仪(美国,应用生物系统公司);电泳仪(美国,伯乐公司)。
实施例1:大鼠体内药动学实验
1、动物的分组及处理
8只大鼠随机分为四组,分别为fk506或phii-7单用组、联用组:(fk506+sch-a),或(fk506+phii-7),每组四只,灌胃给药,给药前大鼠禁食8h(自由饮水),每组分别给予fk5061.89mg·kg-1、phii-73mg·kg-1、fk506+scha:1.89mg·kg-1+10mg·kg-1,实验组给予fk506+phii-7:1.89mg/·kg-1+3mg·kg-1,给药一次,给药4h后给予动物饲料。各组大鼠于给药前及给药后0.0167、0.5、0.75、1、2、3、4、6、8、12和24h经大鼠颈静脉穿刺采血,采集约0.2ml置于edta抗凝管,血液样本分析前存放于-80℃冰箱。
2、样本检测条件
色谱条件:色谱柱:accucorec18(2.1×50mm2.6μm),流动相:0.1%甲酸+10mm醋酸铵水溶液(a):甲醇(b),梯度洗脱,柱温:40℃,进样体积:6μl。
质谱条件:absciex5500三重四级杆串联质谱系统,离子源为esi源,气帘气压力:35psi,喷撞气:8psi,离子化电压:5500psi,离子源温度:550℃,喷雾气:55psi,辅助加热器:55psi,多重反应监测(mrm)模式。检测条件如表1所示。
表1不同样本检测条件
3、样本处理检测
取20μl血浆样品置于1.5ml离心管中,加入180μl内标乙腈溶液(tbtm40ng·ml-1),涡旋2min,13000rpm(8℃)离心10min,取上清液,进样6μl检测。
4、实验结果
根据血药浓度测定结果,以时间为横坐标,血药浓度为纵坐标,绘制两组大鼠fk506药-时曲线(如图2所示),大鼠血浆中fk506药动学参数计算结果如表2所示。
结果显示,与fk506+sch-a组比较,fk506+phii-7组auc0-t、cl明显增加(p<0.05);提示phii-7像sch-a一样,可提高fk506cmax,增加auc0-t、cl。
表2不同组大鼠中fk506的药代动力学参数
*p<0.05vsfk506+sch-a组。
实施例2:细胞活力检测
取对数生长期的hepg2和ls174t细胞接种于96孔板中培养(每孔约15000个细胞),在37℃,5%co2条件下培养24h,分组加药,每个浓度设3个平行孔,实验组加入不同浓度的phii-7(0~30umol·l-1)和sch-a(0~60umol·l-1),阴性对照组加入等体积的培养基,使每孔的终体积为200ul,继续培养24h,每孔加入20ulmtt,避光温育4h后,弃上清,每孔加入150uldmso,振荡混匀后于酶标仪波长490nm处测吸光度。实验重复三次计算平均半数抑制浓度(50%concentrationofinhibition,ic50值)。
实验结果:
采用mtt比色法观察细胞生长抑制作用。结果显示,phii-7和sch-a对hepg2和ls174t细胞均有生长抑制作用,phii-7对hepg2和ls174t细胞的ic50分别为(17.82±1.33)和(7.17±0.37)umol·l-1。sch-a对hepg2和ls174t细胞的ic50分别为(40.38±4.1)和(44.1±1.94)umol·l-1(结果如图3所示)。
实施例3:实时荧光定量pcr检测pxr/cyp3a4/cyp3a5/abcb1基因的表达
接种2.5×105个/ml状态良好的hepg2和ls174t细胞于6孔板中,每孔2ml,其中实验分组进行如下处理:9umol·l-1phii-7孵育hepg2细胞24h,18umol·l-1phii-7分别孵育hepg2细胞24h和72h;3.5umol·l-1phii-7孵育ls174t细胞24h,7umol·l-1phii-7分别孵育ls174t细胞24h和48h;20umol·l-1sch-a孵育hepg2细胞24h,40umol·l-1sch-a分别孵育hepg2细胞24h和48h;22umol·l-1sch-a孵育ls174t细胞24h,44umol·l-1sch-a分别孵育ls174t细胞24h和48h,分别收集对照组和处理组细胞,使用trizol提取细胞总rna,cdna合成根据takaracdna合成试剂盒说明操作,q-pcr检测细胞内各个基因表达水平,内参为β-actin。反应条件:95℃预变性30s,95℃5s,60℃退火34s,40个循环。各组设3个平行孔,反应结束后,设定阈值,软件输入ct值。根据比较ct值法公式2-δδct,其中δδct=实验组(ct目的基因-ct管家基因)-对照组(ct目的基因-ct管家基因),获得不同组间相关基因表达值。
根据gene-bank数据库提供的基因序列信息,采用primer5.0软件设计引物,并经blast分析,由华大基因公司合成。本研究所用的引物序列如表3所示。
表3实时荧光定量pcr引物序列
实验结果:
将不同浓度phii-7和sch-a分别作用于hepg2和ls174t细胞,作用不同时间后,与control组相比,phii-7和sch-a加药处理后,hepg2和ls174t细胞的pxr、cyp3a4、cyp3a5和abcb1基因mrna表达显著降低,且呈剂量依赖性与时间依赖性(结果如图4所示)。
实施例4:免疫印迹法检测pxr/cyp3a4/3a5/abcb1蛋白的表达
接种2.5×105个/ml的hepg2和ls174t细胞于6孔板中,每孔2ml,其中实验分组进行如下处理:9umol·l-1phii-7孵育hepg2细胞24h,18umol·l-1phii-7分别孵育hepg2细胞24h和72h;3.5umol·l-1phii-7孵育ls174t细胞24h,7umol·l-1phii-7分别孵育ls174t细胞24h和48h;20umol·l-1sch-a孵育hepg2细胞24h,40umol·l-1sch-a分别孵育hepg2细胞24h和48h;22umol·l-1sch-a孵育ls174t细胞24h、44umol·l-1sch-a分别孵育ls174t细胞24h和48h,分别收集对照组和处理组细胞,ripa裂解后蛋白定量并用于westernblot检测。以每孔上样量50ug进行sds-聚丙烯酰胺凝胶电泳,将蛋白样品转移至pvdf膜,封闭后分别孵育pxr(1:1000)、abcb1(1:1000)、cyp3a4(1:5000)、cyp3a5(1:10000)及β-actin抗体(1:10000),4℃孵育过夜,再与二抗室温孵育1h,化学发光法发光曝片。
实验结果:
将不同浓度phii-7和五味子甲素分别作用于hepg2和ls174t细胞,作用不同时间后,与control组相比,phii-7和五味子甲素加药处理后,hepg2和ls174t细胞的pxr、cyp3a4、cyp3a5和abcb1蛋白表达显著降低,且呈剂量依赖性与时间依赖性(结果如图5所示)。
实施例5:瞬时转染和报告基因检测
取对数生长期hepg2或ls174t细胞接种24孔板,待融合率为70%~80%时。用lipofectaminetm2000脂质体、无酚红rpmi1640进行转染。将pcdna-hpxr或空载体(455ng)、abcb1-mcs或cyp3a5-mcs荧光素酶报告基因(455ng)和prl-tk(90ng)作为内对照。转染6h后,每组设3个平行孔,用不同药物处理细胞24h后收集细胞,pbs洗涤3次,每孔加入100ul细胞裂解液,避光裂解15min,用酶标仪测定荧光素酶活性。以萤火虫荧光素酶的活性与海肾荧光素酶活性的比值表示被检测的质粒在转染细胞后所测得的荧光素酶相对活性。实验所用质粒由上海吉凯公司提供(如图1所示),质粒的序列信息如表4所示。
表4pcr引物及pcr扩增产物大小
实验结果:
本实验通过双荧光素酶报告基因实验研究abcb1和cyp3a5启动子在报告基因转染的hepg2和ls174t细胞中的pxr反活化。如图所示,在转染空质粒的细胞中,报告基因的活性不受phii-7处理的影响。在转染hpxr的细胞中,phii-7处理显著激活了abcb1和cyp3a5启动子,但当单用phii-7(hepg2:1、9、18umol·l-1;ls174t:1、3.5、7umol·l-1)对启动子活性无明显影响。而当用利福平(10umol·l-1)诱导时,再加药phii-7(hepg2:1、9、18umol·l-1;ls174t:1、3.5、7umol·l-1)时abcb1和cyp3a5启动子活性明显下降。ktz被用作abcb1和cyp3a5抑制剂的阳性对照。这些结果表明phii-7可能是pxr的拮抗剂(结果如图6所示)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!