一种治疗IL-6相关疾病的人源化抗体的液体制剂的制作方法
分案申请相关信息
本案是分案申请。该分案的母案是申请日为2018年11月30日、申请号201811453328.3、发明名称为“一种治疗il-6相关疾病的人源化抗体的液体制剂”的发明专利申请案。
相关申请交叉引用
本申请要求2017年11月30日递交的,申请号为201711239538.8,标题为“一种治疗il-6相关疾病的人源化抗体的液体制剂”的发明专利的优先权,其以全文引用的方式并入本文中。
本发明涉及一种治疗白介素6(il-6)相关疾病的人源化抗体的液体制剂。
背景技术:
抗白介素6受体人源化抗体是一种可用于治疗类风湿关节炎(ra)的药物[1],其作用机制是特异性结合可溶性及膜结合的il-6受体(sil-6r和mil-6r),并抑制sil-6r和mil-6r介导的信号传导。
il-6在ra的发病过程中起着中枢性作用[2]。它能激活内皮细胞增殖和新的血管形成,并在血管内皮细胞表达内皮细胞粘附分子-1(icam-1)和血管细胞粘附分子-1(vcam-1),进一步促进血液中的淋巴细胞、中性粒细胞等迁移进入关节;能够激活破骨细胞导致软骨和骨损伤;促进原始t细胞向th17分化,th17促进t细胞向加重ra炎症反应的th1类型分化,抑制treg分化。th17/treg失衡使免疫系统对炎症扩大的抑制作用和免疫耐受减弱,是很多自身免疫性疾病和慢性炎症的重要病理过程。此外,抗白介素6受体人源化抗体通过降低il-6刺激的铁调素的生成,而使铁的利用度升高,从而提高血红蛋白水平,改善ra伴随的贫血;通过抑制il-6的jak/stat信号传导,使肝细胞分泌的急性期反应蛋白crp及血清淀粉样蛋白a水平快速下降,血沉速率下降,全身性炎症反应得到控制。抗白介素6受体人源化抗体能够特异性阻断il-6与il-6受体的结合,减少局部炎症细胞浸润和炎症因子生成,减缓关节炎症引起的关节疼痛、肿胀和软骨、骨关节破坏,减轻炎症引起的乏力、食欲减退和贫血等全身症状,对于传统抗风湿化学药物治疗无效的中重度类风湿关节炎患者具有良好的治疗效果。
ra分布于世界各地。近年来多数研究者认为ra的发病率大约1%左右,女性患者较多,大约为男性患者的3倍。风湿关节炎在各年龄中均可发病,成人多见于中年女性,绝经期为发病高峰。美国统计35至44年龄组患病率0.9%,以后随年龄的增加而增高,55至64岁为2.9%,大于65岁达4.90%【3】。据统计,我国ra患病率约0.24%~0.4%【4】,随着人口老龄化增加,ra患病率还将增高。ra是造成我国劳动力丧失和致残的主要疾病之一。大部分ra患者病情呈进展性,破坏性。在出现症状两年内,50%--90%的患者有关节受损的放射学的改变,未经治疗的患者2年致残率约50%,3年致残率70%,而且一旦出现骨破坏改变,不可逆转【5】。积极、正确的治疗可使80%以上的类风湿关节炎患者病情缓解。
本发明所开发的抗体制剂,包含活性成分抗白介素6受体人源化抗体,用于治疗il-6引起的相关疾病。为了提供活性稳定的抗体产品,有必要开发有利于抗体稳定保存的制剂,使抗体的功能和结构得以长期保持。
技术实现要素:
本发明的目的在于提供一种稳定的包含单克隆抗体的液体制剂。
本发明的目的通过以下技术手段实现:
一方面,本发明提供了一种抗体制剂,所述抗体制剂包括抗白介素6受体人源化抗体、缓冲液体系、稳定剂和表面活性剂。具体地,本发明的抗体制剂含有以下组分:
(1)抗体:2~100mg/ml的抗il-6受体人源化抗体;
(2)缓冲体系:通过缓冲剂在所述制剂中形成缓冲体系,所述缓冲体系为5~20mm组氨酸盐缓冲液,或者5~20mm组氨酸盐与5-20mm醋酸钠的组合的缓冲液;
(3)表面活性剂:0.1~1g/l;
(4)稳定剂:30~400mm;
(5)注射用水。
所述抗体制剂的ph为5.0-7.0。
所述抗白介素6受体人源化抗体是通过基因工程手段,在cho细胞中表达的,并且通过一系列标准的层析步骤纯化获得的。在制备抗体后,制备药物制剂。
作为优选的实施方式,所述抗il-6受体人源化抗体在制剂中的浓度为10-90mg/ml;作为更优选的实施方式,所述抗il-6受体人源化抗体在制剂中的浓度为15-50mg/ml;作为特别优选的实施方式,所述抗il-6受体人源化抗体在制剂中的浓度为18-25mg/ml;作为最优选的实施方式,所述抗il-6受体人源化抗体在制剂中的浓度为20mg/ml。
作为优选的实施方式,所述的抗体含有seqidno.1所示的重链以及seqidno.2所示的轻链;作为更优选的实施方式,所述抗体为bat1806;进一步地,所述的bat1806含有2条seqidno.1所示的重链以及2条seqidno.2所示的轻链。
其中,所述的稳定剂选自精氨酸盐酸盐和蔗糖的组合、或者甘露醇、或者氯化钠;进一步地,选自50~200mm(10.533~42.132g/l)精氨酸盐酸盐和58~205mm(20~70g/l)蔗糖的组合;或者选自167~388mm(30~70g/l)甘露醇;又或者选自100~300mm(5.85~17.55g/l)氯化钠。
其中,所述的表面活性剂选自聚山梨酯-20、聚山梨酯-80、泊洛沙姆188中的一种或几种。作为优选的实施方式,所述的表面活性剂选自聚山梨酯-80;进一步地,所述表面活性剂选自0.1-0.7g/l聚山梨酯-80。
作为优选的实施方式,所述的抗体制剂的ph为5.5~6.5;作为更优选的实施方式,所述抗体制剂的ph为6.0~6.4;作为还更优选的实施方式,所述抗体制剂的ph为6.2。
作为优选的实施方式,本发明的抗体制剂含有以下组分:
(1)18~22mg/ml的抗il-6受体人源化抗体;
(2)8~15mm组氨酸盐缓冲液;
(3)0.45g/l~0.65g/l聚山梨酯80;
(4)40~60mm精氨酸盐酸盐;
(5)15~25g/l蔗糖;
(6)注射用水;
ph为6.0~6.4;
或者优选地,含有以下组分:
(1)18~22mg/ml的抗il-6受体人源化抗体;
(2)8~15mm组氨酸盐缓冲液;
(3)0.45~0.65g/l聚山梨酯80;
(4)30~45g/l甘露醇;
(5)注射用水;
(6)ph为6.0~6.4;
又或者优选地,含有以下组分:
(1)18~22mg/ml的抗il-6受体人源化抗体;
(2)8~15mm组氨酸盐;
(3)0.45~0.65g/l聚山梨酯80;
(4)90~110mm氯化钠;
(5)注射用水;
ph为6.0~6.4。
作为更优选的实施方式,本发明的抗体制剂含有以下组分:
(1)20mg/ml的抗il-6受体人源化抗体;
(2)10mm组氨酸盐缓冲液;
(3)0.5g/l聚山梨酯80;
(4)50mm精氨酸盐酸盐;
(5)20g/l蔗糖;
(6)注射用水;
ph为6.2;
或者更优选地,含有以下组分:
(1)20mg/ml的抗il-6受体人源化抗体;
(2)10mm组氨酸盐缓冲液;
(3)0.5g/l聚山梨酯80;
(4)30g/l甘露醇;
(5)注射用水;
ph为6.2;
或者更优选地,含有以下组分:
(1)20mg/ml的抗il-6受体人源化抗体;
(2)10mm组氨酸盐缓冲液;
(3)0.5g/l聚山梨酯80;
(4)42g/l甘露醇;
(5)注射用水;
ph为6.2;
又或者更优选地,含有以下组分:
(1)20mg/ml的抗il-6受体人源化抗体;
(2)10mm组氨酸盐缓冲液;
(3)0.5g/l聚山梨酯80;
(4)100mm氯化钠;
(5)注射用水;
ph为6.2。
本发明的抗体制剂还含有碱,用于调节ph。在本发明作为示范性的实施例中,所述的碱为naoh。
本发明的抗体制剂为含水制剂,其剂型为注射制剂。该制剂适用于进行皮下注射或静脉注射。
另一方面,本发明还提供了上述抗体制剂的制备方法,其包含以下步骤:
(1)将称好的缓冲剂、稳定剂、表面活性剂溶解在注射用水中;
(2)用氢氧化钠水溶液调节步骤(1)配置好的液体至ph为5-7;优选地,氢氧化钠水溶液的浓度为1m;
(3)将步骤(2)制备得到的液体过滤到无菌容器;优选地,过滤的膜的孔径为0.22um,用于过滤细菌和真菌;
(4)将步骤(3)制备得到的液体加到抗体液中。
本发明的抗体制剂为治疗与il-6相关疾病的药物制剂;具体地,所述与il-6相关疾病为:成人类风湿关节炎、全身型幼年特发性关节炎、多关节型幼年特发性关节炎、巨细胞动脉炎、巨淋巴结增生症、免疫治疗引起的细胞因子风暴、成人斯蒂尔病、复发性多软骨炎、ⅱ型糖尿病、强直性脊柱炎、甲状腺相关性眼病、类风湿关节炎引起的心血管疾病、风湿性多肌痛、急性移植物抗宿主病、非st段抬高型心肌梗死、系统性红斑狼疮、精神分裂症、葡萄膜炎、卵巢癌、抗中性粒细胞胞浆抗体相关的血管炎、视神经脊髓炎、慢性肾小球肾炎、结直肠癌等等;作为优选实施方式,所述与il-6相关疾病为成人类风湿关节炎、全身型幼年特发性关节炎、多关节型幼年特发性关节炎、巨细胞动脉炎、巨淋巴结增生症。
在本发明优选的实施例中,所述的抗体为bat1806,是采用重组dna技术在cho-k1中进行生产,经澄清获得培养上清,然后进行纯化的人用单克隆抗体。其作用机制是特异性结合可溶性及膜结合的il-6受体(sil-6r和mil-6r),并抑制sil-6r和mil-6r介导的信号传导。对成人类风湿关节炎、全身型幼年特发性关节炎、多关节型幼年特发性关节炎、巨细胞动脉炎、巨淋巴结增生症、免疫治疗引起的细胞因子风暴等il-6相关的疾病有良好的治疗作用。
本发明所提供的抗体制剂中,为了保持抗白介素6受体人源化抗体的稳定性,通过选择适当的缓冲体系、优化稳定剂和添加表面活性剂,经过大量的研究工作,开发得到的抗体制剂可以显著抑制冷冻/解冻循环期间、长期存储和温度变化过程中酸峰、二聚物、多聚物、降解物和不溶性微粒的形成,具体地,抗白介素6受体人源化抗体在上述制剂中,在经过至少5次冻融循环后保持稳定性,在室温可稳定保存至少6个月,在4℃可稳定保存36个月。因此本发明的抗体制剂可用于稳定地保存临床治疗用的抗白介素6受体人源化抗体,对于治疗il-6引起的相关疾病有重大意义。
附图说明
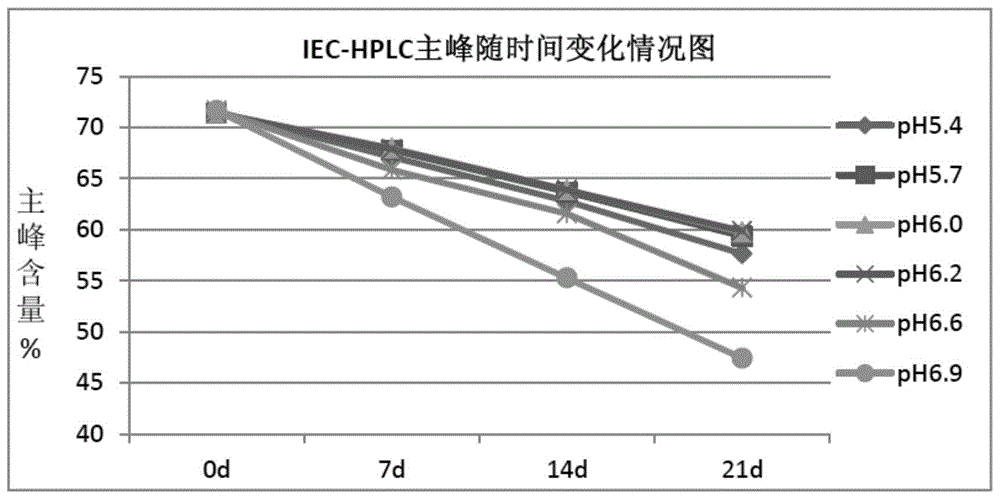
图1a抗白介素6受体人源化抗体bat1806制剂处方ph筛选(40℃高温)iec-hplc主峰分析;
图1b抗白介素6受体人源化抗体bat1806制剂处方稳ph筛选(40℃高温)sec-hplc主峰分析。
图2a抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(50℃高温)sec主峰分析;
图2b抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(50℃高温)sec多聚体分析;
图2c抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(50℃高温)sec片段分析;
图2d抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(50℃高温)iec主峰分析;
图2e抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(50℃高温)iec酸峰分析;
图示说明(图2a-2e):
zt(pb):15mmpbs缓冲液,5%蔗糖,蛋白浓度20mg/ml,ph=6.5;
zt(his):10mmhis缓冲液,5%蔗糖,蛋白浓度20mg/ml,ph=6.2;
arg-hcl:10mmhis缓冲液,100mm盐酸精氨酸,蛋白浓度20mg/ml,ph=6.2;
pro:10mmhis缓冲液,100mm脯氨酸,蛋白浓度20mg/ml,ph=6.2;
nacl:10mmhis缓冲液,100mm氯化钠,蛋白浓度20mg/ml,ph=6.2;
glc:10mmhis缓冲液,4.2%甘露醇,蛋白浓度20mg/ml,ph=6.2;
arg-hcl+zt:10mmhis缓冲液,50mm盐酸精氨酸,2%蔗糖,蛋白浓度20mg/ml;ph=6.2;
arg-hcl(naac):10mm醋酸钠缓冲液,100mm盐酸精氨酸,蛋白浓度20mg/ml,ph=6.2;
0d:第0天;4d:第4天;8d:第8天;12d:第12天。
图3a抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(40℃高温)sec主峰分析;
图3b抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(40℃高温)sec多聚体分析;
图3c抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(40℃高温)sec片段分析;
图3d抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(40℃高温)iec主峰分析;
图3e抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(40℃高温)iec酸峰分析;
图式说明(图3a-3e):
zt(pb):15mmpbs缓冲液,5%蔗糖,蛋白浓度20mg/ml,ph=6.5;
zt(his):10mmhis缓冲液,5%蔗糖,蛋白浓度20mg/ml,ph=6.2;
arg-hcl:10mmhis缓冲液,100mm盐酸精氨酸,蛋白浓度20mg/ml,ph=6.2;
pro:10mmhis缓冲液,100mm脯氨酸,蛋白浓度20mg/ml,ph=6.2;
nacl:10mmhis缓冲液,100mm氯化钠,蛋白浓度20mg/ml,ph=6.2;
glc:10mmhis缓冲液,4.2%甘露醇,蛋白浓度20mg/ml,ph=6.2;
arg-hcl+zt:10mmhis缓冲液,50mm盐酸精氨酸,5%蔗糖,蛋白浓度20mg/ml;ph=6.2;
arg-hcl(naac):10mm醋酸钠缓冲液,100mm盐酸精氨酸,蛋白浓度20mg/ml,ph=6.2;
0d:第0天;7d:第7天;14d:第14天;25d:第25天。
图4a抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(光照4000lx)sec主峰分析;
图4b抗白介素6受体人源化抗体bat1806制剂处方稳定剂筛选(光照4000lx)iec主峰分析;
图式说明(图4a-4b):
zt(pb):15mmpbs缓冲液,5%蔗糖,蛋白浓度20mg/ml,ph=6.5;
zt(his):10mmhis缓冲液,5%蔗糖,蛋白浓度20mg/ml,ph=6.2;
arg-hcl:10mmhis缓冲液,100mm盐酸精氨酸,蛋白浓度20mg/ml,ph=6.2;
pro:10mmhis缓冲液,100mm脯氨酸,蛋白浓度20mg/ml,ph=6.2;
nacl:10mmhis缓冲液,100mm氯化钠,蛋白浓度20mg/ml,ph=6.2;
glc:10mmhis缓冲液,4.2%甘露醇,蛋白浓度20mg/ml,ph=6.2;
arg-hcl+zt:10mmhis缓冲液,50mm盐酸精氨酸,5%蔗糖,蛋白浓度20mg/ml;ph=6.2;
arg-hcl(naac):10mm醋酸钠缓冲液,100mm盐酸精氨酸,蛋白浓度20mg/ml,ph=6.2;
0d:第0天;7d:第7天;14d:第14天。
图5a制剂e和f在加速条件下的sec趋势变化图;
图5b制剂e和f在加速条件下的iec趋势变化图;
图5c制剂e和f在加速条件下的ce(非还原)趋势变化图。
图6a制剂e的高温和光照sec趋势变化图;
图6b制剂e的高温和光照iec趋势变化图;
图6c制剂e的高温和光照ce(非还原)趋势变化图。
图7a抗白介素6受体人源化抗体bat1806对cia模型治疗效果评价:esr:红细胞沉降率;*p<0.05
图7b抗白介素6受体人源化抗体bat1806对cia模型治疗效果评价:il-6:白介素6;*p<0.05
图7c抗白介素6受体人源化抗体bat1806对cia模型治疗效果评价;il-6r:白介素6受体;*p<0.05
图式说明(图7a-7c):
0d:建模前;28d:建模成功后/给药前;40d:给药后第7天。
图8a抗白介素6受体人源化抗体bat1806的静脉注射药代动力学研究;
图8b抗白介素6受体人源化抗体bat1806的皮下注射药代动力学研究。
具体实施方式
本发明通过对缓冲液和稳定剂进行筛选,开发出抗体制剂配方,可以增强抗白介素6受体人源化抗体制剂的稳定性,防止单克隆抗体聚集、降解和酸性异构体增多。
本文的“稳定性”、“稳定”,是指包含抗体(包括其抗体片段)的液体制剂中,抗体(包括其抗体片段)在给定的生产、制备、运输和/或贮存条件下不发生、或仅极少地发生聚集、降解或片段化。“稳定”制剂在给定的生产、制备、运输和/或贮存条件下保持生物学活性。可通过例如sec-hplc、iec-hplc、ce-sds等技术测量所述制剂的聚集、降解或片段化程度等,从而评估所述抗体(包括其抗体片段)的稳定性。
需要说明的是,本发明中,如涉及到制剂中含有缓冲液或者缓冲体系,也是指制剂中含有缓冲剂,而通过缓冲剂在所述的制剂中形成缓冲体系。
在本发明的一种实施方案中,所述单克隆抗体在所述抗体制剂中的浓度为大约2~100mg/ml;作为优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为10-90mg/ml;作为更优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为15-50mg/ml;作为更优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为18-25mg/ml;作为特别优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为18-22mg/ml;作为最优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为20mg/ml。该实施方案中,评价了不同缓冲体系如:磷酸盐(pb)缓冲液、组氨酸盐(his)缓冲液、柠檬酸盐cb(nms)缓冲液、磷酸盐+醋酸(hac)缓冲液、柠檬酸盐+醋酸缓冲液、组氨酸盐+醋酸钠(naac)缓冲液共六种缓冲液体系对抗体稳定性的影响。在上述缓冲液中,组氨酸盐缓冲液和组氨酸盐+醋酸钠缓冲液效果最好,柠檬酸盐缓冲液和磷酸盐+醋酸缓冲液效果次之,单独使用pb缓冲液效果最差。
在本发明的另一种实施方案中,所述单克隆抗体在所述抗体制剂中的浓度为大约2~100mg/ml;作为优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为10-90mg/ml;作为更优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为15-50mg/ml;作为更优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为18-25mg/ml;作为特别优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为18-22mg/ml;作为最优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为20mg/ml。该实施方案中,评价了在缓冲液中加入适当的稳定剂,如:蔗糖(zt)、甘露醇(glc)、精氨酸盐酸盐(arg-hcl)、脯氨酸(pro)、氯化钠(nacl)对抗体稳定性的影响。稳定剂的添加进一步增加了制剂的稳定性,各种稳定剂对抗体的稳定作用效果差别不大。
在本发明的另一种实施方案中,所述单克隆抗体在所述抗体制剂中的浓度为大约2~100mg/ml;作为优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为10-90mg/ml;作为更优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为15-50mg/ml;作为更优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为18-25mg/ml;作为特别优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为18-22mg/ml;作为最优选的实施方式,所述单克隆抗体在所述抗体制剂中的浓度为20mg/ml。该实施方案中,评价了在含有适当缓冲液和稳定剂的处方中加入适当的表面活性剂(去污剂)如:聚山梨酯-20、聚山梨酯-80和泊洛沙姆188,对反复冻融后制剂处方中不溶性微粒产生的影响。不同种类的上述表面活性剂,均可减少冻融后制剂处方中不溶性微粒产生,不同种类表面活性剂之间差异不大。
通过对缓冲液、稳定剂和表面活性剂的筛选,筛选出优选处方。其中一种处方可以为:20mg/ml有效量的抗白介素6受体人源化抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,50mm精氨酸盐酸盐,20g/l蔗糖,注射用水,ph6.0~6.4;另一种处方可以为:20mg/ml有效量的抗il-6受体人源化抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,30g/l甘露醇,注射用水,ph6.0~6.4;另一种处方可以为:20mg/ml有效量的抗il-6受体人源化抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,42g/l甘露醇,注射用水,ph6.0~6.4;另一种处方也可以为:20mg/ml有效量的抗il-6受体人源化抗体,10mm组氨酸盐酸盐,0.5g/l聚山梨酯80,100mm氯化钠,注射用水,ph6.0~6.4;另一种处方可以为:50mg/ml有效量的抗白介素6受体人源化抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,50mm精氨酸盐酸盐,20g/l蔗糖,注射用水,ph6.0~6.4。
本发明抗il-6受体人源化抗体制剂的各种组分中,缓冲体系成为最关键的控制环节之一,并且为了获得好的稳定性,缓冲体系优选组氨酸盐缓冲体系。缓冲液除了提供该抗体的最适ph范围外,可能还有一些稳定剂的作用,对缓冲液的种类进行筛选是有必要的。不同抗体类型的稳定性受不同因素的影响程度及影响结果各不相同。本发明的制剂体系的设计是发明人以丰富的经验为基础设计出来的一些备选方案。但其最终实验结果仍然是不可被预期的或需要长期储存试验的检验。外源缓冲体系并非对所有种类抗体的制剂稳定性均有重要影响,例如,对于另一种抗体,比如adalimumab,根据稳定性筛选结果经验,则其最关键的影响因素是稳定剂的选择,而非缓冲体系,因为高浓度蛋白本身的缓冲作用即可在储存期内维持ph在最适范围之内。
对上述优选制剂处方的稳定性、体内外药效、药代动力学进行评价,本发明所述抗体制剂在室温可稳定保存至少6个月,在4℃可稳定保存36个月,在经过至少5次冻融循环后保持稳定性。上述优选制剂处方具有相似的体内外药效和药代动力学特征。
本发明的包含单克隆抗体的液体制剂提供了能够稳定保存活性成分的制剂组合,优选处方的制剂配方如下,分别以a、b、c、d、e、f制剂表示:
表1a.抗白介素6受体人源化抗体bat1806的制剂a成份列表
表1b.抗白介素6受体人源化抗体的制剂b成份列表
表1c.抗白介素6受体人源化抗体的制剂c成份列表
表1d.抗白介素6受体人源化抗体的制剂d成份列表
表1e.抗白介素6受体人源化抗体的制剂e成份列表
表1f.抗白介素6受体人源化抗体的制剂f成份列表
综上而言,本发明提供保护单克隆抗体的抗体制剂处方,该制剂处方可以包含以下成分:2~100mg/ml的抗体,5~20mm组氨酸盐缓冲液,0.25-1g/l聚山梨酯80,以及稳定剂,稳定剂选自50~120mm精氨酸盐酸盐和10-50g/l蔗糖组合,或10-50g/l甘露醇,或50~120mm氯化钠,ph为5.0~7.0。一种优选处方是:20mg/ml的抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,50mm精氨酸盐酸盐,20g/l蔗糖,调节ph的氢氧化钠和注射用水,ph为5.0~7.0(简称为制剂a)。另一种优选处方是:20mg/ml的抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,30g/l甘露醇,调节ph的氢氧化钠和注射用水,ph为5.0~7.0(简称为制剂b)。另一种优选处方是:20mg/ml的抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,42g/l甘露醇,调节ph的氢氧化钠和注射用水,ph为5.0~7.0(简称为制剂c)。另一种优选处方还可以是:20mg/ml的抗体,10mm组氨酸盐,0.5g/l聚山梨酯80,100mm氯化钠,调节ph的氢氧化钠和注射用水,ph为5.0~7.0(简称为制剂d)。另一种处方可以为:50mg/ml的抗体,10mm组氨酸盐缓冲液,0.5g/l聚山梨酯80,50mm精氨酸盐酸盐,20g/l蔗糖,调节ph的氢氧化钠和注射用水,ph6.0~6.4(简称为制剂f)。总之,本发明所提供的抗体制剂中,通过选择适当的缓冲体系、优化稳定剂和添加表面活性剂,可以有效抑制由于冷冻/解冻循环、长期存储和温度、光照变化过程中酸峰、多聚物、降解物和不溶性微粒的增多,活性成分能够长期稳定保存。其中缓冲体系的选用对制剂的稳定有着最为重要的作用,相对于磷酸盐缓冲液,选用组氨酸盐缓冲液可以显著抑制长期存储和温度变化过程中酸性异构体、多聚物和降解物的形成。
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
需要说明的是,本发明中,“质量体积比”为组分的质量与制剂的体积比。
“组氨酸盐缓冲体系”为组氨酸和组氨酸盐酸盐的组合。作为一种优选实施例,优选含有0.81g/l的组氨酸、1.01g/l组氨酸盐酸盐的缓冲液。
抗体样品
bat1806抗体为抗白介素6受体人源化抗体,通过抗体制备技术构建能够稳定表达bat1806的cho细胞株,收获表达上清后通过proteina柱子纯化后获得。
实施例1制剂制备
本发明的包含单克隆抗体的液体制剂提供了能够稳定保存活性成分的制剂组合,优选方案的制剂配方如表1a、表1b、表1c、表1d、表1e、表1f。
本发明的抗体制剂的制备方法为:
(1)将称好的缓冲剂、稳定剂、表面活性剂溶解在注射用水中;
(2)用氢氧化钠水溶液调节步骤(1)配置好的液体至ph为5-7;优选地,氢氧化钠水溶液的浓度为1m;
(3)将步骤(2)制备得到的液体过滤到无菌容器;优选地,过滤的膜的孔径为0.22um;
(4)将步骤(3)制备得到的液体加到抗体液中。
作为一个示范性的例子,本发明制备10l制剂a的制剂缓冲液(不含抗体bat18106)的方法如下:
称量出以下量的成分:10.08g组氨酸、7.34g组氨酸盐酸盐,105.33g精氨酸盐酸盐,200g蔗糖,5ml聚山梨酯80。将氢氧化钠溶解在注射用水中使其成为浓度1m的溶液。
将上述称好的成分溶解在大约9l的注射用水中,添加制剂成分的顺序并不会影响制剂质量,可自由选择。
在添加上述制剂成分之后,添加1m的氢氧化钠调节ph,最后加注射用水定容至10l,然后通过0.22um孔径,亲水性聚偏二氟乙烯的过滤膜,将上述10l制剂过滤到无菌容器中。
制备10l制剂a(含抗体bat18006)的方法如下:
在制备好上述已无菌过滤的制剂a的制剂缓冲液(不含抗体bat1806)后,将上述制剂a的缓冲液加到抗体浓缩物中。在制备包含抗体的液体制剂之前,在水浴(常温)中对所述抗体浓缩物进行解冻。无菌操作,在搅拌状态下添加上述制剂a的缓冲液到含200g总抗体量的抗体浓缩物,得到本发明所述的包含抗体的液体制剂a。
在制备好包含抗体的液体制剂后,对所述试剂进行包装,以便在管形瓶或预先填充的注射器中使用。
技术人员还可以理解的是,本文所提到的重量、重量与体积比、体积与体积比可以利用所述成分的公知的分子量换算成摩尔和/或摩尔浓度。本文所列举的重量是用于所述体积的。技术人员可以理解的是,在需要不同的制剂体积时,可以成比例地调整所述重量。例如16l、14l、12l、10l、5l制剂分别包括1.6、1.4、1.2、1.0、0.5倍的所列举的重量。
另外五种制剂(制剂b、制剂c、制剂d、制剂e、制剂f)的制备方法同制剂a的制备方法类似,所称取的试剂和重量做相应调整即可。
实施例2缓冲液筛选
采用多种缓冲液体系进行抗体稳定性研究。
根据抗体的性质,发明人根据经验初步确定以下多种缓冲液体系:
pb、l-his、cb(nms)、pb+hac、cb+hac、l-his+naac
上述各英文缩写的含义:
pb:15mm磷酸盐缓冲液,ph6.0~6.5
l-his:10mm组氨酸盐缓冲液,ph6.0~6.4
cb:10mm柠檬酸盐缓冲液,ph6.0~6.4
pb+hac:5mm磷酸盐+5mm醋酸钠混合缓冲液,ph6.0~6.4
cb+hac:5mm柠檬酸盐+5mm醋酸钠混合缓冲液,ph6.0~6.4
l-his+naac:5mm组氨酸盐+5mm醋酸钠混合缓冲液,ph6.0~6.4
进行稳定性试验的抗体-缓冲液体系中,所含有的抗体20mg/ml(bat1806),缓冲液10~15mm(见表2),ph6.0~6.4。
研究各种配方在高温40℃的条件下放置21天,单体纯度(sec-hplc,简称sec)和电荷异构体(iec-hplc,简称iec)变化的趋势,见表2。
sec-hplc分析方法:
用水将供试品稀释为5mg/ml的供试品溶液。色谱柱为tsk-gelg3000swxl7.8×300mm,5μm(tosoh),流动相为200mmk3po4、250mmkcl(ph7.0),设定紫外检测波长为280nm,柱温为30℃,上样40μl(200μg蛋白),流速0.5ml/min下等度运行35min,记录色谱图,积分后按面积归一化法计算供试品溶液的单体、多聚体百分含量。
iec-hplc分析方法:
用水将供试品稀释为5mg/ml的供试品溶液。色谱条件:色谱柱,tsk-gel
洗脱梯度
根据以上试验结果,筛选出最优处方:组氨酸盐缓冲液、组氨酸盐+醋酸钠缓冲液;因为在ph6.0-6.4范围内主要起作用是组氨酸,而醋酸钠的缓冲能力ph在4.5-5.8左右,而组合起来结果好,主要是因为组氨酸盐存在影响的,相比较来说组氨酸盐和组氨酸盐+醋酸钠的结果也相差不太大。如果单一缓冲液和组合缓冲液结果相差不大,我们选择处方是越简单越好。因此,最合适的缓冲溶液的选择为组氨酸盐缓冲液。其在高温实验后,不管是sec聚集或是iec酸峰,均明显低于其他缓冲液或组合缓冲液。
对组氨酸盐的浓度进行筛选,配制浓度范围5~20mm的组氨酸盐缓冲液,蛋白浓度20mg/ml,ph6.0~6.4。研究在40℃高温的条件下放置21天,sec和iec变化的趋势,见表3。可见组氨酸盐缓冲液在5~20mm范围内均能起到很好的缓冲保护作用。
对制剂缓冲液的最佳ph进行筛选,配制浓度10mm的组氨酸盐缓冲液,蛋白浓度20mg/mlph范围5.4-6.9。研究在40℃高温的条件下放置21天,sec和iec变化的趋势,见图1。从sec-hplc和iec检测主峰数据作图可以看出,随着时间的增长,ph在5.7~6.2范围内均能起到很好的缓冲保护作用。ph6.2优于ph6.0,并优于其它ph。表明样品在ph6.2时稳定性较高。
表2制剂缓冲液高温(40℃)筛选
表3组氨酸盐缓冲液浓度高温(40℃)筛选
实施例3稳定剂筛选
进行稳定剂筛选的体系中,所含有的抗体、缓冲液和稳定剂见表4。
研究各种配方在25℃、40℃、50℃和光照的条件下放置3个月,单体纯度(sec-hplc,简称sec)和电荷异构体(iec-hplc,简称iec)变化的趋势,见表4。检测方法见实施例2。
在抗体制剂中,常见的稳定剂有糖醇类、氨基酸、盐类等。稳定剂可以稳定抗体的结构,减少外力作用下的蛋白分子的聚集、降解和酸性电荷异构体的形成。该抗体在不同缓冲体系如pb、his、naac和不同的稳定剂如蔗糖(zt)、甘露醇(glc)、精氨酸盐酸盐(arg-hcl)、脯氨酸(pro)、氯化钠(nacl)的组合处方中比较稳定。40度高温、50度高温、光照试验结果分别见附图2-4。在高温条件下,稳定剂性能排序从高到低依次为:glc=arg-hcl+zt、arg-hcl、zt、nacl、pro;在光照条件分析sec主峰,稳定剂性能排序从高到低依次为:arg-hcl+zt≥pro≥arg-hcl≥zt≥glc≥nacl;在光照条件下分析iec主峰,稳定剂性能排序从高到低依次为:arg-hcl≥arg-hcl+zt≥pro≥zt≥glc≥nacl。经过25℃,3个月的加速稳定性试验,在组氨酸盐(his)缓冲液中,各种稳定剂对蛋白聚集和降解的稳定能力相似,但是在减少酸性异构体的形成方面,稳定剂性能从高到低依次为arg-hcl、nacl、glc、zt、pro。通过温度、光照影响抗体稳定性的试验,筛选出最优的缓冲液和稳定剂的组合如下,一种组合含如下成分:10mm组氨酸盐缓冲液,50mm精氨酸盐酸盐,2%蔗糖;另一种组合为:10mm组氨酸盐缓冲液,3%甘露醇;另一种组合为:10mm组氨酸盐缓冲液,4.2%甘露醇;另一种组合还可以是:10mm组氨酸盐缓冲液,100mm氯化钠。
此外,经过25℃,3个月的加速稳定性试验,不添加稳定剂的组氨酸盐(his)组与添加稳定剂的zt(his)组比较,三个月时的sec主峰分别为97.06%和97.76%,iec主峰分别为61.94%和63.17%,可见,(组氨酸盐)his组中添加稳定剂比不添加稳定剂,sec主峰增加约0.7%,iec主峰增加约2%;不添加稳定剂的pb组与添加稳定剂的zt(pb)组比较,三个月时的sec主峰分别为95.51%和96.11%,iec主峰分别为50.26%和55.10%,,pb中添加稳定剂比不添加稳定剂,sec主峰增加约0.6%,iec主峰增加约5%;不添加稳定剂,使用不同的缓冲体系,三个月时的pb组与(组氨酸盐)his组的sec主峰分别为95.51%和97.06%,iec主峰分别为50.26%和61.94%,组氨酸盐(his)缓冲液比pb缓冲液sec主峰增加约1.5%,iec主峰增加约11%。可见,选择合适的缓冲液对于保持该抗体的稳定性非常重要,缓冲液对于减少该抗体的结构变化,增加主峰纯度具有重要作用。见表4。
表4抗白介素6受体人源化抗体bat1806稳定剂筛选(25℃,3个月)
实施例4表面活性剂筛选
进行表面活性剂筛选的体系中,所含有的抗体、缓冲液、稳定剂、表面活性剂见表5。
研究各种配方在-20℃~4℃冻融三次后不溶性颗粒数量。
不溶性颗粒数量的测定方法为:依照《中华人民共和国药典2015年版第四部》通则0903:不溶性微粒检查法。仪器清洗至合格后,在超净台中,取供试品4瓶,用水将容器外壁洗净,小心翻转20次,混匀,静置2分钟脱气,将样品置于分析仪上,每瓶由仪器测定1次,每次进样量为3.0ml。依次测定4瓶样品后,取后3瓶的数据平均值计算每瓶样品所含微粒总数。
在抗体制剂中,在经过冷冻/解冻循环时,容易产生不溶性颗粒,可以通过添加一定量的表面活性剂来防止。常用的表面活性剂为非离子表面活性剂,如:聚山梨酯-20、聚山梨酯-80和泊洛沙姆188。在本实施例中,向含有缓冲液和稳定剂的配方中分别添加0.1%聚山梨酯-20、0.05%的聚山梨酯-80或者0.1%泊洛沙姆188,观察由-20℃~4℃冻融三次后不溶性颗粒数量。结果显示,三种表面活性剂均能抑制冻融产生的不溶性颗粒,效果相似,见表5。
表5抗白介素6受体人源化抗体表面活性剂筛选(-20℃-4℃冻融三次)
实施例5冻融研究
按照实施例1描述的方法,制备抗体浓度为20mg/ml的bat1806抗体制剂a、制剂b、制剂c、制剂d和浓度为50mg/ml的bat1806抗体制剂f。对于制剂a、b、c、d,-20℃-4℃反复冻融五次,对于制剂f,-20℃-室温反复冻融五次,elisa检测抗体浓度,考察五次冻融后制剂溶液中抗体含量的稳定性。此外,对于制剂a、b、c、d进行快慢冻融,按照-20℃—4℃、-20℃—37℃、-80℃—4℃、-80℃—37℃,分别循环五次,对于制剂f,-20℃-室温反复冻融五次,观察透明性、颜色、ph、不溶性微粒、sec、iec、细胞活性变化情况。
elisa检测方法简述如下:包被抗原重组人白介素6受体(rhil-6r),1ug/ml,100ul/孔;用含5%bsa的pbs封闭;bat1806抗体制剂a、制剂b、制剂c和制剂d分别稀释1×105倍,每孔100ul,每种稀释度的抗体分别加样5个孔;标准品起始浓度1ug/ml,用含2%bsa的pbs两倍稀释8个梯度,做标准曲线,以鼠抗人iggkappa-hrp为二抗,进行elisa检测。
细胞活性检测方法简述如下:以抗白介素6受体人源化抗体bat1806抗体标准品为标准品,起始终浓度为20ug/ml梯度稀释加入96孔板,50ul/孔。待测样品也按照标准曲线样品的稀释方法进行稀释,加入96孔板,50ul/孔。hil-6稀释至4ng/ml,加入96孔板,50ul/孔。取对数生长期的tf-1细胞,接种于96孔板中,100000cells/孔/100ul。37度5%co2培养箱中培养72小时。加入celltiterglo试剂,50ul/孔。避光室温放置2小时,在酶标仪(moleculardevicesspectramax)中,采用celltiterglo方法读取微孔板数据,通过四参数拟合曲线c值(ic50),按照公式相对比活力=[标准品ic50/待测样品ic50]×100%,如果计算结果为80%-125%,则认为待测样品的活性正常。
结果表明bat1806抗体制剂五次冻融后,其回收率范围为97.5-102.4%。说明抗体制剂在冻存条件下,反复冻融五次,抗体含量基本不变,见表6a、6b、6c、6d、6e。抗体制剂从-20度或者-80度快速或者慢速解冻,反复冻融五次,透明性、颜色、ph、不溶性微粒、sec、iec、细胞活性均没有明显变化,说明样品在反复冻融试验中性质稳定,无析出物,基本对蛋白不吸附,不会影响样品的性状。此外,样品的sec-hplc纯度,iec-hplc主峰含量性等检测项也无明显变化,活性冻融5次都在合格范围内。
见表7a、7b、7c、7d、7e。
表6a制剂a冻/融五次后抗体含量(-20℃-4℃)
表6b制剂b冻/融五次后抗体含量(-20℃-4℃)
表6c制剂c冻/融五次后抗体含量(-20℃-4℃)
表6d制剂d冻/融五次后抗体含量(-20℃-4℃)
表6e制剂f冻/融五次后抗体含量(-20℃-室温)
表7a制剂a的快/慢冻融五次实验结果
表7b制剂b的快/慢冻融五次实验结果
表7c制剂c的快/慢冻融五次实验结果
表7d制剂d的快/慢冻融五次实验结果
表7e制剂f的-20℃-室温反复冻融五次实验结果
实施例6微生物研究
需要对药物制剂(制剂a、b、c、d)进行微生物研究,以便确定所述制剂是否能支持微生物生长。通过用微生物(例如,金黄色葡萄球菌,atdd-no.:6538p,白色念球菌,atdd-no.:10231,黑曲霉,atdd-no.:16404,环境分离物)在低水平(nmt100cfu/ml)下直接接种所述无菌制剂,然后检查接种过的制剂的总体微生物生长。评价的指标主要有显微镜下微生物的数目以及浊度的变化,其中,浊度的缺乏是没有总体生长的指标,并且在14天之后在接种的容器中检测。另外,从这些容器中不能重新分离到微生物。表8表明,如果在室温20-25℃保存14天,所述制剂不支持微生物生长。
表8抗白介素6受体人源化抗体bat1806制剂的微生物检测
-=浊度不变
实施例7加速稳定性研究
按照实施例1的方法配制药物制剂a、制剂b、制剂c、制剂d、制剂e、制剂f。将上述六种制剂放置于生化培养箱中,在(25±2)℃的条件下放置6个月,分别于第0、1、2、3、6个月末取样。按稳定性重点考察项目进行检测,考察样品的单体纯度(sec-hplc)、电荷异构体(iec-hplc)、非还原毛细管凝胶电泳(ce-sds-nr)、不溶性微粒及细胞活性(见表9)。此外,对于制剂f,还考察了加速条件下的溶液性状、ph以及抗体含量。
单体纯度(sec-hplc)、电荷异构体(iec-hplc)的检测方法见实施例2。(ce-sds-nr)的分析方法:用水将重组供试品稀释至4mg/ml,取25μl稀释好的供试品溶液,加入70μlce-sdssamplebuffer和5μl0.25m碘乙酰胺水溶液,混匀后65℃水浴加热4min,转移至样品瓶中,即得对照品工作液。采用-5.0kv电压,进样10s,然后用-15kv电压进行分离分析,记录图谱,在14~35min之间自动积分。主峰为完整抗体蛋白的色谱峰,主峰前的杂质峰均为fraction的色谱峰(包含l峰、h峰、hl、hh和hhl峰),采用面积归一化方法计算单体峰的百分含量。不溶性微粒的分析方法见实施例4。细胞活性检测的方法见实施例5。
结果见表9。由表9可知,在加速稳定性研究条件下,6个月,单体纯度随着时间的延长而降低,说明加速条件下会产生聚体,但抗体的sec主峰降低在2.28%以内;在iec-hplc方面,25℃条件,抗体的iec主峰含量均出现下降,降解趋势也基本一致,iec的主峰降低在16.54%以内;ce-sds-nr主峰降低在2.1%以内,不溶性颗粒远低于合格标准,细胞活性物无明显变化,表明本发明的抗体制剂在室温下,6个月内仍能保持稳定性。
制剂f的溶液性状、ph以及抗体浓度结果见表10。从表的数据可知,在25℃条件下放置6个月后,同第0天比较,样品仍为澄清透明液体,无可见异物出现,样品的ph、抗体浓度也无明显变化,说明在加速试验中,样品较为稳定。
表9加速稳定性研究(25±2)℃
表10制剂e加速稳定性研究(25±2)℃
从上表的数据可知,在25℃条件下放置6个月后,制剂e同第0天比较,样品仍为澄清透明液体,无可见异物出现,样品的ph、抗体浓度也无明显变化,说明在加速试验中,样品较为稳定。
制剂e和f在25℃加速条件下的sec、iec和ce(非还原)趋势变化图依次见图5a-5c。通过制剂e和制剂f(二者为同一处方,两种不同浓度的抗体)进行对比,在25℃加速实验6个月后sec、iec和ce(非还原)主峰降解趋势一致,sec主峰单体纯度在96.5%以上,ce(非还原)主峰在94%以上,ph、微粒和生物活性也都符合质量标准,表明该处方对不同浓度的抗体均具有稳定性。
实施例8长期稳定性研究
按照实施例1的方法配制药物制剂a、制剂b、制剂c、制剂d。将上述四种制剂在4℃条件下放置36个月,分别于第0、3、6、9、12、24、30、36个月末取样,考察样品的纯度(sec-hplc)、电荷异构体(iec-hplc)、非还原毛细管凝胶电泳(ce-sds-nr)、不溶性微粒及细胞活性。结果见表11。由表11可知,本发明的抗体制剂在4℃下,能够保持长期稳定,在36个月时,仍维持稳定性。
表11长期稳定性研究4℃
实施例9高温和光照稳定性研究
取实施例1中的制剂e和制剂f进行高温和光照的研究,以便考察处方在高温和光照条件下的稳定性情况。检测方法参见其余实施例。
表12制剂e的高温影响因素试验验结果
从上表的数据可知,在40℃条件下放置28天后,同第0天比较,样品仍为澄清透明液体,无可见异物出现,样品的ph、抗体浓度也无明显变化,说明在强制降解试验中,样品较为稳定。在sec-hplc方面,在40℃条件下放置28天,单体纯度随着时间的延长而降低,说明高温条件下会产生聚体;在iec-hplc方面,40℃条件,抗体的iec主峰含量均出现下降,降解趋势也基本一致;从不溶性微粒数据可以看出,不同天的检测结果出现了一定的波动,但数据并没有出现逐渐增多的趋势,活性都在合格的范围。
表13制剂e的光照影响因素试验验结果
从上表的数据可知,在4000xl光照条件下放置14天后,同第0天比较,样品仍为澄清透明液体,无可见异物出现,样品的ph、抗体浓度也无明显变化,说明在光照条件,样品较为稳定。在sec-hplc方面,单体纯度变化不太明显;在iec-hplc方面,4000xl光照条件,抗体的iec主峰含量均出现下降,降解趋势也基本一致;从不溶性微粒数据可以看出,不同天的检测结果出现了一定的波动,但数据并没有出现逐渐增多的趋势,活性均在合格范围,远低于标准。
制剂e的高温和光照sec趋势变化见图6a,sec趋势变化见图6b,ce(非还原)趋势变化见图6c。综合sec、iec和ce(非还原)的结果,在高温和光照14天,主峰下降趋势一致,高温和光照条件下,都会形成聚集,样品须低温和避光保存。
表14制剂f的高温和光照影响因素试验验结果
从上表的数据可知,制剂在40℃或者4000lx条件下放置14天后,同第0天比较,样品仍为澄清透明液体,无可见异物出现,原液的ph、抗体浓度也无明显变化,说明在强制降解试验中,样品较为稳定,无析出物,基本对蛋白不吸附,不会影响样品的性状。在sec-hplc方面,样品在40℃条件下放置14天,单体纯度基本无变化,在光照条件下,单体纯度随着时间的延长而降低,说明抗体在光照条件下比高温条件下易聚合;在iec-hplc方面,40℃条件或是光照条件,抗体的iec主峰含量均出现下降,降解趋势也基本一致;从不溶性微粒数据可以看出,不同天的检测结果出现了一定的波动,但数据并没有出现逐渐增多的趋势,也未出现微粒突增的现象,远低于合格标准。
该实验表明,不同浓度的抗体制剂,在高温和光照下均具有一定的稳定性。
实施例10振荡稳定性研究
实验条件:取制剂f,在200rpm下,平放,常温振荡48h,每隔一段时间检测溶液性状、抗体含量、sec、iec、生物活性、ce-sds(非还原和非还原)、不溶性颗粒。检测方法参见其它实施例。
表15振荡影响因素试验验结果
从上表的数据可知,样品振荡48小时后,同第0次比较,样品仍为澄清透明液体,无可见异物出现,样品的ph值、抗体浓度也无明显变化,说明在振荡试验中,样品稳定性良好。此外,样品的sec-hplc纯度,iec-hplc主峰含量性等检测项也无明显变化,活性也都在合格范围内。
实施例11抗白介素6受体人源化抗体bat1806蛋白序列
一种治疗il-6相关疾病的抗白介素6受体人源化抗体bat1806,是通过基因工程手段,在cho细胞中表达的,并且通过一系列标准的层析步骤纯化获得的。bat1806属于igg抗体,分子量为145kda,每条重链含有449个氨基酸,分子量为53kda,重链氨基酸序列见表16;每条轻链含有214个氨基酸,分子量为24kda,轻链氨基酸序列见表17。
表16抗白介素6受体人源化抗体bat1806重链氨基酸序列
表17抗白介素6受体人源化抗体bat1806轻链氨基酸序列
实施例12抗白介素6受体人源化抗体bat1806的表达和纯化
参照woodetal.,jimmunol.145:3011(1990)等的方法,特异性结合il-6r的抗白介素6受体人源化抗体bat1806在cho细胞表达。含抗体基因的表达载体用常规的分子生物学方法构建(molecularcloning),以cho-k1细胞(atccccl61)的一种衍生细胞系作为宿主细胞表达。高产稳定细胞系的构建过程简单描述如下:宿主细胞悬浮生长于cd-cho培养基(gibco,ca),取处于对数生长期的宿主细胞离心,重悬于新鲜的cd-cho培养基,计数并调节细胞密度到1.43×107个/毫升,取600ul上述细胞悬液加入电击杯,然后加入已线性化的质粒40ug,(用移液枪吸打使细胞与质粒混合均匀。用bio-rad电转仪电击转化,仪器参数设定为:电容:960ufd,电压:300v。通常电击时间为15-20毫秒为正常。把电击后的细胞立即重悬于37℃预热的cd-cho培养基,每孔100ul接种于96孔板,2-3天后加入等量的筛选培养基(cd-chomedia+50ummsx)。测定96孔板细胞培养上清来测定抗体的表达水平。表达水平较高的克隆从96孔板转移到24孔板,待细胞生长到一定数量,把细胞转入6孔板,使每孔3ml培养基含2×105个细胞,测定细胞的抗体产量和产率。通常20-30个克隆被转到摇瓶做进一步评价。最后5-8个表达量最高的克隆进行亚克隆和进一步的表达检测。收获料液,通过低速离心使细胞和培养基分离,把离心上清高速离心进一步澄清。用蛋白a亲和纯化和离子交换纯化。
实施例13抗白介素6受体人源化抗体的生物活性研究
按照实施例1描述的方法,制备抗体浓度为20mg/ml的bat1806抗体制剂a、制剂b、制剂c、制剂d,进行细胞活性检测。检测方法简述如下:以抗白介素6受体人源化抗体bat1806标准品为标准品,起始终浓度为20ug/ml梯度稀释加入96孔板,50ul/孔。待测样品也按照标准曲线样品的稀释方法进行稀释,加入96孔板,50ul/孔。hil-6稀释至4ng/ml,加入96孔板,50ul/孔。取对数生长期的tf-1细胞,接种于96孔板中,100000cells/孔/100ul。37度5%co2培养箱中培养72小时。加入celltiterglo试剂,50ul/孔。避光室温放置2小时,在酶标仪(moleculardevicesspectramax)中,采用celltiterglo方法读取微孔板数据,通过四参数拟合曲线c值(ic50),按照公式相对比活力=[标准品ic50/待测样品ic50]×100%,如果计算结果为80%-125%,则认为待测样品的活性正常。检测结果见表18。
按照实施例1描述的方法,制备抗体浓度为20mg/ml的bat1806抗体制剂a、制剂b、制剂c、制剂d,进行竞争elisa检测。检测方法简述如下:用pbs将hil-6稀释成10ug/ml,充分混匀后,100ul/孔,即1ug/孔,4℃过夜。用含5%脱脂牛奶的pbs封闭,200μl/孔,于37℃孵育2小时,pbst洗板3次。用稀释液将hil-6r稀释成1μg/ml,50μl/孔即50ng/孔,室温静置30min。将bat1806稀释至起始浓度80μg/ml,然后用稀释液倍比稀释成40、20、10、5、2.5、1.25、0.625、0.3125、0.156、0.08、0.04μg/ml,漩涡混匀。用稀释液将兔抗his血清稀释10000倍后,加入100μl/孔,37℃孵育1小时,pbst洗板5次。用稀释液将羊抗兔hrp稀释10000倍,加入100μl/孔,37℃孵育0.5小时,pbst洗板8次。加入tmb显色液100μl/孔,室温避光10分钟后加入50μl/孔1mh2so4终止。用酶标检测仪分析软件softmaxpro测od450nm读数,进行四参数分析。通过四参数拟合曲线c值(ic50),按照公式相对比活力=[标准品ic50/待测样品ic50]×100%,如果计算结果为80%-125%,则认为待测样品的活性正常。检测结果见表19。
表18抗白介素6受体人源化抗体细胞活性检测结果
表19抗白介素6受体人源化抗体竞争elisa检测结果
实施例14抗白介素6受体人源化抗体的体内药效
动物体内药效学评价主要进行了抗白介素6受体人源化抗体对食蟹猴胶原诱导的关节炎(cia)模型治疗效果的研究。具体实验步骤如下:分两次使用小牛ii型胶原免疫雌性猴子,进行cia模型造模。将造模成功的动物平均分成四组,分别为:阴性对照ns组,bat1806制剂a组、bat1806制剂b组、bat1806制剂c组、bat1806制剂d组,每组9只猴子,单次静脉给药30mg/kg。随后连续观察4周,评价重组抗人白介素6受体单克隆抗体对食蟹猴cia模型的治疗效果。
单次静脉给药30mg/kg/iv后,bat1806与阴性对照组相比,受试动物的esr、il-6、il-6r等血液生化指标有明显改善,差异具有统计学意义,见图7。
实施例15抗白介素6受体人源化抗体的药代动力学
药代动力学研究在wisteria大鼠体内进行。静脉注射,给药一次,剂量12mg/kg,分四组,分别是bat1806制剂a、bat1806制剂b、bat1806制剂c、bat1806制剂d组,每组10只,雌雄各半,分别于给药前、给药后即刻、1h、2h、5h、24h、48h、96h、7天、10天、14天采血检测血药浓度;皮下注射,剂量12mg/kg,给药一次,分四组,分别是bat1806制剂a、bat1806制剂b、bat1806制剂c、bat1806制剂d组,每组10只,雌雄各半,分别于给药前、给药后即刻、5h、8h、24h、48h、96h、7天、10天、14天静脉采血。可见各组静脉或皮下给药皆具有相似的药代动力学特征,见图8。
参考文献:
[1]josefssmolen,robertlandewé,ferdinandcbreedveld,etal.eularrecommendationsforthemanagementofrheumatoidarthritiswithsyntheticandbiologicaldisease-modifyingantirheumaticdrugs:2013update[j].annrheumdis,2013,0:1-18.
[2]gowoonkim,etal.il-6inhibitorsfortreatmentofrheumatoidarthritis:past,present,andfuture[j].arch.pharm.res,2015,38:575–584.
[3]vealedj,fearonu.inhibitionofangiogenicpathwaysinrheumatoidarthritis:potentialfortherapeutictargeting[j].bestpractresclinrheumato,2006,(20):pp.941-947.
[4]xusd,tangfi,shil,etal.anti-saantibodyinchineserheumatoidarthritis[j].chinesemedj,1998,111(3):204-207.
[5]ritchiedm,boyleja,mclnnesjm,etal.clinicalstudieswithanarticularindexfortheassessmentofjointtendernessinpatientswithrheumatoidarthritis[j].qjmed,1986,37:393-406.
序列表
<110>百奥泰生物制药股份有限公司
<120>一种治疗il-6相关疾病的人源化抗体的液体制剂
<130>pt20200701-dd-p
<150>201711239538.8
<151>2017-11-30
<160>2
<170>siposequencelisting1.0
<210>1
<211>449
<212>prt
<213>人工序列(artificialsequence)
<400>1
glnvalglnleuglngluserglyproglyleuvalargprosergln
151015
thrleuserleuthrcysthrvalserglytyrserilethrserasp
202530
hisalatrpsertrpvalargglnproproglyargglyleuglutrp
354045
ileglytyrilesertyrserglyilethrthrtyrasnproserleu
505560
lysserargvalthrmetleuargaspthrserlysasnglnpheser
65707580
leuargleuserservalthralaalaaspthralavaltyrtyrcys
859095
alaargserleualaargthrthralametasptyrtrpglyglngly
100105110
serleuvalthrvalserseralaserthrlysglyproservalphe
115120125
proleualaproserserlysserthrserglyglythralaalaleu
130135140
glycysleuvallysasptyrpheprogluprovalthrvalsertrp
145150155160
asnserglyalaleuthrserglyvalhisthrpheproalavalleu
165170175
glnserserglyleutyrserleuserservalvalthrvalproser
180185190
serserleuglythrglnthrtyrilecysasnvalasnhislyspro
195200205
serasnthrlysvalasplyslysvalgluprolyssercysasplys
210215220
thrhisthrcysproprocysproalaprogluleuleuglyglypro
225230235240
servalpheleupheproprolysprolysaspthrleumetileser
245250255
argthrprogluvalthrcysvalvalvalaspvalserhisgluasp
260265270
progluvallyspheasntrptyrvalaspglyvalgluvalhisasn
275280285
alalysthrlysproargglugluglntyrasnserthrtyrargval
290295300
valservalleuthrvalleuhisglnasptrpleuasnglylysglu
305310315320
tyrlyscyslysvalserasnlysalaleuproalaproileglulys
325330335
thrileserlysalalysglyglnproarggluproglnvaltyrthr
340345350
leuproproserargaspgluleuthrlysasnglnvalserleuthr
355360365
cysleuvallysglyphetyrproseraspilealavalglutrpglu
370375380
serasnglyglnprogluasnasntyrlysthrthrproprovalleu
385390395400
aspseraspglyserphepheleutyrserlysleuthrvalasplys
405410415
serargtrpglnglnglyasnvalphesercysservalmethisglu
420425430
alaleuhisasnhistyrthrglnlysserleuserleuserprogly
435440445
lys
<210>2
<211>214
<212>prt
<213>人工序列(artificialsequence)
<400>2
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnaspilesersertyr
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrtyrthrserargleuhisserglyvalproserargphesergly
505560
serglyserglythraspphethrphethrileserserleuglnpro
65707580
gluaspilealathrtyrtyrcysglnglnglyasnthrleuprotyr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
proservalpheilepheproproseraspgluglnleulyssergly
115120125
thralaservalvalcysleuleuasnasnphetyrproarggluala
130135140
lysvalglntrplysvalaspasnalaleuglnserglyasnsergln
145150155160
gluservalthrgluglnaspserlysaspserthrtyrserleuser
165170175
serthrleuthrleuserlysalaasptyrglulyshislysvaltyr
180185190
alacysgluvalthrhisglnglyleuserserprovalthrlysser
195200205
pheasnargglyglucys
210
- 还没有人留言评论。精彩留言会获得点赞!