一种索磷布韦与达拉他韦双层片及其制备方法与流程
1.本发明涉及一种药物的制备,具体涉及一种索磷布韦与达拉他韦双层片及其制备方法。
背景技术:
2.索磷布韦(sofosbuvir,sovaldi)由美国吉利德科学公司开发,并于2014年fda获批上市,在中国于2017年9月获批上市。索磷布韦是病毒复制所必需的丙型肝炎病毒(hcv)非结构蛋白5b(ns5b)核糖核酸(rna)-依赖rna聚合酶的抑制剂。根据丙肝病毒的不同类型,索磷布韦的临床治愈率达30%-97%。
3.索磷布韦的结构式如下:
[0004][0005]
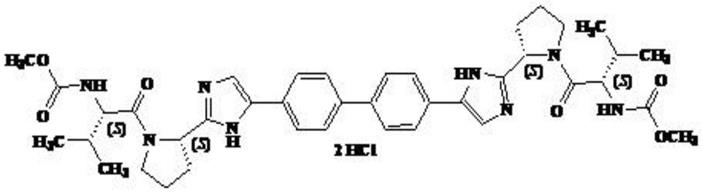
达拉他韦(daclatasvir,daklinza)是由施贵宝公司开发的丙型肝炎ns5a蛋白的高选择抑制剂。盐酸达拉他韦片与其它药物联合,用于治疗成人慢性丙型肝炎病毒感染。盐酸达拉他韦片不得作为单药治疗。
[0006]
达拉他韦的结构式如下:
[0007][0008]
临床上通常用索磷布韦可与达拉他韦、利巴韦林、干扰素等联合给药用于治疗丙肝。
[0009]
上述两种药物在体内的药物机理不相同,其生物利用度也不一样,故提高药物制剂的体外溶出度有助于药物制剂在体内的释放,有助于提高药物的口服吸收,进而提高其口服生物利用度,以确保临床用药的安全与有效。
[0010]
临床上,通常将上述两种药物常联合给药来治疗丙肝。但是需要分别购买后服用,而对于患者特别是老年人等服用药物依从性不高的人来说,能将两种药物合并一起服用将更大地提高患者治疗的依从性。且目前没有企业将这两种不同公司的药物综合起来形成一个复方,基于如上需求,我公司创新性地从这两种药物的不同特性出发,开发出索磷布韦与达拉他韦双层片,更能够满足市场需求。
技术实现要素:
[0011]
(一)要解决的技术问题
[0012]
为了解决现有两种药物制剂体内溶出行为不一样,而且需要分开购买和服用等待问题,本发明提供一种索磷布韦与达拉他韦双层片,用于治疗丙肝病毒感染,具有较高的溶出度,更好的稳定性与更强的药效。
[0013]
(二)技术方案
[0014]
为了达到上述目的,本发明采用的主要技术方案包括:
[0015]
一种索磷布韦与达拉他韦双层片,其包括第一层片和第二层片,所述第一层片包含有索磷布韦;所述第二层片包含有达拉他韦或/和其药学可接受的盐。
[0016]
本发明索磷布韦与达拉他韦双层片优选的方案中,所述索磷布韦与达拉他韦或/和其药学可接受的盐的按重量份比为20∶1~5。
[0017]
本发明索磷布韦与达拉他韦双层片优选的方案中,所述达拉他韦药学可接受的盐包括达拉他韦盐酸盐或/和达拉他韦双磷酸盐。
[0018]
本发明索磷布韦与达拉他韦双层片优选的方案中,所述第一层片或第二层片均包含有辅料,所述辅料为药学可接受的辅料,其包含有以下组分,填充剂、黏合剂、崩解剂、润滑剂。
[0019]
进一步的,所述填充剂为但不仅限于无水乳糖、微晶纤维素、甘露醇一种或两种以上的组合;所述黏合剂为但不仅限于聚维酮,所述崩解剂为但不仅限于交联羧甲基纤维素钠;所述润滑剂为但不仅限于硬脂酸镁、二氧化硅中的一种或两种以上的组合。
[0020]
进一步的,所述第一层片和第二层片包含的组分按重量份计分别为:第一层片包含以下重量份的组分:第一层片中含有索磷布韦200~500份、甘露醇100~300份、微晶纤维素150~250份、交联羧甲基纤维素钠30~60份、聚维酮50~80份、硬脂酸镁10~45份。相应的,第二层片包含以下重量份的组分,包含达拉他韦或/和其药学可接受的盐25~75份、无水乳糖50~150份、微晶纤维素50~100份、交联羧甲基纤维素钠5~20份、聚维酮5~40份、硬脂酸镁5~30份。
[0021]
一种索磷布韦与达拉他韦双层片的制备方法,其包括以下步骤:
[0022]
s1将索磷布韦微粉化处理后,与填充剂、崩解剂混合均匀,加入黏合剂制成索磷布韦药粒,干燥后与润滑剂混合制成索磷布韦颗粒;
[0023]
s2将达拉他韦或/和其药学可接受的盐过筛后,与填充剂、崩解剂混合均匀,加入黏合剂制粒得达拉他韦药粒后,与润滑剂混合制成达拉他韦颗粒;
[0024]
s3将s2得到的索磷布韦颗粒和s1得到的达拉他韦颗粒分别制成第一层片和第二层片,并将第一层片和第二层片压制得到素片;
[0025]
s4将素片经薄膜包衣成双层片。
[0026]
本方案中,步骤s1所述的将索磷布韦微粉化处理后,与填充剂、崩解剂利用等量递增法混合均匀;
[0027]
步骤s2中,达拉他韦或/和其药学可接受的盐、填充剂、崩解剂利用等量递增法混合均匀。
[0028]
本发明制备方法优选的方案中,步骤s1中,所述索磷布韦微粉化后成粒径小于0.25mm的粉末。
[0029]
本发明制备方法优选的方案中,步骤s2中达拉他韦或/和其药学可接受的盐过筛后的粒径小于0.20mm。
[0030]
本发明制备方法优选的方案中,所述填充剂包含无水乳糖和微晶纤维素;或所述黏合剂包含聚维酮;或所述崩解剂包含交联羧甲基纤维素钠。
[0031]
本发明制备方法优选的方案中,步骤s1中所述干燥处理的条件为:在50~70℃下干燥索磷布韦药粒使其水分含量低于3%,并过15~25目筛进行整粒,再与润滑剂混合制成索磷布韦颗粒;
[0032]
或步骤s2中,将所得到达拉他韦药粒控制达拉他韦或/和其药学可接受的盐粒径小于0.15mm。利用三维旋振控制粒径小于0.15mm进行整粒。
[0033]
本发明提供一种上述任一项所述的索磷布韦与达拉他韦双层片在治疗丙型肝炎中的应用。
[0034]
(三)有益效果
[0035]
本发明的有益效果是:
[0036]
1.相对于现有技术,本发明将索磷布韦与达拉他韦制备成双层片,可以提高药物的溶出率和稳定性;通过双层片剂,将索磷布韦与达拉他韦的有效成分的配比限定,减少每次治疗时确定索磷布韦与达拉他韦的配比用量的环节,提高用药准确率,便于医生,特别是患者的用药。
[0037]
2.通过本发明的方法制备得到的双层片,其通过控制粒径,添加崩解剂而具有较高的溶出率和稳定性,且本发明的制备方法可防止双层片中活性成分的损失,控制第一层片和第二层片不同的溶出率,使索磷布韦和达拉他韦达到最佳的配伍,使其发挥最佳的药效作用,从而提高治疗丙肝病毒的效果。
具体实施方式
[0038]
为了更好的解释本发明,以便于理解,下面通过具体实施方式,对本发明作详细描述。
[0039]
下面实施例索磷布韦与达拉他韦双层片的各组分的含量单位mg可替换为重量份。
[0040]
本发明实施例中涉及的包衣粉为市场购买而得。
[0041]
实施例1:
[0042]
一种索磷布韦与达拉他韦双层片,包括第一层片和第二层片,所述第一层片中含有索磷布韦200mg、甘露醇150mg、微晶纤维素250mg、交联羧甲基纤维素钠30mg、聚维酮50mg、硬脂酸镁10mg;所述第二层片中包含达拉他韦30mg、无水乳糖75mg、微晶纤维素50mg、交联羧甲基纤维素钠5mg、聚维酮5mg、硬脂酸镁10mg。
[0043]
上述索磷布韦与达拉他韦双层片的制备方法如下,
[0044]
s1索磷布韦颗粒的制备
[0045]
s11微粉化处理:称取上述相应重量的索磷布韦进行微粉化处理,使微粉化后的索磷布韦的粒经小于0.25mm;
[0046]
s12原料混合:利用等量递增法将微粉化后的索磷布韦与甘露醇、微晶纤维素及交联羧甲基纤维素钠进行预混,后利用高效混合制粒机混合均匀;
[0047]
s13黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为
3%的聚维酮溶液即黏合剂;将黏合剂加入到步骤s12中的高效混合制粒机混匀,得到软材;将所得软材用筛网为60目的高速摇摆制粒机制成索磷布韦药粒;
[0048]
s14制成颗粒:将索磷布韦药粒置于50℃烘箱中干燥至水分含量低于3%,经20目筛进行整粒后,与作为润滑剂的硬脂酸镁用总混机混合均匀,得索磷布韦颗粒;
[0049]
s2达拉他韦颗粒准备
[0050]
s21原料预混:取上述相应重量份的达拉他韦过20目筛处理使其粒径小于0.20mm,利用等量递增法加入上述相应重量份的无水乳糖、微晶纤维素、交联羧甲基纤维素钠进行预混;
[0051]
s22黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为3%的聚维酮溶液即黏合剂;将黏合剂与步骤s21中将步骤s21中预混得到的混合物加入利用湿法制粒机制成达拉他韦药粒;
[0052]
s23制成颗粒
[0053]
将所得到的达拉他韦药粒利用三维旋振筛对所得颗粒进行筛分得粒径适中的颗粒后与作为润滑剂的硬脂酸镁用总混机混合均匀,得达拉他韦颗粒;
[0054]
s3双层压片:将s1得到的索磷布韦颗粒置于双层压片机第一层加料器中,将s2得到的达拉他韦颗粒置于双层压片机第二层加料斗中,调节两层压力及片重,压制得素片;
[0055]
s4包衣液制备:按包衣增重5%称取包衣粉和纯化水,将包衣粉缓慢加入纯化水中,边加入边搅拌,使包衣粉分散均匀,搅拌时间30min。
[0056]
s5包衣:将素片和包衣液放入高效包衣锅中进行包衣得薄膜包衣片,检查包衣片外观,干燥,称量包衣实际增重,即得索磷布韦和达拉他韦双层片。
[0057]
实施例2:一种索磷布韦与达拉他韦双层片,包括第一层片和第二层片,所述第一层片中含有索磷布韦400mg、甘露醇150mg、微晶纤维素200mg、交联羧甲基纤维素钠45mg、聚维酮60mg、硬脂酸镁45mg;所述第二层片中包含达拉他韦60mg、无水乳糖100mg、微晶纤维素100mg、交联羧甲基纤维素钠10mg、聚维酮10mg、硬脂酸镁20mg。
[0058]
上述索磷布韦与达拉他韦双层片的制备方法如下,
[0059]
s1索磷布韦颗粒的制备
[0060]
s11微粉化处理:称取上述相应重量的索磷布韦进行微粉化处理,使微粉化后的索磷布韦的粒经小于0.25mm;
[0061]
s12原料混合:利用等量递增法将微粉化后的索磷布韦与甘露醇、微晶纤维素及交联羧甲基纤维素钠进行预混,后利用高效混合制粒机混合均匀;
[0062]
s13黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为3%的聚维酮溶液即黏合剂;将黏合剂加入到步骤s12中的高效混合制粒机混匀,得到软材;将所得软材用筛网为60目的高速摇摆制粒机制成索磷布韦药粒;
[0063]
s14制成颗粒:将索磷布韦药粒置于70℃烘箱中干燥至水分含量低于3%,经15目筛进行整粒后,与作为润滑剂的硬脂酸镁用总混机混合均匀,得索磷布韦颗粒;
[0064]
s2达拉他韦颗粒准备
[0065]
s21原料预混:取上述相应重量份的达拉他韦过20目筛处理使其粒径小于0.20mm,利用等量递增法加入上述相应重量份的无水乳糖、微晶纤维素、交联羧甲基纤维素钠进行预混;
[0066]
s22黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为3%的聚维酮溶液即黏合剂;将黏合剂与步骤s21中将步骤s21中预混得到的混合物加入利用湿法制粒机制成达拉他韦药粒;
[0067]
s23将所得到的达拉他韦药粒利用三维旋振筛对所得颗粒进行筛分得粒径适中的颗粒后与作为润滑剂的硬脂酸镁用总混机混合均匀,得达拉他韦颗粒;
[0068]
s3:双层压片:将s1得到的索磷布韦颗粒置于双层压片机第一层加料器中,将s2得到的达拉他韦颗粒置于双层压片机第二层加料斗中,调节两层压力及片重,压制得素片;
[0069]
s4包衣液制备:按包衣增重5%称取包衣粉和纯化水,将包衣粉缓慢加入纯化水中,边加入边搅拌,使包衣粉分散均匀,搅拌时间60min。
[0070]
s5包衣:将素片和包衣液放入高效包衣锅中进行包衣得薄膜包衣片,检查包衣片外观,干燥,称量包衣实际增重,即得索磷布韦和达拉他韦双层片。
[0071]
实施例3:一种索磷布韦与达拉他韦双层片,包括第一层片和第二层片,所述第一层片中含有索磷布韦200mg、甘露醇100mg、微晶纤维素150mg、交联羧甲基纤维素钠30mg、聚维酮50mg、硬脂酸镁20mg。相应的,第二层片包含以下重量份的组分,包含达拉他韦盐酸盐33mg、无水乳糖100mg、微晶纤维素50mg、交联羧甲基纤维素钠5mg、聚维酮10mg、硬脂酸镁15mg。
[0072]
上述索磷布韦与达拉他韦双层片的制备方法如下,
[0073]
s1索磷布韦颗粒的制备
[0074]
s11微粉化处理:称取上述相应重量的索磷布韦进行微粉化处理,使微粉化后的索磷布韦的粒经小于0.25mm;
[0075]
s12原料混合:利用等量递增法将微粉化后的索磷布韦与甘露醇、微晶纤维素及交联羧甲基纤维素钠进行预混,后利用高效混合制粒机混合均匀;
[0076]
s13黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为3%的聚维酮溶液即黏合剂;将黏合剂加入到步骤s12中的高效混合制粒机混匀,得到软材;将所得软材用筛网为60目的高速摇摆制粒机制成索磷布韦药粒;
[0077]
s14制成颗粒:将索磷布韦药粒置于60℃烘箱中干燥至水分含量低于3%,经15目筛进行整粒后,与作为润滑剂的硬脂酸镁用总混机混合均匀,得索磷布韦颗粒;
[0078]
s2达拉他韦颗粒准备
[0079]
s21原料预混:取上述相应重量份的达拉他韦盐酸盐过20目筛处理使其粒径小于0.20mm,利用等量递增法加入上述相应重量份的无水乳糖、微晶纤维素、交联羧甲基纤维素钠进行预混;
[0080]
s22黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为3%的聚维酮溶液即黏合剂;将黏合剂与步骤s21中将步骤s21中预混得到的混合物加入利用湿法制粒机制成达拉他韦药粒;
[0081]
s23制成颗粒
[0082]
将所得到的达拉他韦药粒利用三维旋振筛对所得颗粒进行筛分得粒径适中的颗粒后与作为润滑剂的硬脂酸镁用总混机混合均匀,得达拉他韦颗粒;
[0083]
s3双层压片:将s1得到的索磷布韦颗粒置于双层压片机第一层加料器中,将s2得到的达拉他韦颗粒置于双层压片机第二层加料斗中,调节两层压力及片重,压制得素片;
[0084]
s4包衣液制备:按包衣增重5%称取包衣粉和纯化水,将包衣粉缓慢加入纯化水中,边加入边搅拌,使包衣粉分散均匀,搅拌时间45min。
[0085]
s5包衣:将素片和包衣液放入高效包衣锅中进行包衣得薄膜包衣片,检查包衣片外观,干燥,称量包衣实际增重,即得索磷布韦和达拉他韦双层片。
[0086]
实施例4:一种索磷布韦与达拉他韦双层片,包括第一层片和第二层片,所述第一层片中含有索磷布韦400mg、甘露醇300mg、微晶纤维素250mg、交联羧甲基纤维素钠60mg、聚维酮80mg、硬脂酸镁15mg。相应的,第二层片包含以下重量份的组分,包含达拉他韦双磷酸盐75mg、无水乳糖150mg、微晶纤维素100mg、交联羧甲基纤维素钠10mg、聚维酮20mg、硬脂酸镁30mg。
[0087]
上述索磷布韦与达拉他韦双层片的制备方法如下,
[0088]
s1索磷布韦颗粒的制备
[0089]
s11微粉化处理:称取上述相应重量的索磷布韦进行微粉化处理,使微粉化后的索磷布韦的粒经小于0.25mm;
[0090]
s12原料混合:利用等量递增法将微粉化后的索磷布韦与甘露醇、微晶纤维素及交联羧甲基纤维素钠进行预混,后利用高效混合制粒机混合均匀;
[0091]
s13黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为3%的聚维酮溶液即黏合剂;将黏合剂加入到步骤s12中的高效混合制粒机混匀,得到软材;将所得软材用筛网为60目的高速摇摆制粒机制成索磷布韦药粒;
[0092]
s14制成颗粒:将索磷布韦药粒置于65℃烘箱中干燥至水分含量低于3%,经15目筛进行整粒后,与作为润滑剂的硬脂酸镁用总混机混合均匀,得索磷布韦颗粒;
[0093]
s2达拉他韦颗粒准备
[0094]
s21原料预混:取上述相应重量份的达拉他韦双磷酸盐过20目筛处理使其粒径小于0.20mm,利用等量递增法加入上述相应重量份的无水乳糖、微晶纤维素、交联羧甲基纤维素钠进行预混;
[0095]
s22黏合剂制成药粒:称取上述相应重量的聚维酮,加入纯化水搅拌溶解为含量为3%的聚维酮溶液即黏合剂;将黏合剂与步骤s21中将步骤s21中预混得到的混合物加入利用湿法制粒机制成达拉他韦药粒;
[0096]
s23制成颗粒
[0097]
将所得到的达拉他韦药粒利用三维旋振筛对所得颗粒进行筛分得粒径适中的颗粒后与作为润滑剂的硬脂酸镁用总混机混合均匀,得达拉他韦颗粒;
[0098]
s3:双层压片:将s1得到的索磷布韦颗粒置于双层压片机第一层加料器中,将s2得到的达拉他韦颗粒置于双层压片机第二层加料斗中,调节两层压力及片重,压制得素片;
[0099]
s4包衣液制备:按包衣增重5%称取包衣粉和纯化水,将包衣粉缓慢加入纯化水中,边加入边搅拌,使包衣粉分散均匀,搅拌时间60min。包衣:将素片和包衣液放入高效包衣锅中进行包衣得薄膜包衣片,检查包衣片外观,干燥,称量包衣实际增重,即得索磷布韦和达拉他韦双层片。
[0100]
实验数据分析:
[0101]
1.稳定性试验数据分析
[0102]
取实施例1、2、3和4配方及方法制得的索磷布韦-达拉他韦双层片,和市售索磷布
韦片、达拉他韦片,置40℃
±
2℃、相对湿度75%
±
5%条件下放置3个月,分别于第0、1、2、3个月时取样检测,以索磷布韦和其药学可接受的盐含量、达拉他韦含量和其药学可接受的盐、以及杂质含量为指标,比较双层片与市售普通片的加速稳定性,结果如表1所示。
[0103]
表1:实施例1加速稳定性测定结果
[0104][0105]
表2:实施例2加速稳定性测定结果
[0106][0107]
表3:实施例3加速稳定性测定结果
[0108][0109]
表4:实施例4加速稳定性测定结果
[0110][0111][0112]
由上表1-4可知,在加速条件下,本发明四个实施例的双层片在3个月的考察期中,实现了索磷布韦和达拉他韦两个有效成分的含量同步均一稳定,且有关物质较市售普通片含量低,在3个月的考察期中索磷布韦和达拉他韦的有关物质含量保持恒定,而市售片呈现一定幅度增长。
[0113]
2.另取由实施例2配方及方法制得的索磷布韦-达拉他韦双层片,和市售索磷布韦片、达拉他韦片,置25℃
±
2℃、相对湿度60%
±
5%条件下6个月,分别于第0、3、6个月时取样检测,以索磷布韦含量、达拉他韦含量与杂质含量为指标,比较两者的长期稳定性,结果如表5所示。
[0114]
表5:长期稳定性测定结果
[0115][0116]
由上表可知,在经过6个月的长期稳定性试验,双层片的药物含量和杂质含量均无明显变化,实现了两个药物成分的同步稳定,且其杂质含量均低于市售普通片。
[0117]
3、溶出度试验
[0118]
取市售索磷布韦片、市售达拉他韦片、本发明实施例2样品各6片,照溶出度与释放度测定法,以ph1.0盐酸1000ml为溶出介质,转速为每分钟50转,依次经过5、10、15、20、30、45、60min时取液测定,比较盐酸溶液中的溶出和释放情况。
[0119]
表6:本发明实施例2在盐酸溶液中溶出曲线与市售样品的对比
[0120][0121]
从上表可知,本发明所制得的索磷布韦与达拉他韦双层片,实现了两个主要成分的同步快速释放,与市售单一片剂的溶出曲线高度拟合,具有临床上替代使用的可行性。
[0122]
4.联合用药的药理实验:
[0123]
本实验在24孔板中加入huh7细胞,每孔106个细胞,24h后,去上清,加入含有丙肝病毒体的细胞培养物上清液,此上清液10倍稀释,每孔加入1ml的稀释后的上清液;后将索磷布韦片分别用培养基配成15、60、240μg/ml的3种浓度,达拉他韦片分别用培养基配成2.25、9、36μg/ml的3种浓度,将本发明实施例2制得的双层片配成混合药液用培养基配成上述浓度对应的3种浓度药液,另设正常对照,以上不同浓度的索磷布韦片、达拉他韦片、双层片药液分别设置两组,以及无菌蒸馏水六组分别置于24孔板中。24h后,除去接种物,并用含10%胎牛血清的1ml新鲜dmem取代之。培养2d之后,收集细胞,并从细胞中提取全部的rna。
[0124]
用rt-pcr检测丙肝病毒的电泳带,使用定性逆转录pcr(rt-pcr)试剂,按试剂盒说明操作。各组的丙肝病毒电泳带测定结果如表7所示。
[0125]
表7:rt-pcr测定结果
[0126][0127]
备注:“+”表示阳性;+的数量表示电泳带强度;
“-”
表示阴性
[0128]
由上表可知,本发明实施例2制得的混合药液对丙肝病毒的抑制均明显高于索磷布韦与达拉他韦。此外,与单用索磷布韦或达拉他韦相比,联合使用索磷布韦与达拉他韦可以更彻底的抑制丙肝病毒,使丙肝病毒电泳带由对照组的阳性完全转阴。因此,经过本发明的创造性研究,索磷布韦达拉他韦双层片抑制丙型肝炎病毒的效果得到了增强。
[0129]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效质量的变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1