一种牙髓干细胞外泌体制剂、制备方法及其应用与流程
本发明涉及生物技术领域,具体而言,涉及一种牙髓干细胞外泌体制剂、制备方法及其应用。
背景技术:
创伤性脑损伤(tbi)是指暴力因素作用于头部造成的局部解剖、病理结构的改变,导致患者偏瘫、失语、智力障碍甚至昏迷、死亡,其发病率、致残率较高。随着我国经济社会的高速发展,交通、建筑、地质勘探、高竞技性体育项目等行业迅速崛起。与此同时,由生产安全事故及其它意外伤害造成的tbi发病率呈现持续升高的趋势,已达到100/10万,危害十分严重。tbi发生后,神经元细胞损伤是导致神经功能障碍的直接原因,由于神经元很难再生与修复,造成tbi缺乏有效的临床治疗手段。目前常用的手术和药物两种对症治疗方式,仅限于控制患者的颅内压,维持血压,疗效及预后较差。如何修复tbi患者受损的神经组织,并改善相应的神经功能障碍,一直是神经外科领域关注的焦点之一。
大量的实验研究提示,干细胞移植能够改善tbi动物的神经功能恢复,包括胚胎干细胞(escs),间充质干细胞(mscs)及神经干细胞(nscs)等。escs是多能干细胞,具有无限的自我更新能力和各个方向分化的能力。由于其具有极高的全能性,escs细胞成为干细胞移植的最理想的细胞来源。从胎儿的脑部分离出的escs在体外能够存活长达6周,在严重的皮层损伤后,escs移植入受损区域治疗,发现其能减少星形胶质细胞的数量,促进血管生成,改善大鼠运动功能。然而,escs的应用也会受到一定的限制,由于其取材的伦理学要求极高,所以无法获得有效数量的escs用于移植。
在成年哺乳动物的中枢神经系统中,nscs主要位于侧脑室和海马的齿状回周围的侧脑室下区。nscs可以用于治疗大鼠实验性tbi。成年猴子nscs可以存活3个月,并且在重新植入供体大脑后表现出神经元表型。将成年人类nscs移植到脱髓鞘的大鼠脊髓中,这些细胞还可以恢复受损cns的解剖结构和功能。然而,到目前为止,在实验性tbi的治疗中,nscs都表现出一定的限制性,其不能长期存活进而发挥功能。
成人来源的mscs,特别是骨髓间充质干细胞(bmscs)也具有潜在的营养和神经保护作用。在tbi后的急性或亚急性期,bmscs移植明显恢复受损的神经功能,包括运动和认知功能。在大鼠皮层挫伤后24小时内,将大鼠bmscs颅内注射到邻近病变部位的大脑区域,发现其感觉运动功能都有明显改善。然而,骨髓间充质干细胞的取材也在一定程度上受伦理的限制,以至于在临床上很难获得足够量的bmscs用于tbi的修复。
鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种牙髓干细胞外泌体制剂、制备方法及其应用以解决上述技术问题。
本发明的实现途径:
一种牙髓干细胞在制备创伤性脑损伤神经修复制剂中的应用。
发明人创造性的发现,以牙髓干细胞替代传统的胚胎干细胞,神经干细胞或骨髓间充质干细胞具有如下优点:来源丰富,取材简便,免疫原性低以及同时规避了伦理问题等。
用牙髓干细胞制备的制剂可以用于注射治疗创伤性脑损伤,可以显著改善损伤导致的运动功能障碍。
牙髓干细胞(dpscs)作为来源丰富的牙源性间充质干细胞,具有多能干细胞的特性,且能表达神经元细胞表面标志物,并可向神经细胞分化,促进神经细胞的增殖。因此,dpscs具有修复tbi受损神经细胞的潜能。
有报道指出,干细胞发挥治疗作用的机理在很大程度上依赖于其分泌的外泌体所介导的细胞间通讯,与细胞相比,外泌体属于纳米级别的囊泡,内含多种功能性生物学信息,能够更加准确的靶向受体细胞发挥治疗功能。
因此,应用牙髓干细胞外泌体治疗tbi更具有可行性。
在本发明应用较佳的实施方式中,上述牙髓干细胞为成人牙髓干细胞。
牙髓干细胞选自成人牙髓干细胞,成人牙髓干细胞可以从试剂公司购买获得,也可以自行制备,从成人牙中取出牙髓组织,经过消化、离心、培养获得牙髓干细胞。
在本发明应用较佳的实施方式中,上述创伤性脑损伤神经修复制剂的药型为注射剂、喷雾剂、滴剂或贴剂。
修复制剂的剂型可以根据实际修复的需要进行自适应调整,可以制备成注射剂用于待修复部位的注射修复。
一种牙髓干细胞外泌体在制备创伤性脑损伤神经修复制剂中的应用。
外泌体(exosomes)是一种由真核细胞的多泡内涵体(multivesicularbodies,mvbs)与细胞膜融合后释放到细胞外环境中的纳米量级的膜性小囊泡,可由多种类型细胞分泌,其内含有不同种类的蛋白质、脂质、mrnas、micrornas、信号分子等具有生物学活性的物质,较易与邻近细胞的细胞膜发生融合,将生物学活性物质选择性地递送至受体细胞,在不同细胞间进行信息传递,调节细胞间的信号传导,发挥多种生物学功能。
发明人创造性的发现,牙髓干细胞外泌体可以用于制备创伤性脑损伤神经修复制剂,进而实现外泌体治疗tbi。该应用不仅扩大了牙髓干细胞的应用范围,也为创伤性脑损伤的治疗提供新的有效选择。
由于外泌体兼具其来源细胞的生物学特性,用外泌体选择性地替代间充质干细胞(mscs)进行移植,能降低msc引起的注入致畸致癌和免疫排斥的风险,此外,与细胞产品相比,牙髓干细胞外泌体制备的修复制剂稳定性更好,保存和应用都更为方便。因此,外泌体治疗是非细胞治疗的新型替代疗法。
在本发明应用较佳的实施方式中,上述牙髓干细胞外泌体为成人牙髓干细胞外泌体。
一种牙髓干细胞外泌体在制备神经炎症抑制剂中的应用,神经炎症为小胶质细胞介导的神经炎症。
本发明研究发现,牙髓干细胞外泌体可以抑制大鼠损伤脑组织小胶质细胞的m1型极化,促进m2型极化,抑制神经炎症,进而显著改善损伤导致的运动功能障碍,治疗创伤性脑损伤,因此,牙髓干细胞外泌体可以用于制备神经炎症抑制剂。
在本发明应用较佳的实施方式中,上述牙髓干细胞为成人牙髓干细胞。
一种牙髓干细胞外泌体制剂的制备方法,其包括如下步骤:取培养后的牙髓干细胞进行超速离心,去上清得到外泌体,将外泌体与溶剂混合,制得牙髓干细胞外泌体制剂。
上述牙髓干细胞外泌体制备方法包括将牙髓干细胞复苏并培养于无血清dmem/f12培养基,40-48h后收集培养上清。室温,1500-2500g离心10-40min,以去除残留细胞。
2-4℃,8000-10000g离心30-40min,去除细胞碎片。2-4℃,100000-150000g离心3-8h,得到牙髓干细胞外泌体。
再将牙髓干细胞外泌体与溶剂混合即可制得牙髓干细胞外泌体制剂。
一种由上述制备方法制得的牙髓干细胞外泌体制剂,其包括牙髓干细胞外泌体和溶剂,牙髓干细胞外泌体在牙髓干细胞外泌体制剂中的浓度为10-4000μg/ml。
在本发明应用较佳的实施方式中,上述牙髓干细胞外泌体在牙髓干细胞外泌体制剂中的浓度为400-800μg/ml,溶剂为生理盐水。
一种牙髓干细胞外泌体在制备改善运动功能障碍药物中的应用;
优选的,牙髓干细胞外泌体在制备改善平衡能力药物中的应用。本发明研究表明,牙髓干细胞外泌体可以有效改善创伤性脑损伤模型大鼠运动功能障碍,尤其对于改善其平衡能力具有显著的效果。
本发明具有以下有益效果:
本发明提供一种牙髓干细胞外泌体制剂、制备方法及其应用,以牙髓干细胞替代传统的胚胎干细胞,神经干细胞或骨髓间充质干细胞用于治疗神经损伤具有来源丰富,取材简便,免疫原性低以及同时规避了伦理问题等的优点。牙髓干细胞作为来源丰富的牙源性间充质干细胞,具有多能干细胞的特性,且能表达神经元细胞表面标志物,并可向神经细胞分化,促进神经细胞的增殖,因此可以用于制备修复创伤性脑损伤(tbi)等神经损伤的细胞制剂。牙髓干细胞外泌体能准确的靶向受体细胞,用于制备tbi等损伤的神经修复制剂,进而实现外泌体治疗tbi等神经损伤。牙髓干细胞外泌体也可以用于制备神经炎症抑制剂,制备改善运动功能障碍药物。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为透射电镜图;
图2为流式细胞图;
图3为损伤组大鼠脑组织切片he染色图;
图4为牙髓干细胞治疗组大鼠脑组织切片he染色图;
图5为小胶质细胞m1型极化标志物cd68表达情况;
图6为小胶质细胞m2型极化标志物cd206表达情况。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供了一种牙髓干细胞外泌体的制备方法,其包括如下步骤,本实施例选择成人牙髓干细胞(dentalpulpstemcells,dpscs):
(1)牙髓干细胞取材,其取材方法包括如下依次进行的步骤:取自西安交通大学口腔颌面外科门诊拔除的智齿,完整、无龋、无牙髓病、根尖周病及牙周病。患者年龄13-30岁,性别不限,无肝炎、结核等传染性疾病。牙齿拔除前,用安尔碘ⅲ消毒牙齿。完整拔除后,再次消毒。
(2)牙髓干细胞的分离。
在超净台内操作,将拔除智齿(用骨凿从釉牙骨质界处分开牙根和牙冠)置于无菌的35mm培养皿中,用含2倍三抗(100u/ml青霉素,100μg/ml链霉素,0.25μg/ml两性霉素b,均购自invitrogen公司,美国)的pbs反复冲洗3次,使用拔髓针尽量完整拔出牙髓组织,将牙髓置于35mm培养皿中(剪除根尖端2mm),分别加入0.5ml的3mg/ml的ⅰ型胶原酶和0.5ml的4mg/ml的dispase酶(中性蛋白酶),使用眼科剪剪碎牙髓组织,于37℃消化30分钟(5%co2),每10分钟轻轻摇晃,直到无明显组织块漂浮。
将消化后的组织块和细胞悬液转移到60mm培养皿中,置于孵育箱中静置培养,培养条件:37℃,5%co2,饱和湿度。
细胞贴壁后隔日半量换液,倒置显微镜观察细胞生长状况,以后每3天换液1次,细胞达到80%融合后1:2传代。4周后如未有细胞长出则弃之。
(3)牙源性干细胞的冻存,即建立牙源性干细胞库。观察当细胞融合达到80%时冻存,具体包括如下步骤:
从孵育箱中取出培养皿,弃去原培养液,pbs冲洗2次;加入1ml胰酶+0.01%edta,轻轻晃动培养皿,使消化液覆盖所有细胞表面;37℃中消化2min,显微镜下观察细胞形态;当细胞间隙变大、形态变圆,有少数细胞脱落时,以体积比1:1加入含10%fbs的dmem/f12(购自invitrogen公司,美国)终止消化。
将培养液以一定顺序吹打皿底,使细胞脱壁,收集至15ml离心管,至大部分细胞脱落后,再加入2mlpbs吹打皿底,再收集至同一离心管中,在1000r/min下离心5min,弃上清;向离心管中加入0.9ml培养液和0.1mldmso,混匀,并轻轻吹散细胞团块,移入1.5ml冻存管,封口膜密封。做好标记,将冻存管置于程序降温盒内,放入-70℃组织库内,24h后转移到干细胞库专用液氮罐内。
(4)牙髓干细胞外泌体的提取:将牙髓干细胞进行复苏并培养于无血清的dmem/f12培养基,48h后收集培养上清。然后在室温环境下,2000g离心30min,以去除残留细胞。
4℃,10000g离心30min,去除细胞碎片。4℃,100000g离心5h,得到牙髓干细胞外泌体。
实施例2
本实施例对实施例1制备的牙髓干细胞外泌体进行鉴定。
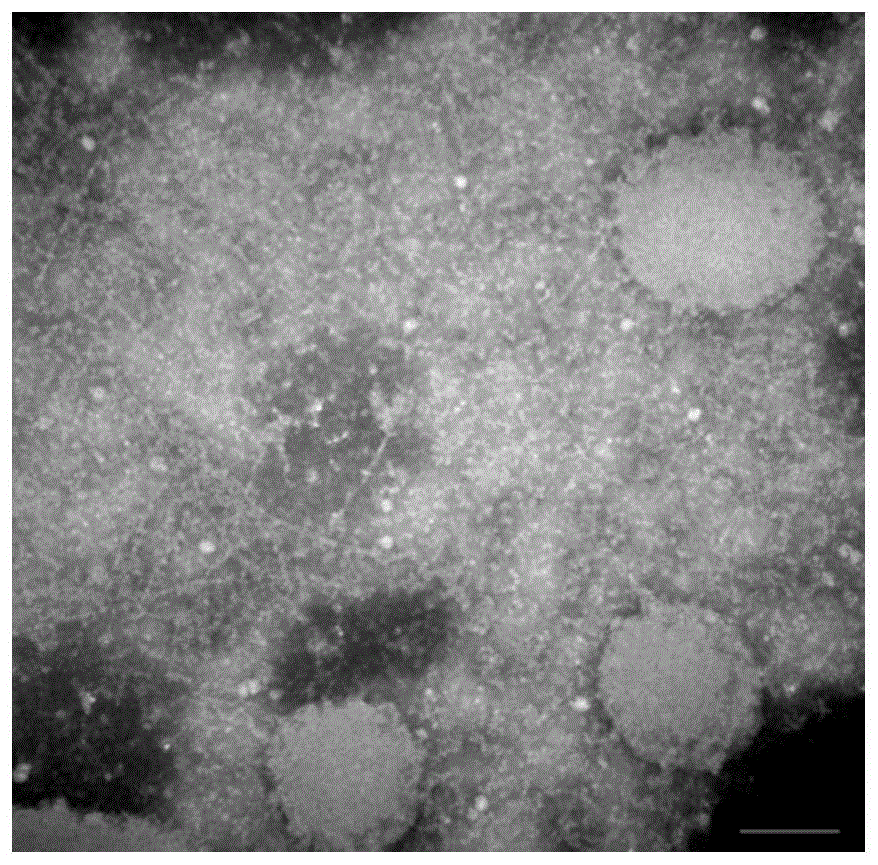
(1)进行透射电镜观察。
用质量体积浓度为4%pfa(多聚甲醛溶液,购自北京索莱宝科技有限公司)固定牙髓干细胞外泌体,将固定液加到载样网上,吸收20min。将100μlpbs加到封口膜上清洗,1%戊二醛5min,超纯水2min(洗8次),将铜网放在50μl草酸双氧铀(ph7)液滴上5min,将铜网放在50μl甲基纤维素-ua液滴上10min,冰上操作,用不锈钢环移开铜网,在滤纸上轻轻吸去多余液体,留下薄层甲基纤维素膜,铜网仍在不锈钢环上,空气中干燥5min。干燥后,出现蓝-金色的干涉条纹说明甲基纤维素膜厚度合适、均匀。在80kv下拍摄电镜照片。
电镜图参照图1所示,由图1可知,制备的外泌体呈现大小不一的囊泡结构,直径在30-100nm之间,标尺=200nm。
(2)进行流式细胞术检测。
在实施例1中牙髓干细胞外泌体悬液中加入100μl去离子水进行溶解,使最终浓度为1μg/μl。制备外泌体beads,混合5μl外泌体悬液和5μlfacs-beads,室温孵育15min。加入0.7ml1xpbs并在振荡器中室温孵育2h。在4500rpm,4℃条件下离心5min,弃去上清液。加入1ml样品缓冲液,重悬5次,室温孵育15min。4500rpm,4℃离心5min,弃去上清液。1×pbs稀释2%fbs,重悬于100μl样品缓冲液中。
一抗与缓冲液的体积比为1:200,加入一抗,4℃避光孵育2h。每管加入4ml洗涤缓冲液,4000g离心5min,弃上清。将沉淀重悬于100μl样品缓冲液中,二抗与缓冲液的体积比为1:2000,加入二抗。4℃避光孵育1h。
在每个孵育后的管中加入4ml洗涤缓冲液,4℃4000g离心5min,弃去上清。每管加入500μl洗涤缓冲液,上机检测。
流式细胞术检测结果参照图2所示,由图2可知,制备的外泌体表达外泌体表面标记物cd63,表达比例为92.23%。
实施例3
本实施例构建了一种创伤性脑损伤模型,并对其进行牙髓干细胞外泌体治疗。
选择200g体重雄性成年sd大鼠,在腹腔注射10%水合氯醛麻醉,给药剂量为350mg/kg。找准目标前囟区,脑立体定位仪固定大鼠脑部,备皮消毒。在备皮区沿中线矢状方向剪开皮肤,钝性分离皮下组织,暴露前囟。前囟左旁开1mm处(大鼠右后肢运动功能定位区域),开直径2mm的颅骨开窗孔。在高度20cm,用重量20g的重物垂直击打开窗区域内脑组织。
进行牙髓干细胞外泌体治疗。损伤后即刻利用微量注射器对各组进行损伤区域局部注射治疗,取实施例1中的外泌体浓度为400μg/ml,注射3μl,对位缝合皮肤。
实施例4
本实施例对实施例3进行牙髓干细胞外泌体治疗后的大鼠组织进行组织学及免疫荧光染色分析。
治疗后2周,对大鼠脑组织损伤部位进行取样,组织切片。切片常规脱蜡至水,二甲苯脱蜡,梯度(100%,95%,80%,70%)乙醇处理至水。苏木素5min,流水冲洗5min,分化液浸润30s,流水冲洗5min,伊红10s,流水冲洗5min,脱水至二甲苯。用树胶封片,观察组织的恢复情况。
he染色结果参照图3和图4所示,由图3和图4可知,牙源性干细胞外泌体能够明显促进大鼠脑损伤的修复。图3为损伤组大鼠2周后脑组织切片he染色图,图4为牙髓干细胞治疗组,损伤治疗后2周大鼠脑组织切片he染色图。
治疗后48h,对大鼠脑组织损伤部位进行取样,组织切片,切片常规脱蜡至水,3%过氧化氢室温反应10min,用pbs洗3次,在0.3%的triton-100溶液下,室温孵育30min。孵育后用pbs洗3次,用正常山羊血清,在室温封闭1h,cd68(m1极化标志物)及cd206(m2极化标志物)抗体孵育,4℃过夜。pbs洗3次,荧光二抗,避光孵育2h,pbs洗3次,dapi染核,封片,检测损伤处相关分子的表达。
免疫荧光染色结果参照图5和图6所示,图5为小胶质细胞m1型极化标志物cd68表达情况,从左向右依次为tbi损伤组和牙髓干细胞外泌体治疗组,图5中的左图显示的是tbi损伤组大鼠48h后脑组织切片免疫荧光染色图,图5中的右图显示的是损伤治疗后48h大鼠脑组织切片免疫荧光染色图;图6为小胶质细胞m2型极化标志物cd206表达情况,从左向右依次为tbi损伤组,牙髓干细胞外泌体治疗组,图6中的左图显示的是tbi损伤组大鼠48h后脑组织切片免疫荧光染色图,图6中的右图显示的是损伤治疗后48h大鼠脑组织切片免疫荧光染色图。
由图5和图6可知,牙髓干细胞外泌体抑制大鼠损伤脑组织小胶质细胞的m1型极化,促进m2型极化,抑制神经炎症。
实施例5
本实施例进行大鼠运动功能检测。利用basso-beattie-bresnahan(bbb)评价标准对大鼠创伤治疗后48h、1周、2周、3周运动功能进行评价,bbb评价标准参照表1所示。
表1bbb大鼠运动功能评分表。
治疗后48h、1w、2w、3w对大鼠进行运动功能检测,bbb评分结果显示,如表2,牙髓干细胞外泌体治疗明显恢复大鼠受损的运动功能。
表2大鼠bbb运动功能评分
本发明使用牙髓干细胞外泌体治疗神经相关疾病(创伤性脑损伤),提出的牙髓干细胞外泌体制备方法在保证有效性的前提下具有可重复性,结合应用实例,本发明制备的牙髓干细胞外泌体局部注射可以治疗创伤性脑损伤,2周后能够显著改善损伤导致的运动功能障碍,且治疗作用的机制依赖于减轻小胶质细胞介导的神经炎症。本发明为干细胞应用于神经损伤的修复提供了新的治疗选择和方案。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!