用于图像引导消融术的消融导管和消融设备的制作方法
本发明涉及一种用于图像引导消融术的消融导管,同时涉及包括上述消融导管的消融设备,属于医疗器械领域。
背景技术:
肿瘤热疗是指利用某种加热方法把肿瘤组织加热至超过其耐热温度以杀死癌细胞,其包括温热疗法和高温热凝固法两种。温热疗法是加热肿瘤至42.5-45℃并保持一定时间(通常为数分钟到几十分钟),抑制肿瘤组织的生长以达到治疗癌症的目的。高温热凝固法是将肿瘤组织加热到较高的温度(一般为60℃即刻,或54℃保持一分钟)而使肿瘤完全性坏死。近十年来,随着微波技术,特别是植入式微波技术、射频技术及高能聚焦超声技术的发展,高温热凝固疗法发展迅速,已成为一种临床实用的肿瘤治疗手段。
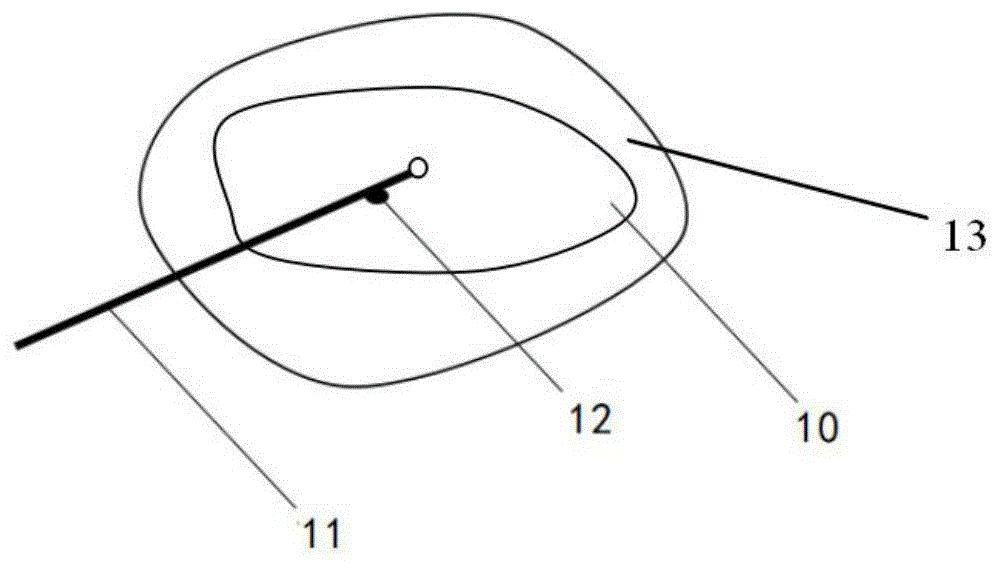
一个有效的热疗必须将被治疗组织中的温度分布控制在适宜范围内,因此对组织温度进行准确测控非常重要。目前临床上多采用的有创测温技术也称侵入式测量。如图1所示,在消融探针11的远端设置有测温传感器12,测温传感器12与消融探针11连接,通过把热电偶、热敏电阻之类的测温传感器12与消融探针11一起放置到肿瘤组织10内(也在肿瘤组织与正常组织的交界区13内)待测部位进行单点或多点的直接测温。然而侵入肿瘤内部进行温度测量的方法相对危险,并且,通过对肿瘤内部进行测温所获取的温度还需要结合操作者的经验或预设算法估算整个肿瘤范围内的温度分布,进而对肿瘤消融的过程进行控制。这种温度监测方式,对于整个肿瘤范围的温度分布无法精确测量,需要对肿瘤交界区的温度进行估计,从而根据估算的温度对消融过程进行控制,存在测量不准确的问题,容易造成肿瘤未完全消融或过度消融损伤正常组织的情况。
上述侵入式测温是有创伤监测,目前国内外的研究方向还在于无创测温,例如:超声波、磁共振等等。但是,超声波只能在没有气体和骨骼等干扰的条件下进行,而磁共振成像设备昂贵,并且高强度磁场使得使用的设备器械必须与磁场兼容,进一步加大了成本和应用限制。
冷冻消融术是指使癌组织快速冷冻至特定温度(例如,-60℃)以下,然后复温,从而导致癌细胞脱水破裂,或者导致肿瘤小血管缺氧,从而导致癌细胞死亡。进行冷冻消融术后,病变部位的死亡肿瘤组织将作为抗原,促进机体发生抗肿瘤免疫反应。由于冷冻后的癌细胞对化疗或放疗的敏感程度较大,所以化疗或放疗对其的治疗效果增强。同样,现有冷冻消融针消融过程中也存在温度检测不准确的问题,此时,如果仍按照原规划的消融条件进行消融,将可能导致不完全消融或过度消融的问题。
技术实现要素:
本发明所要解决的首要技术问题在于提供一种用于图像引导消融术的消融导管。
本发明所要解决的另一技术问题在于提供一种包括上述消融导管的消融设备。
为了实现上述目的,本发明采用下述的技术方案:
根据本发明实施例的第一方面,提供一种用于图像引导消融术的消融导管,包括细长形的导管主体,在导管主体的远端设置有不同的第一导管分支和第二导管分支;在第一导管分支的远端设置有消融探针,在第二导管分支的远端设置有测温探针;在导管主体的近端设置有控制手柄。
其中较优地,在本发明所提供的一个实施例中,所述消融探针的远端为针尖型,所述消融探针远端设置有消融电极;
所述测温探针的远端为针尖型,所述测温探针远端设置有第一测温传感器。
其中较优地,所述第一测温传感器嵌设在所述测温探针远端,并且,所述第一测温传感器的表面与所述测温探针的表面平齐。
其中较优地,当第一测温传感器和消融电极组成回路时,可以测量位于所述测温探针和所述消融探针之间的人体组织的阻抗。
其中较优地,在本发明所提供的又一实施例中,所述测温探针的远端为针尖型,设置有第一测温传感器;
所述消融探针的近端设置有第二测温传感器和第三测温传感器,所述第二测温传感器设置于与流向所述消融探针的远端的冷冻剂接近的位置,所述第三测温传感器设置于与回流的所述冷冻剂接近的位置。
其中较优地,所述导管主体内部设置有冷冻剂进液管路和冷冻剂回流管路,所述冷冻剂进液管路从所述第一分支管路中延伸到所述消融探针的内部,并与冷冻剂进液口连通;所述冷冻剂回流管路从所述第一分支管路中延伸到所述消融探针的内部,并与冷冻剂回流口接通,
所述第二测温传感器设置于所述冷冻剂进液管路;所述第三测温传感器设置于所述冷冻剂回流管路。
其中较优地,所述第二测温传感器和所述第三测温传感器位于手术时不会进入人体内的位置。
根据本发明实施例的第二方面,提供一种消融设备,包括上述消融导管,还包括消融主机,所述消融主机通过连接线与所述控制手柄连接;
所述消融主机包括控制模块、温度监测模块和消融模块,所述控制模块分别与所述温度监测模块和所述消融模块连接;其中,
所述消融模块用于控制消融探针的能量;
所述温度监测模块用于通过测温探针对交界区外的温度进行实时测量;
所述控制模块用于根据所述温度监测模块所采集的实时温度值,对所述消融模块的消融时间和功率进行控制。
其中较优地,在本发明所提供的一个实施例中,所述消融主机还包括与控制模块连接的阻抗监测模块;所述阻抗监测模块用于获取消融探针和测温探针之间的组织的阻抗;所述控制模块,用于通过所述阻抗监测模块所获得的阻抗值对待消融组织的消融效果进行评估。
其中较优地,在本发明所提供的又一实施例中,所述温度监测模块还用于获取消融探针冷冻剂进口温度和冷冻剂出口温度;所述控制模块还用于根据所述冷冻剂进口温度和冷冻剂出口温度对消融温度进行控制。
本发明所提供的用于图像引导消融术的消融导管,消融探针和测温探针分别设置,在将消融探针放置于待消融组织内消融的同时,可以将测温探针定位于待消融组织与正常组织的交界处,对待消融组织交界区的实际温度进行实时准确地测量,通过上述测温探针对待消融组织的消融过程进行监测,可以准确测量待消融组织交界区的温度,从而精准控制消融手术实施,使待消融组织消融完全、防止待消融组织复发,又可以有效保护正常组织,防止过度消融。
附图说明
图1是现有介入手术中,侵入式测温方式的示意图;
图2是本发明的交界区示意图;
图3是本发明第一实施例所提供的消融导管的测温方式的示意图;
图4是本发明第一实施例所提供的消融设备的结构示意图;
图5是本发明第一实施例所提供的消融主机的模块组成图;
图6是本发明第二实施例所提供的消融导管中,消融探针的结构示意图;
图7是本发明第二实施例所提供的消融设备的结构示意图;
图8是本发明第二实施例所提供的消融主机的模块组成图。
具体实施方式
下面结合附图和具体的实施例对本发明的技术方案进行进一步地详细描述。
众所周知,根据活检结果,肿瘤细胞的浸润范围要比ct上的低密度影和mri上t2加权像的高信号范围更广,因此无法根据影像来准确地判断肿瘤细胞浸润范围,这就造成很多介入手术没有将肿瘤组织及其浸润范围内的组织全部消融,显著降低了肿瘤手术的疗效。
如图2所示ct影像示意图中,待消融组织10(例如肿瘤组织)浸润到待消融组织10边缘外的正常组织中。医生从影像图中可以判断出完全没有肿瘤细胞的正常组织15。在待消融组织10边缘与正常组织(无肿瘤细胞)15之间的部位,即图中箭头所示区域,是交界区13。本发明的交界区13,是指从待消融组织10(例如,肿瘤组织)边缘(影像学上看到的边缘)过渡到完全没有肿瘤细胞的肿瘤周边正常组织15的这部分组织,交界区13内有少量肿瘤细胞和大量正常组织。
本发明所提供的消融导管包括独立设置的测温探针,通过将测温探针的测温点(测温探针进入待消融组织的点)18位于待消融组织10和正常组织15的交界区13外部,使其位于正常组织15内靠近交界区13的位置,改善了消融手术过程中的温度监测效果。
<第一实施例>
本发明所提供的消融导管和消融设备适用于图像引导下的消融手术。如图3和图4所示,本发明所提供的射频导管,具有独立的消融探针20和测温探针21,通过将消融探针20放置于待消融组织10(例如肿瘤)内,并将测温探针21定位于待消融组织10与正常组织15的(肿瘤组织与正常组织的)交界区13之外,对待消融组织10交界区的实际温度进行实时准确地测量,从而可以精确控制消融手术实施,使待消融组织消融完全、防止待消融组织复发,又可以有效保护正常组织,防止过度消融。
具体来说,如图4所示,本发明所提供的射频导管,包括细长型的导管主体24,在导管主体24的远端还设置有不同的第一分支导管25和第二分支导管26。在第一分支导管25的远端设置有消融探针20,消融探针20硬度较高,远端设置为针尖型,便于刺入待消融组织10,消融探针20可以采用医用穿刺针的材质制造,例如不锈钢或工具钢。在第二消融导管26的远端设置有测温探针21,测温探针21硬度较高,测温探针21远端设置为针尖型,测温探针21能够独立刺入待消融组织10和正常组织15的交界区13之外的位置。测温探针21同样可以采用医用穿刺针的材质制造,例如不锈钢或工具钢。第一分支导管25和第二分支导管26相对于导管主体24长度较短、质地较软,弯曲度更高,便于握持消融探针20和测温探针21实现穿刺操作。
在导管主体24的近端设置有控制手柄27。在导管主体24的内部设置有平行的第一导线和第二导线。第一导线的远端从第一分支导管25内部穿过,并与消融探针20的近端连接;第一导线的近端连接到控制手柄27。第二导线的远端从第二分支导管26内部穿过,并与测温探针21的近端连接;第二导线的近端连接到控制手柄27。
射频探针20包括空心的穿刺针,在穿刺针的远端(也可以是靠近病灶的一端)设置有消融电极23,第一导线的远端穿入穿刺针的内部并与消融电极23连接,用于向消融电极23传输能量。较优地,消融电极23嵌入穿刺针的内部,消融电极23的表面与穿刺针平齐,便于穿刺操作。
测温探针21包括空心的穿刺针,并在穿刺针的远端(也可以是靠近病灶的一端)设置有第一测温传感器22(例如,热电偶、热敏电阻,等),第二导线的远端穿入穿刺针的内部并与第一测温传感器22连接。较优地,第一测温传感器22嵌入穿刺针的内部,第一测温传感器22的表面与穿刺针平齐,便于穿刺操作。
通过第一测温传感器22和消融电极23组成回路,可以在消融之前对消融探针20和测温探针21之间的待消融组织10的阻抗进行测量,得到第一阻抗。在消融完毕之后,通过再次测量待消融组织的阻抗,得到第二阻抗。将第一阻抗与第二阻抗进行比较,以评估消融效果。
较优地,图像引导消融治疗手术过程中,医生通过观察影像,使测温探针21中第一测温传感器22的测量位置控制在距离待消融组织10与正常组织15的交界区13之外(即,图2中靠近无肿瘤细胞的正常组织的一侧)2~10mm的范围内。具体到每个肿瘤需要消融掉多少肿瘤边缘之外的交界区的组织,需要医生根据肿瘤情况来确定,因此,第一测温传感器22的测量位置在交界区外2~10mm的范围内由医生选定。
更优的是,第一测温传感器22的测量位置在,交界区13中距离消融电极23最远的位置的外侧(远离消融电极13的一侧)。这样的第一测温传感器22位置,可以实现从消融电极23到第一测温传感器22的距离,大于消融电极23到待消融组织(肿瘤组织)10的交界区上任意一点的距离,也大于消融电极23到交界区13的任意一点的距离,因此第一测温传感器22的温度,低于待消融组织(肿瘤组织)10的交界区上任意一点的温度,也低于交界区13的任意一点的温度。所以,只要保证第一测温传感器22的温度高于杀灭肿瘤细胞的预设温度(例如60度),整个待消融组织(肿瘤组织)10及交界区13的温度,都会高于预设温度,从而达到将整个待消融组织(肿瘤组织)10及交界区13的细胞都杀灭的效果。
控制手柄27上设置有多个接头,用于实现消融探针20、测温探针21与消融主机30的连接。
使用上述消融导管进行消融时,通过将消融探针20放置于待消融组织10(例如肿瘤)内,并将测温探针21定位于待消融组织10与正常组织15的交界区之外,靠近交界区13的位置,可以对待消融组织10交界区的实际温度进行实时准确地测量。其中,测温探针21测量的部位为待消融组织10的交界区,由于消融探针20的穿刺消融部位通常为待消融组织10的中心位置,通过对其一侧交界区外部(远离肿瘤组织的外部)的温度进行测量,可以据此精确控制消融手术实施,使待消融组织消融完全、防止待消融组织复发,又可以有效保护正常组织,防止过度消融。
此外,通过将测温探针21和消融探针20独立设置,可以将测温探针21设置在待消融组织10边缘的正常组织内,一方面,可以对待消融组织交界区的温度进行实时测量;另一方面,测温探针21不直接与待消融组织10接触,防止待消融组织沿针道播散。
如图4和图5所示,本发明所提供的消融设备,除去包括上述消融导管外,还包括消融主机30和连接线31,连接线31用于将消融主机30和控制手柄27连接起来。连接线31的一端分别通过第一导线和第二导线与消融探针20和测温探针21相连;连接线31的另一端分别与消融主机30中的消融模块33、温度监测模块34和阻抗测量模块35相连。
如图5所示,消融主机30包括控制模块32、消融模块33、温度监测模块34和阻抗测量模块35;控制模块32分别与温度监测模块33、消融模块34和阻抗测量模块35连接。其中,消融电极23与消融模块33连接,第一测温传感器22与温度监测模块34连接;并且,消融电极23和第一测温传感器22可以同时与阻抗测量模块35连接。
较优地,连接线31是一根由多根导线集成的导线,通过将连接线31的两端分别插入控制手柄27和消融主机30的对应位置,可以实现消融主机30和消融导管的连接。
消融模块33用于控制消融电极23向待消融组织10传递射频能量。温度监测模块34用于通过第一测温传感器22测量待消融组织10和正常组织15的交界区13的温度。阻抗监测模块35用于获取消融探针20和测温探针21之间的组织的阻抗,从而对待消融组织的消融效果进行评估。
控制模块32用于根据温度监测模块34所采集的实时温度值,对消融模块33的消融时间和功率进行控制,以达到精确消融的目的。其中,当测温探针21周围的温度达到设定阈值(例如,42.5°),并保持设定时间(例如,1min)后,表明待消融组织包括交界地带的一部分正常组织细胞已经被杀死,即可停止消融。此时,待消融组织10以及周边1~2cm左右的正常组织20被杀灭,从而保证消融手术的效果达到外科切除的要求。同时,控制模块32用于根据阻抗监测模块35监测消融探针20与测温探针21之间的电阻抗变化,可以推测出待消融组织的消融状态。
<第二实施例>
第二实施例所提供的消融导管和消融设备同样适用于图像引导下的冷冻消融手术。其中,射频导管具有独立的消融探针40和测温探针51,通过将消融探针40刺入待消融组织(例如肿瘤)内,并将测温探针51定位于待消融组织10与正常组织15的(肿瘤组织与正常组织的)交界区13之外,对待消融组织10交界区的实际温度进行实时准确地测量,从而可以精确控制消融手术实施,使待消融组织消融完全、防止待消融组织复发,又可以有效保护正常组织,防止过度消融。
在该实施例中,如图6和图7所示,射频导管包括细长型的导管主体55,在导管主体55的远端设置有不同的柔软的第一分支导管53和第二分支导管54。在第一分支导管53的远端(靠近待消融组织10)设置有消融探针40,消融探针40硬度较高,远端设置为针尖型,便于刺入待消融组织10。在第二消融导管54的远端(靠近待消融组织10)设置有测温探针51,测温探针51硬度较高,测温探针51远端设置为针尖型,测温探针51能够独立刺入待消融组织10和正常组织15的交界区13之外的位置。
在导管主体55的近端设置有控制手柄56。在导管主体55的内部设置有冷冻剂进液管路45和冷冻剂回流管路46。冷冻剂进液管路45的一端连接到控制手柄56,另一端从第一分支管路53中延伸到消融探针40内部,并在消融探针40远端形成冷冻剂进液口43;冷冻剂回流管路46的一端连接到控制手柄56,另一端从第一分支管路53中延伸到消融探针40内部,并在消融探针40远端形成冷冻剂回流口44。
在导管主体55的内部设置有多条平行的导线。其中,第一导线的远端从第一分支导管53内部穿过,并与设置在消融探针40中的第二测温传感器41连接;第一导线的近端连接到控制手柄56。第三导线的远端从第一分支导管53内部穿过,并与设置在消融探针40中的第三测温传感器42连接;第三导线的近端连接到控制手柄56。第二测温传感器41设置于冷冻剂进液管路45的近端,用于测量流向冷冻剂进液口43的冷冻剂的温度;第三测温传感器42设置于冷冻剂回流管路46的近端,用于测量回流的冷冻剂的温度。换言之,第二测温传感器设置于与流向消融探针的远端的冷冻剂接近的位置,第三测温传感器设置于与回流的冷冻剂接近的位置。用于测量冷冻剂的进液温度和回流温度的第二测温传感器41和第三测温传感器42位于近端,在即使手术时也不会进入人体内的位置(例如位于第一分支导管53与消融探针40连接处),这样可以减小消融探针40的远端管径,减小消融探针40远端刺入体内造成的创口。
第二导线的远端从第二分支导管54内部穿过,并与设置在测温探针51中的第一测温传感器52连接;第二导线的近端连接到控制手柄56。第一测温传感器52用于测量待消融组织10和正常组织15的交界处13外的温度。第一测温传感器52的使用方式和作用与第一实施例中第一测温传感器22的使用方式和作用相同。在此不再赘述。
控制手柄56上设置有多个接头,用于实现消融探针40、测温探针51与消融主机60的连接。
使用上述消融导管进行消融时,通过将消融探针40送入待消融组织10(例如肿瘤)内,并将测温探针51定位于待消融组织10与正常组织15的交界区之外,靠近交界区13的位置,可以对待消融组织10交界区的实际温度进行实时准确地测量。其中,测温探针51测量的部位为待消融组织10的交界区外侧(靠近无肿瘤细胞的正常组织),由于消融探针40的穿刺消融部位通常为待消融组织10的中心位置,通过对其一侧交界区外部(远离肿瘤组织的外部)的温度进行测量,可以据此判断整个交界区内的温度均达到预期温度,从而精确控制冷冻消融范围,使待消融组织及交界区内的组织被完全消融、防止复发,又可以有效保护正常组织,避免过度消融。
此外,通过将测温探针51和消融探针40独立设置,可以将测温探针51设置在待消融组织10边缘的正常组织内,一方面,可以对待消融组织交界区13的温度进行实时测量;另一方面,测温探针51不直接与待消融组织10接触,防止待消融组织沿针道播散。
如图7和图8所示,本发明所提供的消融设备,除去包括上述消融导管外,还包括消融主机60和连接线61,连接线61用于将消融主机60和控制手柄56连接起来。连接线61的一端分别通过不同的导线与消融探针40和测温探针51中的测温传感器相连;连接线61的另一端与消融主机60中的温度监测模块64相连。此外,连接线61还包括两条冷冻剂连接管路,两条冷冻剂连接管路分别与冷冻剂进液管路和冷冻剂回流管路对应接通,形成冷冻剂循环管路。其中,在与冷冻剂进液管路45连通的冷冻剂连接管路的末端连接有冷冻剂储存瓶67,用于提供冷冻剂;较优地,在与冷冻剂回流管路46连通的冷冻剂连接管路的末端连接有另一个冷冻剂储存瓶,用于储存经过循环的冷冻剂。在冷冻剂循环管路上设置有控制阀66。
消融主机60包括控制模块62、消融模块63、温度监测模块64。控制模块62分别与温度监测模块63、消融模块64连接。其中,冷冻液循环管路上的控制阀66与消融模块63连接,第一测温传感器52、第二测温传感器41、第三测温传感器42分别与温度监测模块64连接。
较优地,连接线61是一根由多根导线和多根冷冻剂连接管路集成的连接线,通过将连接线61的两端分别插入控制手柄56和消融主机60的对应位置,可以实现消融主机60和消融导管的连接。
消融模块63用于控制消融探针40向待消融组织10传递冷冻能量。温度监测模块64用于通过第一测温传感器52测量待消融组织10和正常组织15的交界区16的温度,并通过第二测温传感器41测量冷冻剂进液温度,通过第三测温传感器42测量冷冻剂回流温度。
控制模块62用于根据温度监测模块64所采集的实时温度值,对消融模块63的消融时间和功率进行控制,以达到精确消融的目的。其中,当测温探针51周围的温度达到设定阈值(例如,-60°),并保持设定时间后,表明待消融组织包括交界区的一部分正常组织细胞已经被杀死,即可停止消融。此时,待消融组织10以及周边2mm左右的正常组织20(发生肿瘤浸润的区域)均被杀灭,从而保证消融手术的效果达到外科切除的要求。
在上述冷冻消融的过程中,控制模块62用于根据第一测温传感器52所测得的待消融组织交界区的温度(低于-40度,更优的是零下42度至零下50度),对待消融组织的实际消融情况进行监测;控制模块62还用于根据第二测温传感器41和第三测温传感器42所测得的冷冻剂进液温度和冷冻剂回流温度之间的差值,控制待消融组织的消融效果。具体而言,根据第二测温传感器41和第三测温传感器42所测得的冷冻剂进液温度和冷冻剂回流温度之间的差值,结合冷冻剂的流速和管径等信息,可以计算出这些冷冻剂在待消融组织体内传导的热量。再根据热量,结合影像学上看到的待消融组织和交界区的体积,可以估算出待消融组织受热情况(例如,消融针头部的温度),因此可以判断出消融效果。
综上所述,本发明所提供的消融导管和消融设备,包括独立的消融探针和测温探针,以微创的方式,将微小的测温探针设置在需要消融的待消融组织与正常组织的交界区外,消融手术中实时监测该区域的温度变化,精准控制消融手术实施,使待消融组织消融完全、防止待消融组织复发,又可以有效保护正常组织,防止过度消融。
本发明所提供的消融探针和测温探针独立设计方案,与惯常设计思路不同。惯常设计思路是减少创伤,将二者结合在一起,通过一个创口同时送入消融探针和测温探针。本发明则需要用两个创口分别送入消融探针和测温探针,或者通过一个创口分两次分别送入消融探针和测温探针,但是通过将测温探针设置在需要消融的待消融组织与正常组织的交界区外,在消融手术中实时监测该区域的温度变化,精准控制消融手术实施,达到彻底消融整个肿瘤组织及其浸润的正常组织的效果,避免肿瘤复发。
以上对本发明所提供的用于图像引导消融术的消融导管和消融设备进行了详细的说明。对本领域的一般技术人员而言,在不背离本发明实质内容的前提下对它所做的任何显而易见的改动,都将构成对本发明专利权的侵犯,将承担相应的法律责任。
- 还没有人留言评论。精彩留言会获得点赞!