电聚合导电高分子载药人工耳蜗电极及其制作方法与流程
本发明涉及电子医疗领域,特别涉及一种电聚合导电高分子载药人工耳蜗电极及其制作方法。
背景技术:
世界卫生组织数据显示,全球目前约有2.8亿人口患有残疾性听力损失。中国现有2780万名听障人士,其中重聋患者达到800万人。除了脑膜炎,麻疹,腮腺炎和慢性耳部感染等感染性原因外,听力损伤通常是由于暴露于过度噪音,头部和耳朵受伤,衰老和使用耳毒性药物而引起的。
药物治疗一直是内耳病的首选治疗方法。当药物治疗无效时,才考虑其他治疗方案。通过静脉、肌内或口服给药的方法仍为内耳病治疗的主要给药方式。由于内耳与全身血液循环之间存在血-迷路屏障,在解剖学和功能上类似于血脑屏障。因此,对于许多药物来说,全身治疗是不可行的,局部给药具有优势。此外,经全身给药可能对身体其他器官造成不良反应,或者有些系统性疾病患者对药物有禁忌证,如糖尿病、高血压、胃溃疡的患者不能给予全身激素治疗。内耳包括耳蜗和前庭,具有精细而复杂的结构。耳蜗是一个小的螺旋管(长度约35毫米),在耳蜗内,大多数目标组织浸入在约76ml的外周淋巴液,淋巴液类似于脑脊液。研究表明内耳局部给药使药物跨越血-迷路屏障直接进入内耳,在内耳达到的药物浓度是全身给药的100倍以上,从而可以减少用药剂量,同时避免全身用药的不良反应,克服圆窗膜给药时蜗内分布不均的缺点,使药物在内耳局部作用效力得到提高。
内耳局部给药已有长期临床应用。目前的主要方式为鼓室灌注给药,其次为经圆窗膜缓释/控释给药,两者都以内耳圆窗膜的通透性为理论依据,到达中耳腔的药物分子通过圆窗膜渗透到内耳而发挥作用。圆窗膜的渗透性受到多种因素的影响,如分子的大小、构型、浓度、脂溶性、电荷及圆窗膜的厚度等,圆窗膜的渗透直径在2μm以下,直径3μm或以上的颗粒则不能通过。
由于哺乳动物的内耳的感觉细胞仅在胚胎发生期间发育,无法在产后再生,因此在药物治疗无效的情况下,目前听力只能通过植入人工耳蜗来恢复。人工耳蜗系统是一种能够为重度和极重度感音神经性耳聋患者提供功能性听力的植入型电子装置,也是目前临床实践中对感音神经性耳聋唯一有效的治疗方法。人工耳蜗技术通过植入耳蜗的电极刺激螺旋神经节神经元(sgns),为重度至严重的感音神经性听力丧失患者提供听觉。人工耳蜗越过人体的外耳、中耳、内耳,用带有声音信息的电脉冲直接刺激听神经来产生听觉。它通常由一个体外装置和一个可植入的体内装置组成。
体外装置称为人工耳蜗言语处理器(简称为:言语处理器),主要原理是由言语处理器上的麦克风拾取声音信号,并对采集的声音信号进行处理和编码后以无线的方式发射到植入体。体内装置称为人工耳蜗植入体(简称为:植入体),其原理是把言语处理器处理后的声信号,通过射频形式接收,经解码后转化为电流脉冲;电流脉冲通过电极阵列刺激耳蜗残存的听神经,从而使重度和极重度感音神经性耳聋患者大脑感知到声音。
人工耳蜗手术后,残余听力和人工耳蜗产生的听力常常受到术后耳蜗内纤维细胞生长和神经元组织延迟退化的影响。对人工耳蜗植入患者的颞骨的组织学评估显示,有近60%的受检病例形成了纤维组织增生。纤维组织增生的形成被认为是由于电极插入造成耳蜗精细结构机械损伤以及人体对植入物的排异反应引起的。电极与耳蜗之间纤维组织形成,导致毛细胞及螺旋神经节细胞的损伤,同时电极周围纤维组织增生使电极抗值增大而影响在耳蜗内对听神经电刺激的有效性,减小阈值的动态范围,降低语音感效果和人工耳蜗本身的功能。纤维组织增生主要发生在植入的前4周,临床上可以从人工耳蜗的电极阻抗增加来判断。
人工耳蜗技术的最新进展已开发出新一代具有较少创伤性的电极,最大程度地减少了电极插入过程中对内耳的伤害。对于那些有残留听力的人来说尤其如此,他们可能会受益于采用声电联合刺激的新兴刺激策略。此外,插入创伤还可能导致疤痕和纤维组织形成,从而导致阻抗增加和残余听力下降。目前已经使用了两种手术策略来减少插入创伤:柔软手术和靶向药物递送。然而,即使引入了创伤最小的“柔软”外科手术技术,并且对电极进行了修改以减少插入过程中的耳蜗内损伤,有三分之一的病例仍会丢失或没有完全保留残存的听力。在人工耳蜗植入手术时通过在内耳应用保护性药理作用来实现残余听力保护,但是由于给药量有限,只能起到暂时短暂效应。由于人工耳蜗中电极阵列与螺旋形神经元非常接近,用人工耳蜗中电极阵列作为载体,向内耳输送药物技术是一个有效的方法。
先进的药物输送系统(dds)为药物管理带来了不可估量的好处。在过去的三十年中,已经提出了新的方法来开发用于药物递送的新型载体。
地塞米松(dexamethasonedxms)是一种人工合成的皮质类固醇,化学式为c22h29fo5。地塞米松与其他糖皮质激素一样具有抗炎作用,可减轻和防止组织对炎症的反应,具有抗内毒素、抑制免疫、抗休克及增强应激反应等药理作用。研究表明局部应用的糖皮质激素受体激动剂(如地塞米松)可抑制内耳发炎,因此可阻止与纤维化相关的结缔组织扩张,细胞变性和残余听力丧失。由于进入内耳相对困难,因此在长时间内维持足够治疗水平的该药剂一直是有问题的。
层粘连蛋白又称板层素是构成细胞间质的一种非胶原糖,与胶原一起构成耳蜗基底膜的成分。研究表明通过电极吸附给药并促进螺旋神经神经元在电极插入创伤后的生存,有降低声学脑干反应和电诱发听觉脑干反应(即ecap和eabr)阈值的能力。
胰岛素样生长因子1(igf1)和含肝细胞生长因子(hgf)的水凝胶在植入豚鼠耳朵的动物实验中局部应用的结果表明生长因子可以保护听觉,从而大大改善听力毛细胞(hcs)避免因强烈的噪音暴露,药物引起的听力丧失或缺血性损伤而引起的损害,而并没有不良事件。igf1抑制细胞凋亡并促进细胞周期进程,以维持受损耳蜗的残余听毛细胞值。此外,人类临床试验表明,igf1水凝胶治疗对于突发性糖皮质激素治疗难以治疗的突发性感音神经性听力损失的患者。
现有技术中的给药人工耳蜗电极主要是在电极的硅胶体内或水凝胶体内参杂载药。由于参杂会影响硅胶的质量,药物溶解后硅胶表面受损影响电极的功能性和长期可靠性。并且硅胶或水凝胶体内参杂载药属于物理吸附,药物的释放受自由扩散的影响而无法控制。
技术实现要素:
本发明在人工耳蜗电极阵列的硅胶体上设置金属薄膜作为基底、电聚合化学反应将耳部药物和导电高分子聚合物固化到薄膜电极基底的表面。
为了实现上述目的,本发明的技术方案如下:一种电聚合导电高分子载药人工耳蜗电极,包括柔性电极头、n个刺激电极、m个药物薄膜电极、硅胶体、第一助推环、第二助推环、植入鳍、波浪引线束、螺旋引线束、回路电极、薄膜电极引线、刺激引线和回路引线,其中,所述药物薄膜电极为以惰性金属为基底,电聚合化学反应将耳部药物和导电高分子聚合物固化在基底上,耳部药物的释放通过对药物薄膜电极施加的电量控制;所述柔性电极头设置在最前端,n个刺激电极和m个药物薄膜电极均设置在硅胶体上,n个刺激电极和m个药物薄膜电极相对同位置或相对交错设置,在二者后方设置第一助推环、第二助推环和植入鳍,回路电极设置在硅胶体的末端,刺激电极与刺激引线连接,药物薄膜电极与薄膜电极引线连接,回路电极与回路引线连接,薄膜电极引线与刺激引线在硅胶体内形成波浪引线束和螺旋引线束。
优选地,所述耳部药物包括糖皮质激素受体激动剂、层粘连蛋白、胰岛素样生长因子或含肝细胞生长因子。
优选地,所述导电高分子聚合物包括聚吡咯、聚吡咯的衍生物、聚噻吩或聚噻吩的衍生物。
优选地,所述糖皮质激素受体激动剂为地塞米松。
优选地,所述聚噻吩衍生物为聚乙烯二氧噻吩。
基于上述目的,本发明还提供了一种电聚合导电高分子载药人工耳蜗电极的制作方法,包括以下步骤:
制作药物薄膜电极;
制作刺激电极;
制作薄膜电极引线和刺激引线,将与薄膜电极引线与药物薄膜电极焊接,将刺激电极与刺激引线焊接、超声波清洗和等离子处理;
用硅胶注塑;
制作回路电极和回路引线,将回路电极与回路引线焊接、超声波清洗和等离子处理;
与螺旋引线束一同固定于模具中,加入硅胶注塑,表面进行自润滑硅胶涂层;
所述制作药物薄膜电极包括以下步骤:
将惰性金属片作为工作电极、甘汞电极或银或氯化银作为参考电极、铂作为辅助电极,分别与电化学工作站连接;
放入电解池,电解池中盛放沉积溶液,沉积溶液中包括耳部药物和导电高分子聚合物;
电解池放置在磁力搅拌器上,磁力子放置在电解池底部中央;
开启电化学工作站和磁力搅拌器,将耳部药物和导电高分子聚合物沉积在工作电极上。
优选地,所述制作刺激电极包括以下步骤:
将铂铱合金坯料进行退火、轧制为铂铱合金片;
对铂铱合金片激光切割后,冲压成型;
所述制作薄膜电极引线和刺激引线包括以下步骤:
将铂铱合金坯料进行退火、冷拔和矫直为铂铱合金丝;
对铂铱合金丝进行涂层和波浪形、螺旋形处理;
将铂铱合金丝剪线,两端去涂层;
所述制作回路电极包括以下步骤:
将铂铱合金坯料进行退火、冷拔、矫直、研磨为环形的铂铱合金片;
进行激光切割和去毛刺;
所述制作回路引线包括以下步骤:
将铂铱合金坯料进行退火、冷拔和矫直为铂铱合金丝;
对铂铱合金丝进行涂层、剪线,两端去涂层。
优选地,所述耳部药物包括糖皮质激素受体激动剂、层粘连蛋白、胰岛素样生长因子或含肝细胞生长因子。
优选地,所述导电高分子聚合物包括聚吡咯、聚吡咯的衍生物、聚噻吩或聚噻吩的衍生物。
优选地,所述沉积采用恒电流沉积,电流密度为0.1-0.9ma/cm2,沉积时间不超过500s。
本发明至少包括以下有益效果:导电高分子聚合物是由具有共扼π-键的高分子,经化学或电化学“掺杂”使其由非导体转变为导体的一类高分子材料。在使用时,人工耳蜗系统根据需要对含有耳部药物的导电高分子聚合物的药物薄膜电极施加电量来控制药物的释放。由于耳部药物是通过电聚合化学反应固定在电极阵列的表面,耳部药物的释放不会自由扩散,也不会影响电极阵列硅胶体的物理和化学性能,因而不会影响人工耳蜗电极的功能性和可靠性。
附图说明
图1为本发明实施例1电聚合导电高分子载药人工耳蜗电极的结构示意图;
图2为本发明实施例1电聚合导电高分子载药人工耳蜗电极的药物薄膜电极结构示意图;
图3为本发明实施例2中电聚合导电高分子载药人工耳蜗电极的药物薄膜电极结构示意图;
图4为本发明实施例3中电聚合导电高分子载药人工耳蜗电极的药物薄膜电极结构示意图;
图5为本发明实施例4电聚合导电高分子载药人工耳蜗电极的结构示意图;
图6为本发明实施例4电聚合导电高分子载药人工耳蜗电极的药物薄膜电极结构示意图;
图7为本发明实施例5电聚合导电高分子载药人工耳蜗电极的结构示意图;
图8为本发明实施例1电聚合导电高分子载药人工耳蜗电极的截面图;
图9为本发明实施例电聚合导电高分子载药人工耳蜗电极制作方法的沉积装置结构示意图;
图10为本发明实施例电聚合导电高分子载药人工耳蜗电极的电化学反应控制耳部药物的释放曲线图。
具体实施方式
实施例1
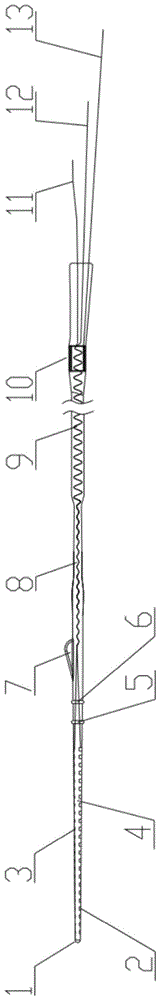
参见图1所示,一种电聚合导电高分子载药人工耳蜗电极,包括柔性电极头1、n个刺激电极2、m个药物薄膜电极3、硅胶体4、第一助推环5、第二助推环6、植入鳍7、波浪引线束8、螺旋引线束9、回路电极10、薄膜电极引线11、刺激引线12和回路引线13,其中,药物薄膜电极3为以惰性金属为基底,电聚合化学反应将耳部药物和导电高分子聚合物固化在基底上,耳部药物的释放通过对药物薄膜电极施加的电量控制;柔性电极头1设置在最前端,n个刺激电极2和m个药物薄膜电极3均设置在硅胶体4上,n个刺激电极2和m个药物薄膜电极3相对同位置设置,在二者后方设置第一助推环5、第二助推环6和植入鳍7,回路电极10设置在硅胶体4的末端,刺激电极2与刺激引线12连接,药物薄膜电极3与薄膜电极引线11连接,回路电极10与回路引线13连接,薄膜电极引线11与刺激引线12在硅胶体4内形成波浪引线束8和螺旋引线束9。
耳部药物包括糖皮质激素受体激动剂、层粘连蛋白、胰岛素样生长因子或含肝细胞生长因子,导电高分子聚合物包括聚吡咯、聚吡咯的衍生物、聚噻吩或聚噻吩的衍生物。
具体实施例中,耳部药物为地塞米松,导电高分子聚合物为聚吡咯,参见图2,药物薄膜电极3-1裸露在硅胶体外的为圆形,与刺激电极截面上看为相对,其放大图参见图8,药物薄膜电极分为两层,底层为基底14,上层为聚合层15,聚合层15为耳部药物与导电高分子聚合物的结合。
对于药物薄膜电极3有以下实施例
实施例2
参见图3,n个刺激电极2和m个药物薄膜电极3-2相对同位置设置,药物薄膜电极3-2为椭圆形,增加了暴露面积,提高耳部药物释放量。
实施例3
参见图4,n个刺激电极2和m个药物薄膜电极3-3相对同位置设置,药物薄膜电极3-3为弧形,亦增加了暴露面积,提高耳部药物释放量。
实施例4
参见图5-图6,n个刺激电极2和m个药物薄膜电极3-4相对交错位置设置,药物薄膜电极3-4为半环形,进一步增加了暴露面积,提高耳部药物释放量,交错地设置,使得不因药物薄膜电极3-4暴露于硅胶体的面积增大而影响刺激电极2。
实施例5
参见图7,n个刺激电极2和m个药物薄膜电极3-5间隔设置,药物薄膜电极3-5为全环形,使得暴露面积增大到了极致,同理于耳部药物释放量,此实施例适用于耳部纤维组织增生评估高风险使用者。
基于上述目的,本发明还提供了一种电聚合导电高分子载药人工耳蜗电极的制作方法,包括以下步骤:
制作药物薄膜电极;
制作刺激电极;
制作薄膜电极引线和刺激引线,将与薄膜电极引线与药物薄膜电极焊接,将刺激电极与刺激引线焊接、超声波清洗和等离子处理;
用硅胶注塑;
制作回路电极和回路引线,将回路电极与回路引线焊接、超声波清洗和等离子处理;
与螺旋引线束一同固定于模具中,加入硅胶注塑,表面进行自润滑硅胶涂层;
制作药物薄膜电极,包括以下步骤:
将惰性金属片作为工作电极、甘汞电极或银或氯化银作为参考电极、铂作为辅助电极,分别与电化学工作站连接;
放入电解池,电解池中盛放沉积溶液,沉积溶液中包括耳部药物和导电高分子聚合物;
电解池放置在磁力搅拌器上,磁力子放置在电解池底部中央;
开启电化学工作站和磁力搅拌器,将耳部药物和导电高分子聚合物沉积在工作电极上。
当然还可以采用气相沉淀法,固相沉淀法,无电化学镀法等方法产生。惰性金属片的厚度为0.3μm-1μm,惰性金属可以是任何生物兼容的惰性金属,例如金,铂,铱,钌,钯以及它们的合金。
制作药物薄膜电极的装置结构参见图9,电化学合成使用了三电极电解池装置,电解池24是一个50ml玻璃比色皿,恒温水进水口25位于低侧,恒温水出水口26位于高侧,电解池24中含有工作电极(即待镀的惰性金属片,镀后即为药物薄膜电极3),铂辅助电极23,以及甘汞电极(sce)或银/氯化银(ag/agcl)参考电极22;在电聚合过程中工作电极作为电解池24的阳极,发生氧化反应,使用chi660e电化学工作站21进行控制,沉积溶液(15ml)含有0.2m聚吡咯(ppy,分子式为c4h5n)和0.3m地塞米松磷酸二钠,沉积溶液中的实际电极面积即产生的聚合物药物膜覆盖的区域为100-300mm2。在恒电位记时电流静态模式下,使用相对于参考电极的恒定电位1.0v(0.5-1.5v范围)。沉积在工作电极3表面的物料量通过沉积过程中的总电荷随时间控制,沉积电荷密度10-100mc/cm2,其中25-50mc/cm2在薄膜稳定性和释放效率方面为最佳。
聚吡咯和地塞米松一步式电聚合的基本原理如下列方程式为:
在存在a-(阴离子或带负电荷的生物分子或药物)的情况下,吡咯单体被氧化和电聚合,产生的聚合物沉积在阳极上。由于聚合物骨干带正电荷,因此将带负电荷的药物离子合并以保持电荷中性,带负电荷的耳部药物是地塞米松磷酸二钠(dxms),在地塞米松类固醇环结构上存在磷酸盐组对药物产生负电荷,以使其在电聚合后被合成到聚吡咯中。
用飞利浦xl-30场发射扫描电子显微镜(sem)用于检查ppy/dxms薄膜涂层的形态,为提高扫描电镜图像的清晰度,一层薄薄的金薄膜(约10纳米)被溅射到电极表面上,金薄膜溅射使用的是悍马(hummer)-600溅射系统,使用sem扫描电镜观测ppy/dxms薄膜表面,为微米极的导电高分子颗粒,观测导电高分子表面是否均匀,无裂缝。
以导电高分子聚合物聚噻吩的衍生物聚乙烯二氧噻吩,即pedot为具体实施例,耳部药物为糖皮质激素地塞米松(dxms),惰性金属片为黄金。地塞米松(dxms)和聚噻吩(pedot)的导电聚合物在惰性金属片上以恒电流的方式生长。
pedot以3,4-乙烯二氧噻吩(edot)为单体,pedot在异环的3和4位置具有二氧乙烯桥接组,可阻止耦合的可能性,从而提供卓越的电化学稳定性,和良好的导电率,3,4-乙烯二氧噻吩edot单体和地塞米松阳离子一步式电聚合沉积在电极表面的方程式为:
惰性金属片由黄金镀膜工艺制作,裸露表面直径为100-500微米。惰性金属片表面在沉积pedot/dxms之前进行了电化学清洗。
具体来说,pedot/dxms是从edot和地塞米松磷酸二钠水溶液中电聚合的,在水溶液中edot浓度为0.1m,地塞米松磷酸二钠0.2m,与恒电位沉积相比,恒电流沉积可提供更稳定、更均匀的pedot/dxms薄膜。电聚合使用的电流密度为0.64ma/cm2,可以为0.1-0.9ma/cm2,而沉积时间从10、50、100、190、300、410、500s不同沉积量和薄膜厚度不等。电流输出由电化学工作站21控制,并且记录每个沉积的计时电量,整个电聚合反应在三电极电解池24内完成。
随着薄膜的增长,工作电极3上的电位迅速下降,然后减慢,但继续下降高达500s,电位降被认为是电极阻抗变化的指示,初始急剧下降表示金电极/电解质界面与pedot/电解质界面之间的显著阻抗差,一旦电极被pedot涂层完全覆盖,阻抗会显著减小,因为较厚的薄膜的有效表面积增加。超过500s,电位仍在逐渐下降,然而,pedot涂层的增长超出了金电极表面定义区域,此类涂层容易脱落,有效电极表面面积也难以定义。
同前述,飞利浦xl-30场发射扫描电子显微镜(sem)检查pedot/dxms薄膜涂层的形态,为提高扫描电镜图像的清晰度,一层薄薄的金薄膜(约10纳米)被溅射到电极表面上,金薄膜溅射使用的是悍马(hummer)-600溅射系统。使用sem扫描电镜观测pedot/dxms薄膜表面,为微米极的导电高分子颗粒,观测导电高分子表面是否均匀,无裂缝。
采用电刺激控制药物释放导电高分子载药以地塞米松与ppy沉积在电极上为具体实施例,所选的刺激波形类型为三角波循环伏特扫描(cv),即电位定期在正值和负值之间循环扫描,释放的药物使用紫外线光谱法进行量化。三角波循环伏特扫描(cv)在gamry软件框架的控制下使用gamryfas2/femostat(gamostat)恒电位仪进行,三角波循环伏特扫描在100ml双电极电解池中完成,电解质为ph7.4,100mm的磷酸盐缓冲盐水(pbs),回路电极10为耳蜗外的管状铂金电极或平板铂金电极,电压在100mv/s的扫描速率下从-0.7v扫描到+1.3v,然后回扫到-0.7v以形成一个循环。
溶液中的地塞米松释放通过紫外线吸收率进行量化以确定地塞米松释放浓度,释放的药物是使用紫外线光谱仪(uv757crt紫外可见分光光度计,上海精密科学仪器公司)检测的,地塞米松的特性吸收带读数取在242nm。在开始循环伏特扫描之前,药物薄膜电极3被浸泡在蒸馏水中,以去除表面任何可能松散附着的地塞米松,这确保了地塞米松的释放主要是由电位循环刺激引起的,磷酸盐缓冲盐水用作空白,从释放样品的读数中减去磷酸盐缓冲盐水的读数,绘制了地塞米松的标准校准曲线,以定义观测到的地塞米松吸收度和浓度之间的定量关系,由循环伏特扫描刺激触发的释放量标准校准曲线,参见图10,明显看出,地塞米松的释放以大致线性的方式(r2=0.989)与给定循环伏特扫描刺激数相关。作为对照,uv读数取自浸在pbs中的涂层电极,没有施加电刺激,这些对照样品没有通过扩散显著释放地塞米松,由于扩散是一个时间依赖过程,对照样品还在24小时后进行了读数,并且没有看到明显的地塞米松释放,上述表明,药物薄膜电极是一个真正的电控释放系统。
先前的研究表明,地塞米松在0.2-0.7μm浓度下有效,围绕这种局部浓度,在神经植入物周围可以看到炎症组织反应的显著减少。本发明能够在每个循环伏特扫描周期后释放0.0823μg/cm2地塞米松,并在300个循环伏特扫描周期后释放总计近23μg/cm2。根据大多数组织学研究,由增强的胶质纤维酸性蛋白(gfap)表示的反应区域,这是一种关键的中间长丝,耳蜗神经电极阵列周围的活动半径小于500μm,0.0823μg/cm2的地塞米松的释放将使电极在500μm半径内的平均地塞米松浓度为0.67μm。因此,由1个循环伏特扫描周期触发的剂量可以使电极阵列周围达到有效的浓度足以减少炎症。
在具体实施例中,制作刺激电极包括以下步骤:
将铂铱合金坯料进行退火、轧制为铂铱合金片;
对铂铱合金片激光切割后,冲压成型。
制作薄膜电极引线和刺激引线包括以下步骤:
将铂铱合金坯料进行退火、冷拔和矫直为铂铱合金丝;
对铂铱合金丝进行涂层和波浪形、螺旋形处理;
将铂铱合金丝剪线,两端去涂层;
所述制作回路电极包括以下步骤:
将铂铱合金坯料进行退火、冷拔、矫直、研磨为环形的铂铱合金片;
进行激光切割和去毛刺。
制作回路引线包括以下步骤:
将铂铱合金坯料进行退火、冷拔和矫直为铂铱合金丝;
对铂铱合金丝进行涂层、剪线,两端去涂层。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!