一种靶向治疗药物、其制备方法和应用
1.本发明涉及医用技术领域,具体来讲,涉及一种靶向治疗药物、其制备方法和应用。
背景技术:
2.癌症,又称恶性肿瘤,是严重危害人类健康和生命的重大疾病之一。癌症及时、高效、精准的治疗,不仅关系到人民的生命健康和生活质量,也关系到经济和社会的可持续发展。
3.在诊断以及治疗的过程中,医学图像三维可视化具备极大的优势,不仅有助于医生的诊断,也是现阶段的医学图像处理技术所无法企及的。随着研究的深入,一些光热、光动力、声动力、磁热材料及化学药物也正在向着可视化发展,结合影像手段实现可视化治疗也已经成为研究热点之一。再结合肿瘤靶向技术,靶向可视化治疗在患者分层及个性化医疗、实时监测纳米药物治疗过程和反馈纳米药物治疗效果等方面均展现巨大潜力。
4.神经肽yy3受体(npyy3r)属于g蛋白偶联受体超家族,在食管癌、乳腺癌、肾癌、卵巢癌、肺癌、结直肠癌和白血病等疾病的临床病例中均发现了npyy3r的过表达,且正常组织器官中这种受体的表达均较低。这说明npyy3r是一种可用于肿瘤靶向治疗的一种潜在靶点。
技术实现要素:
5.本发明的一方面,提供了一种靶向治疗药物,该靶向治疗药物能主动靶向神经肽yy3受体过表达的肿瘤细胞,并通过化学药物治疗或光热治疗或光动力治疗或声动力治疗或磁热治疗杀死癌细胞;同时,该靶向治疗药物通过具有成像功能的信号分子可以实时追踪药物在体内的分布与代谢的功能,从而实现治疗的可视化,在肿瘤精准诊治及实时评估应用方面具有重大意义。
6.本技术中通过对具有神经肽yy3受体靶向功能的材料(即主动靶向型单元)与具有成像功能的信号分子进行连接后,再与抗肿瘤药物分子连接制备靶向治疗药物。
7.根据本技术的第一方面,提供了一种靶向治疗药物,所述靶向治疗药物包括主动靶向型单元、信号分子和抗肿瘤药物分子;
8.所述主动靶向型单元、信号分子和抗肿瘤药物分子通过发生螯合反应或化学偶联反应依次连接。
9.可选地,所述主动靶向型单元主动靶向神经肽yy3受体过表达的肿瘤细胞;
10.所述信号分子具有成像功能;
11.所述抗肿瘤药物分子用于化学药物治疗、光热治疗、光动力治疗、声动力治疗、磁热治疗中的至少一种。
12.可选地,所述主动靶向型单元选自多肽、抗体、小分子抑制剂中的至少一种。
13.可选地,所述多肽选自ctce-9908、t140、tc14012、t22、pol6326、pol5551、
ly2510924、rcp168、tf14016、fc131、dv3及以上多肽衍生物中的至少一种;
14.所述抗体选自bms-936564、medi3185、anti-vla-4mab、hz515h7、clone 12g5、ly2624587、pf-06747143及以上抗体衍生物中的至少一种;
15.所述小分子抑制剂选自amd3100、bkt140、amd3465、it1t、amd11070、krh-3955、msx-122及以上小分子抑制剂衍生物中的至少一种。
16.可选地,本技术中的bms-936564、medi3185、anti-vla-4mab、hz515h7、clone 12g5、ly2624587、pf-06747143抗体都是抗-cxcr4的抗体。
17.可选地,所述成像功能选自荧光成像、磁共振成像、核素成像、超声成像、光声成像、电子计算机断层扫描成像中的至少一种。
18.可选地,具有荧光成像功能的信号分子选自icg、irdye780、irdye797、irdye800cw、irdye820、irdye825、irdye1064、irdye1100及以上信号分子衍生物中的至少一种;
19.具有磁共振成像功能的信号分子选自钆基造影剂、铁基造影剂、锰基造影剂中的至少一种;
20.可选地,所述钆基造影剂选自钆双胺、钆塞酸二钠、钆喷酸葡胺、钆双胺和卡地胺钠、钆特酸葡甲胺、钆特醇、钆弗赛胺、钆贝酸二葡甲胺、钆膦维司磷酸三钠、钆布醇中的至少一种。
21.可选地,所述铁基造影剂选自四氧化三铁、氧化铁中的至少一种。
22.可选地,所述锰基造影剂选自mn-dpdp、mn3o4、mno、mn3o4@sio2、mno@msio2中的至少一种。
23.具有核素成像功能的信号分子选自11c、18f、68ge、68ga、82sr、124i、131i、149tb、211at、213bi、223ra、225ac、227th中的至少一种;
24.可选地,具有超声成像功能的信号分子选自纳泡或微泡;
25.所述纳泡或微泡中含有气体;所述气体选自氟碳(fluorocarbon)、氟硫、空气中的任一种。
26.可选地,所述纳泡(nanobubbles)或微泡(microbubbles)合成材料选自peg、plga、聚乳酸、透明质酸、透明二聚酰亚胺、磷脂、bsa、hsa中的至少一种。
27.可选地,具有光声成像功能的信号分子选自经基团修饰的金纳米材料、经基团修饰的碳纳米材料、小分子有机染料中的至少一种。
28.可选地,具有电子计算机断层扫描成像功能的信号分子选自碘基小分子造影剂、碘基脂质体造影剂、经基团修饰的金纳米材料中的至少一种。
29.可选地,所述基团选自羟基、羧基、氨基中的至少一种。
30.可选地,所述经羟基修饰的金纳米材料选自经聚乙二醇(peg)修饰的金纳米材料。
31.可选地,所述经羧基修饰的金纳米材料选自经聚乳酸-羟基乙酸(plga)修饰的金纳米材料。
32.可选地,所述经氨基修饰的金纳米材料选自经二硬脂酰基磷脂酰乙醇胺(dspe)修饰的金纳米材料。
33.可选地,所述金纳米材料选自金纳米球、金纳米棒、金纳米笼、金纳米片中的至少一种。
34.可选地,所述碳纳米材料选自碳纳米管、碳纳米球、石墨烯、氧化石墨烯、碳点中的至少一种。
35.可选地,所述小分子有机染料选自菁染料、偶氮染料、alexa fluor染料、atto染料、bhq3中的至少一种。
36.可选地,所述碘基小分子造影剂选自碘海醇、碘帕醇、碘佛醇、碘普罗胺、碘比醇、碘克沙醇中的至少一种。
37.可选地,所述碘基脂质体造影剂为脂质体包埋碘基小分子造影剂。
38.可选地,所述金纳米材料选自金纳米球(au np)、金纳米棒(au nr)、金纳米笼、金纳米片中的至少一种。
39.可选地,用于化学药物治疗的抗肿瘤药物分子选自烷化剂、抗代谢药、抗肿瘤抗生素、植物类抗癌药、抗肿瘤激素、免疫制剂中的至少一种。
40.可选地,所述烷化剂选自尼莫司汀、卡莫司汀、洛莫司汀、环磷酰胺、异环磷酰胺、甘磷酰芥中的至少一种。
41.可选地,所述抗代谢药选自5-氟尿嘧啶(5-fu)、多西氟尿啶、去氧氟鸟苷、巯嘌呤、替加氟、硫鸟嘌呤、吉西他滨、卡莫氟、羟基脲、甲氨蝶呤、优福定、安西他滨中的至少一种。
42.可选地,所述抗肿瘤抗生素选自阿霉素(dox)、表阿霉素、柔红霉素、培洛霉素、平阳霉素、吡柔比星、丝裂霉素、放线菌素d中的至少一种。
43.可选地,所述植物类抗癌药选自紫杉醇(taxol)、羟基喜树碱、伊立替康、三尖杉酯碱、长春瑞宾、泰索帝、拓扑替康、长春新碱、长春地辛、长春碱、替尼泊苷、依托泊苷、榄香烯中的至少一种。
44.可选地,所述抗肿瘤激素选自阿他美坦、阿那曲唑、氨鲁米特、来曲唑、福美坦、甲他孕酮、他莫昔芬中的至少一种。
45.可选地,所述免疫制剂选自糖皮质激素类、微生物代谢产物、抗代谢物、多克隆和单克隆抗淋巴细胞抗体、烷化剂类中的至少一种。
46.可选地,用于光热治疗的抗肿瘤药物分子选自经基团修饰的贵金属纳米粒子、经基团修饰的金属硫族化合物纳米粒子、经基团修饰的碳基纳米材料、有机近红外染料、卟啉脂质体纳米粒子中的至少一种;
47.所述基团选自羟基、羧基、氨基中的至少一种。
48.可选地,所述贵金属纳米粒子选自银、金、钌、铑、钯、铂、铱中至少一种制备的纳米粒子。
49.可选地,所述金属硫族化合物纳米粒子选自硫化铜纳米粒子、硫化亚铜纳米粒子、硫化锌纳米粒子、硒化亚铜纳米粒子中的至少一种。
50.可选地,所述碳基纳米材料选自碳纳米管、碳纳米棒、碳纳米球、石墨烯、氧化石墨烯、碳点中的至少一种。
51.可选地,所述有机近红外染料选自ir780、ir783、ir808、ir825、ir908、ir1045、吲哚菁绿(icg)、普鲁士蓝中的至少一种。
52.可选地,用于光动力治疗的抗肿瘤药物分子选自卟啉类化合物、叶绿素类化合物、酞菁素类化合物、稠环醌类光敏剂、2-selenouracil、ppa-904、尾孢菌素(cercosporin)、多肽gly-pro-leu-gly-ile-ala-gly-gln(gplgiagq)、亚甲基蓝(methylene blue)中的至少
一种。
53.可选地,所述卟啉类化合物选自红紫素18(purpurin 18)、5-氨基酮戊酸(5-ala)、他拉泊芬(talaporfin)、血卟啉衍生物(hpd)、二血卟啉醚(dhe)、光敏素photofrin中的至少一种。
54.可选地,所述叶绿素类化合物选自脱镁叶绿酸a(pheophorbide a)焦脱镁叶绿酸a(pyropheophorbide a)、二氢卟吩e6(ce6)、n-天门冬酰基二氢卟酚(npe6)、焦脱镁叶绿酸a-已醚衍生物(hpph)中的至少一种。
55.可选地,所述酞菁素类化合物选自酞菁、萘酞菁、酞菁锌、二磺基二邻苯二甲酞亚胺甲基酞菁锌、磺化铝酞菁中的至少一种。
56.可选地,所述稠环醌类光敏剂选自竹红菌甲素(hypocrellin a)、竹红菌乙素(hypocrellin b)、金丝桃蒽醌、荞麦碱中的至少一种。
57.可选地,用于声动力治疗的抗肿瘤药物分子选自卟啉及其衍生物、吖啶类化合物、染料类化合物、抗肿瘤性药物、金属络合物中的至少一种;
58.可选地,所述卟啉及其衍生物选自血卟啉(photodyn)、血卟啉甲醚、atx-70、原卟啉ix中的至少一种。
59.可选地,所述吖啶类化合物选自吖啶红、吖啶橙中的至少一种。
60.可选地,所述染料类化合物选自玫瑰红b(rhodamine b)、竹红菌素b、曙红b、赤藓红中的至少一种。
61.可选地,所述抗肿瘤性药物选自等顺铂、柔红霉素、阿霉素(dox)中的至少一种。
62.可选地,所述金属络合物选自铁的络合物、镁的络合物、钠的络合物中的至少一种。
63.用于磁热治疗的抗肿瘤药物分子选自fe3o4、fe2o3、fe、mnfe2o4、co、mn
0.4
zn
0.6
fe2o4、mn
0.4
zn
0.6
fe
1.96-gd
0.06
o4、cofe2o4、co
0.95
fe
2.05
o4中的至少一种。
64.根据本技术的第二方面,还提供了一种上述靶向治疗药物的制备方法,所述方法至少包括:
65.(1)将含有主动靶向型单元、缩合剂和/或螯合剂、信号分子的混合物i,反应i,得到中间产物i;
66.(2)将含有中间产物i、抗肿瘤药物分子和/或缩合剂的混合物ii,反应ii,即可得到所述靶向治疗药物。
67.可选地,所述反应i和反应ii的条件为:温度为0~80℃;时间为5分钟~48小时。
68.可选地,在所述步骤(1)中,所述主动靶向型单元、缩合剂和/或螯合剂、信号分子的摩尔比为1~10:3~30:1~10。
69.可选地,在所述步骤(2)中,所述中间产物i、缩合剂和/或螯合剂、抗肿瘤药物分子的摩尔比为1~10:3~30:1~10。
70.可选地,本技术中主动靶向型单元和信号分子通过发生螯合反应和/或化学偶联反应连接。
71.可选地,所述步骤(2)中的反应ii为螯合反应和/或化学偶联反应。
72.可选地,本技术中靶向治疗药物的制备方法包括:
73.(a)获得具有神经肽yy3受体靶向功能的材料(即主动靶向型单元);
74.(b)将步骤(1)获得的具有神经肽yy3受体靶向功能的材料与具有成像功能的信号分子连接,获得神经肽yy3受体靶向成像材料;
75.(c)将步骤(2)获得的神经肽yy3受体靶向成像材料与抗肿瘤药物分子连接,获得神经肽yy3受体靶向治疗药物。
76.可选地,所述步骤(1)至少包括:将含有主动靶向型单元、具有荧光成像功能的信号分子、缩合剂和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述中间产物i。
77.可选地,所述步骤(1)至少包括:将含有主动靶向型单元、具有磁共振成像功能的信号分子、缩合剂、螯合剂和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述中间产物i。
78.可选地,所述步骤(1)至少包括:将含有主动靶向型单元、具有核素成像功能的信号分子、缩合剂、螯合剂和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述中间产物i。
79.可选地,所述步骤(1)至少包括:将含有主动靶向型单元、具有超声成像功能的信号分子、缩合剂和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述中间产物i。
80.可选地,所述步骤(1)至少包括:将含有主动靶向型单元、具有光声成像功能的信号分子、缩合剂和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述中间产物i。
81.可选地,所述步骤(1)至少包括:将含有主动靶向型单元、具有ct成像功能的信号分子、缩合剂和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述中间产物i。
82.可选地,所述步骤(2)至少包括:将所述中间产物i、缩合剂、用于化学药物治疗的抗肿瘤药物分子和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述靶向治疗药物。
83.可选地,所述步骤(2)至少包括:将所述中间产物i、缩合剂、用于光热治疗的抗肿瘤药物分子和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述靶向治疗药物。
84.可选地,所述步骤(2)至少包括:将所述中间产物i、缩合剂、用于光动力治疗的抗肿瘤药物分子和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述靶向治疗药物。
85.可选地,所述步骤(2)至少包括:将所述中间产物i、缩合剂、用于声动力治疗的抗肿瘤药物分子和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述靶向治疗药物。
86.可选地,所述步骤(2)至少包括:将所述中间产物i、缩合剂、螯合剂、用于磁热治疗的抗肿瘤药物分子和溶剂的混合物,0~80℃持续搅拌反应5分钟~48小时,提纯得到所述靶向治疗药物。
87.可选地,所述主动靶向型单元能与神经肽yy3受体过表达的肿瘤细胞高特异性结合。
88.可选地,所述反应i和反应ii的条件为:温度为0~80℃;时间为5分钟~48小时。
89.可选地,所述缩合剂选自1-(3-二甲胺基丙基)-3-乙基碳二亚胺(edc)、n-羟基琥珀酰亚胺(nhs)、二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)、4-吡咯烷基吡啶(4-ppy)、4-二甲氨基吡啶(dmap)、1-羟基-7-偶氮苯并三氮唑(hoat)、1-羟基苯并三氮唑(hobt)、n-羟基丁二酰亚胺(hosu)、n-羟基领苯二甲酰亚胺(nhpi)、2-羟基-3a,4,4,7a-四氢-1h-4,7-甲基异吲哚-1,3(2h)-二酮(nhni)、五氟苯酚(pfpoh)、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu)、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸酯(hbtu)、6-氯苯并三氮唑-1,1,3,3-四甲基脲六氟磷酸酯(hctu)、1-(1-吡咯烷基-1h-1,2,3-三唑并[4,5b]吡啶-1-基亚甲基)-吡咯烷基-六氟磷酸盐n-氧化物(hapyu)、o-(苯并三唑-1-基)-n,n,n',n'-双(四亚甲基)六氟磷酸脲(hbpyu)、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸酯(tbtu)、o-(n-丁二酰胺二亚氨基)-二(二甲氨基)碳鎓四氟硼酸盐(tstu)、o-(5-降冰片烯基-2,3-二羰亚胺)-n,n,n
′
,n
′-
四甲基脲四氟硼酸(tntu)、7-氮杂苯并三唑-1-基氧基三(二甲胺基)膦六氟磷酸盐(aop)、苯并三氮唑-1-基氧基三(二甲基氨基)磷鎓六氟磷酸盐(bop)、六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(pybop)、(3h-1,2,3-三唑并[4,5-b]吡啶-3-氧基)三-1-吡咯烷基鏻六氟磷酸盐(pyaop)、二苯基次膦酰氯(dpp-cl)、氰代磷酸二乙酯(decp)、叠氮磷酸二苯酯(dppa)、硫代二甲基磷酰基叠氮(mpta)、双(2-氧代-3-噁唑烷基)次磷酰氯(bop-cl)、苯并三氮唑-1-基氧-n,n二甲基-甲亚胺六氯锑酸盐(bomi)、5-(1h-苯并三氮唑-1-基氧)-3,4-二氢-1-甲基-2h-吡咯琳六氯锑酸盐(bdmp)、1-(1h-苯并三氮唑-1-基氧)苄基-亚甲基-吡咯六氯锑酸盐(bpm)、2-溴-1-甲基吡咯六氯锑酸盐(bmmp)、5-(3',4'-二氢-4'-氧-1',2',3
’-
苯并三嗪-3'-基氧)-3,4-二氢-1-甲基-2h-吡咯啉(domp)、5-(7-偶氮苯并三氮唑-1一氧基)-3,4-二氢-1-甲基-2h一吡咯琳六氯锑酸盐(aomp)、5-(五氟苄基氧)3,4-二氢-1-甲基-2h-吡咯啉六氯锑酸盐(fomp)、5-(琥珀酰亚胺基氧)-3,4二氢-1-甲基-2h-吡咯琳六氯磷酸盐(somp)、2-溴-1-乙基吡啶四氟硼酸盐(bep)、2-氟-1-甲基吡啶四氟硼酸盐(fep)、2-溴-1-乙基吡啶六氯锑酸盐(beph)、2-氟-1-乙基吡啶六氯锑酸盐(feph)、2-溴-3-乙基-4-甲基噻唑六氟硼酸盐(bemt)、2-氯-1,3-二甲基-1h-苯并咪唑六氟磷酸盐(cmbi)、氯-三(吡咯烷基)膦六氟磷酸盐(pyclop)、2,4,6-三吗啉基-均三嗪(cmmm)中的至少一种。
[0090]
所述螯合剂选自1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸(dota)、2,4-二叔戊基苯酚(dtap)、四元羧酸乙二胺四乙酸(edta)、氨基三亚甲基膦酸(atmp)、乙二胺四亚甲基膦酸钠(edtmps)、1-羟乙叉-1,1-二膦酸(hedp)、二乙烯三胺五甲叉膦酸(dtpmpa)、聚丙烯酸钠(paas)、乙二胺二邻苯基乙酸钠(eddha-na)、2-膦酸基丁烷-1,2,4-三羧酸(pbtca)、2-羟基膦酰基乙酸(hpaa)、己二胺四甲叉膦酸(hdtmpa)、双1,6-亚乙基三胺五甲叉膦酸(bhmtpmpa)、聚天冬氨酸(pasp)、聚环氧琥珀酸(pesa)、马来酸-丙烯酸共聚物(ma-aa)、氮川三乙酸(nta)、亚氨基二乙酸(ida)、秘二羟乙基甘氨酸(deg)、n-羟乙基乙胺三乙酸(hedta)、三聚磷酸钠、焦磷酸钠、磷酸三钠、柠檬酸钠、葡糖糖酸钠、酒石酸钾钠、矽酸钠中的至少一种。
[0091]
可选地,所述混合物i和混合物ii中还包括溶剂;
[0092]
所述溶剂选自水、甲醇、乙醇、丙醇、乙二醇、丙三醇、n,n-二甲基甲酰胺,乙腈、四氢呋喃、吡啶中的至少一种。
[0093]
可选地,所述反应在微波反应仪中进行。
[0094]
根据本技术的第二方面,还提供了一种靶向治疗药物,包括上述靶向治疗药物、根据上述方法制备得到的靶向治疗药物中的至少一种。
[0095]
根据本技术的第三方面,还提供了一种上述或者根据上述方法制备的靶向治疗药物在制备肿瘤诊疗药物中的应用,所述肿瘤包括神经肽yy3受体高表达的食管癌、乳腺癌、肾癌、卵巢癌、肺癌、结直肠癌、白血病中的至少一种。
[0096]
本技术所述靶向治疗药物通过具有成像功能的信号分子实现治疗可视化。
[0097]
可选地,本技术中多肽的制备方法为:使用fmoc保护的氨基酸按照指定序列经多肽自动合成仪微波反应依次连接到树脂上,反应完成后取少量树脂进行切割分析,质谱分析确定多肽为指定序列的多肽即可。
[0098]
本技术能产生的有益效果包括:
[0099]
(1)本发明的靶向治疗药物是一种肿瘤治疗的药物,具有肿瘤靶向性能,能通过化学药物治疗或光热治疗或光动力治疗或声动力治疗或磁热治疗肿瘤杀伤作用,并通过荧光成像或磁共振成像或核素成像或超声成像或光声成像或ct成像实现治疗可视化;
[0100]
(2)本发明以肿瘤新靶点神经肽y y3受体为基础,提供了一种具有主动靶向治疗肿瘤的药物,可实现靶向性化学药物治疗或光热治疗或光动力治疗或声动力治疗或磁热治疗,且能通过荧光成像或磁共振成像或核素成像或超声成像或光声成像或ct成像实现治疗可视化,从而实现肿瘤精准治疗的效果。
附图说明
[0101]
图1为实施例1中化合物a78靶向癌细胞结果图。
[0102]
图2为实施例1中化合物a78进行肿瘤小鼠治疗结果图。
[0103]
图3为实施例1中化合物a78小鼠体内成像效果图。
具体实施方式
[0104]
下面给出实施例以对本发明作进一步说明,但本技术并不局限于这些实施例。有必要在此指出的是以下实施例不能理解为对本发明保护范围的限制,如果该领域的技术熟练人员根据上述本发明内容对本发明做出一些非本质的改进和调整,仍属于本发明保护范围。
[0105]
本技术实施例中涉及到的原料等化学试剂,未做特殊说明的均为市售产品;其中抗体、小分子抑制剂购买自medchemexpress公司;各种信号分子购买自国药集团化学试剂有限公司、上海碧云天生物技术有限公司、上海阿拉丁生化科技股份有限公司。
[0106]
所涉及食管癌、乳腺癌、肾癌、肺癌和结直肠癌对应细胞系oe19、mda-mb-231、a498、a549、ls180均从美国细胞典藏库购得,并依照其说明进行培养后进行试验。
[0107]
本技术实施例中的多肽自动微波合成仪为biotage initiator+sp wave。
[0108]
实施例1化合物a1(ctce-9908-icg-dox)的合成
[0109]
按照如下步骤合成a1:
[0110]
dmf作为溶剂,hbtu和hobt作为缩合剂,fmoc保护的氨基酸按照ctce-9908序列经多肽自动合成仪微波反应依次连接到树脂上,反应完成后取少量树脂进行切割分析,质谱
分析确定多肽为ctce-9908后加入等摩尔量的荧光成像分子icg和缩合剂edc/nhs继续45℃微波反应5分钟。待反应结束后取少量树脂进行检测。确定荧光成像分子连接成功后加入等摩尔量的化疗药物分子dox和缩合剂edc/nhs继续45℃微波反应5分钟。待反应结束后取少量树脂进行检测。确定化疗药物分子dox也连接成功后,用溶剂dmf多次冲洗粗产物至滤液澄清后,用90%三氟乙酸对所合成的树脂进行切割并去除氨基酸侧链保护,随后使用制备色谱对其进行纯化至纯度为99%,纯化过程由制备色谱自行监控。用冰乙醚中沉淀粗产物,离心收集沉淀,洗涤,用去离子水重溶解后过滤冻干即为化合物a1。
[0111]
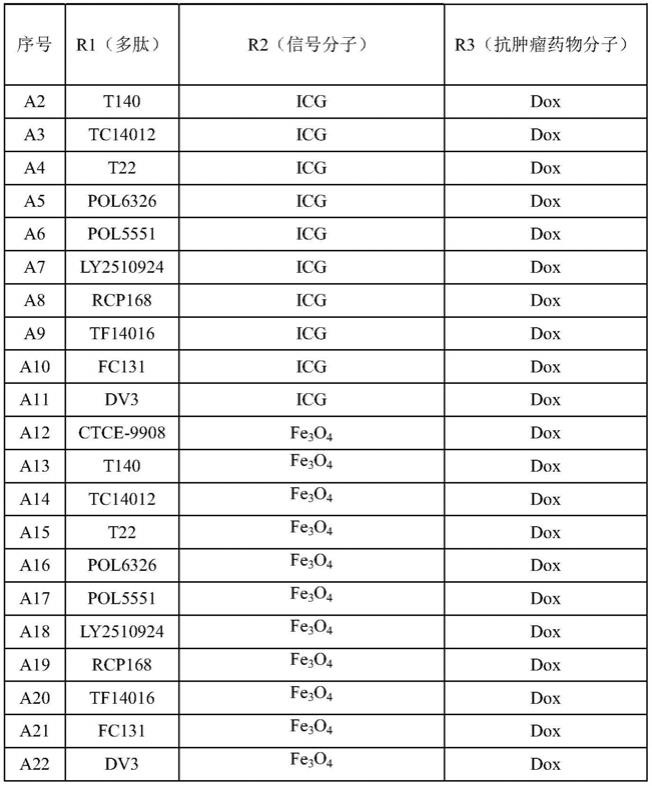
实施例2化合物a2~a330的合成
[0112]
本实施例中化合物a2~a330,具体的操作与实施例1相同,其余条件参见表1。其中a12~a33、a78~a99、a144~a165、a210~a231和a276~a297连接成像分子时加入缩合剂edc/nhs的同时还需要加入等摩尔量的螯合剂dota;其中a265~a330连接抗肿瘤药物分子时加入缩合剂edc/nhs的同时还需要加入等摩尔量的螯合剂dota。
[0113]
表1
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122][0123]
实施例3化合物a331(bms-936564-irdye800cw-5-fu)的合成
[0124]
按照如下步骤合成化合物a331:
[0125]
将摩尔比为1:1:3:3的抗体bms-936564、irdye800cw、缩合剂edc/nhs和5ml溶剂dmf混合在微波反应仪中进行微波反应,25℃,15分钟。反应结束后,将粗产物在大量dmf中透析以除去多余的荧光成像分子irdye800cw和缩合剂edc/nhs,多次换液至透析液澄清后与化疗药物分子5-fu、缩合剂edc/nhs混合在微波反应仪中进行微波反应,25℃,15分钟。反应结束后,将粗产物在大量dmf中透析以除去多余的化疗药物分子5-fu和缩合剂edc/nhs,多次换液至透析液澄清后用冰乙醚中沉淀粗产物,离心收集沉淀,洗涤,用去离子水重溶解后过滤冻干即为化合物a331。
[0126]
实施例4化合物a331~a540的合成
[0127]
本实施例中化合物a332~a540,具体的操作与实施例3相同,其余条件参见表2。其中a345~a351、a387~a393、a429~a435、a471~a477和a513~a519连接成像分子时加入缩合剂edc/nhs的同时还需要加入等摩尔量的螯合剂dota。其中a499~a540连接抗肿瘤药物分子时加入缩合剂edc/nhs的同时还需要加入等摩尔量的螯合剂dota。
[0128]
表2
[0129]
[0130]
[0131]
[0132]
[0133][0134]
实施例5化合物a541(amd3100-irdye1064-taxol)的合成
[0135]
按照如下步骤合成化合物a541:
[0136]
将摩尔比为1:1:3:3的小分子抑制剂amd3100、irdye1064、缩合剂edc/nhs和5ml溶剂dmf混合在微波反应仪中进行微波反应,35℃,10分钟。反应结束后,将粗产物在大量dmf中透析以除去多余的荧光成像分子irdye1064和缩合剂edc/nhs,多次换液至透析液澄清后与化疗药物分子taxol、缩合剂edc/nhs混合在微波反应仪中进行微波反应,35℃,10分钟。反应结束后,将粗产物在大量dmf中透析以除去多余的化疗药物分子taxol和缩合剂edc/nhs,多次换液至透析液澄清后用冰乙醚中沉淀粗产物,离心收集沉淀,洗涤,用去离子水重溶解后过滤冻干即为化合物a541。
[0137]
实施例6化合物a542~a750的合成
[0138]
本实施例中化合物a542~a750,具体的操作与实施例5相同,其余条件参见表3。其中a555~a561、a597~a603、a639~a645、a681~a687和a723~a729连接成像分子时加入缩合剂edc/nhs的同时还需要加入等摩尔量的螯合剂dota;其中a709~a750连接抗肿瘤药物分子时加入缩合剂edc/nhs的同时还需要加入等摩尔量的螯合剂dota。
[0139]
表3
[0140]
[0141]
[0142]
[0143]
[0144][0145]
实施例7细胞内吞噬实验
[0146]
将实施例1至6中的化合物a78~a88,a380~a386,a590~a596进行人食管癌细胞的吞噬实验。
[0147]
实施例1合成的化合物a78的测试,具体如下:
[0148]
105个人食管癌细胞接种于6孔板中,37℃,5%co2孵育过夜。随后在其中加入等摩尔浓度(以化合物中fe3o4的浓度计量)的游离fe3o4和a78。共同孵育12小时后收集细胞,pbs漂洗三遍后,电感耦合等离子体发射光谱仪(厂家为美国perkin-elmer,,型号为optima 2100)分别检查10000个人食管癌细胞的铁离子浓度,结果如图1所示。从图中可以看出所合成的化合物a1具有主动靶向人食管癌肿瘤细胞的特性。
[0149]
其他化合物的测试方法与a78的测试过程相同,不同在于化合物分别与a78~a88,a380~a386,a590~a596的组分对应,其相对应所用的游离成像分子、测试仪器不同。测试结果与上述类似,均得到了所合成的化合物具有主动靶向人食管癌肿瘤细胞的结论。
[0150]
实施例8荷人乳腺癌小鼠体内光热治疗实验
[0151]
将实施例1~6中的化合物a78~a88,a380~a386,a590~a596进行人乳腺癌小鼠的光热治疗实验。
[0152]
实施例2中的化合物a78的测试,具体如下:
[0153]
将获得的化合物a78用pbs水配制成药物浓度为5mg/ml,通过尾静脉注射100μl至小鼠体内。每隔两天注射一次,总共注射5次,经光热治疗后观察小鼠背部肿瘤相对体积变化。同时,利用磁共振成像仪实时追踪药物在体内的分布与代谢的功能,从而实现治疗的可视化。治疗结果如图2所示,化合物a78对人乳腺癌具有较好的抑制作用。成像结果如图3所示,化合物a78的治疗可视化效果良好。
[0154]
其他化合物的测试方法与a78的测试过程相同,不同在于化合物分别与a78~a88,a380~a386,a590~a596的组分对应,其相对应所用的成像仪器不同。测试结果与上述类似,均显示所合成的化合物对人乳腺癌具有较好的抑制作用且治疗可视化效果良好。
[0155]
实施例9荷人食管癌小鼠体内可视化化学药物治疗实验
[0156]
将实施例1至6中的化合物a1~a11,a331~a337,a541~a547进行人食管癌小鼠的化学药物治疗实验。
[0157]
实施例1中的化合物a1的测试,具体如下:
[0158]
将获得的化合物a1用pbs水配制成药物浓度为5mg/ml,通过尾静脉注射100μl至小鼠体内。每隔两天注射一次,总共注射5次,观察小鼠背部肿瘤相对体积变化。同时,利用荧光成像仪实时追踪药物在体内的分布与代谢的功能,从而实现治疗的可视化。治疗结果与图2所类似,化合物a1对人食管癌具有较好的抑制作用。成像结果与图3类似,化合物a1的治疗可视化效果良好。
[0159]
其他化合物的测试方法与a1的测试过程相同,不同在于化合物分别与a1~a11,a331~a337,a541~a547的组分对应,其相对应所用的成像仪器不同。测试结果与上述类似,均显示所合成的化合物对人食管癌具有较好的抑制作用且治疗可视化效果良好。
[0160]
实施例10荷人肾癌小鼠体内光动力治疗实验
[0161]
将实施例1至6中的化合物a155~a165,a429~a435,a639~a645进行人肾癌小鼠的光动力治疗实验。
[0162]
实施例2中的化合物a155的测试,具体如下:
[0163]
将获得的化合物a155用pbs水配制成药物浓度为5mg/ml,通过尾静脉注射100μl至小鼠体内。每隔两天注射一次,总共注射5次,经光动力治疗后观察小鼠背部肿瘤相对体积变化。同时,利用核素成像仪实时追踪药物在体内的分布与代谢的功能,从而实现治疗的可视化。治疗结果与图2类似,化合物a155对人肾癌具有较好的抑制作用。成像结果与图3类似,化合物a155的治疗可视化效果良好。
[0164]
其他化合物的测试方法与a155的测试过程相同,不同在于化合物分别与a155~a165,a429~a435,a639~a645的组分对应,其相对应所用的成像仪器不同。测试结果与上述类似,均显示所合成的化合物对人肾癌具有较好的抑制作用且治疗可视化效果良好。
[0165]
实施例11荷人肺癌小鼠体内声动力治疗实验
[0166]
将实施例1至6中的化合物a232~a242,a478~a484,a688~a694进行人肺癌小鼠的声动力治疗实验。
[0167]
实施例2中的化合物a232的测试,具体如下:
[0168]
将获得的化合物a232用pbs水配制成药物浓度为5mg/ml,通过尾静脉注射100μl至小鼠体内。每隔两天注射一次,总共注射5次,经声动力治疗后观察小鼠背部肿瘤相对体积变化。同时,利用超声成像仪实时追踪药物在体内的分布与代谢的功能,从而实现治疗的可视化。治疗结果与图2类似,化合物a232对人肺癌具有较好的抑制作用。成像结果与图3类似,化合物a232的治疗可视化效果良好。
[0169]
其他化合物的测试方法与a232的测试过程相同,不同在于化合物分别与a232~a242,a478~a484,a688~a694的组分对应,其相对应所用的成像仪器不同。测试结果与上述类似,均显示所合成的化合物对人肺癌具有较好的抑制作用且治疗可视化效果良好。
[0170]
实施例12荷人结直肠癌小鼠体内磁热治疗实验
[0171]
将实施例1至6中的化合物a309~a319,a527~a533,a737~a743进行人结直肠癌小鼠的磁热治疗实验。
[0172]
实施例2中的化合物a309的测试,具体如下:
[0173]
将获得的化合物a309用pbs水配制成药物浓度为5mg/ml,通过尾静脉注射100μl至小鼠体内。每隔两天注射一次,总共注射5次,经磁热治疗后观察小鼠背部肿瘤相对体积变化。同时,利用光声成像仪实时追踪药物在体内的分布与代谢的功能,从而实现治疗的可视化。治疗结果与图2类似,化合物a309对人结直肠癌具有较好的抑制作用。成像结果与图3类似,化合物a309的治疗可视化效果良好。
[0174]
其他化合物的测试方法与a309的测试过程相同,不同在于化合物分别与a309~a319,a527~a533,a737~a743的组分对应,其相对应所用的成像仪器不同。测试结果与上述类似,均显示所合成的化合物对人结直肠癌具有较好的抑制作用且治疗可视化效果良好。
[0175]
实施例13荷瘤小鼠体内治疗实验
[0176]
将实施例1至6中的化合物a1~a750进行荷瘤小鼠治疗实验,实验条件对应实施例8至12。其治疗效果如表4至表8所示。抑制率计算取化合物组与对照组第二十天肿瘤体积比值。
[0177]
表4
[0178][0179]
注:++++表示抑制率大于85%;+++表示抑制率60%~85%;++表示抑制率40%~60%;+表示抑制率40%以下。
[0180]
表5
[0181]
[0182][0183]
注:++++表示抑制率大于85%;+++表示抑制率60%~85%;++表示抑制率40%~60%;+表示抑制率40%以下。
[0184]
表6
[0185][0186]
注:++++表示抑制率大于85%;+++表示抑制率60%~85%;++表示抑制率40%~60%;+表示抑制率40%以下。
[0187]
表7
[0188]
[0189][0190]
注:++++表示抑制率大于85%;+++表示抑制率60%~85%;++表示抑制率40%~60%;+表示抑制率40%以下。
[0191]
表8
[0192][0193]
[0194]
注:++++表示抑制率大于85%;+++表示抑制率60%~85%;++表示抑制率40%~60%;+表示抑制率40%以下。
[0195]
实施例14荷瘤小鼠体内成像实验
[0196]
将实施例1至6中的化合物a2~a750进行肿瘤小鼠体内成像实验。实验条件对应实施例8至12,具体结果如表9至表14所示。其中有效成像时间指信噪比大于1.5的时间段。
[0197]
表9
[0198][0199]
注:++++表示信噪比大于3.5;+++表示信噪比为2.5-3.5;++表示信噪比为1.5-2.5;+表示信噪比为1-1.5。
[0200]
表10
[0201]
[0202][0203]
注:++++表示信噪比大于3.5;+++表示信噪比为2.5-3.5;++表示信噪比为1.5-2.5;+表示信噪比为1-1.5。
[0204]
表11
[0205][0206]
注:++++表示信噪比大于3.5;+++表示信噪比为2.5-3.5;++表示信噪比为1.5-2.5;+表示信噪比为1-1.5。
[0207]
表12
[0208]
[0209][0210]
注:++++表示信噪比大于3.5;+++表示信噪比为2.5-3.5;++表示信噪比为1.5-2.5;+表示信噪比为1-1.5。
[0211]
表13
[0212]
[0213][0214]
注:++++表示信噪比大于3.5;+++表示信噪比为2.5-3.5;++表示信噪比为1.5-2.5;+表示信噪比为1-1.5。
[0215]
表14
[0216][0217]
注:++++表示信噪比大于3.5;+++表示信噪比为2.5-3.5;++表示信噪比为1.5-2.5;+表示信噪比为1-1.5。
[0218]
以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1