重组人源Ⅰ型胶原蛋白在制备促进创面愈合材料中的应用的制作方法
重组人源ⅰ型胶原蛋白在制备促进创面愈合材料中的应用
技术领域
1.本发明属于生物工程技术领域,涉及一种重组人源ⅰ型胶原蛋白((rhcⅰ))在制备促进创面愈合材料中的应用。
背景技术:
2.创面的修复愈合是一个复杂、动态的生物学过程。愈合包括了止血、炎症反应、肉芽组织再生以及基质重塑四个步骤。愈合过程顺利进行是确保皮肤修复以及功能恢复的重要前提,其中肉芽组织和上皮再生在创面愈合中的作用至关重要。
3.胶原蛋白(collagen)是脊椎动物体内最重要的结构蛋白,约占蛋白总量的25~30%。作为细胞外基质中含量最丰富的蛋白,胶原蛋白是结缔组织和几乎所有薄壁器官间隙组织中最主要的结构蛋白,起着稳定组织和器官并维持其结构完整的作用。研究表明,胶原蛋白应用于创面具有强效的抗感染能力,能够促进细胞生长、黏附、止血和伤口愈合。作为细胞外基质(ecm)主要结构成分,胶原蛋白含量最多并且相互聚合、连接,并参与组织器官形态发生、代谢更新、损伤修复。胶原蛋白应用于创面可通过促进ecm内细胞募集以及纤维蛋白的合成等加速创面愈合,因此胶原蛋白的表达和分解直接影响创面愈合速度。正常皮肤组织中的胶原蛋白分为ⅰ型和ⅲ型胶原蛋白。ⅰ型胶原蛋白主要分布于皮肤细胞外间质,具备引导上皮细胞迁入缺损区的功能,同时在细胞迁移过程中起到支持和润滑作用。另外,ⅰ型胶原纤维相对粗大的特性,更决定了新生皮肤组织的抗拉性和创面愈合成熟程度。
4.目前,应用于创面修复的胶原蛋白主要来源于动物。但天然动物胶原蛋白分子量大小不等,性质非常复杂,存在的动物病毒隐患在应用过程中无法彻底消除。
技术实现要素:
5.本发明的目的在于提供一种重组人源ⅰ型胶原蛋白在制备促进创面愈合材料中的应用。本发明将重组人源胶原蛋白应用于创面愈合修复,克服了动物胶原蛋白的缺陷,具有无病毒隐患、无免疫原性和良好的水溶性以及生物相容性的优点。
6.本发明所述的重组人源ⅰ型胶原蛋白在制备促进创面愈合材料中的应用,所述的促进创面愈合材料可以是促进创面愈合的组合物,如与抑菌材料等复配制成促进创面愈合的药物组合物;或促进创面愈合的敷料等。
7.在本发明的具体实施方式中,所述的促进创面愈合材料中,重组人源ⅰ型胶原蛋白的浓度为0.1%(w/v,g/ml)。本发明所述的重组人源ⅰ型胶原蛋白,氨基酸序列如seq no.2所示。
8.本发明所述的重组人源ⅰ型胶原蛋白的编码基因iα1 510aa,核苷酸序列如seq no.3所示。
9.本发明构建的重组人源ⅰ型胶原蛋白质粒ppic9k-iα1 510aa的核苷酸序列如seq no.4所示,通过将重组人源ⅰ型胶原蛋白的编码基因iα1 510aa双酶切连接至ppic9k载体的ecor i和not i间构建而成。
10.本发明构建的分泌表达重组人源ⅰ型胶原蛋白的菌株为巴斯德毕赤酵母pichia pastoris jy0201,保藏编号为cgmcc no.16461,该菌种已于2018年9月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。所述的巴斯德毕赤酵母pichia pastoris jy0201通过将sac i酶切得到的线性化重组人源ⅰ型胶原蛋白质粒ppic9k-iα1 510aa诱导入巴斯德毕赤酵母中构建而成。
11.本发明从已知序列的人体胶原蛋白基因i型的螺旋区中选择水溶性、稳定性强的核苷酸序列,将优选基因片段插入毕赤酵母表达质粒中,转化毕赤酵母筛选得到高表达毕赤酵母基因工程菌,经过初步发酵及纯化步骤,得到高纯度的重组类人胶原蛋白。本发明的重组人源ⅰ型胶原蛋白具有良好的亲水性及稳定性,其结构与天然胶原蛋白基因序列相应部分100%相同,应用于人体当中不会造成免疫排斥。相同浓度下,重组人源ⅰ型胶原蛋白的细胞修复能力更突出,孵育24h显示重组人源ⅰ型胶原蛋白的细胞修复百分比分别比空白对照组和罗非鱼胶原蛋白组高出19.67%和15.69%,具有起效时间短、创面愈合速度快的优点,作为促进创面愈合材料适用于生物医用材料和化妆品领域。
附图说明
12.图1为人ⅰ型α1链胶原蛋白氨基酸的疏水性分析图。
13.图2为重组人源ⅰ型胶原蛋白氨基酸的疏水性分析图。
14.图3为重组人源ⅰ型胶原蛋白质粒ppic9k-iα1 510aa的构建示意图。
15.图4为重组人源ⅰ型胶原蛋白质粒ppic9k-iα1 510aa的sac i酶切琼脂糖凝胶电泳图。
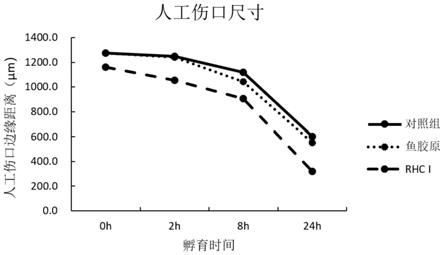
16.图5为电转后的毕赤酵母gs115平板图。
17.图6为阳性克隆菌株的凝胶电泳图。
18.图7为阳性克隆菌株的pcr凝胶电泳图。
19.图8为#3,#5,#7,#8阳性克隆菌株培养48和72小时的样品的蛋白表达分析图。
20.图9为#7阳性克隆菌株的蛋白表达的sds-page电泳图。
21.图10为对照组、罗非鱼胶原组和重组人源ⅰ型胶原蛋白的人工伤口尺寸曲线。
22.图11为对照组0小时和24小时人工伤口的愈合程度图。
23.图12为罗非鱼胶原组0小时和24小时人工伤口的愈合程度图。
24.图13为重组人源ⅰ型胶原蛋白组0小时和24小时人工伤口的愈合程度图。
具体实施方式
25.下面结合实施例和附图对本发明作进一步详述。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
26.实施例1
27.1.蛋白序列选择
28.对人ⅰ型α1链胶原蛋白的氨基酸序列(seq no.1)进行疏水性分析,评价结果如图1所示。疏水性评价分值越低其亲水性越好。根据疏水性分析结果,选择评分低的氨基酸片
段,将这些片段整合成新的蛋白,即本发明的重组人源ⅰ型胶原蛋白(seq no.2)。对重组人源ⅰ型胶原蛋白的氨基酸进行疏水性分析,结果如图2所示,该蛋白中所有氨基酸疏水性评价均低于零,表明该蛋白的亲水性很好。
29.2.质粒构建及线性化
30.将重组人源ⅰ型胶原蛋白翻译成碱基序列(seq no.3),采用基于pas(pcr-based accurate synthesis)的方法合成基因iα1 510aa,双酶切连接至ppic9k载体的ecor i和not i之间,图3为重组人源ⅰ型胶原蛋白质粒ppic9k-iα1 510aa的构建示意图。将获得的重组质粒ppic9k-iα1 510aa转入top10克隆菌株,挑取阳性克隆子测序,测序结果拼接如seq no.4所示。seq no.4的第77-82碱基处及1625-1632碱基处区域为酶切位点。
31.提取质粒20μg,使用sac i酶切线性化,冻干浓缩待用。37℃消化3h。取5μl,进行1%琼脂糖凝胶电泳,电泳结果如图4所示。其中m为dna标准品,从下到上1000,2000,3000,4000,5000,6000,8000,10000bp;1为sac i酶切;2为回收的目的片段。
32.表1酶切线性化体系配制表
[0033][0034]
3.电转毕赤酵母细胞gs115
[0035]
冰浴电转杯,将10μl线性化质粒加入到装有80μl毕赤酵母gs115感受态细胞的1.5ml ep管内,混匀转移至直径为0.2cm电转化杯中,然后把电转杯冰浴5min。电击条件为:电压1.5kv;电容25μf;电阻200ω,电击时间为4~10msec。电击完成后,将650ul冰上预冷的浓度为1m山梨醇溶液加入到电击转化杯里,用枪头轻轻地吹打溶液均匀。把电转杯中的全部液体转移到新的2ml ep管中,30℃静置培养2h。低速离心收集菌体,全部涂布于md平板上,30℃恒温培养3-4d。图5为电转后的毕赤酵母gs115平板图。
[0036]
4.pcr鉴定阳性克隆菌株
[0037]
待平板长出菌落,用接种环挑取平板上生长的单菌,将它接入到装有500μl ypd液体培养基离心管,30℃,180r/min过夜培养。挑选10株克隆,分别提取基因组dna,如图6所示。图中,m为dna标准品,从下到上1000,2000,3000,4000,5000,6000,8000,10000bp;1-10:各克隆菌株提取的基因组。
[0038]
使用载体上引物pcr鉴定,预期条带大小约2kb,2kb为扩增序列大小,结果如图7所示,其中,m:dna标准品,从下到上100,200,500,750,1000,2000bp;1-10:各克隆菌株的pcr扩增片段。
[0039]
5.小试表达
[0040]
诱导表达:取鉴定的阳性菌株(3#,5#,7#,8#)50μl接入装有10mlbmgy的锥形瓶中,30℃,220r/min过夜培养,摇至od
600
=2-6(对数生长,大约16-18h);室温离心5000r/min离心5min,收集细胞,去除上清,用10ml bmmy重悬细胞,进行诱导表达;每24h从培养基中取样
1ml,并加甲醇至终浓度0.5%继续诱导;以下各时间点0,24,48,72,96hr样品10000r/min离心2min收集上清液待检测。
[0041]
三氯乙酸沉淀法浓缩表达产物:
[0042]
(1)在离心管中加入500μl培养液上清和1/9体积的100%的tca,振荡混合,4℃沉淀过夜;
[0043]
(2)12000r/min离心10min,沉淀为粘稠带黄褐色胶状物,弃上清,收集沉淀,另将ep管倒置于吸水纸上,37℃烘箱静置10~20min,使管壁无明显液体残留;
[0044]
(3)加入200μl冷丙酮,振荡混匀,样品在室温下静置10min,洗去管壁和管底残留的tca;
[0045]
(4)12000r/min离心10min,弃上清,重复步骤(2)和(3),重复2~3次;
[0046]
(5)加入上样缓冲液30μl,37℃孵育1h,溶解沉淀;如果沉淀不溶解,可用100μl枪头吹打至沉淀溶解。
[0047]
6.鉴定分析
[0048]
western blotting检测:
[0049]
(1)取样品上样10μl;
[0050]
(2)上样完毕后,聚丙烯酰胺凝胶先90v跑完积层胶,再将电压升至200v直到电泳结束;
[0051]
(3)电泳结束后,取下凝胶进行转膜,恒压100v转膜,约为1.5h,恒流250ma;
[0052]
(4)电转结束后,取下膜后先用pbst洗涤4次,每次5min;
[0053]
(5)将膜置于5%脱脂奶粉封闭液中封闭37℃1h;
[0054]
(6)用封闭液稀释一抗(rabbitanti-his),膜在一抗稀释液(稀释比例1:1000)中4℃过夜;
[0055]
(7)次日将膜取出后用pbst洗膜4次,每次5min;
[0056]
(8)用含5%牛奶的封闭液稀释二抗(羊抗兔),膜在二抗稀释液(稀释比例1:5000)中37℃反应1h;
[0057]
(9)反应完毕后,把膜取出后置于干净的盒子中洗膜4次,每次5min;
[0058]
(10)ecl显影,曝光。
[0059]
将选择的#3,#5,#7,#8阳性克隆菌株培养48和72小时的样品,进行western blot初步检测。检测结果如图8所示,其中m:蛋白标准品;1:gs115菌株培养72小时上清样品;2:3#阳性菌株培养48小时上清样品;3:3#阳性菌株培养72小时上清样品;4:5#阳性菌株培养48小时上清样品;5:5#阳性菌株培养72小时上清样品;6:7#阳性菌株培养48小时上清样品;7:7#阳性菌株培养72小时上清样品;8:8#阳性菌株培养48小时上清样品;9:8#阳性菌株培养72小时上清样品。
[0060]
表达分析:
[0061]
sds-page电泳检测:选取7#阳性菌进行表达情况分析结果如图9所示。其中,m:蛋白标准品;1:gs115菌株培养72小时上清;2:7#阳性菌株培养0小时上清;3:7#阳性菌株培养24小时上清;4:7#阳性菌株培养48小时上清;5:7#阳性菌株培养72小时上清;6:7#阳性菌株培养96小时上清。7#阳性菌命名为巴斯德毕赤酵母pichia pastoris jy0201,该菌种已于2018年9月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏中心地址:北
型胶原蛋白具有优异的促进创面愈合效果。
[0076]
本发明从已知序列的人体胶原蛋白基因i型的螺旋区中选择水溶性好、稳定性强的核苷酸序列,将优选基因片段插入毕赤酵母表达质粒中,转化毕赤酵母筛选得到高表达毕赤酵母基因工程菌,经过初步发酵及纯化步骤,得到高纯度的重组类人胶原蛋白。实验证明该法生产的重组类人胶原蛋白具有良好的亲水性及稳定性,由于其结构与天然胶原蛋白基因序列相应部分100%相同,所以应用于人体当中不会造成免疫排斥,可以广泛应用于生物医用材料、化妆品等领域。本发明采用的是分泌型表达载体,成功实现了重组类人胶原蛋白的分泌型表达,表达产物分泌在上清液中,方便纯化,具有其他重组类人胶原蛋白生产所不具备的优势,便于规模化生产操作。由于载体电转入毕赤酵母之后,基因整合在毕赤酵母基因组上,所以重组菌的稳定性好,经过多次传代基因不容易发生流失并能保持高效表达的性状,能够很好的实现稳定生产,毕赤酵母生产方法为好氧发酵,菌体密度高,表达量还有很大的提升空间。并且,本发明的重组人源ⅰ型胶原蛋白作为促进创面愈合材料,具有起效时间短、创面愈合速度快的优点,适用于生物医用材料和化妆品领域。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1