青蒿素类化合物在治疗冠状病毒感染方面的应用的制作方法
本发明涉及生物医药领域,具体涉及青蒿素类化合物在治疗冠状病毒感染方面的应用。
背景技术:
青蒿素是我国科学家从菊科植物黄花蒿中提取的半萜内酯类化合物,青蒿素相关化合物(式i化合物)是与青蒿素结构相近或者组成复方的一类化合物的统称,包括蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸等化合物。青蒿素及其衍生物是目前世界上治疗疟疾最有效的药物之一,青蒿素联合疗法已被世界各地广泛应用。在青蒿素类相关化合物中,双氢青蒿素、蒿甲醚、青蒿琥酯以及蒿乙醚均已作为抗疟药上市。此外,青蒿乙素、青蒿酸等其它衍生物同样具有良好的抗疟活性。除治疗疟疾外,青蒿素及其衍生物还被证明具有抗肿瘤、抗真菌、抗炎、抗病毒、抗纤维化、免疫调节等多种药理学活性。
2019新型冠状病毒(2019-ncov)是以前从未在人类中发现的冠状病毒新毒株。2020年2月11日,国际病毒分类委员会(ictv)宣布,2019新型冠状病毒(2019-ncov)的正式分类名为严重急性呼吸综合征冠状病毒2(severeacuterespiratorysyndromecoronavirus2,sars-cov-2)。同日,世界卫生组织(who)宣布,由这一病毒导致的疾病的正式名称为covid-19。sars-cov-2感染的症状主要以肺炎为主,依据病情的轻重程度可分为单纯性感染、轻症肺炎、重症肺炎、急性呼吸窘迫综合症、脓毒症、脓毒症休克等。单纯性感染的患者可能有非特异性症状,例如发热、咳嗽、咽痛、鼻塞、乏力、头痛、肌肉疼痛或不适,老年人和免疫抑制者可能会出现非典型症状。轻症肺炎的患者主要以咳嗽、呼吸困难+呼吸急促为主。重症肺炎可见于青少年、成人或儿童,主要症状为呼吸频率增加,严重的呼吸衰竭或呼吸困难,中心型发绀、嗜睡、意识不清或惊厥、抽气等。急性呼吸窘迫综合症的肺部影像为双侧磨玻璃影,但不能完全由积液、大叶渗出或者肺不张或者肺部块影解释,以肺水肿为主要症状。脓毒症患者往往有致命的器官功能障碍,脓毒性休克是最为危重的患者,死亡可能性较高。目前,针对新型冠状病毒感染,临床上以支持治疗为主,无特异抗病毒药物可用。
技术实现要素:
本发明目的是发现对冠状病毒特别是sars-cov-2有抗病毒活性的药物,可用于其感染引起相关疾病如单纯性感染如发热、咳嗽和咽痛等、肺炎、急性或严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症和脓毒性休克等的救治。本发明通过创造性的研究发现,青蒿素类化合物(例如,青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸,优选青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素,尤其是青蒿素)具有抑制sars-cov-2复制方面的功能,在治疗sars-cov-2引起的疾病方面具有很好的潜在治疗效果。
为此,在本发明的第一方面,本发明提供了化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物在制备药物中的用途,所述药物用于治疗冠状病毒(优选sars-cov-2)引起的疾病或感染,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
发明人发现,青蒿素类化合物(尤其是青蒿素)可在细胞上抑制病毒复制,减少细胞培养物中病毒核酸载量。
在一些实施方案中,所述sars-cov-2引起的疾病为covid-19。
在一些实施方案中,所述sars-cov-2引起的疾病或感染为呼吸系统疾病,例如单纯性感染、轻症肺炎、重症肺炎、急性呼吸道感染、严重急性呼吸道感染(sari)、低氧性呼吸衰竭、急性呼吸窘迫综合症、脓毒症、脓毒症休克等。
在一些实施方案中,所述单纯性感染包括但不限于发热、咳嗽、咽痛、鼻塞、乏力、头痛、肌肉疼痛或不适。在一些实施方案中,所述轻症肺炎包括但不限于咳嗽,呼吸困难和/或呼吸急促。在一些实施方案中,所述重症肺炎包括但不限于呼吸频率增加,严重的呼吸衰竭或呼吸困难,中心型发绀、嗜睡、意识不清或惊厥、抽气。在一些实施方案中,所述急性呼吸窘迫综合症包括但不限于肺水肿。在一些实施方案中,所述脓毒症包括但不限于器官功能障碍。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第二方面,本发明提供了药物组合物在制备治疗冠状病毒(优选sars-cov-2)引起的疾病或感染的药物中的用途,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述sars-cov-2引起的疾病为covid-19。
在一些实施方案中,所述sars-cov-2引起的疾病或感染为呼吸系统疾病,例如单纯性感染、轻症肺炎、重症肺炎、急性呼吸道感染、严重急性呼吸道感染(sari)、低氧性呼吸衰竭、急性呼吸窘迫综合症、脓毒症、脓毒症休克等。
在一些实施方案中,所述单纯性感染包括但不限于发热、咳嗽、咽痛、鼻塞、乏力、头痛、肌肉疼痛或不适。在一些实施方案中,所述轻症肺炎包括但不限于咳嗽,呼吸困难和/或呼吸急促。在一些实施方案中,所述重症肺炎包括但不限于呼吸频率增加,严重的呼吸衰竭或呼吸困难,中心型发绀、嗜睡、意识不清或惊厥、抽气。在一些实施方案中,所述急性呼吸窘迫综合症包括但不限于肺水肿。在一些实施方案中,所述脓毒症包括但不限于器官功能障碍。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在本发明的第三方面,本发明提供了化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物,其用于治疗冠状病毒(优选sars-cov-2)引起的疾病或感染,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
在一些实施方案中,所述sars-cov-2引起的疾病为covid-19。
在一些实施方案中,所述sars-cov-2引起的疾病或感染为呼吸系统疾病,例如单纯性感染、轻症肺炎、重症肺炎、急性呼吸道感染、严重急性呼吸道感染(sari)、低氧性呼吸衰竭、急性呼吸窘迫综合症、脓毒症、脓毒症休克等。
在一些实施方案中,所述单纯性感染包括但不限于发热、咳嗽、咽痛、鼻塞、乏力、头痛、肌肉疼痛或不适。在一些实施方案中,所述轻症肺炎包括但不限于咳嗽,呼吸困难和/或呼吸急促。在一些实施方案中,所述重症肺炎包括但不限于呼吸频率增加,严重的呼吸衰竭或呼吸困难,中心型发绀、嗜睡、意识不清或惊厥、抽气。在一些实施方案中,所述急性呼吸窘迫综合症包括但不限于肺水肿。在一些实施方案中,所述脓毒症包括但不限于器官功能障碍。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第四方面,本发明提供了药物组合物,其用于治疗冠状病毒(优选sars-cov-2)引起的疾病或感染,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述sars-cov-2引起的疾病为covid-19。
在一些实施方案中,所述sars-cov-2引起的疾病或感染为呼吸系统疾病,例如单纯性感染、轻症肺炎、重症肺炎、急性呼吸道感染、严重急性呼吸道感染(sari)、低氧性呼吸衰竭、急性呼吸窘迫综合症、脓毒症、脓毒症休克等。
在一些实施方案中,所述单纯性感染包括但不限于发热、咳嗽、咽痛、鼻塞、乏力、头痛、肌肉疼痛或不适。在一些实施方案中,所述轻症肺炎包括但不限于咳嗽,呼吸困难和/或呼吸急促。在一些实施方案中,所述重症肺炎包括但不限于呼吸频率增加,严重的呼吸衰竭或呼吸困难,中心型发绀、嗜睡、意识不清或惊厥、抽气。在一些实施方案中,所述急性呼吸窘迫综合症包括但不限于肺水肿。在一些实施方案中,所述脓毒症包括但不限于器官功能障碍。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在本发明的第五方面,本发明提供了治疗疾病的方法,其包括给予有需要的受试者治疗有效量的化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述疾病为冠状病毒(优选sars-cov-2)引起的疾病或感染,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
在一些实施方案中,所述sars-cov-2引起的疾病为covid-19。
在一些实施方案中,所述sars-cov-2引起的疾病或感染为呼吸系统疾病,例如单纯性感染、轻症肺炎、重症肺炎、急性呼吸道感染、严重急性呼吸道感染(sari)、低氧性呼吸衰竭、急性呼吸窘迫综合症、脓毒症、脓毒症休克等。
在一些实施方案中,所述单纯性感染包括但不限于发热、咳嗽、咽痛、鼻塞、乏力、头痛、肌肉疼痛或不适。在一些实施方案中,所述轻症肺炎包括但不限于咳嗽,呼吸困难和/或呼吸急促。在一些实施方案中,所述重症肺炎包括但不限于呼吸频率增加,严重的呼吸衰竭或呼吸困难,中心型发绀、嗜睡、意识不清或惊厥、抽气。在一些实施方案中,所述急性呼吸窘迫综合症包括但不限于肺水肿。在一些实施方案中,所述脓毒症包括但不限于器官功能障碍。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第六方面,本发明提供了治疗疾病的方法,其包括给予有需要的受试者治疗有效量的药物组合物,所述疾病为冠状病毒(优选sars-cov-2)引起的疾病或感染,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述sars-cov-2引起的疾病为covid-19。
在一些实施方案中,所述sars-cov-2引起的疾病或感染为呼吸系统疾病,例如单纯性感染、轻症肺炎、重症肺炎、急性呼吸道感染、严重急性呼吸道感染(sari)、低氧性呼吸衰竭、急性呼吸窘迫综合症、脓毒症、脓毒症休克等。
在一些实施方案中,所述单纯性感染包括但不限于发热、咳嗽、咽痛、鼻塞、乏力、头痛、肌肉疼痛或不适。在一些实施方案中,所述轻症肺炎包括但不限于咳嗽,呼吸困难和/或呼吸急促。在一些实施方案中,所述重症肺炎包括但不限于呼吸频率增加,严重的呼吸衰竭或呼吸困难,中心型发绀、嗜睡、意识不清或惊厥、抽气。在一些实施方案中,所述急性呼吸窘迫综合症包括但不限于肺水肿。在一些实施方案中,所述脓毒症包括但不限于器官功能障碍。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在本发明的第七方面,本发明提供了化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物在制备作为冠状病毒(优选sars-cov-2)抑制剂的药物中的用途,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第八方面,本发明提供了药物组合物在制备作为冠状病毒(优选sars-cov-2)抑制剂的药物中的用途,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在本发明的第九方面,本发明提供了化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物,其为冠状病毒(优选sars-cov-2)抑制剂,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第十方面,本发明提供了药物组合物,其为冠状病毒(优选sars-cov-2)抑制剂,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在本发明的第十一方面,本发明提供了化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物在制备用于抑制冠状病毒(优选sars-cov-2)在细胞(例如哺乳动物细胞)中复制或繁殖的药物中的用途,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第十二方面,本发明提供了药物组合物在制备用于抑制冠状病毒(优选sars-cov-2)在细胞(例如哺乳动物细胞)中复制或繁殖的药物中的用途,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在本发明的第十三方面,本发明提供了化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物,其用于抑制冠状病毒(优选sars-cov-2)在细胞(例如哺乳动物细胞)中复制或繁殖,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第十四方面,本发明提供了药物组合物,其用于抑制冠状病毒(优选sars-cov-2)在细胞(例如哺乳动物细胞)中复制或繁殖,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在本发明的第十五方面,本发明提供了抑制冠状病毒(优选sars-cov-2)在细胞(例如哺乳动物细胞)中复制或繁殖的方法,其包括给予细胞(例如哺乳动物细胞)有效量的化合物、其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种。
在一些实施方案中,所述化合物选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种。
在一些实施方案中,所述化合物为青蒿素,其结构为
在本发明的第十六方面,本发明提供了抑制冠状病毒(优选sars-cov-2)在细胞(例如哺乳动物细胞)中复制或繁殖的方法,其包括给予细胞(例如哺乳动物细胞)有效量的药物组合物,所述药物组合物包含化合物,或其立体异构体、药学上可接受的盐、溶剂化物或其水合物,所述化合物选自青蒿素、蒿乙醚、蒿甲醚、青蒿酮、双氢青蒿素、青蒿琥酯、青蒿乙素、青蒿酸的一种或多种,优选选自青蒿素、青蒿乙素、蒿甲醚、青蒿琥酯、双氢青蒿素的一种或多种,更优选为青蒿素。
在一些实施方案中,所述药物组合物还包含苯芴醇。
在一些实施方案中,所述药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在一些实施方案中,所述哺乳动物包括牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物,例如是人,猫,狗或猪。
本发明中,所用术语“2019新型冠状病毒(2019-ncov)”的正式分类名为严重急性呼吸综合征冠状病毒2(severeacuterespiratorysyndromecoronavirus2,sars-cov-2)。
本发明中,所用术语“2019新型冠状病毒(2019-ncov)引起的疾病”的正式名称为covid-19。
在本发明中,“受试者”指脊椎动物。在某些实施方案中,脊椎动物指哺乳动物。所述哺乳动物包括牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物,例如是人,猫,狗或猪。哺乳动物包括,但不限于,牲畜(诸如牛)、宠物(诸如猫、犬、和马)、灵长类动物、小鼠和大鼠。在某些实施方案中,哺乳动物指人。
本发明中,术语“治疗有效量”或“预防有效量”是指在合理的医学判断范围内,足以治疗或预防患者疾病但足够低地避免严重副作用(在合理的利益/风险比)的量。化合物的治疗有效量将根据所选择的具体化合物(例如考虑化合物的效力、有效性和半衰期)、所选择的给药途径、所治疗的疾病、所治疗的疾病的严重性、所治疗的患者的年龄、大小、体重和身体疾病、所治疗的患者的医疗史、治疗持续时间、并行疗法的性质、所需的治疗效果等因素发生变化,但仍可以由本领域技术人员常规确定。
另外需要指出,所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物针对不同患者的特定使用剂量和使用方法决定于诸多因素,包括患者的年龄,体重,性别,自然健康状况,营养状况,药物的活性强度,服用时间,代谢速率,病症的严重程度以及诊治医师的主观判断。这里优选使用剂量介于0.001-1000mg/kg体重/天。
本发明化合物的药学上可接受的盐包括其无机或有机酸盐,以及无机或有机碱盐,本发明涉及上述盐的所有形式。其中包括但不限于:钠盐、钾盐、钙盐、锂盐、葡甲胺盐、盐酸盐,氢澳酸盐,氢腆酸盐,硝酸盐,硫酸盐,硫酸氢盐,磷酸盐,磷酸氢盐,乙酸盐,丙酸盐,丁酸盐,草酸盐,三甲基乙酸盐,己二酸盐,藻酸盐,乳酸盐,柠檬酸盐,酒石酸盐,琥珀酸盐,马来酸盐,富马酸盐,苦味酸盐,天冬氨酸盐,葡糖酸盐,苯甲酸盐,甲磺酸盐,乙磺酸盐,苯磺酸盐,对甲苯磺酸盐和双羟萘酸盐等。
本发明涉及的药物组合物可以包括药学上可接受的载体,载体包括但不限于:离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白如人血白蛋白,缓冲物质如磷酸盐,甘油,山梨酸,山梨酸钾,饱和植物脂肪酸的部分甘油酯混合物,水,盐或电解质,如硫酸鱼精蛋白,磷酸氢二钠,磷酸氢钾,氯化钠,锌盐,胶态氧化硅,三硅酸镁,聚乙烯吡咯烷酮,纤维素物质,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜂蜡,羊毛脂。
本发明所述药物组合物可以根据不同给药途径而制备成各种形式。
根据本发明,所述的药物组合物可以以下面的任意方式施用:口服、喷雾吸入、直肠用药、鼻腔用药、颊部用药、阴道用药、局部用药、非肠道用药如皮下、静脉、肌内、腹膜内、鞘内、心室内、胸骨内和颅内注射或输入、或借助一种外植储器用药。其中优选口服、腹膜内或静脉内用药方式。
当口服用药时,所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物可制成任意口服可接受的制剂形式,包括但不限于片剂、胶囊、水溶液或水悬浮液。其中,片剂一般使用的载体包括乳糖和玉米淀粉,另外也可加入润滑剂如硬质酸镁。胶囊制剂一般使用的稀释剂包括乳糖和干燥玉米淀粉。水悬浮液制剂则通常是将活性成分与适宜的乳化剂和悬浮剂混合使用。如果需要,以上口服制剂形式中还可加入一些甜味剂、芳香剂或着色剂。
当直肠用药时,所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物一般可制成栓剂的形式,其通过将药物与一种适宜的非刺激性赋形剂混合而制得。该赋形剂在室温下呈现固体状态,而在直肠温度下熔化释出药物。该类赋形剂包括可可脂、蜂蜡和聚乙二醇。
当局部用药时,特别是治疗局部外敷容易达到的患面或器官,如眼睛、皮肤或下肠道神经性疾病时,所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物可根据不同的患面或器官制成不同的局部用药制剂形式,具体说明如下:
当眼部局部施用时,所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物可配制成一种微粉化悬浮液或溶液的制剂形式,所使用载体为等渗的一定ph的无菌盐水,其中可加入也可不加防腐剂如氯化苄基烷醇盐。此外对于眼用,也可将化合物制成膏剂形式如凡士林膏。
当皮肤局部施用时,所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物可制成适当的软膏、洗剂或霜剂制剂形式,其中活性成分悬浮或溶解于一种或多种载体中。这里软膏即可使用的载体包括但不限于:矿物油、液体凡士林、白凡士林、丙二醇、聚氧化乙烯、聚氧化丙烯、乳化蜡和水;洗剂或霜剂可使用的载体包括但不限于:矿物油、脱水山梨糖醇单硬脂酸酯、吐温60、十六烷酯蜡、十六碳烯芳醇、2-辛基十二烷醇、苄醇和水。
当下肠道局部施用时,所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物可制成如上所述的直肠栓剂制剂或适宜的灌肠制剂形式,另外也可使用局部透皮贴剂。
所述化合物、其立体异构体或其药学上可接受的盐和/或其溶剂化物和/或其水合物还可以无菌注射制剂形式用药,包括无菌注射水或油悬浮液,或无菌注射溶液。其中,可使用的载体和溶剂包括水,林格氏溶液和等渗氯化钠溶液。另外,灭菌的非挥发油也可用作溶剂或悬浮介质,如单甘油酯或二甘油酯。
上述各种剂型的药物均可以按照药学领域的常规方法制备。
附图说明
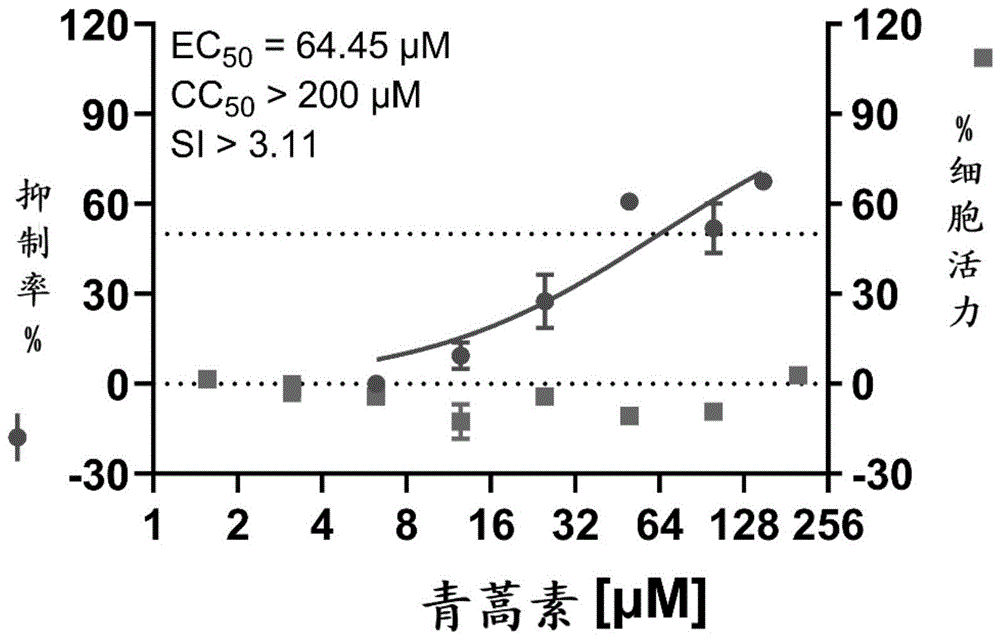
图1显示青蒿素有效降低sars-cov-2感染的veroe6细胞上病毒核酸载量。青蒿素在细胞感染sars-cov-248h后能够抑制细胞上的病毒rna载量,且抑制活性呈剂量依赖性。左侧纵坐标为依据样品中病毒rna的拷贝数计算出的百分比抑制率(对应图中的圆点及其拟合线),右侧纵坐标为依据细胞活力计算出的百分比毒性(对应图中的方块及其拟合线),横坐标为药物(青蒿素,artemisinin)浓度。
图2显示青蒿乙素有效降低sars-cov-2感染的veroe6细胞上病毒核酸载量。青蒿乙醚在细胞感染sars-cov-248h后能够抑制细胞上的病毒rna载量,且抑制活性呈剂量依赖性。左侧纵坐标为依据样品中病毒rna的拷贝数计算出的百分比抑制率(对应图中的圆点及其拟合线),右侧纵坐标为依据细胞活力计算出的百分比毒性(对应图中的方块及其拟合线),横坐标为药物(青蒿乙素,arteannuinb)浓度。
图3显示蒿甲醚有效降低sars-cov-2感染的veroe6细胞上病毒核酸载量。蒿甲醚在细胞感染sars-cov-248h后能够抑制细胞上的病毒rna载量,且抑制活性呈剂量依赖性。左侧纵坐标为依据样品中病毒rna的拷贝数计算出的百分比抑制率(对应图中的圆点及其拟合线),右侧纵坐标为依据细胞活力计算出的百分比毒性(对应图中的方块及其拟合线),横坐标为药物(蒿甲醚,artemether)浓度。
图4显示青蒿琥酯有效降低sars-cov-2感染的veroe6细胞上病毒核酸载量。青蒿琥酯在细胞感染sars-cov-248h后能够抑制细胞上的病毒rna载量,且抑制活性呈剂量依赖性。左侧纵坐标为依据样品中病毒rna的拷贝数计算出的百分比抑制率(对应图中的圆点及其拟合线),右侧纵坐标为依据细胞活力计算出的百分比毒性(对应图中的方块及其拟合线),横坐标为药物(青蒿琥酯,artesunate)浓度。
图5显示双氢青蒿素有效降低sars-cov-2感染的veroe6细胞上病毒核酸载量。双氢青蒿在细胞感染sars-cov-248h后能够抑制细胞上的病毒rna载量,且抑制活性呈剂量依赖性。左侧纵坐标为依据样品中病毒rna的拷贝数计算出的百分比抑制率(对应图中的圆点及其拟合线),右侧纵坐标为依据细胞活力计算出的百分比毒性(对应图中的方块及其拟合线),横坐标为药物(双氢青蒿素,dihydroartemisinin)浓度。
具体实施方式
下面详细描述本发明的实施例,下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
本发明提供具有式i结构的化合物,其立体异构体,其药学上可接受的盐和/或其溶剂化物和/或其水合物:
在某些实施方案中,本发明式i所示化合物的药学上可接受的盐包括其无机或有机酸盐,以及无机或有机碱盐,本发明涉及上述盐的所有形式。其中包括但不限于:钠盐、钾盐、钙盐、锂盐、葡甲胺盐、盐酸盐,氢澳酸盐,氢腆酸盐,硝酸盐,硫酸盐,硫酸氢盐,磷酸盐,磷酸氢盐,乙酸盐,丙酸盐,丁酸盐,草酸盐,三甲基乙酸盐,己二酸盐,藻酸盐,乳酸盐,柠檬酸盐,酒石酸盐,琥珀酸盐,马来酸盐,富马酸盐,苦味酸盐,天冬氨酸盐,葡糖酸盐,苯甲酸盐,甲磺酸盐,乙磺酸盐,苯磺酸盐,对甲苯磺酸盐和双羟萘酸盐等。
式i所示化合物可在细胞上抑制病毒复制,减少细胞培养物中病毒核酸载量。
本发明涉及式i所示的化合物,其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物在制备用于治疗冠状病毒特别是sars-cov-2引起的疾病或感染(包括但不限于呼吸系统疾病(例如单纯性感染如发热、咳嗽和咽痛等、肺炎、急性或严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症和脓毒性休克、重症急性呼吸综合征等))的药物中的用途,
本发明还涉及式i所示的化合物,其立体异构体、其药学上可接受的盐和/或其溶剂化物和/或其水合物在制备作为冠状病毒抑制剂的药物中的用途。
本发明还涉及式i所示的化合物,其立体异构体、其药学上可接受的盐和/或其溶剂化物和/或其水合物在制备用于抑制冠状病毒在细胞(例如哺乳动物细胞)中复制或繁殖的药物中的用途。
本发明还涉及一种药物组合物,其包含所述的式ⅰ所示化合物、其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物,优选地,所述的药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
本发明还涉及所述包含所述的式ⅰ所示化合物、其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物的药物组合物或所述式ⅰ所示化合物、其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物在制备用于治疗呼吸系统疾病但不限于呼吸系统疾病(包括单纯性感染如发热、咳嗽和咽痛等、肺炎、急性或严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症和脓毒性休克、重症急性呼吸综合征等)的药物中的用途。
本发明还涉及一种在有需要的哺乳动物中治疗和/或预防疾病的方法或者在有需要的哺乳动物中抑制冠状病毒复制或繁殖的方法,该方法包括给有需要的哺乳动物施用治疗和/或预防有效量的所述包含所述的式ⅰ所示化合物、其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物的药物组合物或所述的式i所示化合物、其立体异构体、其药物上可接受的盐和/或其溶剂化物和/或其水合物,其中所述的疾病包括冠状病毒引起的疾病。
在某些实施方案中,所述的冠状病毒特别是sars-cov-2引起的疾病包括但不限于呼吸系统疾病(例如单纯性感染如发热、咳嗽和咽痛等、肺炎、急性或严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症和脓毒性休克、重症急性呼吸综合征等)。
本发明还涉及药物组合物在制备用于治疗冠状病毒特别是sars-cov-2引起的疾病或感染(例如呼吸系统疾病(例如单纯性感染如发热、咳嗽和咽痛等、肺炎、急性或严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症和脓毒性休克、重症急性呼吸综合征等))的药物中的用途,其中所述药物组合物包含所述的式ⅰ所示化合物、其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物
优选地,所述的药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
本发明还涉及药物组合物在制备作为冠状病毒抑制剂的药物中的用途,其中所述药物组合物包含式ⅰ所示化合物、其立体异构体、其药学上可接受的盐和/或其溶剂化物和/或其水合物,
优选地,所述的药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
本发明还涉及药物组合物在制备用于抑制冠状病毒在细胞(例如哺乳动物细胞)中复制或繁殖的药物中的用途,其中所述药物组合物包含式ⅰ所示化合物、其立体异构体、其药盐上可接受的盐和/或其溶剂化物和/或其水合物,
优选地,所述的药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
本发明还涉及式i所示的化合物,其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物,其用于治疗冠状病毒特别是sars-cov-2引起的疾病或感染(包括但不限于呼吸系统疾病(例如单纯性感染如发热、咳嗽和咽痛等、肺炎、急性或严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症和脓毒性休克、重症急性呼吸综合征等))。
本发明还涉及式i所示的化合物,其立体异构体、其药学上可接受的盐和/或其溶剂化物和/或其水合物,其用作冠状病毒抑制剂。
本发明还涉及式i所示的化合物,其立体异构体、其药学上可接受的盐和/或其溶剂化物和/或其水合物,其用于抑制冠状病毒在细胞(例如哺乳动物细胞)中复制或繁殖。
本发明还涉及药物组合物,其用于治疗冠状病毒特别是sars-cov-2引起的疾病或感染(例如呼吸系统疾病(例如单纯性感染如发热、咳嗽和咽痛等、肺炎、急性或严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症和脓毒性休克、重症急性呼吸综合征等)),其中所述药物组合物包含所述的式ⅰ所示化合物、其立体异构体或其药物上可接受的盐和/或其溶剂化物和/或其水合物
优选地,所述的药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
本发明还涉及药物组合物,其用作冠状病毒抑制剂,其中所述药物组合物包含式ⅰ所示化合物、其立体异构体、其药学上可接受的盐和/或其溶剂化物和/或其水合物,
优选地,所述的药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
本发明还涉及药物组合物,其用于抑制冠状病毒在细胞(例如哺乳动物细胞)中复制或繁殖,其中所述药物组合物包含式ⅰ所示化合物、其立体异构体、其药盐上可接受的盐和/或其溶剂化物和/或其水合物,
优选地,所述的药物组合物还包含药学上可接受的载体或辅料,具体地,所述药物组合物为固体制剂、注射剂、外用制剂、喷剂、液体制剂、或复方制剂。
在某些实施方案中,本发明所述的冠状病毒为sars-cov-2。
在某些实施方案中,本发明所述冠状病毒引起的疾病为sars-cov-2引起的疾病,即covid-19。
在某些实施方案中,本发明所述哺乳动物包括牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物,例如是人、猫、狗或猪。
下面结合具体实施例对本发明进行进一步的解释说明。
实施例1:青蒿素降低sars-cov-2感染的细胞病毒核酸载量实验
(1)药物处理感染病毒的细胞
将veroe6细胞(购自atcc,货号1586)接种至24孔板,培养24h;然后进行病毒感染,具体的,用2%细胞维持液(配方为:将fbs(购自gibco公司,货号16000044)按照2%的体积比加入mem(购自gibco公司,货号10370021),即为2%细胞维持液)将sars-cov-2(2019-ncov)病毒(ncov-2019betacov/wuhan/wiv04/2019株,由中国科学院武汉病毒研究所提供)稀释成相应浓度,然后加入24孔板中使每孔含有病毒量为100tcid50。接下来再用2%细胞维持液将青蒿素(购自selleckchemicals,货号s1282)分别稀释成相应浓度,加入到对应的孔中,使药物最终浓度分别为150μm、100μm、50μm、25μm、12.5μm、6.25μm,然后放37℃、5%co2孵箱继续培养48h,细胞对照组只加不含有任何受试药物的2%细胞维持液。
(2)rna提取
rna提取试剂盒购自qiagen公司,货号74106。下述rna提取步骤中所涉及的耗材(离心柱、无rna酶的2ml收集管等)及试剂(rlt、rw1、rpe、无rna酶水等)均为试剂盒的组成部分。下述提取步骤均为试剂盒说明书所推荐的步骤。
1)取受试培养板的上清液100μl,加入无核酸酶ep管中,然后每孔加入350μlbufferrlt,用移液枪吹吸混匀使其充分裂解后,离心取上清;
2)向1)中所得上清液加入等体积的70%乙醇,混匀;
3)将上述2)中所得混合液转入无rna酶的离心柱中,12000rpm离心15s,弃废液;
4)加入700μlbufferrw1,12000rpm离心15s清洗离心柱,弃废液;
5)加入500μlbufferrpe,12000rpm离心15s清洗离心柱,弃废液;
6)加入500μlbufferrpe,12000rpm离心2min清洗离心柱,弃废液;
7)换新的无rna酶的2ml收集管,12000rpm离心1min,干燥离心柱,然后离心柱整体转移至步骤8)的1.5ml收集管中;
8)换上新的1.5ml收集管,放入步骤7)中干燥后的离心柱,并向离心柱中加入30μl不含rna酶的水,12000rpm离心2min,洗脱液即含有相应的rna,加入rna酶抑制剂(购自neb公司,货号m0314l),用nanodrop(购自thermoscientific,型号nanodropone)检测各rna浓度。
(3)rna反转录
实验采用takara公司生产的反转录试剂盒(primescripttmrtreagentkitwithgdnaeraser,货号rr047q)进行rna反转录,步骤如下。
①gdna去除:收集各实验组rna样品,分别取1μg进行反转录。首先,向各实验组rna中加入2μl5×gdnaeraserbuffer,用rnasefree水补足反应体系至10μl,充分混匀,42℃水浴2min去除样品中可能存在的gdna;
②逆转录:向①所得样品中加入适量的酶和引物mix及反应缓冲液,用rnasefree水补足体积至20μl,37℃水浴反应15min,之后投入85℃水中5sec,既可转录得到cdna。
(4)real-timepcr
采用荧光定量pcr检测原病毒液每毫升所含拷贝数。
采用tbgreenpremix(takara,cat#rr820a)混好反应体系,在steponeplusreal-timepcr仪(品牌:abi)进行扩增反应和读数。计算原病毒液每毫升所含拷贝数。步骤如下:
①首先建立标准品:将质粒pmt-rbd(质粒由中国科学院武汉病毒研究所提供)稀释成5×108copies/μl,5×107copies/μl,5×106copies/μl,5×105copies/μl,5×104copies/μl,5×103copies/μl,5×102copies/μl。取2μl标准品或cdna模板用于qpcr反应。
②实验过程中所用引物序列如下(均为5’-3’方向表示):
rbd-qf:caatggtttaacaggcacagg(seqidno:1)
rbd-qr:ctcaagtgtctgtggatcacg(seqidno:2)
③反应程序如下:
预变性:95℃5分钟;
循环参数:95℃15秒,54℃15秒,72℃30秒,共40个循环。
(5)药物对细胞毒性测试
药物对细胞毒性的检测利用cck-8试剂盒(beoytime)测定。具体步骤如下:
①96孔板中接种1×104个veroe6(atcc)细胞,37℃培养8小时。
②将药物用dmso稀释到合适的母液浓度,再用含2%fbs(购自gibco公司,货号16000044)的mem培养基(购自gibco公司,货号10370021)稀释到与药物处理同样的浓度,弃96孔板中原培养基,取100μl含药物的mem培养基加入到细胞中,每个浓度做三个复孔。注意设置阴性对照(细胞孔中加dmso和培养基,而不加药物)和空白对照(不含细胞,加dmso和培养基)。加药完毕,细胞37℃培养48小时。
③向待测孔中加入20μlcck-8溶液(beoytime),轻轻混匀,不要产生气泡,37℃继续培养2小时。在酶标仪(购自moleculardevices公司,型号spectramaxm5)上读取od450,计算细胞活性:
细胞活性(%)=(a(药物处理组)-a(空白对照))/(a(阴性对照)-a(空白对照))×100%
其中a为酶标仪读数。
(6)实验结果
病毒增殖抑制实验的结果显示,受试化合物在150μm,100μm以及50μm的浓度下,均能够有效抑制感染上清中sars-cov-2病毒基因组的复制。(表1和图1)
表1.受试化合物(青蒿素)的抗病毒实验
细胞毒性结果显示,在所有受试浓度下,受试化合物(青蒿素)的处理均未改变细胞活力,即受试化合物在所有浓度下对细胞均无毒性作用(表2和图1)。
表2.受试化合物(青蒿素)的细胞毒性实验
实施例2:青蒿乙素降低sars-cov-2感染的细胞病毒核酸载量实验
(1)药物处理感染病毒的细胞
将veroe6细胞(购自atcc,货号1586)接种至24孔板,培养24h;然后进行病毒感染,具体的,用2%细胞维持液(配方为:将fbs(购自gibco公司,货号16000044)按照2%的体积比加入mem(购自gibco公司,货号10370021),即为2%细胞维持液)将sars-cov-2(2019-ncov)病毒(ncov-2019betacov/wuhan/wiv04/2019株,由中国科学院武汉病毒研究所提供)稀释成相应浓度,然后加入24孔板中使每孔含有病毒量为100tcid50。接下来再用2%细胞维持液将青蒿乙素(购自mce,货号hy-n2016)分别稀释成相应浓度,加入到对应的孔中,使药物最终浓度分别为50μm、25μm、12.5μm、6.25μm、3.13μm、1.56μm,然后放37℃、5%co2孵箱继续培养48h,细胞对照组只加不含有任何受试药物的2%细胞维持液。
(2)rna提取
rna提取试剂盒购自qiagen公司,货号74106。下述rna提取步骤中所涉及的耗材(离心柱、无rna酶的2ml收集管等)及试剂(rlt、rw1、rpe、无rna酶水等)均为试剂盒的组成部分。下述提取步骤均为试剂盒说明书所推荐的步骤。
1)取受试培养板的上清液100μl,加入无核酸酶ep管中,然后每孔加入350μlbufferrlt,用移液枪吹吸混匀使其充分裂解后,离心取上清;
2)向1)中所得上清液加入等体积的70%乙醇,混匀;
3)将上述2)中所得混合液转入无rna酶的离心柱中,12000rpm离心15s,弃废液;
4)加入700μlbufferrw1,12000rpm离心15s清洗离心柱,弃废液;
5)加入500μlbufferrpe,12000rpm离心15s清洗离心柱,弃废液;
6)加入500μlbufferrpe,12000rpm离心2min清洗离心柱,弃废液;
7)换新的无rna酶的2ml收集管,12000rpm离心1min,干燥离心柱,然后离心柱整体转移至步骤8)的1.5ml收集管中;
8)换上新的1.5ml收集管,放入步骤7)中干燥后的离心柱,并向离心柱中加入30μl不含rna酶的水,12000rpm离心2min,洗脱液即含有相应的rna,加入rna酶抑制剂(购自neb公司,货号m0314l),用nanodrop(购自thermoscientific,型号nanodropone)检测各rna浓度。
(3)rna反转录
实验采用takara公司生产的反转录试剂盒(primescripttmrtreagentkitwithgdnaeraser,货号rr047q)进行rna反转录,步骤如下。
①gdna去除:收集各实验组rna样品,分别取1μg进行反转录。首先,向各实验组rna中加入2μl5×gdnaeraserbuffer,用rnasefree水补足反应体系至10μl,充分混匀,42℃水浴2min去除样品中可能存在的gdna;
②逆转录:向①所得样品中加入适量的酶和引物mix及反应缓冲液,用rnasefree水补足体积至20μl,37℃水浴反应15min,之后投入85℃水中5sec,既可转录得到cdna。
(4)real-timepcr
采用荧光定量pcr检测原病毒液每毫升所含拷贝数。
采用tbgreenpremix(takara,cat#rr820a)混好反应体系,在steponeplusreal-timepcr仪(品牌:abi)进行扩增反应和读数。计算原病毒液每毫升所含拷贝数。步骤如下:
①首先建立标准品:将质粒pmt-rbd(质粒由中国科学院武汉病毒研究所提供)稀释成5×108copies/μl,5×107copies/μl,5×106copies/μl,5×105copies/μl,5×104copies/μl,5×103copies/μl,5×102copies/μl。取2μl标准品或cdna模板用于qpcr反应。
②实验过程中所用引物序列如下(均为5’-3’方向表示):
rbd-qf:caatggtttaacaggcacagg(seqidno:1)
rbd-qr:ctcaagtgtctgtggatcacg(seqidno:2)
③反应程序如下:
预变性:95℃5分钟;
循环参数:95℃15秒,54℃15秒,72℃30秒,共40个循环。
(5)药物对细胞毒性测试
药物对细胞毒性的检测利用cck-8试剂盒(beoytime)测定。具体步骤如下:
①96孔板中接种1×104个veroe6(atcc)细胞,37℃培养8小时。
②将药物用dmso稀释到合适的母液浓度,再用含2%fbs(购自gibco公司,货号16000044)的mem培养基(购自gibco公司,货号10370021)稀释到与药物处理同样的浓度,弃96孔板中原培养基,取100μl含药物的mem培养基加入到细胞中,每个浓度做三个复孔。注意设置阴性对照(细胞孔中加dmso和培养基,而不加药物)和空白对照(不含细胞,加dmso和培养基)。加药完毕,细胞37℃培养48小时。
③向待测孔中加入20μlcck-8溶液(beoytime),轻轻混匀,不要产生气泡,37℃继续培养2小时。在酶标仪(购自moleculardevices公司,型号spectramaxm5)上读取od450,计算细胞活性:
细胞活性(%)=(a(药物处理组)-a(空白对照))/(a(阴性对照)-a(空白对照))×100%
其中a为酶标仪读数。
(6)实验结果
病毒增殖抑制实验的结果显示,受试化合物在50μm,25μm以及12.5μm的浓度时,均能够有效抑制感染上清中sars-cov-2病毒基因组的复制。(表3和图2)
表3.受试化合物(青蒿乙素)的抗病毒实验
细胞毒性结果显示,在50μm浓度时,受试化合物(青蒿乙素)有一定毒性。受试化合物在25μm浓度下对未改变细胞活力,即均无毒性作用。(表4和图2)。
表4.受试化合物(青蒿乙素)的细胞毒性实验
实施例3:蒿甲醚降低sars-cov-2感染的细胞病毒核酸载量实验
(1)药物处理感染病毒的细胞
将veroe6细胞(购自atcc,货号1586)接种至24孔板,培养24h;然后进行病毒感染,具体的,用2%细胞维持液(配方为:将fbs(购自gibco公司,货号16000044)按照2%的体积比加入mem(购自gibco公司,货号10370021),即为2%细胞维持液)将sars-cov-2(2019-ncov)病毒(ncov-2019betacov/wuhan/wiv04/2019株,由中国科学院武汉病毒研究所提供)稀释成相应浓度,然后加入24孔板中使每孔含有病毒量为100tcid50。接下来再用2%细胞维持液将蒿甲醚(购自selleckchemicals,货号s3889)分别稀释成相应浓度,加入到对应的孔中,使药物最终浓度分别为200μm、100μm、50μm、25μm、12.5μm、6.25μm,然后放37℃、5%co2孵箱继续培养48h,细胞对照组只加不含有任何受试药物的2%细胞维持液。
(2)rna提取
rna提取试剂盒购自qiagen公司,货号74106。下述rna提取步骤中所涉及的耗材(离心柱、无rna酶的2ml收集管等)及试剂(rlt、rw1、rpe、无rna酶水等)均为试剂盒的组成部分。下述提取步骤均为试剂盒说明书所推荐的步骤。
1)取受试培养板的上清液100μl,加入无核酸酶ep管中,然后每孔加入350μlbufferrlt,用移液枪吹吸混匀使其充分裂解后,离心取上清;
2)向1)中所得上清液加入等体积的70%乙醇,混匀;
3)将上述2)中所得混合液转入无rna酶的离心柱中,12000rpm离心15s,弃废液;
4)加入700μlbufferrw1,12000rpm离心15s清洗离心柱,弃废液;
5)加入500μlbufferrpe,12000rpm离心15s清洗离心柱,弃废液;
6)加入500μlbufferrpe,12000rpm离心2min清洗离心柱,弃废液;
7)换新的无rna酶的2ml收集管,12000rpm离心1min,干燥离心柱,然后离心柱整体转移至步骤8)的1.5ml收集管中;
8)换上新的1.5ml收集管,放入步骤7)中干燥后的离心柱,并向离心柱中加入30μl不含rna酶的水,12000rpm离心2min,洗脱液即含有相应的rna,加入rna酶抑制剂(购自neb公司,货号m0314l),用nanodrop(购自thermoscientific,型号nanodropone)检测各rna浓度。
(3)rna反转录
实验采用takara公司生产的反转录试剂盒(primescripttmrtreagentkitwithgdnaeraser,货号rr047q)进行rna反转录,步骤如下。
①gdna去除:收集各实验组rna样品,分别取1μg进行反转录。首先,向各实验组rna中加入2μl5×gdnaeraserbuffer,用rnasefree水补足反应体系至10μl,充分混匀,42℃水浴2min去除样品中可能存在的gdna;
②逆转录:向①所得样品中加入适量的酶和引物mix及反应缓冲液,用rnasefree水补足体积至20μl,37℃水浴反应15min,之后投入85℃水中5sec,既可转录得到cdna。
(4)real-timepcr
采用荧光定量pcr检测原病毒液每毫升所含拷贝数。
采用tbgreenpremix(takara,cat#rr820a)混好反应体系,在steponeplusreal-timepcr仪(品牌:abi)进行扩增反应和读数。计算原病毒液每毫升所含拷贝数。步骤如下:
①首先建立标准品:将质粒pmt-rbd(质粒由中国科学院武汉病毒研究所提供)稀释成5×108copies/μl,5×107copies/μl,5×106copies/μl,5×105copies/μl,5×104copies/μl,5×103copies/μl,5×102copies/μl。取2μl标准品或cdna模板用于qpcr反应。
②实验过程中所用引物序列如下(均为5’-3’方向表示):
rbd-qf:caatggtttaacaggcacagg(seqidno:1)
rbd-qr:ctcaagtgtctgtggatcacg(seqidno:2)
③反应程序如下:
预变性:95℃5分钟;
循环参数:95℃15秒,54℃15秒,72℃30秒,共40个循环。
(5)药物对细胞毒性测试
药物对细胞毒性的检测利用cck-8试剂盒(beoytime)测定。具体步骤如下:
①96孔板中接种1×104个veroe6(atcc)细胞,37℃培养8小时。
②将药物用dmso稀释到合适的母液浓度,再用含2%fbs(购自gibco公司,货号16000044)的mem培养基(购自gibco公司,货号10370021)稀释到与药物处理同样的浓度,弃96孔板中原培养基,取100μl含药物的mem培养基加入到细胞中,每个浓度做三个复孔。注意设置阴性对照(细胞孔中加dmso和培养基,而不加药物)和空白对照(不含细胞,加dmso和培养基)。加药完毕,细胞37℃培养48小时。
③向待测孔中加入20μlcck-8溶液(beoytime),轻轻混匀,不要产生气泡,37℃继续培养2小时。在酶标仪(购自moleculardevices公司,型号spectramaxm5)上读取od450,计算细胞活性:
细胞活性(%)=(a(药物处理组)-a(空白对照))/(a(阴性对照)-a(空白对照))×100%
其中a为酶标仪读数。
(6)实验结果
病毒增殖抑制实验的结果显示,受试化合物在200μm、100μm、50μm以及25μm浓度时能够有效抑制感染上清中sars-cov-2病毒基因组的复制。(表5和图3)
表5.受试化合物(蒿甲醚)的抗病毒实验
细胞毒性结果显示,在所有受试浓度下,受试化合物(蒿甲醚)的处理均未改变细胞活力,即受试化合物在所有浓度下对细胞均无毒性作用。(表6和图3)
表6.受试化合物(蒿甲醚)的细胞毒性实验
实施例4:青蒿琥酯降低sars-cov-2感染的细胞病毒核酸载量实验
(1)药物处理感染病毒的细胞
将veroe6细胞(购自atcc,货号1586)接种至24孔板,培养24h;然后进行病毒感染,具体的,用2%细胞维持液(配方为:将fbs(购自gibco公司,货号16000044)按照2%的体积比加入mem(购自gibco公司,货号10370021),即为2%细胞维持液)将sars-cov-2(2019-ncov)病毒(ncov-2019betacov/wuhan/wiv04/2019株,由中国科学院武汉病毒研究所提供)稀释成相应浓度,然后加入24孔板中使每孔含有病毒量为100tcid50。接下来再用2%细胞维持液将青蒿琥酯(购自selleckchemicals,货号s2265)分别稀释成相应浓度,加入到对应的孔中,使药物最终浓度分别为25μm、12.5μm、6.25μm、3.13μm、1.88μm、0.94μm,然后放37℃、5%co2孵箱继续培养48h,细胞对照组只加不含有任何受试药物的2%细胞维持液。
(2)rna提取
rna提取试剂盒购自qiagen公司,货号74106。下述rna提取步骤中所涉及的耗材(离心柱、无rna酶的2ml收集管等)及试剂(rlt、rw1、rpe、无rna酶水等)均为试剂盒的组成部分。下述提取步骤均为试剂盒说明书所推荐的步骤。
1)取受试培养板的上清液100μl,加入无核酸酶ep管中,然后每孔加入350μlbufferrlt,用移液枪吹吸混匀使其充分裂解后,离心取上清;
2)向1)中所得上清液加入等体积的70%乙醇,混匀;
3)将上述2)中所得混合液转入无rna酶的离心柱中,12000rpm离心15s,弃废液;
4)加入700μlbufferrw1,12000rpm离心15s清洗离心柱,弃废液;
5)加入500μlbufferrpe,12000rpm离心15s清洗离心柱,弃废液;
6)加入500μlbufferrpe,12000rpm离心2min清洗离心柱,弃废液;
7)换新的无rna酶的2ml收集管,12000rpm离心1min,干燥离心柱,然后离心柱整体转移至步骤8)的1.5ml收集管中;
8)换上新的1.5ml收集管,放入步骤7)中干燥后的离心柱,并向离心柱中加入30μl不含rna酶的水,12000rpm离心2min,洗脱液即含有相应的rna,加入rna酶抑制剂(购自neb公司,货号m0314l),用nanodrop(购自thermoscientific,型号nanodropone)检测各rna浓度。
(3)rna反转录
实验采用takara公司生产的反转录试剂盒(primescripttmrtreagentkitwithgdnaeraser,货号rr047q)进行rna反转录,步骤如下。
①gdna去除:收集各实验组rna样品,分别取1μg进行反转录。首先,向各实验组rna中加入2μl5×gdnaeraserbuffer,用rnasefree水补足反应体系至10μl,充分混匀,42℃水浴2min去除样品中可能存在的gdna;
②逆转录:向①所得样品中加入适量的酶和引物mix及反应缓冲液,用rnasefree水补足体积至20μl,37℃水浴反应15min,之后投入85℃水中5sec,既可转录得到cdna。
(4)real-timepcr
采用荧光定量pcr检测原病毒液每毫升所含拷贝数。
采用tbgreenpremix(takara,cat#rr820a)混好反应体系,在steponeplusreal-timepcr仪(品牌:abi)进行扩增反应和读数。计算原病毒液每毫升所含拷贝数。步骤如下:
①首先建立标准品:将质粒pmt-rbd(质粒由中国科学院武汉病毒研究所提供)稀释成5×108copies/μl,5×107copies/μl,5×106copies/μl,5×105copies/μl,5×104copies/μl,5×103copies/μl,5×102copies/μl。取2μl标准品或cdna模板用于qpcr反应。
②实验过程中所用引物序列如下(均为5’-3’方向表示):
rbd-qf:caatggtttaacaggcacagg(seqidno:1)
rbd-qr:ctcaagtgtctgtggatcacg(seqidno:2)
③反应程序如下:
预变性:95℃5分钟;
循环参数:95℃15秒,54℃15秒,72℃30秒,共40个循环。
(5)药物对细胞毒性测试
药物对细胞毒性的检测利用cck-8试剂盒(beoytime)测定。具体步骤如下:
①96孔板中接种1×104个veroe6(atcc)细胞,37℃培养8小时。
②将药物用dmso稀释到合适的母液浓度,再用含2%fbs(购自gibco公司,货号16000044)的mem培养基(购自gibco公司,货号10370021)稀释到与药物处理同样的浓度,弃96孔板中原培养基,取100μl含药物的mem培养基加入到细胞中,每个浓度做三个复孔。注意设置阴性对照(细胞孔中加dmso和培养基,而不加药物)和空白对照(不含细胞,加dmso和培养基)。加药完毕,细胞37℃培养48小时。
③向待测孔中加入20μlcck-8溶液(beoytime),轻轻混匀,不要产生气泡,37℃继续培养2小时。在酶标仪(购自moleculardevices公司,型号spectramaxm5)上读取od450,计算细胞活性:
细胞活性(%)=(a(药物处理组)-a(空白对照))/(a(阴性对照)-a(空白对照))×100%
其中a为酶标仪读数。
(6)实验结果
病毒增殖抑制实验的结果显示,受试化合物在25μm,12.5μm以及6.25μm的浓度时,均能够有效抑制感染上清中sars-cov-2病毒基因组的复制。(表7和图4)
表7.受试化合物(青蒿琥酯)的抗病毒实验
细胞毒性结果显示,在25μm浓度时,受试化合物(青蒿琥酯)有轻微毒性。受试化合物在12.5μm浓度下对未改变细胞活力,即均无毒性作用。(表8和图4)
表8.受试化合物(青蒿琥酯)的细胞毒性实验
实施例5:双氢青蒿素降低sars-cov-2感染的细胞病毒核酸载量实验
(1)药物处理感染病毒的细胞
将veroe6细胞(购自atcc,货号1586)接种至24孔板,培养24h;然后进行病毒感染,具体的,用2%细胞维持液(配方为:将fbs(购自gibco公司,货号16000044)按照2%的体积比加入mem(购自gibco公司,货号10370021),即为2%细胞维持液)将sars-cov-2(2019-ncov)病毒(ncov-2019betacov/wuhan/wiv04/2019株,由中国科学院武汉病毒研究所提供)稀释成相应浓度,然后加入24孔板中使每孔含有病毒量为100tcid50。接下来再用2%细胞维持液将双氢青蒿素(购自selleckchemicals,货号s2290)分别稀释成相应浓度,加入到对应的孔中,使药物最终浓度分别为25μm、12.5μm、6.25μm、3.13μm、1.88μm、0.94μm,然后放37℃、5%co2孵箱继续培养48h,细胞对照组只加不含有任何受试药物的2%细胞维持液。
(2)rna提取
rna提取试剂盒购自qiagen公司,货号74106。下述rna提取步骤中所涉及的耗材(离心柱、无rna酶的2ml收集管等)及试剂(rlt、rw1、rpe、无rna酶水等)均为试剂盒的组成部分。下述提取步骤均为试剂盒说明书所推荐的步骤。
1)取受试培养板的上清液100μl,加入无核酸酶ep管中,然后每孔加入350μlbufferrlt,用移液枪吹吸混匀使其充分裂解后,离心取上清;
2)向1)中所得上清液加入等体积的70%乙醇,混匀;
3)将上述2)中所得混合液转入无rna酶的离心柱中,12000rpm离心15s,弃废液;
4)加入700μlbufferrw1,12000rpm离心15s清洗离心柱,弃废液;
5)加入500μlbufferrpe,12000rpm离心15s清洗离心柱,弃废液;
6)加入500μlbufferrpe,12000rpm离心2min清洗离心柱,弃废液;
7)换新的无rna酶的2ml收集管,12000rpm离心1min,干燥离心柱,然后离心柱整体转移至步骤8)的1.5ml收集管中;
8)换上新的1.5ml收集管,放入步骤7)中干燥后的离心柱,并向离心柱中加入30μl不含rna酶的水,12000rpm离心2min,洗脱液即含有相应的rna,加入rna酶抑制剂(购自neb公司,货号m0314l),用nanodrop(购自thermoscientific,型号nanodropone)检测各rna浓度。
(3)rna反转录
实验采用takara公司生产的反转录试剂盒(primescripttmrtreagentkitwithgdnaeraser,货号rr047q)进行rna反转录,步骤如下。
①gdna去除:收集各实验组rna样品,分别取1μg进行反转录。首先,向各实验组rna中加入2μl5×gdnaeraserbuffer,用rnasefree水补足反应体系至10μl,充分混匀,42℃水浴2min去除样品中可能存在的gdna;
②逆转录:向①所得样品中加入适量的酶和引物mix及反应缓冲液,用rnasefree水补足体积至20μl,37℃水浴反应15min,之后投入85℃水中5sec,既可转录得到cdna。
(4)real-timepcr
采用荧光定量pcr检测原病毒液每毫升所含拷贝数。
采用tbgreenpremix(takara,cat#rr820a)混好反应体系,在steponeplusreal-timepcr仪(品牌:abi)进行扩增反应和读数。计算原病毒液每毫升所含拷贝数。步骤如下:
①首先建立标准品:将质粒pmt-rbd(质粒由中国科学院武汉病毒研究所提供)稀释成5×108copies/μl,5×107copies/μl,5×106copies/μl,5×105copies/μl,5×104copies/μl,5×103copies/μl,5×102copies/μl。取2μl标准品或cdna模板用于qpcr反应。
②实验过程中所用引物序列如下(均为5’-3’方向表示):
rbd-qf:caatggtttaacaggcacagg(seqidno:1)
rbd-qr:ctcaagtgtctgtggatcacg(seqidno:2)
③反应程序如下:
预变性:95℃5分钟;
循环参数:95℃15秒,54℃15秒,72℃30秒,共40个循环。
(5)药物对细胞毒性测试
药物对细胞毒性的检测利用cck-8试剂盒(beoytime)测定。具体步骤如下:
①96孔板中接种1×104个veroe6(atcc)细胞,37℃培养8小时。
②将药物用dmso稀释到合适的母液浓度,再用含2%fbs(购自gibco公司,货号16000044)的mem培养基(购自gibco公司,货号10370021)稀释到与药物处理同样的浓度,弃96孔板中原培养基,取100μl含药物的mem培养基加入到细胞中,每个浓度做三个复孔。注意设置阴性对照(细胞孔中加dmso和培养基,而不加药物)和空白对照(不含细胞,加dmso和培养基)。加药完毕,细胞37℃培养48小时。
③向待测孔中加入20μlcck-8溶液(beoytime),轻轻混匀,不要产生气泡,37℃继续培养2小时。在酶标仪(购自moleculardevices公司,型号spectramaxm5)上读取od450,计算细胞活性:
细胞活性(%)=(a(药物处理组)-a(空白对照))/(a(阴性对照)-a(空白对照))×100%
其中a为酶标仪读数。
(6)实验结果
病毒增殖抑制实验的结果显示,受试化合物在25μm,12.5μm以及6.25μm的浓度时,均能够有效抑制感染上清中sars-cov-2病毒基因组的复制。(表9和图5)
表9.受试化合物(双氢青蒿素)的抗病毒实验
细胞毒性结果显示,在12.5μm浓度时,受试化合物(双氢青蒿素)有轻微毒性。受试化合物在6.25μm浓度下对未改变细胞活力,即均无毒性作用。(表10和图5)
表10.受试化合物(双氢青蒿素)的细胞毒性实验
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围。
sequencelisting
<110>中国人民解放军军事科学院军事医学研究院
<120>青蒿素类化合物在治疗冠状病毒感染方面的应用
<130>idc200303
<160>2
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>artificial
<220>
<223>rbd-qf
<400>1
caatggtttaacaggcacagg21
<210>2
<211>21
<212>dna
<213>artificial
<220>
<223>rbd-qr
<400>2
ctcaagtgtctgtggatcacg21
- 还没有人留言评论。精彩留言会获得点赞!