抗氧化、口腔保健、调节免疫、促进运动的组合物及其用途的制作方法
1.本发明是有关一种组合物以及其用途,特别是关于一种用以抗氧化、口腔保健、调节免疫以及促进运动至少其中之一的用途的组合物以及其用途。
背景技术:
2.益生菌是人体重要的共生菌,依照菌株及菌种的不同,具有各种不同的生理功能,如调节消化道菌相、消化道机能、调整血糖、增强免疫及抗疲劳等效果,有些菌株甚至有多种不同的功能。举例而言,lactobacillus rhamnosus gg(lgg)是目前被研究最多的菌株,其具有多种不同的功能,例如平衡和改善胃肠道功能、增强人体自身免疫能力、预防和帮助治疗腹泻、减少呼吸道感染的机率、排出毒素以及预防龋齿等等。bifidobacterium lactis bb-12则具有调节免疫系统、整肠及抑制病原菌的功能。这些多功能菌株的发现对于提升人类健康有着很大的帮助。
3.近年来许多研究也指出,肠道菌相的改变和代谢疾病及代谢症候群习习相关。举例而言,糖尿病患者的肠道菌丛被发现bacteroides、clostridium、e.coli的菌丛数量有显著增加;慢性肾病患者的肠道菌丛被发现lactobacillus、bifidobacterium有显著的减少,而补充益生菌也可以有效减缓疾病的进程。因此,服用具有复合功能的菌株,既可减缓疾病进程也可达到降低疾病并发症的效果。
4.有鉴于此,发展出一种安全且可长期使用的具有多种复合功能的功能性益生菌株的营养补充品有其迫切性。而乳酸菌一般来说是安全的,因此,找出具有多种复合功效的乳酸菌菌株便是目前极需努力的目标。
技术实现要素:
5.本发明提供一种包含乳酸菌菌株的组合物,其具有抗氧化、口腔保健、调节免疫以及促进运动至少其中之一的生理活性效果,因此,本发明的含乳酸菌菌株的组合物可作为上述生理活性的用途,且以食品、医药及口腔清洁组合物的形式存在。
6.本发明一实施例的用于多种生理活性用途的组合物包含经分离的乳酸菌菌株以及赋形剂、稀释剂或载体,其中乳酸菌菌株包含保藏编号为cgmcc no.19519的唾液乳杆菌(lactobacillus salivarius)sa-03菌株,其保藏于中国微生物菌种保藏管理委员会普通微生物中心。
7.本发明另一实施例的以包含乳酸菌菌株的组合物作为抗氧化、口腔保健、调节免疫以及促进运动至少其中之一的用途,其中包含乳酸菌菌株的组合物包含经分离的乳酸菌菌株以及赋形剂、稀释剂或载体,其中乳酸菌菌株包含保藏编号为cgmcc no.19519的唾液乳杆菌(lactobacillus salivarius)sa-03菌株,其保藏于中国微生物菌种保藏管理委员会普通微生物中心。
8.以下通过具体实施例配合所附的图式详加说明,当更容易了解本发明的目的、技术内容、特点及其所达成的功效。
附图说明
9.图1为本发明的乳酸菌菌株的清除自由基能力分析的试验结果。
10.图2为本发明的乳酸菌菌株和人类肠上皮细胞株(caco-2)共同培养后,肠上皮细胞所产生的超氧化物歧化酶活性分析的试验结果。
11.图3为本发明的乳酸菌菌株和人类肠上皮细胞株(caco-2)共同培养后,肠上皮细胞所产生的过氧化氢酶活性分析的试验结果。
12.图4为本发明的乳酸菌菌株的口腔病原菌的抑菌能力分析的试验结果。
13.图5为本发明的乳酸菌菌株的抗塑化剂合并ova诱导气喘的呼吸道阻力分析的试验结果。
14.图6为本发明的乳酸菌菌株对于抗塑化剂合并ova诱导气喘的免疫细胞组成的分析结果。
15.图7为本发明的乳酸菌菌株对于调节抗体产生的试验结果。
16.图8为本发明的乳酸菌菌株对于调节treg细胞免疫反应激素的试验结果。
17.图9为补充本发明的乳酸菌菌株的小鼠经诱发气喘后的肺部病理切片样本。
18.图10为补充本发明的乳酸菌菌株对于小鼠前肢抓力表现的试验结果。
19.图11为补充本发明的乳酸菌菌株对于小鼠游泳运动力竭时间表现的试验结果。
20.图12为补充本发明的乳酸菌菌株对于单次90分钟游泳运动并休息60分钟后血液中尿素氮浓度以及肌酸激酶活性的试验结果。
21.图13为补充本发明的乳酸菌菌株对于肝脏以及肌肉部位肝醣含量的试验结果。
22.专利程序的微生物保存:
23.本发明的唾液乳杆菌sa-03:
24.保藏日期:2020年03月30日;
25.保藏单位:中国微生物菌种保藏管理委员会普通微生物中心(cgmcc);
26.保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所
27.保藏编号:cgmcc no.19519;
28.分类命名:唾液乳杆菌(lactobacillus salivarius)。
具体实施方式
29.以下将详述本发明的各实施例,并配合图式作为例示。除了这些详细说明之外,本发明亦可广泛地施行于其它的实施例中,任何所述实施例的轻易替代、修改、等效变化都包含在本发明的范围内,并以申请专利范围为准。在说明书的描述中,为了使读者对本发明有较完整的了解,提供了许多特定细节;然而,本发明可能在省略部分或全部特定细节的前提下,仍可实施。此外,众所周知的步骤或组件并未描述于细节中,以避免对本发明形成不必要的限制。图式中相同或类似的组件将以相同或类似符号来表示。特别注意的是,图式仅为示意之用,并非代表组件实际的尺寸或数量,有些细节可能未完全绘出,以求图式的简洁。
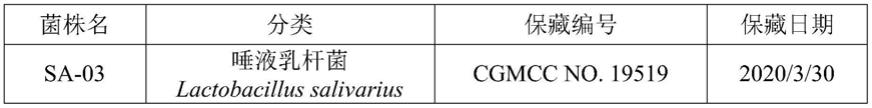
30.本发明所述的乳酸菌菌株的冷冻干燥培养物已保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。保藏的详细资料如表1所示:
31.表1乳酸菌菌株的保藏资料
[0032][0033]
如表1所列已保藏的唾液乳杆菌(lactobacillus salivarius)sa-03菌株被发现具有抗氧化、口腔保健(例如抑制口腔病原菌)、调节免疫、抗过敏气喘、促进运动以及抗疲劳至少其中之一的生理活性效果。因此,表1所列已保藏的唾液乳杆菌可作为抗氧化、口腔保健、调节免疫、抗过敏气喘、促进运动以及抗疲劳至少其中之一的用途。
[0034]
于一实施例中,本发明的用以上述生理活性的组合物包含经分离的唾液乳杆菌(lactobacillus salivarius)sa-03菌株以及赋形剂、稀释剂或载体。唾液乳杆菌sa-03菌株的保藏编号为cgmcc no.19519,保藏于中国微生物菌种保藏管理委员会普通微生物中心。
[0035]
于一实施例中,赋形剂、稀释剂或载体可为生理上可接受的赋形剂、稀释剂或载体,使本发明的组合物作为一食品组合物或口腔清洁组合物使用。于一实施例中,赋形剂、稀释剂或载体可为医药上可接受的赋形剂、稀释剂或载体,使本发明的组合物作为医药组合物使用。
[0036]
于食品组合物的实施例中,生理上可接受的赋形剂、稀释剂或载体可为食品,举例而言,食品可包含但不限于乳制饮品、茶、咖啡、洁牙糖(例如口含片、咀嚼锭、软糖等)、机能性饮品或以上的组合,其中乳制饮品可包含发酵乳、优格、奶酪或乳制饮品乳粉等。
[0037]
于医药组合物的实施例中,医药组合物可为口服剂型。举例而言,口服剂型可为锭剂、胶囊、溶液剂或粉剂等。
[0038]
于口腔清洁组合物的实施例中,赋形剂或稀释剂可为牙膏、洁牙粉、潄口水、口气清新喷雾、涂氟剂(例如涂抹于幼儿牙齿的氟剂)、假牙清洁剂、宠物用洁牙胶或宠物用化毛膏等;载体可为牙刷、牙间刷、牙线、口腔棉棒或宠物用洁牙骨等。
[0039]
于一实施例中,本发明的乳酸菌菌株为具有活性的菌株。于一实施例中,于食品组合物、口腔清洁组合物或医药组合物的实施例中,乳酸菌菌株的数量为106cfu以上;较佳者,乳酸菌菌株的数量为10
10
cfu以上。
[0040]
实施例1:本发明的乳酸菌菌株的形态学以及一般性质
[0041]
根据16s rdna序列分析以及api细菌鉴定系统分析结果来确认菌株在分类学上的特征。本发明的乳酸菌菌株在形态学及一般性质上的特征详细列于表2:
[0042]
表2本发明的乳酸菌菌株的形态学及一般性质特征
[0043][0044]
实施例2:本发明的乳酸菌菌株的收集
[0045]
本发明的乳酸菌菌株是以20%甘油保存于-80℃。使用前,以含有0.05%cysteine
的mrs broth(difco),37℃下活化(24小时)二次后使用。使用于研究的本发明乳酸菌菌株:唾液乳杆菌(lactobacillus salivarius)sa-03菌株,来源为人类肠道。于一实施例中,适用于本发明唾液乳杆菌sa-03菌株的液态培养基的碳源(carbon source)可为葡萄糖(glucose)、果糖(fructose)、乳糖(lactose)、蔗糖(sucrose)、麦芽糖(maltose)、半乳糖(galactose)、甘露糖(mannose)、海藻糖(trehalose)、淀粉(starch)、糖蜜(molasses)、马铃薯淀粉(potato starch)、玉米淀粉(corn starch)、麦芽萃取物(malt extract)、麦芽糊精(maltodextrin)或以上的组合。举例而言,本发明所使用的液态培养基包含2-5%的葡萄糖以及麦芽糊精的混合物,较佳者,液态培养基包含3%的葡萄糖以及麦芽糊精的混合物。于一实施例中,适用于本发明唾液乳杆菌sa-03菌株的液态培养基的氮源(nitrogen source)可为(nh4)2so4、(nh4)3po4、nh4no3、nh4cl、酪蛋白胺基酸(casamino acid)、尿素(urea)、蛋白胨(peptone)、聚蛋白胨(polypeptone)、胰化胨(tryptone)、肉类萃取物(meat extract)、酵母萃取物(yeast extract)、酵母粉(yeast powder)、牛奶、大豆粉(soybean flour)、乳清、或以上的组合。举例而言,本发明所使用的液态培养基包含5-30%牛奶以及1-10%大豆粉至少其中之一。
[0046]
实施例3:本发明的乳酸菌菌株的自由基清除活性分析
[0047]
dpph(di(phenyl)-(2,4,6-trinitrophenyl)iminoazanium)是稳定自由基分子,ddph自由基在甲醇溶液中在波长517nm下有最高的吸收值。当dpph自由基与抗氧化物质作用后,抗氧化物质提供氢质子而清除自由基,而dpph自由基就会失去本身蓝紫色的特性而造成吸光值的下降。利用测定od
517
值的下降来测定受测乳酸菌菌株的自由基清除能力。
[0048]
乳酸菌菌株的自由基清除能力的检测方法如下。将本发明的唾液乳杆菌sa-03菌株的含菌株菌液(约为2
×
109cfu,约od=2)、4μg/ml维生素c(阳性控制组,positive control)、不具抗氧化活性效果的嗜热链球菌(streptococcus thermophiles)sy-66菌株(约为2
×
109cfu,约od=2,阴性控制组,negative control)及二次水(空白组,blank)分别与0.2mm dpph在甲醇溶液中1∶1混合。混和均匀后,在黑暗室温下反应30分钟。接着于4℃离心(12000rpm,2min)后,取200μl到96孔盘中并测定od
517
值。自由基清除能力的计算公式如下:
[0049]
自由基清除能力=od
blank-od
sample
/od
blank
*100%
[0050]
其中od
sample
为受测样品的吸光值,od
blank
为空白组的吸光值。
[0051]
请参照图1,其为本发明的乳酸菌菌株清除自由基能力分析(dpph assay)的试验结果,其中符号***表示p值<0.005,亦即统计学上具有非常显著的差异。由图1的试验结果可知,相较于嗜热链球菌sy-66菌株,本发明的唾液乳杆菌sa-03菌株具有较强清除自由基的能力。
[0052]
实施例4:本发明的乳酸菌菌株诱发肠上皮细胞表现抗氧化酶分析
[0053]
身体内对于太多的自由基(oxidative stress)会有所谓的调控机制,体细胞会产生抗氧化剂(antioxidant)来因应,如合成谷胱甘肽(glutathione)、泛醇(ubiquinol)和尿酸(uric acid)等物质来吸收游离电子,另一方面从食物中摄取抗氧化剂如维生素c、维生素e等,也能抑制自由基的产生。身体细胞的另一个抗氧化系统为抗氧化酶(antioxidant enzymes)网络。超氧化物歧化酶(superoxide dismutase,sod)是一种重要的抗氧化酶,可以将超氧化物通过歧化反应转化为氧气和过氧化氢。人体内有三种超氧化物歧化酶,分别
存在于胞外、细胞质(cytoplasm)及粒线体(mitochondria)中。另一种酶为过氧化氢酶(catalase)是可以将超氧化物歧化酶所产生的过氧化氢转化为氧气和水。在饱和的状态下,一个过氧化氢酶分子每秒能将四千万个过氧化氢分子转化为水和氧气。
[0054]
caco-2细胞为人类结肠腺癌细胞上皮细胞,其细胞结构和功能相似于分化的小肠上皮细胞。caco-2细胞具有微绒毛等结构并含有与小肠刷状缘上皮相关的酶系,因而被广泛应用在模拟体内肠细胞生理活动模式。在细胞培养系统中,caco-2细胞可以长成单一层细胞,细胞彼此排列紧密,不仅在形态学上和小肠上皮细胞相似,且具有同样的胞饮作用、tight junction等结构。
[0055]
本实验在caco-2细胞的培养系统中加入本发明的唾液乳杆菌sa-03菌株的活菌(实验组)、嗜热链球菌sy-66菌株的活菌(对照组)及不加入任何活菌(空白控制组,control),以比例1:100(cells:probiotics)共同培养16小时后,洗掉菌株,再将caco-2细胞打破萃取蛋白质,以检测细胞内的超氧化物歧化酶(superoxide dismutase,sod)活性(其试验结果如图2所示)及过氧化氢酶(catalase)活性(其试验结果如图3所示)。sod活性分析是使用sod assay kit(cayman cat.706002),而catalase活性分析是使用catalase assay kit(cayman cat.707002)。所有实验流程皆依照kit的说明书建议进行分析。
[0056]
请参照图2及图3,以说明本发明的乳酸菌菌株诱发肠上皮细胞表现抗氧化酶的效果,其中符号*表示p值<0.05,亦即统计学上具有显著差异。相较于对照组嗜热链球菌sy-66菌株,本发明的唾液乳杆菌sa-03菌株可以诱发caco-2细胞增加抗氧化酶的表现,以分解体内过多的自由基。
[0057]
实施例5:本发明的乳酸菌菌株对于口腔病原菌的抑菌能力分析
[0058]
变形链球菌(streptococcus mutans)、牙龈卟啉单胞菌(porphyromonas gingivalis)、具核酸杆菌(fusobacterium nucleatum)以及伴放线聚生杆菌(aggregatibacter actinomycetemcomitans)是恶名昭彰的口腔病原菌。变形链球菌及具核酸杆菌与其他口腔微生物一起生长,并形成生物膜粘附在牙周组织上,引起龋齿和牙菌斑;牙龈卟啉单胞菌则产生蛋白酶并消化胶原蛋白,导致牙周炎;伴放线聚生杆菌感染常与侵袭性牙周炎及口臭有关。如今,各种抗生素,漱口水和牙科凝胶被用于治疗这些口腔疾病,然而滥用这些药物可能会产生多种抗药性口腔病原菌。因此,在治疗口腔疾病时,使用益生菌来控制口腔病原菌的生长并保持口腔微生物群的稳定性是预防产生多种抗药性口腔病原菌的较佳选择之一。
[0059]
本实验利用改良的双层琼脂覆盖法,分析本发明的唾液乳杆菌sa-03菌株、罗伊氏乳酸杆菌(lactobacillus reuteri)te-33菌株以及嗜热链球菌sy-66菌株对口腔病原菌的抑菌能力。将本发明的唾液乳杆菌sa-03菌株、罗伊氏乳酸杆菌te-33菌株以及嗜热链球菌sy-66菌株(约为109cfu)用棉签在mrs琼脂盘上划线(2cm宽),并在37℃的半厌氧条件下培养48小时,以产生2cm宽的测试菌株生长区。接着,将45℃tryptic soy broth(tsb,用以培养变形链球菌、牙龈卟啉单胞菌以及具核酸杆菌)或45℃brain heart infusion(bhi,用以培养伴放线聚生杆菌)添加到琼脂平板中。琼脂凝固后,分别将口腔病原菌(约10
7-109cfu/ml)以棉棒接种在琼脂表面,并在37℃下进一步培养48小时。通过使用半定量评分系统(0-3分)测量抑制区域的宽度来确定本发明的唾液乳杆菌sa-03菌株、罗伊氏乳酸杆菌te-33菌株以及嗜热链球菌sy-66菌株抑菌活性,其中抑制区域的宽度=0cm为0分;抑制区域的宽度
=1-2cm为1分;抑制区域的宽度=2-3cm为2分以及抑制区域的宽度>3cm为3分。
[0060]
请参照图4,其为本发明的唾液乳杆菌sa-03菌株对于口腔病原菌的抑菌能力试验结果。本发明的唾液乳杆菌sa-03菌株对于变形链球菌、牙龈卟啉单胞菌、具核酸杆菌以及伴放线聚生杆菌的口腔病原菌皆具有抑菌能力,共获得9分的抑菌分数,而嗜热链球菌sy-66菌株以及罗伊氏乳酸杆菌te-33菌株仅对特定口腔病原菌具有抑菌能力,分别获得3分的抑菌分数。因此,相较于对照组嗜热链球菌sy-66菌株以及罗伊氏乳酸杆菌te-33菌株,本发明的唾液乳杆菌sa-03菌株可以有效抑制变形链球菌、牙龈卟啉单胞菌、具核酸杆菌和伴放线聚生杆菌等口腔病原菌,且维持口腔健康。
[0061]
实施例6:本发明的乳酸菌菌株对于抑制塑化剂诱导过敏气喘的分析
[0062]
2011年曾发生数千名幼儿接触塑化剂(di(2-ethylhexyl)phthalate,dehp,邻苯二甲酸二(2-乙基己基)酯)污染食品的事件。在事件中,造成临床上小儿气喘及过敏症状显著增加,且越来越多的临床研究也确定了塑化剂与小儿过敏性疾病间的相关性。塑化剂(邻苯二甲酸酯类)是一群邻苯二甲酸(phthalate acid)的酯化衍生物,所包含的品项包括:dmp、dep、dpp、dbp、dnpp、dnhp、dchp、dnop、dop、dehp、diop、dnp、dinp、didp、bbp等。邻苯二甲酸酯类一般为挥发性低、稳定性高且无色具有芳香气味或无气味的粘稠油状液体,在水中溶解度很小,但容易溶解于非极性有机溶剂。因此,邻苯二甲酸酯类目前被认为与过敏性疾病如气喘、异位性皮肤炎有关。
[0063]
本实验利用塑化剂(dehp)诱导小鼠过敏性气喘模式,来测试本发明的唾液乳杆菌sa-03菌株的抗过敏及免疫调节的能力。动物实验使用雌性balb/c品系怀孕母鼠,于怀孕(3周)及哺乳期间(3周)将dehp(400μg/kg)溶于橄榄油中管喂投予,并以纯橄榄油作为对照组。待其子代于5-8周龄时进行ova气喘疾病诱发,并同时给予dehp及本发明的唾液乳杆菌sa-03菌株直至动物牺牲。子代于实验的第1天及第14天以腹腔注射0.1ml内含20μg ova作为过敏原与2.25mg al(oh)3辅以佐剂的磷酸盐缓冲生理盐水(phosphate buffered saline,pbs),进行诱发全身致敏。腹腔注射2次诱导全身过敏反应后,于第28天开始连续3天给予小鼠汽化的ova刺激,致敏小鼠呼吸道以雾气吸入1%ova方式进行诱发局部致敏。控制组则皆以相同实验处理方式并以生理食盐水取代ova。动物实验共分成四组,每组6只,分别为控制组(c)、ova/dehp组(od)、ova/dehp/probiotics(本发明的唾液乳杆菌sa-03菌株)低剂量组(odp-1x)及ova/dehp/probiotics(本发明的唾液乳杆菌sa-03菌株)高剂量组(odp-5x)。odp-1x实验组喂食的菌量为2.05x10
9 cfu;odp-5x实验组喂食的菌量为1.03x10
10 cfu。第32天时进行呼吸道阻力测定(airway hyperresponsiveness,ahr),并在隔天采样及动物牺牲后,进行血清内过敏性因子分析、肺部病理切片及肺冲洗液细胞及细胞激素分析。以上分析的详细实验方法说明如下。
[0064]
呼吸道阻力测定(ahr):
[0065]
甲基胆碱(methacholine)是一种非专一性气管收缩剂,其可作用于支气管副交感神经丛的毒蕈碱性神经传递物质接受体。若有潜在性气喘的病人接受methacholine药剂喷雾后,可使支气管平滑肌收缩产生气喘现象,因此,可经由接受methacholine药剂喷雾后评估动物的肺敏感度。在ova诱发后第32天时进行小鼠呼吸道阻力测定,可观察小鼠呼吸道的收缩状况。首先将小鼠暴露在不同浓度的methacholine(sigma-aldrich,inc.),分别为0、12.5、25和50mg/ml,以蒸气吸入(喷雾)的方式处理3分钟。接着,将小鼠置于有呼吸道阻力
侦测系统(buxco electronics,inc.,wilmington,nc,usa)的腔室中侦测3分钟,由传感器侦测到小鼠呼吸速率及气流量变化再经由biosystem xa软件分析后得到呼吸道阻力的penh值(enhanced pause),阻力越大表示气喘越严重。
[0066]
免疫细胞分析:
[0067]
将试验动物牺牲后进行血液采样,并将血液置于含有edta抗凝剂的收集管中于室温下混合均匀,接着,以全自动血球分析仪进行白血球(wbc)分类项目的检测:包含嗜中性球(neutrophil)、淋巴球(lymphocyte)、单核球(monocyte)、嗜酸性白血球(eosinophil)以及嗜碱性白血球(basophil)。以嗜酸性白血球数量作为评估气喘严重性的指标,其数量越少表示气喘的症状越轻。
[0068]
血清中ova特异性ige、igg1的浓度分析:
[0069]
先以10μg/ml ova(溶于1x pbs)涂布于96孔的elisa孔盘(tpp,trasadingen,switzerland),置于4℃隔夜。接着,在37℃下以3%bovine serum albumin(bsa)(in pbs)进行阻断,1小时后加入待测物于37℃作用1小时。之后加入biotinylated rat anti-mouse monoclonal ige或igg1(bd biosciences)在37℃下作用1小时后,再加入streptavidin conjugated-hrp于室温下作用30分钟。接着,加入受质溶液(包含2mg o-phenylenediamine dihydrochloride(opd,sigma-aldrich)及2μl 30%h2o2溶于5ml pbs)使其呈色,于室温下作用20分钟,再以25μl 3m h2so4终止反应。最后用elisa reader(sunrise
tm
,tecan ltd.)波长450nm测吸光值。ige的浓度越低表示越不容易引发过敏和气喘。
[0070]
支气管肺泡冲洗液(bronchoalveolar lavage fluid,balf)的细胞激素分析:
[0071]
试验动物在试验结束后以zoletil 50(1ml)进行牺牲,并将1ml生理食盐水以24g滞留软管针头、1ml针筒连接pe60软管注射进小鼠肺脏,进行3次balf抽提,共计可回收0.5ml balf。接着,利用luminex机器来侦测肺泡冲洗液及血清中il-4、il-5、il-10、il-13及ifn-γ细胞激素的浓度,并以milliplex套组将欲分析的抗体coating至微珠上。milliplex原理主要是利用抗体抗原免疫键结原理来侦测,微珠由红外光及远红外光2种荧光染剂依不同比例混合而成,总共组合成100种的color code。不同color code的微珠上可接上专一性辨识特定蛋白的抗体,来辨识样品里的特定蛋白。然后与标志生物素(biotin)的检测抗体(detection antibody)作用,最后加入sape(streptavidin phycoerythrin)荧光抗体反应,读取荧光强度即可以知道不同细胞激素的浓度。th2细胞激素如il-4、il-5和il-13越低表示过敏情况较为缓解。il-10和ifn-γ越高表示越不容易造成th2免疫反应所产生的过敏及气喘。
[0072]
支气管肺泡冲洗液(balf)的免疫细胞组成分析:
[0073]
首先,将小鼠牺牲后取得的balf以ack lysis buffer(becton dickinson)去除红血球。接着,将去除红血球的balf细胞悬浮于facs buffer(becton dickinson),并以单株抗体[cd4、cd8、cd3、cd19、foxp3]进行染色。最后,以accuri c6 flow cytometer(bd biosciences)上机检测,并以bd accuri
tm
c6 software进行免疫细胞组成分析。
[0074]
肺部病理切片分析:
[0075]
以ova诱发小鼠肺脏组织慢性病变,牺牲后的采样部位均为左侧肺单叶。将样品以中间横切方式做一切面,将其制作成h&e染色及pas染色切片并进行肺叶横切面的观察。每种评量方式以动物数n=6方式计算。依据wittke et al.(2004)的评分方法并稍加修饰,在
组织病理评估方面采取三个不同的组织型态学变化进行量化评分,分别依支气管上皮增生、肺脏炎症反应以及气管黏液分泌(pas染色)的严重度分为0-4分,其中0分为无反应,4分则为最严重的反应。最后以三项评分加总作为气喘的综合评分指数。
[0076]
请参照图5,以说明本发明的唾液乳杆菌sa-03菌株的抑制塑化剂合并ova诱导气喘的试验结果。由图5所示的结果可知,塑化剂dehp合并ova的od组penh%呼吸阻力增加倍数(与0mg/ml组的比值)上升幅度最大。od组在不同浓度的methacholine测试下皆与高剂量组(odp-5x)具有显著差异,其中以未加入methacholine(0mg/ml)作为比较基准,接受12.5mg/ml methacholine药剂喷雾时,od组为4.46倍,高剂量组为1.44倍;接受25mg/ml methacholine药剂喷雾时,od组为9.76倍,高剂量组为3.21倍;接受50mg/ml methacholine药剂喷雾时,od组为14.95倍,高剂量组为5.64倍(p<0.01)。由此可知,本发明的唾液乳杆菌sa-03菌株的高剂量组(odp-5x)以及低剂量组(odp-1x)与od组相比,于接受最高methacholine(50mg/ml)药剂喷雾时呼吸阻力百分比明显降低,约为od组0.37倍及0.5倍。
[0077]
请参照图6,以说明本发明的唾液乳杆菌sa-03菌株对于抗塑化剂合并ova诱导气喘的免疫细胞组成的分析结果。取10μl支气管肺泡冲洗液(balf)以及血液中的细胞悬浮液滴于载玻片上进行刘氏染色,之后于光学显微镜下观察并计数嗜酸性白血球的数量。由图6中的a可知,od组balf中的嗜酸性白血球数量明显高于其他各组。在给予高剂量唾液乳杆菌sa-03菌株组(odp-5x)的嗜酸性白血球数量明显降低(p<0.05)。采集血液再以全自动血球分析仪进行白血球(wbc)分类,结果显示,各组小鼠在试验期间血液中的白血球种类(嗜中性球、淋巴球、单核球、嗜酸性白血球及嗜碱性球)并无明显差异,如图6中的b所示。由图6所示的结果显示本发明的唾液乳杆菌sa-03菌株主要是调节过敏部位的免疫细胞的组成,而并非调节全身性的免疫细胞的组成变化。可以理解的是,嗜酸性白血球数量降低有助于减缓气喘的症状。
[0078]
请参照图7,以说明本发明的唾液乳杆菌sa-03菌株的调节抗体产生的试验结果。各组试验动物的血清分离后,随即进行与气喘相关的ova特异性ige及igg1免疫球蛋白分析。请参照图7中的a,od组血清中的ova特异性ige浓度为4106.5
±
183.8ng/ml,明显高于其他组别。而在给予本发明的唾液乳杆菌sa-03菌株的组别(odp-1x以及odp-5x)的血清中,ova特异性ige浓度皆明显低于od组,统计学上具有非常显著的差异(p<0.005);但低剂量组(odp-1x)与高剂量组(odp-5x)之间并无明显差异性,其中odp-1x组的ige浓度为2812.7
±
233.3ng/ml,odp-5x组的ige浓度为2700.5
±
368.2ng/ml。请参照图7中的c,在支气管肺泡冲洗液(balf)中,ova特异性ige浓度的部分也是od组最高,而在本发明的唾液乳杆菌sa-03菌株组别(odp-1x以及odp-5x)的支气管肺泡冲洗液(balf)中,ova特异性ige浓度皆明显低于od组,统计学上具有显著差异(p<0.05)。
[0079]
请参照图7中的b,在ova特异性igg1浓度的部分,血清中控制组的ova特异性igg1浓度显著低于od组,统计学上具有非常显著的差异(p<0.005),其中控制组的ova特异性igg1浓度为102936
±
7121ng/ml,od组的ova特异性igg1浓度为325194
±
53859ng/ml。请参照图7中的d,在支气管肺泡冲洗液(balf)中,相较于控制组,od组的ova特异性igg1浓度明显上升,统计学上具有非常显著差异(p<0.005),其中od组的ova特异性igg1浓度为15709
±
1668.2,控制组的ova特异性igg1浓度为1566.7
±
238.8。相较于od组,本发明的唾液乳杆菌sa-03菌株组别(odp-1x以及odp-5x)的ova特异性igg1浓度明显下降,其中odp-1x组的ova
特异性igg1浓度为9714.5
±
504ng/ml(p<0.01),odp-5x组的ova特异性igg1浓度为10167
±
840ng/ml(p<0.05)。由图7的结果可知,本发明的唾液乳杆菌sa-03菌株可以有效降低ova特异性ige和igg1浓度,以减缓过敏气喘症状。
[0080]
请参照图8,以说明本发明的唾液乳杆菌sa-03菌株对于调节treg细胞免疫反应激素il-5、il-10的试验结果。本发明的唾液乳杆菌sa-03菌株诱发treg细胞产生细胞激素il-10。细胞激素il-10可以抑制th1及th2免疫反应达到缓解过敏及气喘症状。请参照图8,细胞激素il-5在血清以及支气管肺泡冲洗液(balf)中的浓度有明显的变化,其中od组皆有显著的上升。在血清的部分,相较于控制组,细胞激素il-5在od组有明显地升高(p<0.01)。而相较于od组,本发明的唾液乳杆菌sa-03菌株组别(odp-1x以及odp-5x)的细胞激素il-5的浓度明显下降(p<0.05)。另一方面,能调节th1/th2平衡的细胞激素il-10在血清中的浓度,odp-5x组相较于od组显著升高(p<0.05)。由图8的结果可知,dehp合并ova能促进血清中及肺脏邻近支气管组织间的细胞激素il-5的活化,而本发明的唾液乳杆菌sa-03菌株的补充则能抑制细胞激素il-5的增加,进而达到降低气喘的效果。
[0081]
请参照图9,以说明补充本发明的唾液乳杆菌sa-03菌株的小鼠的肺部病理切片样本。各组的肺脏组织学的病理切片结果如图9中的a至h所示,其中,od组于肺脏支气管中可见明显的上皮细胞增生及肥大,部份支气管及血管周围有炎症细胞浸润呈现明显增厚现象,如图9中的b所示。使用pas染色评估支气管内杯状上皮细胞的黏液分泌情形,可看到od组的支气管上皮组织黏液量明显增多,如图9中的f所示,图中箭头表示黏液分泌。相反的,在给予本发明的唾液乳杆菌sa-03菌株的odp-1x组及odp-5x组相较于od组,在肺脏组织的上皮细胞增生、炎症反应程度与黏液分泌有明显改善,且经过各指标量化分析结果亦显示均有减轻的情形,具有统计上的差异(符号*代表p<0.05,符号**代表p<0.01,符号***代表p<0.005),如图9中的i至l所示。
[0082]
实施例7:本发明的乳酸菌菌株的运动表现分析
[0083]
疲劳(fatigue)是指动作或运动表现失去正常水平,而疲劳感则为主观的感受,通常与组织损伤以及身体能量短缺有关。良好的肠道菌群可以有效增加宿主的运动能力及抗疲劳的能力。
[0084]
本试验是利用动物运动模式来分析本发明的唾液乳杆菌sa-03菌株促进小鼠运动及抗疲劳的能力。本试验将依照文献补充益生菌的剂量做为参考,并依人体实际建议摄取量作设计,即“建议每人每日建议补充约1
×
10
10
cfu”的剂量作为1倍剂量来进行试验。以成人60kg体重计算,人体每日建议摄取量为1
×
10
10
cfu。为了了解本发明的菌株食用上是否具有剂量效应,所以在分组上,选择人体建议量的1倍、2倍与5倍,共计3个剂量进行实验,并额外增加1组对照组。由于人体与不同实验动物的代谢速率有所差异,因此依据2005年美国食品药物管理局所公告的估算方法(estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult healthy volunteers)(us fda,2005),将人体剂量换算成试验动物的投予剂量。人体与小鼠的换算系数为12.3倍,故小鼠的1倍剂量组为2.05
×
109cfu/kg/day,2倍剂量组为4.10
×
109cfu/kg/day,5倍剂量组为1.03
×
10
10
cfu/kg/day,空白对照组给予等体积pbs。
[0085]
实验动物购入6周大、雄性icr品系小鼠(购自乐斯科生物科技股份有限公司),共计40只,以动物饲料(chow5001)与水提供予小鼠自由摄食,动物房温度控制在24
±
2℃、湿
度60%-70%,光照与黑暗各12小时。动物预养两周适应环境,且所有小鼠皆为8周大成鼠。挑选体重相近的icr小鼠40只,以随机的方式将小鼠分为四组,分别为(a)空白对照组(vehicle);(b)喂食1倍剂量组(1x):2.05
×
109cfu/kg mouse/day;(c)喂食2倍剂量组(2x):4.10
×
109cfu/kg mouse/day;(d)喂食5倍剂量组(5x):1.03
×
10
10
cfu/kg mouse/day。
[0086]
动物试验期间共计4周,第一周至第四周试验期间,于每日管灌喂食本发明的唾液乳杆菌sa-03菌株。连续四周补充本发明的唾液乳杆菌sa-03菌株后,依序进行各项运动能力与疲劳相关的生化指标分析。基于符合动物福祉的实验设计,运动挑战的强度与时间,由低强度至高强度、由短时间至长时间,并抽血进行各项试验。补充不同剂量的本发明唾液乳杆菌sa-03菌株四周后,随即进行以下运动以及抗疲劳实验。
[0087]
前肢抓力(forelimb grip strength)表现:
[0088]
本试验是为了评估补充不同剂量的本发明唾液乳杆菌sa-03菌株对于小鼠前肢抓力表现的影响。本试验使用动物前肢抓力测量装置分析各组动物间前肢抓力的变化,其是依据huang、wu及yeh所提及的试验设计(huang wc,lin ci,chiu cc,lin yt,huang wk,huang hy,huang cc.(2014).chicken essence improves exercise performance and ameliorates physical fatigue.nutrients.6(7):2681-2696);(wu re,huang wc,liao cc,chang yk,kan nw,huang cc.(2013).resveratrol protects against physical fatigue and improves exercise performance in mice.molecules18(4):4689-4702);(yeh ts,chuang hl,huang wc,chen ym,huang cc,hsu mc.(2014).astragalus membranaceus improves exercise performance and ameliorates exercise-induced fatigue in trained mice.molecules 19(3):2793-2807),藉以了解肌力提升情形。于第29天喂食本发明的唾液乳杆菌sa-03菌株后30分钟即进行前肢抓力测试。
[0089]
耐力运动表现:
[0090]
本试验是为了评估补充本发明的唾液乳杆菌sa-03菌株4周后对于耐力运动表现是否具有提升的效果。试验前一周(第21天)喂食本发明的唾液乳杆菌sa-03菌株后30分钟,先让动物在直径28cm、水深25cm以及水温27
±
1℃条件下进行游泳适应。试验满4周,于第31天进行负重游泳力竭试验(小鼠体重5%,wu et al.,2013),游泳前禁食12小时,并以单只游泳方式进行试验,将小鼠放入水缸中,强迫试验动物进行游泳运动。试验过程中水温控制在27
±
1℃之间。此外,在整个实验过程中应使试验动物四肢保持运动,如果试验动物漂浮在水面四肢不动,可用搅拌棒在其附近搅动。记录试验动物头部完全没入水中持续8秒不浮出水面为止的时间。
[0091]
运动挑战后的血液生化指标分析:
[0092]
为了评估补充本发明的唾液乳杆菌sa-03菌株是否对于运动后与疲劳的血液生化指标具有改善的效果,将检测小鼠运动前与运动后血乳酸(lactate)浓度变化,并计算运动后血乳酸升高的比值。为了检测疲劳相关的血乳酸变化情形,游泳测试当日(试验第33天)喂食本发明的唾液乳杆菌sa-03菌株30分钟后采血,然后不负重在温度为27
±
1℃的水中游泳10分钟后停止。在游泳后及休息20分钟后再分别采血0.2ml,共采三个时间点血液作血乳酸分析。
[0093]
另外,检测各组小鼠的血尿素氮(blood urea nitrogen,bun)的浓度变化。游泳测
试当日(试验第35天)喂食本发明的唾液乳杆菌sa-03菌株后30分钟在水中不负重游泳90分钟,休息60分钟后采血0.3ml,进行血尿素氮浓度分析,并取部分血液检体进行肌酸激酶(creatine kinase,ck)活性分析,其可作为肌肉损伤指标,如huang、wang、wu、su及yeh所提及的试验指标分析(huang cc,hsu mc,huang wc,yang hr,hou cc.(2012).triterpenoid-rich extract from antrodia camphorata improves physical fatigue and exercise performance in mice.evid based complement alternat med.2012:364741);(wang sy,huang wc,liu cc,wang mf,ho cs,huang wp,hou cc,chuang hl,huang cc.(2012).pumpkin(cucurbita moschata)fruit extract improves physical fatigue and exercise performance in mice.molecules17(10):11864-11876);(wu re,huang wc,liao cc,chang yk,kan nw,huang cc.(2013).resveratrol protects against physical fatigue and improves exercise performance in mice.molecules 18(4):4689-4702);(su ky,yu cy,chen yw,huang yt,chen ct,wu hf,chen yl.(2014).rutin,a flavonoidand principal component of saussurea involucrata,attenuates physical fatigue in a forced swimming mouse model.int j med sci.11(5):528-537);(yeh ts,chuang hl,huang wc,chen ym,huang cc,hsu mc.(2014).astragalus membranaceus improves exercise performance and ameliorates exercise-induced fatigue in trained mice.molecules 19(3):2793-2807),藉以同步了解测试样品是否具有保护长时间运动肌肉损伤的效果。本次血清样品是采用血液自动分析仪(hitachi 7060,hitachi,tokyo,japan)进行检验。
[0094]
肝脏与肌肉部位肝醣含量的分析:
[0095]
本试验是为了评估补充本发明的唾液乳杆菌sa-03菌株对增加体内组织中重要能量储存物质肝醣的含量的影响。在90分钟游泳测试后,让所有动物进行休息2日之后(试验第37天),于末次喂食30分钟后将所有动物进行牺牲,采集血液进行临床血液分析。另外,采集小鼠肝脏与后肢小腿肌肉,并以生理食盐水清洗后,拭干秤重。于组织相同位置处剪取组织并分装冻存于-80℃供后续分析组织肝醣含量使用。分析方法是依照chamberland及rioux所采用的化学分析法直接针对肝醣进行定量(chamberland v,rioux p.(2010).not only students can express alcohol dehydrogenase:goldfish can too!adv physiol educ 34(4):222-227)。取出待测的组织样品加入5倍体积(w/v)的组织均质液,使用组织均质机bullet blender(next advance,cambridge,ma,usa)将不同组织进行均质化。将组织均质液分装至微量离心管,于4℃、12,000
×
g条件下离心15分钟,取出上层萃取液的部分,直接进行如huang所提及的肝醣含量分析(huang wc,lin ci,chiu cc,lin yt,huang wk,huang hy,huang cc.(2014).chicken essence improves exercise performance and ameliorates physical fatigue.nutrients.6(7):2681-2696)。另以市售肝醣(glycogen sigma)标准品进行检量线的制作,藉以计算不同组别动物肝脏与肌肉组织中肝醣储存量的变化情形。
[0096]
请参照图10,以说明补充本发明的唾液乳杆菌sa-03菌株对于提升前肢抓力表现的效果。图10中的a显示前肢抓力的绝对数值,由于抓力表现可能受到个别动物体重不同而影响,故本试验进一步计算各组相对抓力(相对抓力=前肢抓力/体重
×
100%)表现,其结果如图10中的b所示。图10中条状图上方的英文字母(a,b,c)相异者代表具有显著差异(p<
0.05)。由图10可知,相较于空白对照组,本发明的唾液乳杆菌sa-03菌株具有显著提升老鼠前肢抓力的效果,喂食1倍(1x)、2倍(2x)以及5倍(5x)剂量的本发明唾液乳杆菌sa-03菌株可分别有效增加15%、17%以及23%的前肢抓力。此外,根据趋势统计分析结果进一步显示,随着本发明唾液乳杆菌sa-03菌株的补充剂量的增加,其前肢抓力的提升效果具有显著的剂量效应(trend analysis,p<0.0001)。
[0097]
请参照图11,以说明补充本发明的唾液乳杆菌sa-03菌株对于提升小鼠负重游泳耐力表现的效果,条状图上方英文字母(a,b,c,d)相异者代表具有显著差异(p<0.05)。相较于空白对照组,喂食1x、2x以及5x剂量的本发明唾液乳杆菌sa-03菌株可分别有效增加63%、97%以及176%的负重游泳时间。此外,根据趋势统计分析结果进一步显示,补充1倍、2倍以及5倍剂量的本发明唾液乳杆菌sa-03菌株对于提升负重游泳力竭时间具有显著的剂量效应(trend analysis,p<0.0001)。
[0098]
请参照表3,以说明补充本发明的唾液乳杆菌sa-03菌株对于减少小鼠肌肉疲劳的效果,其中所有数值以mean
±
sd表示,且同一列数据上方英文字母(a,b,c,d)相异者代表具有显著差异(p<0.05)。由表3的结果可知,相较于空白对照组,补充本发明的唾液乳杆菌sa-03菌株1倍(1x)、2倍(2x)以及5倍(5x)剂量组可显著减少血液内的乳酸浓度产生率。而趋势统计分析结果(trend analysis,p<0.0001)也显示,随着本发明的唾液乳杆菌sa-03菌株补充剂量的增加具有明显降低游泳后血乳酸浓度的效果,亦即具有剂量效应。因此,补充本发明的唾液乳杆菌sa-03菌株可显著降低运动后血乳酸浓度升高的效果。
[0099]
表3补充本发明的sa-03菌株对血乳酸浓度的升高与消除比值的影响
[0100][0101][0102]
请参照图12中的a,说明各组小鼠单次90分钟不负重游泳后休息60分钟的血尿素氮的浓度变化,其中条状图上方的英文字母(a,b,c)相异者代表具有显著差异(p<0.05)。空白对照组、补充1倍(1x)、2倍(2x)以及5倍(5x)本发明的唾液乳杆菌sa-03菌株剂量组的血尿素氮浓度依序为35.5
±
4.5、35.3
±
3.9、31.8
±
4.0、29.8
±
3.4(mg/dl)。相较于空白对照组,2倍(2x)与5倍(2x)剂量组的血尿素氮浓度,分别显著减少10.61%(p=0.0416)以及16.16%(p=0.0027)。而趋势统计分析结果也显示,随着本发明的唾液乳杆菌sa-03菌株补充剂量的增加具有明显降低血尿素氮浓度的效果(trend analysis,p<0.0001),亦即具有剂量效应。
[0103]
请参照图12中的b,说明各组小鼠单次90分钟不负重游泳后休息60分钟的血中肌酸激酶活性的变化,其中条状图上方的英文字母(a,b,c)相异者代表具有显著差异(p<
0.05)。相较于空白对照组,补充1倍(1x)、2倍(2x)以及5倍(5x)本发明的唾液乳杆菌sa-03菌株剂量组的血中肌酸激酶活性分别显著降低16.50%(p=0.0019),25.94%(p<0.0001)and 43.14%(p<0.0001)。趋势统计分析结果也显示,随着本发明的唾液乳杆菌sa-03菌株补充剂量的增加具有显著降低血中肌酸激酶活性的效果(trend analysis,p<0.0001)。由上述试验可知道补充本发明的唾液乳杆菌sa-03菌株可以减少肌肉疲劳、增加肌力与体能。
[0104]
请参照图13,以说明补充本发明的唾液乳杆菌sa-03菌株对于增加体内组织中肝醣含量的效果,其中条状图上方的英文字母(a,b,c)相异者代表具有显著差异(p<0.05)。于实验末最后一次喂食结束30分钟后,将4组小鼠予以牺牲。取肝脏与腿部肌肉组织进行肝醣含量的分析。首先,在肝脏部位的肝醣含量的试验结果如图13中的a所示,空白对照组、补充1倍(1x)、2倍(2x)以及5倍(5x)本发明的唾液乳杆菌sa-03菌株剂量组的肝脏部位肝醣含量依序为26.32
±
3.14、29.33
±
5.83、31.35
±
3.82、36.69
±
3.69(mg/g肝脏)。相较于空白对照组,补充2倍(2x)与5倍(5x)剂量组的肝脏肝醣含量依序显著提升1.19倍(p=0.0120)及1.39倍(p<0.0001)。另外,在腿部肌肉的肝醣含量的试验结果如图13中的b所示,空白对照组、补充1倍(1x)、2倍(2x)以及5倍(5x)本发明的唾液乳杆菌sa-03菌株剂量组的肌肉肝醣含量依序为1.58
±
0.24、2.00
±
0.33、1.99
±
0.41、2.19
±
0.32(mg/g肌肉)。相较于空白对照组,补充1倍(1x)、2倍(2x)与5倍(5x)剂量组的肌肉肝醣含量依序显著提升1.26倍(p=0.0084)、1.26倍(p<0.0098)及1.38倍(p=0.0002)。根据趋势统计分析结果进一步显示,随着本发明的唾液乳杆菌sa-03菌株补充剂量的增加,其肝醣含量的提升效果也是同样具有显著的剂量效应(trend analysis,p<0.0001)。
[0105]
需注意的是,乳酸菌对身体健康的功能在于菌株(strain)的特异性,而非菌种(species),此种对于人身体健康有特殊功效的菌株称为功能性益生菌(guidelines for the evaluation of probiotics in food;report of joint fao/who working group on drafting guidelines for the evaluation of probiotics in food;london ontario,canada april30and may 1,2002:1-7)。举例而言,根据ren等人2019年在food and agricultural immunology所发表的一篇论文(2019,vol.30,no.1,281-295),文中发现唾液乳杆菌(l.salivarius)cicc 23174菌株可以诱发th1反应,达到调节免疫的效果。但本发明的唾液乳杆菌sa-03菌株则是会诱发treg细胞产生细胞激素il-10,进而抑制th1和th2免疫反应达到缓解过敏及气喘症状的效果。因此,本发明的唾液乳杆菌sa-03菌株具有其独特性。
[0106]
综合上述,本发明的唾液乳杆菌sa-03菌株具有抗氧化、口腔保健、调节免疫以及促进运动的生理活性效果,因此,本发明的唾液乳杆菌sa-03菌株可作为上述生理活性的用途,并以食品组合物或医药组合物的形式存在。
[0107]
以上所述的实施例仅是为说明本发明的技术思想及特点,其目的在使熟习此项技艺的人士能够了解本发明的内容并据以实施,当不能以之限定本发明的专利范围,即大凡依本发明所揭示的精神所作的均等变化或修饰,仍应涵盖在本发明的专利范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1