紫杉叶素在抑制毛发生长的用途的制作方法
[0001]
本发明主要涉及包含紫杉叶素的药物组合物在治疗和促进个体毛发生长的用途。
背景技术:
[0002]
毛发是毛囊中毛囊干细胞和真皮乳头生长发育的产物,毛囊结构复杂,由多层细胞组成,并呈周期性生长,分为生长期、退行期、休止期。随着社会的发展科技的进步,女性在夏季为腋下、手臂等部位脱毛越来越常见。由于毛囊呈周期性生长的特性及毛囊干细胞的存在,使得脱毛问题十分棘手。
[0003]
目前针对脱毛的常用办法和手段,有刮毛器脱毛、镊子拔毛、蜜蜡脱毛、脱毛膏脱毛,还有光子脱毛、激光脱毛、半导体激光脱毛等,使用最广泛的是脱毛膏脱毛,并且目前尚无辅助脱毛的产品。刮毛器脱毛是最简单的脱毛方法。在家自行刮除,但刮除后只能维持数日。镊子拔除这种方法不能根本破坏毛发的生长中心,所以需要反复拔除,且疼痛感强烈。蜜蜡脱毛近似于镊子拔除,但化学合成的蜜蜡容易对皮肤造成刺激、损伤,且痛感明显。有糖尿病、静脉曲张、疣、皮肤破溃及炎症等人不宜使用该法。光子脱毛和激光脱毛的原理相同,都是通过毛干和毛囊中的黑色素吸收光子或激光发射来的高能量的光,将其转化成为热能,处于生长期的毛囊受热后的结构受损破坏,但由于精度不佳也存在灼伤皮肤的可能,并且由于毛囊的生长周期不一致,使得该法对处于休止期和退行期的毛囊效果不佳,且由于不能杀死毛囊干细胞仍然存在重新长出毛发的可能。近几年人们逐渐研发出温和不刺激的脱毛膏产品,局部擦拭后,其化学成分可使毛发腐蚀、溶解,继而脱去毛发。但是脱毛膏实际上是一种腐蚀剂,反复使用可能会对皮肤造成损伤,并不适合频繁使用。
技术实现要素:
[0004]
本发明的目的是提供紫杉叶素的用途,选择含合适较高浓度的紫杉叶素药物用于抑制个体毛发生长的用途,解决了脱毛后毛发复发快,脱毛不彻底的问题。
[0005]
为解决上述技术问题,本发明采用以下技术方案:紫杉叶素或其药学上可接受的盐或者包含所述紫杉叶素或其药学上可接受的盐的组合物在抑制个体毛发生长的用途,其中所述紫杉叶素的给药浓度为20~50mmol/l。
[0006]
作为优选方案,所述药物经过局部涂抹给药。
[0007]
作为优选方案,所述紫杉叶素的给药浓度为50mmol/l。
[0008]
本发明揭示了紫杉叶素在20~50mmol/l浓度下具有能够抑制脱毛膏脱毛后毛发的生长的用途,20~50mmol/l浓度的紫杉叶素通过抑制wnt/β-cetenin 信号通路,使下游β-catenin在核中的定位情况减少,延缓毛发的生长周期。
附图说明
[0009]
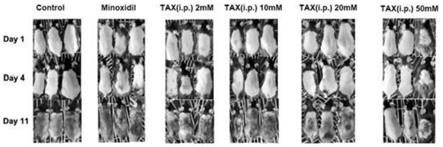
图1a为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的毛发生长情况图;
[0010]
图1b为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的的毛发生长密度统计图;
[0011]
图2a为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的皮肤组织he染色后毛囊形态结构变化对比图;
[0012]
图2b为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的皮肤组织毛囊生长情况统计图;
[0013]
图3a为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的皮肤组织β-catenin核定位情况图;
[0014]
图3b为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的皮肤组织β-catenin核定位统计图;
[0015]
图4a为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的皮肤组织ki-67核定位情况图;
[0016]
图4b为本发明实施例中小鼠上涂抹不同浓度tax和空白对比例的皮肤组织ki-67核定位统计图;
[0017]
图5a为本发明实施例中小鼠上涂抹/不涂抹50mm tax后毛发的生长对照图;
[0018]
图5b为本发明实施例中小鼠上涂抹/不涂抹50mm tax后毛发的生长密度统计图;
[0019]
图6为本发明实施例中小鼠涂抹/不涂抹tax后rna-seq结果分析的 wnt/β-catenin通路差异表达基因对比热图。
[0020]
具体实施方式
[0021]
下面结合附图和具体实施例,进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。
[0022]
除非另外指明,本申请中所有术语均具有本领域技术人员通常所理解含义。本申请所述的包含所述紫杉叶素或其药学上可接受的盐的组合物为紫杉叶素和/ 或其药学上可接受的盐与药学上可接受的载体一起配制成药学上可接受的剂型,包括注射剂、口服液、胶囊、片剂或颗粒剂。
[0023]
所述“药学上可接受的载体”是指不干扰活性成分的生物活性有效性的载体,可以为固体或液体,包括药学上可接受的赋形剂、缓冲剂、乳化剂、稳定剂、防腐剂、稀释剂、封装剂等。例如缓冲剂为磷酸盐、醋酸盐、硼酸盐或碳酸盐等。本申请药物组合物可以采用常规的混合、溶解、制粒、制锭、研磨、乳化、包装、捕获或冻干方法制备。
[0024]
紫杉叶素dihydroqurcetin,又称taxifolin,简称为tax,分子量大小为304.25,易溶于热水。
[0025]
本申请紫杉叶素组药物(tax组)配制:称取0.628gtax并加入10ml 的去离子水,拟配制2mmol/l浓度的工作液;称取3.14gtax并加入10ml 的去离子水,拟配制10mmol/l浓度的工作液;称取6.28mgdhq并加入10ml 的去离子水,拟配制20mmol/l浓度的工作液;称取15.7mgdhq并加入10ml 的去离子水,拟配制50mmol/l浓度的工作液。然后将液体70℃水浴加热充分溶解混匀转移到新的ep管中,分装成1m/ep管,-20℃冰箱保存。将液体70℃水浴加
热充分溶解混匀转移到新的ep管中,分装成1m/ep管,-20℃冰箱保存。
[0026]
minoxidil组配制:称取米诺地尔200mg并加入2.5ml的1,2-丙二醇,再加入7.5ml无水乙醇,配置成2%的米诺地尔工作液,备用。
[0027]
空白对照组(control组):生理盐水。
[0028]
本申请实施例药理学试验方法和试验结果:
[0029] (1)c57/bl6小鼠药理实验:将30只c57/bl6小鼠植物脱毛膏脱毛处理后随机平均分为4组,并对4组按照以下方式处理:
[0030]
a组,小鼠背部涂布生理盐水0.2ml;
[0031]
b组,小鼠背部涂布2%米诺地尔0.2ml。
[0032]
c组,小鼠背部涂布2mm tax 0.2ml;
[0033]
d组,小鼠背部涂布10mm tax 0.2ml;
[0034]
e组,小鼠背部涂布20mm tax 0.2ml;
[0035]
f组,小鼠背部涂布50mm tax 0.2ml。
[0036]
连续给药14天,并每隔一段时间对实验小鼠进行拍摄,肉眼观察药物涂抹部位毛发生长情况,对比不同组别的作用效果。
[0037]
通过图1a和1b显示结果可知:发现4天时2mmtax涂抹组与米诺地尔涂抹组有黑色素沉积,11天时米诺地尔组与10mmtax组生长旺盛,通过image j软件进行光密度分析,与control组相比,米诺地尔组与10mmtax 组光密度值更大,差异具有统计学意义(p<0.05)。tax 20mm和50mm 涂抹组毛发生长受到抑制,且抑制程度随着tax剂量加大而增大。通过 image j软件处理11天时毛发生长直观图得到毛发光密度值,与control组相比,tax 20mm和50mm涂抹组毛发光密度值更低,其中50mm涂抹组光密度值最低,差异具有统计学意义(p<0.05)。
[0038] (2)he染色:取各组小鼠皮肤组织,石蜡切片,常规苏木精-伊红染色,观察比较毛囊形态结构的变化。将烘烤后的组织切片依次侵入二甲苯i,二甲苯 ii进行脱蜡各10min,脱蜡后的组织切片依次浸入无水乙醇i、无水乙醇ii、 95%酒精、80%酒精、70%酒精中各2min,pbs冲洗2次,每次5min。苏木素染色3min,自来水冲洗3min,1%盐酸酒精分色2s,自来水冲洗2min,依次浸入50%、70%、80%的酒精中各2min,伊红浸泡5s,自来水冲洗3min。再将组织切片依次侵入95%酒精、无水乙醇i、无水乙醇ii中各3min,最后再依次侵入二甲苯i,二甲苯ii各5min。中性树胶封片,镜检。分别于200
×
、 400
×
镜下拍照。
[0039]
通过图2a和2b显示可知:不同组别的小鼠的毛囊生长情况不同。在给药后11天取皮,包埋切片,进行he染色,发现10mm tax组的毛囊数目最多,米诺地尔组其次,与control组相比,10mm tax组与米诺地尔组能够促进毛囊生长,毛发生长受到促进,差异具有统计学意义(p<0.05)。与control组的毛囊数相比,tax 20mm和50mm涂抹组毛囊数目较少,差异具有统计学意义(p<0.05)。tax 20mm和50mm涂抹组毛囊形成受到抑制,且抑制程度随着tax剂量加大而增大,50mm tax涂抹的抑制效果最好。
[0040] (3)β-catenin免疫组织化学染色:取各组小鼠皮肤组织,石蜡切片,常规免疫组化染色,观察比较毛囊部位β-catenin的累积。将标本蜡块装在切片机上,切成5μm的薄片,然后把切片放在温水皿中展开。将展开的组织切片移到载玻片上,放在60℃温箱中2h,烘干。将切片架分别浸于i级和ii级二甲苯中脱蜡各15min。取出切片,依次浸入95%、85%、
75%乙醇各1min。取出切片,浸泡在pbs中5min
×
3次。取出切片,置于抗原修复液中,高温低火修复10min。取出切片,浸泡在pbs中5min
×
3次。每张切片用吸水纸擦干,免疫组化笔在组织周围画圈,防止滴加液体时外溢。滴加山羊血清至完全覆盖组织,湿盒内室温 15min。一抗用pbs按1:200稀释,滴加至完全覆盖组织,湿盒内4℃过夜。取出切片,摆放在切片架上,浸泡在pbs中5min
×
3次。滴加荧光二抗,用pbs 1:200 稀释(以下操作注意避光),滴加至完全覆盖组织,室温孵育60min。取出切片,摆放在切片架上,浸泡在pbs中5min
×
3次。擦干周围液体,滴加dapi至完全覆盖组织以复染核。摆放在切片架上,浸泡在pbs中5min
×
3次。依次取出切片,擦干周围液体,滴加抗荧光淬灭剂,盖玻片封片。于荧光显微镜下观察染色效果。分别于200
×
、400
×
镜下拍照。
[0041]
通过图3a和3b显示可知:不同组别的小鼠的毛囊中β-catenin的核聚集程度不同。在给药后11天取皮,包埋切片,进行免疫组化染色,发现与control 组相比,10mmtax组与米诺地尔组的β-catenin的核定位情况最多,差异具有统计学意义(p<0.05)。与control组相比,20mmtax涂抹组和50mmtax 涂抹组β-catenin的核定位情况减少,差异具有统计学意义(p<0.05); 50mmtax涂抹组β-catenin的核定位情况最少,差异具有统计学意义(p<0.05)。
[0042] (4)ki-67免疫组织化学染色:取各组小鼠皮肤组织,石蜡切片,常规免疫组化染色,观察比较毛囊部位ki-67的累积。将标本蜡块装在切片机上,切成5μm 的薄片,然后把切片放在温水皿中展开。将展开的组织切片移到载玻片上,放在 60℃温箱中2h,烘干。将切片架分别浸于i级和ii级二甲苯中脱蜡各15min。取出切片,依次浸入95%、85%、75%乙醇各1min。取出切片,浸泡在pbs中5min
×
3 次。取出切片,置于抗原修复液中,高温低火修复10min。取出切片,浸泡在 pbs中5min
×
3次。每张切片用吸水纸擦干,免疫组化笔在组织周围画圈,防止滴加液体时外溢。滴加山羊血清至完全覆盖组织,湿盒内室温15min。一抗用 pbs按1:200稀释,滴加至完全覆盖组织,湿盒内4℃过夜。取出切片,摆放在切片架上,浸泡在pbs中5min
×
3次。滴加荧光二抗,用pbs 1:200稀释(以下操作注意避光),滴加至完全覆盖组织,室温孵育60min。取出切片,摆放在切片架上,浸泡在pbs中5min
×
3次。擦干周围液体,滴加dapi至完全覆盖组织以复染核。摆放在切片架上,浸泡在pbs中5min
×
3次。依次取出切片,擦干周围液体,滴加抗荧光淬灭剂,盖玻片封片。于荧光显微镜下观察染色效果。分别于200
×
、400
×
镜下拍照。
[0043]
通过图4a和4b显示可知:不同组别的小鼠的毛囊中ki-67的阳性表达程度不同。在给药后11天取皮,包埋切片,进行免疫组化染色,发现与control 组相比,10mm tax组阳性表达细胞数目更多,差异具有统计学意义(p<0.05)。2%米诺地尔涂抹组尽管较control组表达略有增加,但差异不具有统计学意义(p>0.05)。与control组相比,20mmtax涂抹组和 50mmtax涂抹组ki-67阳性表达较少,50mmtax涂抹组ki-67的阳性表达最少,差异具有统计学意义(p<0.05)。
[0044] (5)验证性c57/bl6小鼠药理实验:将4只c57/bl6小鼠植物脱毛膏脱毛处理后随机平均分为2组,并对2组按照以下方式处理:
[0045]
a组,小鼠背部涂布生理盐水0.2ml;
[0046]
b组,小鼠背部涂布50mm tax 0.2ml。
[0047]
连续给药14天,14后对实验小鼠进行拍摄,观察药物涂抹部位毛发生长情况,对比不同组别的作用效果,并利用image j软件对毛发的光密度值进行分析。
[0048]
通过图5a和5b显示结果可知:与control组相比,tax 50mm涂抹组毛发光密度值更低,差异具有统计学意义(p<0.05)。
[0049] (6)rna-seq结果分析:培养5
×
105个细胞/样,提取total rna,经过纯化、建库之后,采用第二代测序技术基于illumina测序平台,对这些小鼠真核基因文库文库进行双末端测序。通过测序获得raw data后过滤,将过滤后得到的高质量序列(clean data)比对到该物种的参考基因组上。根据比对结果,计算每个基因的表达量。在此基础上,进一步对样品进行表达差异分析。筛选策略为foldchange>1,p<0.01,false discovery rate(fdr)<0.01,富集差异基因至 wnt/β-catenin通路,wnt/β-catenin通路下差异基因的详细注释见表1。表1为wnt/β-catenin通路差异表达基因注释。
[0050]
如图6所示结果:通过rna-seq数据,利用r软件对其处理绘图,发现加药后,5个基因下调,21个基因上调。其中较为关键的节点分子apc2以及tcf7l2 均有明显的表达差异。tcf7l2作为β-catenin入核后结合的重要核转录因子在加药后明显下调,使得wnt/β-catenin信号无法继续调节下游靶基因如c-myc的表达,从而抑制毛发生长。apc2作为β-catenin降解复合物的一员,在加药后表达上调,说明是通过tax通过促进apc2的表达从而使得β-catenin的表达减少。
[0051]
wnt/β-catenin信号通路在调节毛囊生长周期过程中起着十分关键的作用,β-cetenin在细胞核中的累积可诱导毛囊干细胞增殖分化。本发明发现,通过抑制β-cetenin在毛囊干细胞中的累积可在确保身体健康的前提下,延缓毛囊生长周期,辅助脱毛膏产生更好的脱毛效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1