一种羟氯喹脂质体吸入剂及其制备方法与流程
1.本发明属于医药制剂领域,具体涉及一种羟氯喹脂质体吸入剂及其制备方法。
背景技术:
2.羟氯喹口服治疗的主要问题可能是严重的副作用和毒性,这主要是药物 在肺泡靶细胞上的蓄积浓度不一致导致的,具体取决于肠道吸收,肝首过代谢等。 通过将其制备成吸入剂,可以将药物靶向地作用于患者的肺部,从而起到减少给 药剂量、进而达到降低全身性不良反应、提高患者依从性的目的。
[0003][0004]
羟氯喹是一种结晶性粉末,味苦。药物的苦味等不良嗅味是提高患者用药依从性的重要制约因素,合适有效的掩味方法能够改善患者依从性,增加疗效,提高药品的临床价值。目前已有的掩味方法包括:1.添加甜味剂、矫味剂等,混淆大脑味觉;2.包衣、微囊化等,形成物理屏障,阻止药物与味蕾接触;3.制粒、固体分散体等,改变药物释放行为,延缓药物释放4.苦味阻滞剂,竞争苦味受体5.形成复合物,延缓释放。许多药物及赋形剂还会引起喉咙刺激,特别是刺激咳嗽反射。
[0005]
脂质体包封药物可以掩盖药物的不良、减少局部刺激,并通过缓释增加治疗效果。脂质体的组成成分是生物相容和可生物可降解的,且脂质体对肺组织的安全性已经在动物以及志愿者的体内外进行了广泛的研究,因此安全性可以得到保证。早期研究表明吸入由大豆磷脂制成的脂质体不会引起肺组织和肺泡巨噬细胞的病理学改变或组织学改变。采用肺部给药途径,将羟氯喹脂质体递送到肺部组织,浓集于肺部炎症部位,增加药物的局部浓度;脂质体可以延长羟氯喹在“深肺”中的滞留,减少在其他组织中的蓄积,从而增加其治疗效果,降低全身副作用。这表明了氢氯喹肺部给药对于提高患者依从性的基本适用性。
[0006]
目前的羟氯喹上市制剂仅有口服制剂,包括片剂、口服混悬剂、口服液,均为经胃肠道给药方式。该给药方式不仅吸收慢,无法直达病灶,还会使药物随血液循环蓄积于非病灶部位,进而导致不良反应的发生。
技术实现要素:
[0007]
本发明制备了一种用于肺部给药的羟氯喹脂质体吸入剂,该制剂的最终给药形式为气雾剂,冻干后的脂质体使用适宜的溶剂(如生理盐水)复溶,经雾化器口鼻吸入给药,药物随着患者呼吸浓集于肺部发挥局部或全身治疗效果。脂质体肺部给药能够提高病灶部位的药物浓度、减少不良反应的发生;同时药物包裹于脂质体内,有效减少不良味觉刺激和或咳嗽刺激。
[0008]
本发明中使用的赋形剂及其制剂形式延缓了活性药物溶解及释放速率,从而使得苦味受体活化和咽喉部感受器水平不超过感知阈值。
[0009]
羟氯喹分布于脾、肾、肺、心和肝脏等组织,皮肤和眼等含黑色素的组织对其有特殊亲和力,由此导致药物的不良反应。本发明的目的是通过肺部给药减少药物在其他组织
器官的蓄积,从而改善药物对上述组织器官的不良反应;同时,脂质体吸入给药减少苦味等不良味道及使刺激咳嗽反射的趋势最小化。解决策略包括包裹于脂质体内或使用能够产生缓释作用的聚合物微球或纳米球等,之前所述其他方法也能够达到这一目的。
[0010]
本发明的羟氯喹脂质体吸入剂包括:羟氯喹、磷脂和胆固醇,所述羟氯喹脂质体吸入剂的给药形式为气雾剂。
[0011]
进一步的,所述羟氯喹与磷脂的质量比为1:5-1:15。
[0012]
进一步的,所述磷脂和胆固醇的质量比为1:1-6:1。
[0013]
进一步的,所述磷脂包括天然磷脂和合成磷脂,所述天然磷脂选自卵磷脂、大豆磷脂或蛋黄卵磷脂中的任一种。所述合成磷脂选自二棕榈酰磷脂酰胆碱、二棕榈酰磷脂酰乙醇胺、二硬脂酰磷脂酰胆碱中的任一种。
[0014]
一种制备羟氯喹脂质体吸入剂的方法,包括如下步骤:(1)称取适量磷脂和胆固醇于反应器中,加入有机溶剂溶解,减压蒸馏,待有机溶剂蒸干后,向反应器中加入的硫酸铵溶液,溶解搅拌后,使用0.22μm滤膜过滤。
[0015]
(2)将步骤1中的液体转入透析袋中,置于的1-10% 葡萄糖溶液中,在37℃
±
0.5℃、100 rpm/min的空气浴振荡器中透析。
[0016]
(3)透析结束后倒出透析袋中的液体,向其中加入适量的羟氯喹,在40-60℃水浴条件下孵育40-80 min,即得羟氯喹脂质体液体制剂。
[0017]
(4)将步骤3中制得的羟氯喹脂质体液体制剂进行分装并密封,置于
-ꢀ
80℃冰冻24 h。冻干操作前,揭开盖子用保鲜膜封口并扎孔;冻干操作时,先按照机器提示进行预冻,预冻结束后将物料均匀放在隔板或干燥盘上进行真空干燥,干燥时间为24-72 h。冷冻干燥结束后,加入保护气体氮气,即得羟氯喹脂质体吸入剂。进一步的,所述步骤(1)中的有机溶剂为:乙醇、乙酸乙酯、氯仿中的任一种。
[0018]
进一步的,所述步骤(1)中的硫酸铵溶液的浓度为100-300mmol/l.羟氯喹脂质体吸入剂应用于新型冠状病毒导致的肺炎。
[0019]
本发明具有以下有益效果:本发明是将羟氯喹制备成脂质体制剂,药物包裹于脂质体中即能够减少不良的味觉刺激,患者的顺应性提高,羟氯喹肺部给药方式针对于肺炎能够使药物直接到达肺部发挥药效,从而提高药物疗效,减少不良反应的发生。
[0020]
本发明的最终制剂形式为冻干品并用氮气填充,能够避免脂质体制剂在储存、运输过程中的不稳定现象,制剂的稳定性提高。
[0021]
本发明作为羟氯喹的一种新剂型,弥补了制剂上的空白,让针对不同疾病用药的患者有了更好的选择。
附图说明
[0022]
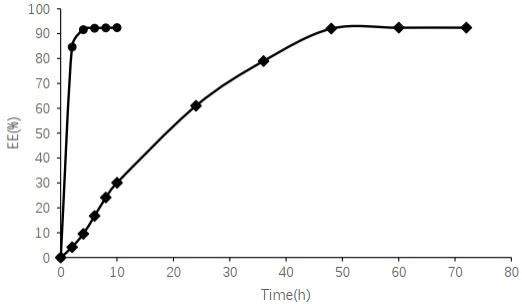
图1为实施例1羟氯喹脂质体的体外释放曲线。
具体实施方式
[0023]
以下通过实施例进一步说明本发明,但不作为对本发明的限制。
[0024]
实施例1:一种羟氯喹脂质体吸入剂的其制备方法
(1)按照质量比为4:1的比例称取适量磷脂和胆固醇于茄形瓶中,加入10ml乙醇并超声使其完全溶解。将茄形瓶安装在旋转蒸发仪上,在40℃条件下挥干有机溶剂。待乙醇完全挥发,向茄形瓶中加入5ml的硫酸铵溶液(200 mmol/l),40℃水化40min,充分水合后超声5 min,使用0.22μm滤膜过滤。
[0025]
(2)将步骤1中的液体转入透析袋中,置于250 ml的1% 葡萄糖溶液中,在37℃、100 rpm/min的空气浴振荡器中透析,每隔1 h更换一次透析介质,整个透析过程中需更换6次透析介质。
[0026]
(3)透析结束后倒出透析袋中的液体,向其中加入适量的羟氯喹,在40℃水浴条件下孵育40 min,即得羟氯喹脂质体液体制剂。
[0027]
(4)将步骤3中制得的羟氯喹脂质体液体制剂进行分装并密封,置于-80℃冰冻24 h。冻干操作前,揭开盖子用保鲜膜封口并扎孔;冻干操作时,先按照机器提示进行预冻,预冻结束后将物料均匀放在隔板或干燥盘上进行真空干燥,干燥时间为48 h。冷冻干燥结束后,加入保护气体氮气,即得羟氯喹脂质体吸入剂。
[0028]
实施例2. 羟氯喹脂质体冻干粉的制备(1)按照质量比为4:1的比例称取适量磷脂和胆固醇共100mg于茄形瓶中,加入10ml乙醇并超声使其完全溶解。将茄形瓶安装在旋转蒸发仪上,在40℃条件下挥干有机溶剂。待乙醇完全挥发,向茄形瓶中加入5ml的硫酸铵溶液(300 mmol/l),40℃水化40min,充分水合后超声5 min,使用0.22μm滤膜过滤。
[0029]
(2)将步骤1中的液体转入透析袋中,置于250 ml的1% 葡萄糖溶液中,在37℃、100 rpm/min的空气浴振荡器中透析,每隔1 h更换一次透析介质,整个透析过程中需更换6次透析介质。
[0030]
(3)透析结束后倒出透析袋中的液体,向其中加入8mg的羟氯喹,在40℃水浴条件下孵育40 min,即得羟氯喹脂质体液体制剂。
[0031]
(4)将步骤3中制得的羟氯喹脂质体液体制剂进行分装并密封,置于
-ꢀ
80℃冰冻24 h。冻干操作前,揭开盖子用保鲜膜封口并扎孔;冻干操作时,先按照机器提示进行预冻,预冻结束后将物料均匀放在隔板或干燥盘上进行真空干燥,干燥时间为48 h。冷冻干燥结束后,加入保护气体氮气,即得羟氯喹脂质体吸入剂。
[0032]
实施例3. 羟氯喹脂质体冻干粉的制备(1)按照质量比为5:1的比例称取适量磷脂和胆固醇共100mg于茄形瓶中,加入10ml乙醇并超声使其完全溶解。将茄形瓶安装在旋转蒸发仪上,在40℃条件下挥干有机溶剂。待乙醇完全挥发,向茄形瓶中加入5ml的硫酸铵溶液(400 mmol/l),40℃水化40min,充分水合后超声5 min,使用0.22μm滤膜过滤。
[0033]
(2)将步骤1中的液体转入透析袋中,置于250 ml的1% 葡萄糖溶液中,在37℃、100 rpm/min的空气浴振荡器中透析,每隔1 h更换一次透析介质,整个透析过程中需更换6次透析介质。
[0034]
(3)透析结束后倒出透析袋中的液体,向其中加入6.67mg的羟氯喹,在40℃水浴条件下孵育40 min,即得羟氯喹脂质体液体制剂。
[0035]
(4)将步骤3中制得的羟氯喹脂质体液体制剂进行分装并密封,置于
-ꢀ
80℃冰冻24 h。冻干操作前,揭开盖子用保鲜膜封口并扎孔;冻干操作时,先按照机器提示进行预冻,预
冻结束后将物料均匀放在隔板或干燥盘上进行真空干燥,干燥时间为48 h。冷冻干燥结束后,加入保护气体氮气,即得羟氯喹脂质体吸入剂。
[0036]
实施例4. 羟氯喹脂质体冻干粉的制备(1)按照质量比为4:1的比例称取适量磷脂和胆固醇共100mg于茄形瓶中,加入10ml乙醇并超声使其完全溶解。将茄形瓶安装在旋转蒸发仪上,在40℃条件下挥干有机溶剂。待乙醇完全挥发,向茄形瓶中加入5ml的硫酸铵溶液(200 mmol/l),40℃水化40min,充分水合后超声5 min,使用0.22μm滤膜过滤。
[0037]
(2)将步骤1中的液体转入透析袋中,置于250 ml的1% 葡萄糖溶液中,在37℃、100 rpm/min的空气浴振荡器中透析,每隔1 h更换一次透析介质,整个透析过程中需更换6次透析介质。
[0038]
(3)透析结束后倒出透析袋中的液体,向其中加入10.67mg的羟氯喹,在40℃水浴条件下孵育40 min,即得羟氯喹脂质体液体制剂。
[0039]
(4)将步骤3中制得的羟氯喹脂质体液体制剂进行分装并密封,置于
-ꢀ
80℃冰冻24 h。冻干操作前,揭开盖子用保鲜膜封口并扎孔;冻干操作时,先按照机器提示进行预冻,预冻结束后将物料均匀放在隔板或干燥盘上进行真空干燥,干燥时间为48 h。冷冻干燥结束后,加入保护气体氮气,即得羟氯喹脂质体吸入剂。
[0040]
实施例5:形态观察将制备的羟氯喹脂质体溶液滴1滴于铜网(覆有支撑膜)上,固定2
ꢀ-ꢀ
3 min后吸干铜网边缘的多余液体,用1%的磷钨酸液进行染色,2
ꢀ-ꢀ
3 min后吸干多余染色液,自然干燥,置于透射电子显微镜下观察羟氯喹脂质体的外观形态。结果为实施例1制得的羟氯喹脂质体吸入剂的粒径为130
±
15nm,所制备的羟氯喹脂质体外观呈球形或类球形。
[0041]
实施例6.:粒径及粒径分布将制备的羟氯喹脂质体溶液用适量蒸馏水稀释,采用用马尔文激光粒径分析仪对其进行测定,实施例1制得的羟氯喹脂质体吸入剂的粒径分布小于200nm且粒径分布较均匀,纳米粒的稳定性良好。
[0042]
实施例7:包封率(ee)的测定采用超滤离心法分离游离药物和脂质体,测定并计算羟氯喹脂质体中药物的ee和dl。具体操作如下:精密吸取羟氯喹脂质体适量置于超滤管中,于4℃、14000r/min条件下离心30min,取一定量离心后溶液稀释后过0.45μm滤膜,取续滤液进液相进行分析,测定并计算出游离药物的含量(w
游离
);hplc测定原稀释样品浓度,计算样品中药物的总含量(w
总
);w
药
为包载于羟氯喹脂质体中羟氯喹的量;将结果带入公式(1)计算ee;带入公式(2)计算dl。
[0043]
ee(%)=(w
总
ꢀ-ꢀw游离
)/ w
总
ꢀ×ꢀ
100%
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)结果:实施例1制备得到的羟氯喹脂质体的包封率在93.12
±
0.67%以上。
[0044]
实施例8:体外释放试验选用动态透析法进行测定,选取ph 5.5的pbs溶液作为释放介质,考察羟氯喹脂质体的体外释放特征。吸取一定量羟氯喹脂质体放置于透析袋中,密封后置于释放介质中,37
±
5℃、100r/min条件下,在振荡仪中进行体外释放实验。
[0045]
结果:见图1,由图可知和羟氯喹溶液4小时即达到释放平台期相比,羟氯喹脂质体在48小时内平稳释放,于48小时达到释放平台期,累积释放度为92.41%。表明羟氯喹脂质体
制剂能够产生一定的缓释效果。
[0046]
综上所述,本发明是将羟氯喹制备成脂质体制剂,药物包裹于脂质体中即能够减少不良的味觉刺激,患者的顺应性提高,羟氯喹肺部给药方式针对于肺炎能够使药物直接到达肺部发挥药效,从而提高药物疗效,减少不良反应的发生。
[0047]
本发明的最终制剂形式为冻干品并用氮气填充,能够避免脂质体制剂在储存、运输过程中的不稳定现象,制剂的稳定性提高。
[0048]
本发明作为羟氯喹的一种新剂型,弥补了制剂上的空白,让针对不同疾病用药的患者有了更好的选择。
[0049]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1