无细胞脂肪提取液对骨髓抑制的治疗用途的制作方法
1.本发明涉及药物领域,具体涉及无细胞脂肪提取液对骨髓抑制的治疗用途。
背景技术:
2.骨髓抑制是指骨髓中的血细胞前体的活性下降,血流里的血细胞寿命短,常常需要不断补充。为了达到及时补充的目的,作为血细胞前体的干细胞必须快速分裂。
3.化学治疗(chemotherapy)和放射治疗(radiation)、以及许多其它抗肿瘤治疗方法,都是针对快速分裂的细胞,因而常常导致正常骨髓细胞受到抑制。骨髓抑制是肿瘤治疗常见毒性反应,肿瘤治疗如化学治疗和放射治疗均可引起有不同程度的骨髓抑制,使周围血细胞数量减少,血细胞由多种成分组成,每一种成分都对人体起着不可缺少的作用,任何一种成分的减少都使机体产生相应的副反应。现有的临床抗癌治疗过程中,由于缺乏有效的治疗骨髓抑制的药物,导致抗肿瘤的骨髓抑制副作用得不到有效改善,从而增大了肿瘤患者的痛苦。
4.因此,本领域需要开发一种能够有效治疗骨髓抑制的药物。
技术实现要素:
5.本发明的目在于提供一种无细胞脂肪提取物在预防和/或治疗骨髓抑制、升高血细胞数量和预防或治疗血细胞减少症方面中的用途。
6.本发明第一方面,提供一种无细胞脂肪提取物的用途,用于制备组合物或制剂,所述组合物或制剂用于选自下组的一种或多种用途:(i)预防和/或治疗骨髓抑制;(ii)升高血细胞数量;和/或(iii)用于预防或治疗血细胞减少症。
7.在另一优选例中,所述的骨髓抑制包括抗肿瘤药物引起的骨髓抑制。
8.在另一优选例中,所述的骨髓抑制包括血细胞减少。
9.在另一优选例中,所述骨髓抑制的对象为肿瘤患者。
10.在另一优选例中,所述的血细胞选自下组:红细胞、白细胞、淋巴细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞,或其组合。
11.在另一优选例中,所述升高血细胞数量包括通过治疗骨髓抑制来升高血细胞数量。
12.在另一优选例中,所述“升高血细胞数量”指使得一对象的血液中血细胞数量上升。
13.在另一优选例中,所述的对象为血细胞数量下降的人。
14.在另一优选例中,所述的血细胞数量下降包括骨髓抑制引起的血细胞数量下降。
15.在另一优选例中,所述的“血细胞数量下降”指与正常人的血细胞数量的下限a0相比,所述对象的血细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
16.在另一优选例中,所述的“红细胞数量下降”指与正常人的红细胞数量的下限a0相
比,所述对象的红细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
17.在另一优选例中,所述的“白细胞数量下降”指与正常人的白细胞数量的下限a0相比,所述对象的白细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
18.在另一优选例中,所述的“淋巴细胞数量下降”指与正常人的淋巴细胞数量的下限a0相比,所述对象的淋巴细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
19.在另一优选例中,所述的“中性粒细胞数量下降”指与正常人的中性粒细胞数量的下限a0相比,所述对象的中性粒细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
20.在另一优选例中,所述的“嗜酸性粒细胞数量下降”指与正常人的嗜酸性粒细胞数量的下限a0相比,所述对象的嗜酸性粒细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
21.在另一优选例中,所述的“嗜碱性粒细胞数量下降”指与正常人的嗜碱性粒细胞数量的下限a0相比,所述对象的嗜碱性粒细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
22.在另一优选例中,所述“升高血细胞数量”指,与对照的血细胞数量c0相比,使得一对象的血液中血细胞数量c1增加。
23.在另一优选例中,所述的对照的血细胞数量c0为所述对象在用本发明无细胞脂肪提取物进行治疗或处理之前的血细胞数量czs;或者为对照组的血细胞数量cdz。
24.在另一优选例中,所述“升高血细胞数量”指c1/czs≥1.2,较佳地≥1.4,更佳地≥1.5或≥2.0。
25.在另一优选例中,所述“升高血细胞数量”指c1/cdz≥1.2,较佳地≥1.4,更佳地≥1.5或≥2.0。
26.在另一优选例中,所述预防或治疗血细胞减少症包括通过治疗骨髓抑制来预防或治疗血细胞减少症。
27.在另一优选例中,所述的血细胞减少症包括骨髓抑制引起的血细胞减少症。
28.在另一优选例中,所述的血细胞减少症包括抗肿瘤药物引起的血细胞减少症。
29.在另一优选例中,所述的血细胞减少症包括血细胞数量下降引起的疾病或症状。
30.在另一优选例中,所述血细胞减少症的对象为肿瘤患者。
31.在另一优选例中,所述的对象为肿瘤患者。
32.在另一优选例中,所述的对象为已经、正在、或将要接受抗肿瘤治疗的对象。
33.在另一优选例中,所述的抗肿瘤治疗包括:化疗、放疗、或其组合。
34.在另一优选例中,所述的化疗包括抗肿瘤药物治疗。
35.在另一优选例中,所述的抗肿瘤治疗包括抗肿瘤药物治疗。
36.在另一优选例中,所述的对象为人、或非人哺乳动物(如啮齿动物)。
37.在另一优选例中,所述的抗肿瘤药物为口服制剂、注射制剂或外用制剂。
38.在另一优选例中,所述的注射制剂为静脉注射剂、肌肉注射剂、皮下注射、腹腔注
射。
39.在另一优选例中,所述的抗肿瘤药物包括氮芥类抗肿瘤药物。
40.在另一优选例中,所述的抗肿瘤药物选自下组:环磷酰胺、磷酰胺氮芥、异环磷酰胺、美法仑、苯丁酸氮芥、苯达莫司汀、雌莫司汀,或其组合。在另一优选例中,所述的无细胞脂肪提取物为从人或非人哺乳动物中的脂肪中提取制备获得的无细胞脂肪提取物。
41.在另一优选例中,所述的非人哺乳动物为猴、猩猩、牛、猪、狗、羊、鼠或兔。
42.在另一优选例中,所述的组合物或制剂包括药物组合物或制剂、食品组合物或制剂、保健品组合物或制剂或膳食补充剂。
43.在另一优选例中,所述组合物或制剂中含有0.001-99wt%,较佳地0.1-90wt%,更佳地1-50wt%的无细胞脂肪提取物,按制剂或组合物的总重量计。
44.在另一优选例中,所述的组合物或制剂还包括药学上、食品上、保健品或膳食上可接受的载体。
45.在另一优选例中,所述的组合物或制剂的剂型为口服制剂、外用制剂或注射制剂。
46.在另一优选例中,所述的注射制剂为静脉注射剂或肌肉注射剂。
47.在另一优选例中,所述组合物或制剂的剂型为固体剂型、半固体剂型、或液体剂型,如溶液、凝胶、膏霜、乳液、膏剂、霜剂、糊剂、饼、粉剂、贴剂等。
48.在另一优选例中,所述组合物或制剂的剂型为粉剂、颗粒剂、胶囊剂、注射剂、酊剂、口服液、片剂或含片。
49.在另一优选例中,所述的组合物或制剂通过外用、局部、或皮下注射方式施用。
50.在另一优选例中,所述的组合物或制剂还包括其它(i)预防和/或治疗骨髓抑制;(ii)升高血细胞数量;和/或(iii)用于预防或治疗血细胞减少症的药物。
51.在另一优选例中,所述无细胞脂肪提取物不含有细胞且不含有脂滴。
52.在另一优选例中,所述脂滴为脂肪细胞破碎后释放的油滴。
53.在另一优选例中,所述“不含有脂滴”指所述无细胞脂肪提取物中,油滴体积占总液体百分比小于1%,优选地小于0.5%,更优选地小于0.1%。
54.在另一优选例中,所述细胞选自下组:内皮细胞、脂肪干细胞、巨噬血细胞、基质细胞。
55.在另一优选例中,所述“无细胞”指1ml无细胞脂肪提取物中的细胞平均数量≤1个,优选地≤0.5个,更佳地≤0.1个,或为0个。
56.在另一优选例中,所述无细胞脂肪提取物为天然获得的无添加成分的纳米脂肪提取物。
57.在另一优选例中,所述“无添加成分的”指除漂洗步骤外,在所述脂肪提取物的制备过程中未添加任何溶液、溶剂、小分子、化学制剂、和生物添加剂。
58.在另一优选例中,所述种无细胞脂肪提取物是通过将脂肪组织经过乳化后离心制备获得。
59.在另一优选例中,所述的无细胞脂肪提取物含有一种或多种选自下组的组分:igf-1、bdnf、gdnf、tgf-β1、hgf、bfgf、vegf、tgf-β1、pdgf、egf、nt-3、gh、g-csf,或其组合。
60.在另一优选例中,所述的种无细胞脂肪提取物含有但不限于一种或多种选自下组的组分:igf-1、bdnf、gdnf、bfgf、vegf、tgf-β1、hgf、pdgf,或其组合。
61.在另一优选例中,所述的无细胞脂肪提取物为无细胞脂肪提取液。
62.在另一优选例中,在所述的无细胞脂肪提取物中,所述的igf-1的浓度为5000-30000pg/ml,较佳地6000-20000pg/ml,更佳地7000-15000pg/ml,更佳地8000-12000pg/ml,更佳地9000-11000pg/ml,更佳地9500-10500pg/ml。
63.在另一优选例中,在所述的无细胞脂肪提取物中,所述的bdnf的浓度为800-5000pg/ml,较佳地1000-4000pg/ml,更佳地1200-2500pg/ml,更佳地1400-2000pg/ml,更佳地1600-2000pg/ml,更佳地1700-1850pg/ml。
64.在另一优选例中,在所述的无细胞脂肪提取物中,所述的gdnf的浓度为800-5000pg/ml,较佳地1000-4000pg/ml,更佳地1200-2500pg/ml,更佳地1400-2000pg/ml,更佳地1600-2000pg/ml,更佳地1700-1900pg/ml。
65.在另一优选例中,在所述的无细胞脂肪提取物中,所述的bfgf的浓度为50-600pg/ml,较佳地100-500pg/ml,更佳地120-400pg/ml,更佳地150-300pg/ml,更佳地200-280pg/ml,更佳地220-260pg/ml。
66.在另一优选例中,在所述的无细胞脂肪提取物中,所述的vegf的浓度为50-500pg/ml,较佳地100-400pg/ml,更佳地120-300pg/ml,更佳地150-250pg/ml,更佳地170-230pg/ml,更佳地190-210pg/ml。
67.在另一优选例中,在所述的无细胞脂肪提取物中,所述的tgf-β1的浓度为200-3000pg/ml,较佳地400-2000pg/ml,更佳地600-1500pg/ml,更佳地800-1200pg/ml,更佳地800-1100pg/ml,更佳地900-1000pg/ml。
68.在另一优选例中,在所述的无细胞脂肪提取物中,所述的hgf的浓度为200-3000pg/ml,较佳地400-2000pg/ml,更佳地600-1500pg/ml,更佳地600-1200pg/ml,更佳地800-1000pg/ml,更佳地850-950pg/ml。
69.在另一优选例中,在所述的无细胞脂肪提取物中,所述的pdgf的浓度为50-600pg/ml,较佳地80-400pg/ml,更佳地100-300pg/ml,更佳地140-220pg/ml,更佳地160-200pg/ml,更佳地170-190pg/ml。
70.在另一优选例中,所述的igf-1与vegf的重量比为20-100:1,较佳地30-70:1,更佳地40-60:1,最佳地45-55:1。
71.在另一优选例中,所述的bdnf与vegf的重量比为2-20:1,较佳地4-15:1,更佳地6-12:1,最佳地8-9.5:1。
72.在另一优选例中,所述的gdnf与vegf的重量比为2-20:1,较佳地4-15:1,更佳地6-12:1,最佳地8.5-9.5:1。
73.在另一优选例中,所述的bfgf与vegf的重量比为0.2-8:1,较佳地0.5-5:1,更佳地0.6-2:1,更佳地0.8-1.6:1,最佳地1-1.5:1。
74.在另一优选例中,所述的tgf-β1与vegf的重量比为1-20:1,较佳地1-15:1,更佳地1-10:1,更佳地2-8:1,更佳地4-6:1。
75.在另一优选例中,所述的hgf与vegf的重量比为1-20:1,较佳地1-15:1,更佳地1-10:1,更佳地2-8:1,更佳地4-5.5:1。
76.在另一优选例中,所述的pdgf与vegf的重量比为0.1-3:1,较佳地0.2-2:1,更佳地0.4-1.5:1,最佳地0.7-1.2:1。
77.在另一优选例中,所述的无细胞脂肪提取物通过以下方法制备:
78.(1)提供一脂肪组织原料,将所述脂肪组织原料破碎,并进行漂洗(如用生理盐水),从而获得经漂洗的脂肪组织;
79.(2)对所述经漂洗后的脂肪组织进行离心,获得分层的混合物;
80.(3)对所述分层的混合物,去除上层油层和下层水层,收集中间层(即含脂肪细胞的脂肪层);
81.(4)对所述中间层进行乳化,获得乳化的脂肪混合物(也称为纳米脂肪);
82.(5)将所述乳化的脂肪混合物通过离心处理,从而获得中间液体层,即为脂肪初提物;和
83.(6)对所述脂肪初提物进行过滤和除菌,从而获得无细胞的脂肪提取物。
84.本发明第二方面,提供一种制备无细胞脂肪提取物的方法,所述的方法包括步骤:
85.(1)提供一脂肪组织原料,将所述脂肪组织原料破碎,并进行漂洗(如用生理盐水),从而获得经漂洗的脂肪组织;
86.(2)对所述经漂洗后的脂肪组织进行离心,获得分层的混合物;
87.(3)对所述分层的混合物,去除上层油层和下层水层,收集中间层(即含脂肪细胞的脂肪层);
88.(4)对所述中间层进行乳化,获得乳化的脂肪混合物(也称为纳米脂肪);
89.(5)将所述乳化的脂肪混合物通过离心处理,从而获得中间液体层,即为脂肪初提物;和
90.(6)对所述脂肪初提物进行过滤和除菌,从而获得无细胞的脂肪提取物。
91.在另一优选例中,所述的无细胞脂肪提取物如本发明第一方面所述。
92.在另一优选例中,所述的步骤(2)中,所述离心在800-2500g下离心,较佳地800-2000g,更佳地1000-1500g,最佳地1100-1300g。
93.在另一优选例中,所述的步骤(2)中,所述离心的时间为1-15min,较佳地1-10min,更佳地1-8min,最佳地1-5min。
94.在另一优选例中,所述的离心的温度为2-6℃。
95.在另一优选例中,所述的步骤(4)中,所述的乳化为机械乳化。
96.在另一优选例中,所述机械乳化为经注射器反复吹打(如吹打20-200次,较佳地20-150次,更佳地20-100次,更佳地30-50次)进行机械乳化。
97.在另一优选例中,所述的吹打的方式为2个10ml注射针筒连接三通管反复匀速推打。
98.在另一优选例中,,所述的步骤(4)中,所述乳化为通过组织匀浆机打碎的方法。
99.在另一优选例中,所述的步骤(5)中,在将所述乳化的脂肪混合物通过离心处理前,还包括对所述乳化的脂肪混合物冷冻后解冻处理。
100.在另一优选例中,冷冻后解冻处理后,将解冻后的混合物用于离心。
101.在另一优选例中,所述的冷冻的温度为-50℃至-120℃,较佳地-60℃至-100℃,更佳地-70℃至-90℃。
102.在另一优选例中,所述的解冻的温度为20-40℃,较佳地25-40℃,更佳地37℃。
103.在另一优选例中,所述的冷冻后解冻的循环次数为1-5次(优选为1、2、3或4次)。
104.在另一优选例中,所述的步骤(5)中,离心后,所述乳化的脂肪混合物分层4层,第一层为油层,第二层为残余脂肪组织层,第三层为液体层(即为中间液体层),第四层为细胞/组织碎片沉淀层。
105.在另一优选例中,所述的步骤(5)中,所述离心在800-2500g下离心,较佳地800-2000g,更佳地1000-1500g,最佳地1100-1300g。
106.在另一优选例中,所述的步骤(5)中,所述离心的时间为1-15min,较佳地1-10min,更佳地2-8min,最佳地3-7min。
107.在另一优选例中,所述的离心的温度为2-6℃。
108.在另一优选例中,所述的步骤(5)中,第一层、第二层、第三层和第四层从上到下依次排列。
109.在另一优选例中,所述的步骤(5)中,所述的中间液体层为透明或基本透明层。
110.在另一优选例中,所述的步骤(6)中,所述的过滤包能够将脂肪初提物中的脂肪细胞除去。
111.在另一优选例中,所述的步骤(6)中,所述的过滤和除菌是通过滤器(如0.22μm微孔滤膜)进行。
112.在另一优选例中,所述的过滤器为微孔滤膜过滤器。
113.在另一优选例中,所述的微孔滤膜的孔径大小为0.05-0.8μm,较佳地0.1-0.5μm,更佳地0.1-0.4μm,更佳地0.15-0.3μm,更佳地0.2-0.25μm,最佳地0.22μm。
114.在另一优选例中,所述的步骤(6)中,所述的过滤和除菌是先通过可滤去细胞的第一过滤器,然后再通过可滤去病原体(如细菌)的第二滤器(如0.22μm的滤器)进行的。
115.在另一优选例中,所述的步骤(6)中,还包括对所述脂肪提取物进行分装,形成分装的产品。(所述分装后的提取物可于-20℃保存待用;可低温(如-4℃)或常温解冻后直接使用,或解冻后置于低温(如4℃)保存一段时间,然后使用)。
116.本发明第三方面,提供一种无细胞脂肪提取物,所述的无细胞脂肪提取物通过如本发明第二方面所述的方法制备获得。
117.本发明第四方面,提供一种组合物或制剂,所述的组合物或制剂包含(a)如本发明第三方面所述的无细胞脂肪提取物;和(b)药学上、食品上、保健品或膳食上可接受的载体或赋形剂。
118.在另一优选例中,所述的组合物为药物组合物、食品组合物、保健品组合物或膳食补充剂。
119.在另一优选例中,所述的组合物或制剂的剂型为口服制剂、外用制剂或注射制剂。
120.在另一优选例中,所述组合物或制剂的剂型为粉剂、颗粒剂、胶囊剂、注射剂、酊剂、口服液、片剂或含片。
121.在另一优选例中,所述的注射剂为静脉注射剂或肌肉注射剂。
122.在另一优选例中,所述组合物或制剂的剂型为固体剂型、半固体剂型、或液体剂型,如溶液、凝胶、膏霜、乳液、膏剂、霜剂、糊剂、饼、粉剂、贴剂等。
123.在另一优选例中,在所述组合物或制剂中,无细胞脂肪提取物的质量百分比为5wt%,较佳地1-20wt%,以合物或制剂的总重量计。
124.在另一优选例中,在所述组合物或制剂还包括抗肿瘤药物。
125.在另一优选例中,所述的抗肿瘤药物包括氮芥类抗肿瘤药物。
126.在另一优选例中,所述的抗肿瘤药物选自下组:环磷酰胺、磷酰胺氮芥、异环磷酰胺、美法仑、苯丁酸氮芥、苯达莫司汀、雌莫司汀,或其组合。
127.本发明第五方面,提供一种制备如本发明第四方面所述的组合物或制剂的方法,所述的方法包括步骤:将如本发明第三方面所述的无细胞脂肪提取物与药学上、食品上、保健品或膳食上可接受的载体或赋形剂混合,从而形成组合物或制剂。
128.本发明第六方面,提供一种活性成分组合,所述活性成分组合包括:
129.(1)如本发明第三方面所述的无细胞脂肪提取物;和
130.(2)抗肿瘤活性成分。
131.在另一优选例中,在所述的活性成分组合中,各组分是合并或各自独立。
132.本发明第七方面,提供一种用于治疗肿瘤的组合物或制剂,所述组合物或制剂包括:
133.(a)如本发明第三方面所述的无细胞脂肪提取物;和
134.(b)抗肿瘤的活性成分。
135.在另一优选例中,所述的组合物或制剂还包括药学上可接受的载体或赋形剂。
136.本发明第八方面,提供一种用于治疗肿瘤的药盒,所述药盒包括:
137.(i)第一制剂,所述第一制剂包括如本发明第三方面所述的无细胞脂肪提取物;和
138.(ii)第二制剂,所述的第二制剂包括抗肿瘤活性成分。
139.在另一优选例中,在所述的药盒中,各制剂是合并或各自独立。
140.在另一优选例中,所述的第一制剂为口服制剂、注射制剂或外用制剂。
141.在另一优选例中,所述的第二制剂为口服制剂、注射制剂或外用制剂。
142.本发明第九方面,提供一种如本发明第六方面所述的活性成分组分、如本发明第七面所述的用于治疗肿瘤的组合物或制剂和/或如本发明第八方面所述的药盒的用途,用于制备药物,所述的药物用于预防和/或治疗肿瘤。
143.本发明第十方面,提供一种i)预防和/或治疗骨髓抑制;(ii)升高血细胞数量;和/或(iii)用于预防或治疗血细胞减少症的的方法,对需要的对象施用如本发明第三方面所述的的无细胞脂肪提取物。
144.在另一优选例中,所述的对象为人或非人哺乳动物。
145.在另一优选例中,所述非人哺乳动物包括啮齿动物,如大鼠、小鼠。
146.在另一优选例中,所述的对象为肿瘤患者。
147.在另一优选例中,所述的对象为已经、正在、或将要接受抗肿瘤药物治疗的对象。
148.在另一优选例中,所述的肿瘤治疗包括:化疗、放疗、或其组合。
149.在另一优选例中,所述的抗肿瘤药物为口服制剂、注射制剂或外用制剂。
150.在另一优选例中,所述的注射制剂为静脉注射剂、肌肉注射剂、皮下注射、腹腔注射。
151.在另一优选例中,所述的抗肿瘤药物包括氮芥类抗肿瘤药物。
152.在另一优选例中,所述的抗肿瘤药物选自下组:环磷酰胺、磷酰胺氮芥、异环磷酰胺、美法仑、苯丁酸氮芥、苯达莫司汀、雌莫司汀,或其组合。
153.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具
体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
154.本发明人经过广泛而深入的研究,首次开发了一种无细胞脂肪提取物。本发明所述的无细胞脂肪提取物对骨髓抑制具有优异的治疗效果,且能够升高血细胞数量和治疗血细胞减少症。在此基础上完成了本发明。
155.术语
156.除非另有定义,否则本文中所用的所有技术和科学术语的含义与本发明所属领域普通技术人员普遍理解的含义相同。
157.如本文所用,术语“包括”、“包含”与“含有”可互换使用,不仅包括开放式定义,还包括半封闭式、和封闭式定义。换言之,所述术语包括了“由
……
构成”、“基本上由
……
构成”。
158.如本文所用,术语“无细胞脂肪提取液”、“cell free fat extract”与“ceffe”可互换使用。
159.在本发明中,术语“预防”表示预防疾病和/或它的附随症状的发作或者保护对象免于获得疾病的方法。本文中使用的"预防"还包括延迟疾病和/或它的附随症状的发作和降低对象的得病的风险。
160.本发明所述的“治疗”包括延缓和终止疾病的进展,或消除疾病,并不需要100%抑制、消灭和逆转。在一些实施方案中,与不存在本发明所述的组合物、药盒、食品盒或保健品盒、活性成分组合时观察到的水平相比,本发明所述组合物或药物组合物减轻、抑制和/或逆转了骨髓抑制和/或其并发例如至少约10%、至少约30%、至少约50%、或至少约80%。
161.如文本所用,术语“igf-1”称为胰岛素样生长因子1(insulin-like growth factors-1)。
162.如文本所用,术语“bdnf”称为脑源性神经营养因子(brain-derived neurotrophic factor,bdnf)。
163.如文本所用,术语“gdnf”称为胶质细胞源性神经营养因子(glialcellline-derivedneurotrophicfactor)。
164.如文本所用,术语“bfgf”称为碱性成纤维细胞生长因子(basic fibroblast growth factor)。
165.如文本所用,术语“vegf”称为血管内皮生长因子(vascular endothelial growth factor)。
166.如文本所用,术语“tgf-β1”称为转化生长因子-β1(transforming growth factor-β1)。
167.如文本所用,术语“hgf”称为肝细胞生长因子
168.如文本所用,术语“pdgf”称为血小板衍生生长因子(platelet derived growth factor)
169.如文本所用,术语“egf”称为表皮细胞生长因子(epidermal growth factor)
170.如文本所用,术语“nt-3”称为神经营养因子3(neurotrophins-3)。
171.如文本所用,术语“gh”称为生长激素(growth hormone)。
172.如文本所用,术语“g-csf”称为粒细胞集落刺激因子(granulocyte colony stimulating factor)。
173.无细胞脂肪提取物(cell free fat extract,ceffe)及其制备方法
174.如本文所用,术语“本发明的无细胞脂肪提取物”、“本发明提取物”、“本发明的脂肪提取物”等可互换使用,指在脂肪提取物制备过程中(除漂洗步骤外)未添加任何溶液、溶剂、小分子、化学制剂、和生物添加剂所制备的源自脂肪组织的提取物(或提取液)。一种典型的制备本发明提取物的方法如上本发明第二方面中所述。此外,应理解,虽然本发明提取物在制备过程中不必添加任何添加剂(或添加成分),但是也可以添加一些或少量的对本发明提取物的活性无负面或不利影响的安全的物质(如少量水)。
175.在本发明的一个优选例中,所述的无细胞脂肪提取物为无细胞脂肪提取液。
176.在本发明所述的无细胞脂肪提取物,可以包括多种细胞因子。代表性地,所述的无细胞脂肪提取物包括igf-1、bdnf、gdnf、tgf-β、hgf、bfgf、vegf、tgf-β1、pdgf、egf、nt-3、gh和g-csf中的一种或多种。
177.在另一优选例中,在所述的无细胞脂肪提取物中,所述的igf-1的浓度为5000-30000pg/ml,较佳地6000-20000pg/ml,更佳地7000-15000pg/ml,更佳地8000-12000pg/ml,更佳地9000-11000pg/ml,更佳地9500-10500pg/ml。
178.在另一优选例中,在所述的无细胞脂肪提取物中,所述的bdnf的浓度为800-5000pg/ml,较佳地1000-4000pg/ml,更佳地1200-2500pg/ml,更佳地1400-2000pg/ml,更佳地1600-2000pg/ml,更佳地1700-1850pg/ml。
179.在另一优选例中,在所述的无细胞脂肪提取物中,所述的gdnf的浓度为800-5000pg/ml,较佳地1000-4000pg/ml,更佳地1200-2500pg/ml,更佳地1400-2000pg/ml,更佳地1600-2000pg/ml,更佳地1700-1900pg/ml。
180.在另一优选例中,在所述的无细胞脂肪提取物中,所述的bfgf的浓度为50-600pg/ml,较佳地100-500pg/ml,更佳地120-400pg/ml,更佳地150-300pg/ml,更佳地200-280pg/ml,更佳地220-260pg/ml。
181.在另一优选例中,在所述的无细胞脂肪提取物中,所述的vegf的浓度为50-500pg/ml,较佳地100-400pg/ml,更佳地120-300pg/ml,更佳地150-250pg/ml,更佳地170-230pg/ml,更佳地190-210pg/ml。
182.在另一优选例中,在所述的无细胞脂肪提取物中,所述的tgf-β1的浓度为200-3000pg/ml,较佳地400-2000pg/ml,更佳地600-1500pg/ml,更佳地800-1200pg/ml,更佳地800-1100pg/ml,更佳地900-1000pg/ml。
183.在另一优选例中,在所述的无细胞脂肪提取物中,所述的hgf的浓度为200-3000pg/ml,较佳地400-2000pg/ml,更佳地600-1500pg/ml,更佳地600-1200pg/ml,更佳地800-1000pg/ml,更佳地850-950pg/ml。
184.在另一优选例中,在所述的无细胞脂肪提取物中,所述的pdgf的浓度为50-600pg/ml,较佳地80-400pg/ml,更佳地100-300pg/ml,更佳地140-220pg/ml,更佳地160-200pg/ml,更佳地170-190pg/ml。
185.在另一优选例中,所述的igf-1与vegf的重量比为20-100:1,较佳地30-70:1,更佳
地40-60:1,最佳地45-55:1。
186.在另一优选例中,所述的bdnf与vegf的重量比为2-20:1,较佳地4-15:1,更佳地6-12:1,最佳地8-9.5:1。
187.在另一优选例中,所述的gdnf与vegf的重量比为2-20:1,较佳地4-15:1,更佳地6-12:1,最佳地8.5-9.5:1。
188.在另一优选例中,所述的bfgf与vegf的重量比为0.2-8:1,较佳地0.5-5:1,更佳地0.6-2:1,更佳地0.8-1.6:1,最佳地1-1.5:1。
189.在另一优选例中,所述的tgf-β1与vegf的重量比为1-20:1,较佳地1-15:1,更佳地1-10:1,更佳地2-8:1,更佳地4-6:1。
190.在另一优选例中,所述的hgf与vegf的重量比为1-20:1,较佳地1-15:1,更佳地1-10:1,更佳地2-8:1,更佳地4-5.5:1。
191.在另一优选例中,所述的pdgf与vegf的重量比为0.1-3:1,较佳地0.2-2:1,更佳地0.4-1.5:1,最佳地0.7-1.2:1。
192.优选地,本发明所述的无细胞脂肪提取物通过如上述本发明第二方面所述的方法制备获得。
193.代表性地,本发明所述的无细胞脂肪提取物通过以下方法制备:
194.(1)提供一脂肪组织原料,将所述脂肪组织原料破碎,并进行漂洗(如用生理盐水),从而获得经漂洗的脂肪组织;
195.(2)对所述经漂洗后的脂肪组织进行离心,获得分层的混合物;
196.(3)对所述分层的混合物,去除上层油层和下层水层,收集中间层(即含脂肪细胞的脂肪层);
197.(4)对所述中间层进行乳化,获得乳化的脂肪混合物(也称为纳米脂肪);
198.(5)将所述乳化的脂肪混合物通过离心处理,从而获得中间液体层,即为脂肪初提物;和
199.(6)对所述脂肪初提物进行过滤和除菌,从而获得无细胞的脂肪提取物。
200.具体地,本发明所述的无细胞脂肪提取物
201.在另一优选例中,所述的步骤(2)中,所述离心在800-2500g下离心,较佳地800-2000g,更佳地1000-1500g,最佳地1100-1300g。
202.在另一优选例中,所述的步骤(2)中,所述离心的时间为1-15min,较佳地1-10min,更佳地1-8min,最佳地1-5min。
203.在另一优选例中,所述的步骤(4)中,所述的乳化为机械乳化。
204.在另一优选例中,所述机械乳化为经注射器反复吹打(如吹打20-200次,较佳地20-150次,更佳地20-100次,更佳地30-50次)进行机械乳化。
205.在另一优选例中,所述的吹打的方式为2个10ml注射针筒连接三通管反复匀速推打。
206.在另一优选例中,所述的步骤(4)中,所述乳化为通过组织匀浆机打碎的方法。
207.在另一优选例中,所述的步骤(5)中,在将所述乳化的脂肪混合物通过离心处理前,还包括对所述乳化的脂肪混合物冷冻后解冻处理。
208.在另一优选例中,冷冻后解冻处理后,将解冻后的混合物用于离心。
209.在另一优选例中,所述的冷冻的温度为-50℃至-120℃,较佳地-60℃至-100℃,更佳地-70℃至-90℃。
210.在另一优选例中,所述的解冻的温度为20-40℃,较佳地25-40℃,更佳地37℃。
211.在另一优选例中,所述的冷冻后解冻的循环次数为1-5次(优选为1、2、3或4次)。
212.在另一优选例中,所述的步骤(5)中,离心后,所述乳化的脂肪混合物分层4层,第一层为油层,第二层为残余脂肪组织层,第三层为液体层(即为中间液体层),第四层为细胞/组织碎片沉淀层。
213.在另一优选例中,所述的步骤(5)中,所述离心在800-2500g下离心,较佳地800-2000g,更佳地1000-1500g,最佳地1100-1300g。
214.在另一优选例中,所述的步骤(5)中,所述离心的时间为1-15min,较佳地1-10min,更佳地2-8min,最佳地3-7min。
215.在另一优选例中,所述的步骤(5)中,第一层、第二层、第三层和第四层从上到下依次排列。
216.在另一优选例中,所述的步骤(5)中,所述的中间液体层为透明或基本透明层。
217.在另一优选例中,所述的步骤(6)中,所述的过滤包能够将脂肪初提物中的脂肪细胞除去。
218.在另一优选例中,所述的步骤(6)中,所述的过滤和除菌是通过滤器(如0.22μm微孔滤膜)进行。
219.在另一优选例中,所述的过滤器为微孔滤膜过滤器。
220.在另一优选例中,所述的微孔滤膜的孔径大小为0.05-0.8μm,较佳地0.1-0.5μm,更佳地0.1-0.4μm,更佳地0.15-0.3μm,更佳地0.2-0.25μm,最佳地0.22μm。
221.在另一优选例中,所述的步骤(6)中,所述的过滤和除菌是先通过可滤去细胞的第一过滤器,然后再通过可滤去病原体(如细菌)的第二滤器(如0.22μm的滤器)进行的。
222.在另一优选例中,所述的步骤(6)中,还包括对所述脂肪提取物进行分装,形成分装的产品。(所述分装后的提取物可于-20℃保存待用;可低温(如-4℃)或常温解冻后直接使用,或解冻后置于低温(如4℃)保存一段时间,然后使用)。
223.用途
224.本发明所述的无细胞脂肪提取物能够用于(i)预防和/或治疗骨髓抑制;(ii)升高血细胞数量;和/或(iii)用于预防或治疗血细胞减少症。
225.在本发明的一个优选例中,所述的骨髓抑制包括抗肿瘤药物引起的骨髓抑制。
226.在本发明的一个优选例中,所述骨髓抑制的对象为肿瘤患者。
227.在本发明的一个优选例中,所述的血细胞包括但不限于:红细胞、白细胞、淋巴细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞,或其组合。
228.在另一优选例中,所述“升高血细胞数量”指使得一对象的血液中血细胞数量上升。
229.在本发明的一个优选例中,所述的对象为血细胞数量下降的人。
230.在另一优选例中,所述的血细胞数量下降包括骨髓抑制引起的血细胞数量下降。
231.在另一优选例中,所述的“血细胞数量下降”指与正常人的血细胞数量的下限a0相比,所述对象的血细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳
地0.3-0.7倍。
232.代表性地,所述的“红细胞数量下降”指与正常人的红细胞数量的下限a0相比,所述对象的红细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
233.代表性地,所述的“白细胞数量下降”指与正常人的白细胞数量的下限a0相比,所述对象的白细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
234.代表性地,所述的“淋巴细胞数量下降”指与正常人的淋巴细胞数量的下限a0相比,所述对象的淋巴细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
235.代表性地,所述的“中性粒细胞数量下降”指与正常人的中性粒细胞数量的下限a0相比,所述对象的中性粒细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
236.代表性地,所述的“嗜酸性粒细胞数量下降”指与正常人的嗜酸性粒细胞数量的下限a0相比,所述对象的嗜酸性粒细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
237.代表性地,所述的“嗜碱性粒细胞数量下降”指与正常人的嗜碱性粒细胞数量的下限a0相比,所述对象的嗜碱性粒细胞数量a1低于a0;较佳地,a1为a0的0.1-0.9倍,较佳地0.2-0.8倍,更佳地0.3-0.7倍。
238.在本发明的一个优选例中,所述“升高血细胞数量”指,与对照的血细胞数量c0相比,使得一对象的血液中血细胞数量c1增加。
239.在本发明的一个优选例中,所述的对照的血细胞数量c0为所述对象在用本发明无细胞脂肪提取物进行治疗或处理之前的血细胞数量czs;或者为对照组的血细胞数量cdz。
240.在另一优选例中,所述“升高血细胞数量”指c1/czs≥1.2,较佳地≥1.4,更佳地≥1.5或≥2.0。
241.在另一优选例中,所述“升高血细胞数量”指c1/cdz≥1.2,较佳地≥1.4,更佳地≥1.5或≥2.0。
242.在本发明的一个优选例中,所述的血细胞减少症包括骨髓抑制引起的血细胞减少症。
243.在本发明的一个优选例中,所述的血细胞减少症包括抗肿瘤药物引起的血细胞减少症。
244.在本发明的一个优选例中,所述的血细胞减少症包括血细胞数量下降引起的疾病或症状。
245.在本发明的一个优选例中,所述血细胞减少症的对象为肿瘤患者。
246.在另一优选例中,所述的对象为肿瘤患者。
247.在另一优选例中,所述的对象为已经、正在、或将要接受抗肿瘤治疗的对象。
248.在另一优选例中,所述的抗肿瘤治疗包括:化疗、放疗、或其组合。
249.在另一优选例中,所述的对象为人、或非人哺乳动物(如啮齿动物)。
250.在本发明的一个优选例中,所述的抗肿瘤药物为口服制剂、注射制剂或外用制剂。
251.在另一优选例中,所述的注射制剂为静脉注射剂、肌肉注射剂、皮下注射、腹腔注射。
252.在本发明的一个优选例中,所述的抗肿瘤药物包括氮芥类抗肿瘤药物。
253.在另一优选例中,所述的抗肿瘤药物包括但不限于:环磷酰胺、磷酰胺氮芥、异环磷酰胺、美法仑、苯丁酸氮芥、苯达莫司汀、雌莫司汀,或其组合。
254.组合物和施用
255.本发明所述的组合物包括(但并不限于):药物组合物、食品组合物、保健组合物、膳食补充剂等。
256.代表性地,可将本发明的无细胞脂肪提取物制备成药物组合物,诸如片剂、胶囊、粉剂、微粒剂、溶液剂、锭剂、胶冻、乳膏制剂、醑剂、悬液、酊、泥敷剂、搽剂、洗剂、和气雾剂之类的剂型。药物组合物能够由通常已知的制备技术来制备,并且合适的药物添加剂能够被添加到该药物中。
257.本发明的组合物还可以包括药学上、食品上、保健品或膳食上可接受的载体。“药学上、食品上、保健品或膳食上可接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上、食品上、保健品或膳食上可接受的载体可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如)、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
258.本发明组合物施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、肠胃外(静脉内、肌肉内)、局部施用,优选的施用方式为口服施用和注射施用。
259.本发明所述的组合物或制剂的剂型为口服制剂、外用制剂或注射制剂。代表性地,用于口服施用或给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
260.固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,。
261.用于口服施用或给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混
合物等。
262.除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、娇味剂和香料。
263.除了活性成分外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
264.用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
265.用于局部施用或给药的本发明化合物的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。活性成分在无菌条件下与生理上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合。
266.本发明无细胞脂肪提取物可以单独施用或给药,或者与其它预防和/或治疗骨髓抑制和/或血细胞减少症的药物联合施用或给药。
267.施用组合物时,是将安全有效量的本发明无细胞脂肪提取物适用于需要治疗的人或非人动物(如大鼠、小鼠、狗、猫、牛、鸡、鸭等),其中施用时剂量为药学上、食品上或保健品上可接受认为的有效给药剂量。如本文所用,术语“安全有效量”,是指对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。本领域的普通技术人员应该理解,所述的“安全有效量”可随着药物组合物的形式、给药途径、所用药物的辅料、疾病的严重程度以及与其他药物联合用药等情况的不同而有所不同。例如,对于60kg体重的人而言,日给药剂量通常为0.1~1000mg,优选1~600mg,更优选为2-300mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
268.本发明还提供一种活性成分组合,所述活性成分组合包括:
269.(1)如本发明所述的无细胞脂肪提取物;和
270.(2)抗肿瘤活性成分。
271.在本发明的一个优选例中,在所述的活性成分组合中,各组分是合并或各自独立。
272.本发明还提供一种用于治疗肿瘤的组合物或制剂,所述组合物或制剂包括:
273.(a)如本发明所述的无细胞脂肪提取物;和
274.(b)抗肿瘤的活性成分。
275.在本发明的一个优选例中,所述的组合物或制剂还包括药学上可接受的载体或赋形剂。
276.本发明还提供一种用于治疗肿瘤的药盒,所述药盒包括:
277.(i)第一制剂,所述第一制剂包括本发明所述的无细胞脂肪提取物;和
278.(ii)第二制剂,所述的第二制剂包括抗肿瘤活性成分。
279.在本发明的一个优选例中在所述的药盒中,各制剂是合并或各自独。
280.本发明还提供一种本发明所述的活性成分组分、本发明所述的用于治疗肿瘤的组合物或制剂和/或本发明所述的药盒的用途,用于预防和/或治疗肿瘤。
281.本发明的主要优点包括:
282.本发明首次发现无细胞脂肪提取物对骨髓抑制具有优异的治疗效果,且能够升高血细胞数量和治疗血细胞减少症。
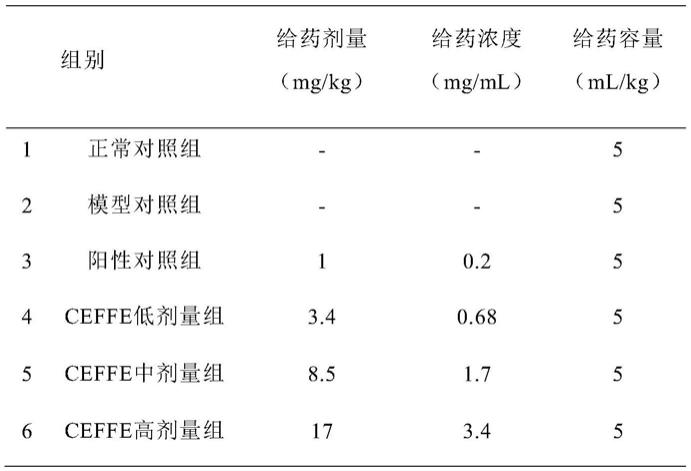
283.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
284.实施例1考出ceffe对骨髓抑制的治疗效果
285.1.实验方法
286.1.1.无细胞脂肪提取液(cell free fat extract,ceffe)的制备
287.脂肪由自愿者在获得知情同意的条件下获得。无细胞脂肪组织提取液的制备方法如下:
288.(1)脂肪组织获取自6名常规脂肪抽吸术的健康女性,平均年龄31岁(24-36岁)。局部注射肿胀液麻醉后,使用具有大侧孔(2mm x 7mm)的3mm吸脂抽脂套管连接20ml注射器,人工负压下放射状抽吸,将获得的脂肪直立静止,去除肿胀液后,用生理盐水漂洗3遍。
289.(2)取经漂洗后的脂肪组织,置于离心管中,放入离心机中以1200g 4℃离心3分钟后,获得分层的混合物。
290.(3)对所述分层的混合物,去除上层油层和下层水层,收集中间层(即含脂肪细胞的脂肪层)。
291.(4)对所述中间层,用2个10ml注射针筒连接三通管反复匀速推打30次,从而进行机械乳化,并获得经机械乳化的脂肪混合物(也称为纳米脂肪)。
292.(5)将所述经机械乳化的脂肪混合物置入-80℃冰箱冷冻,再进行37℃水浴解冻,单次冻融循环后,将解冻后的脂肪混合物以1200g 4℃离心5分钟,获得分层的混合物,分层的混合物共分为4层,第一层为油层,第二层为残余脂肪组织层,第三层为液体层,第四层为细胞/组织碎片沉淀层,去除油层和残余脂肪组织层,吸取液体层,吸取过程中避免细胞/组织碎片沉淀层污染,从而得到脂肪初提取液。
293.(6)将得到的脂肪初提取液经0.22μm滤器过滤除菌,从而灭菌并去除可能混有的活细胞,从而获得无细胞脂肪提取液(ceffe),分装冻存于-20℃保存,使用时4℃解冻。
294.对制备得到的无细胞脂肪提取液,使用elisa免疫吸附测定试剂盒检测细胞因子含量,包括igf-1、bdnf、gdnf、bfgf、vegf、tgf-β1、hgf和pdgf等细胞因子。6例样本检测平均浓度如下:igf-1(9840.6pg/ml)、bdnf(1764.5pg/ml)、gdnf(1831.9pg/ml)、bfgf(242.3pg/ml)、vegf(202.9pg/ml)、tgf-β1(954.5pg/ml)、hgf(898.4pg/ml)和pdgf(179.9pg/ml)。
295.1.2大鼠骨髓抑制模型建立、分组及给药
296.实验动物选择8周龄雄性sd大鼠48只,随机分成6组,每组8只。各组动物分组及给药剂量如表1所示:
297.表1 各组动物分组及给药剂量
[0298][0299]
造模方法:除正常对照组外,其余各组动物分别于d1、d3和d5腹腔注射给予40mg/kg的环磷酰胺溶液,给药浓度为4mg/ml,给药容量为10ml/kg。
[0300]
给药频率和方式:正常对照组动物(组1)与模型对照组动物(组2)给予生理盐水,阳性对照组(组3)动物给予聚乙二醇化重组人粒细胞刺激因子注射液(tbd),实验组(组4~6)动物给予对应剂量的ceffe,以给药第1天为d1,第2天为d2,以此类推。各组均于造模后当天进行给药。
[0301]
阳性对照组动物为皮下给药,每周1次,给药2次(d1、d8)。
[0302]
正常对照组、模型对照组以及ceffe组各组动物均为尾静脉给药,每周2次,共给药4次(d1、d4、d8、d11)。
[0303]
1.3一般临床观察
[0304]
所有动物检疫期每天观察1次,实验期间每天观察2次。观察内容包括死亡或濒死、粪便、摄食情况、精神状态以及行为活动等,发现异常情况,及时记录。濒死动物需由专题负责人或兽医决定实施安乐死。
[0305]
1.4体重
[0306]
所有动物接收检疫出检疫及给药前称重1次,药后所有动物每周称重2次,安乐死前称重1次。发现动物死亡或濒死时称重。
[0307]
1.5血常规检测
[0308]
检测时间:给药前1次,给药后每2天1次(d2、d4、d6、d8、d10、d12、d14)。
[0309]
取血方式:颈静脉(非终点)或腹主动脉(终点)取血约1ml。
[0310]
血样处理:edta-2k抗凝,分离血浆。
[0311]
检测仪器:西门子advia2120全自动血球分析仪。
[0312]
血常规检测指标如下表2所示:
[0313]
表2 血细胞计数
[0314][0315]
1.6大体解剖和病理组织学检查
[0316]
给药后d14将动物安乐死后,取一侧股骨进行骨髓涂片,另一侧股骨置于10%中性福尔马林固定,切片,he染色确认骨髓增生程度。
[0317]
1.7数据统计分析
[0318]
计量资料以平均值标准差来表示,所有数据统计均采用spss13.0或graphpad prism 5.0统计学软件进行。
[0319]
2.实验结果
[0320]
实验结果发现,与正常对照组相比,模型对照组的血细胞数量显著降低,表明骨髓抑制模型成功建立。与模型对照组相比,ceffe组的血细胞数量显著提高,表明ceffe对骨髓抑制具有优异的治疗效果。
[0321]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1