一种预防、治疗疼痛、炎症的化合物及其应用
1.本发明属于生物技术和医药技术领域,涉及一种应用hv1通道作为预防、治疗疼痛、炎症疾病的药物靶点用于制备具有hv1抑制活性的化合物及其应用。
背景技术:
2.电压门控质子通道(voltage-gatedproton channel,hv1)主要生理功能是将胞内的质子快速地移至胞外。hv1调节胞内ph,激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide-adenine dinucleotidephosphateoxidase,nox),协同nox产生氧自由基(ros)(wu lj.voltage-gatedproton channel hv1 in microglia.neuroscientist.2014;20:599-609.)。因此hv1可能与氧化损伤为病因的神经系统疾病及心脑血管系统疾病相关,包括脑卒中、帕金森症、动脉粥样硬化等。
3.脑卒中,又称中风,是一种突发性,发展迅速的急性脑缺血或脑出血性疾病,其中约80%为缺血性脑卒中。在脑缺血状态下,小胶质细胞激活,nox胞内亚单位转运到胞膜。小胶质细胞上的hv1通道协助nox产生ros,进而诱导神经元细胞死亡和缺血性脑卒中所造成的一部分脑损伤。动脉粥样硬化(atherosclerosis,as)是中老年患者常见疾病,也是心脑血管疾病的主要病因(pasquel fj,gregg ew,ali mk.the evolving epidemiology of atherosclerotic cardiovascular disease in people with diabetes〔j〕.endocrinol metab clin north am,2018;47:1-32.)。
4.动脉粥样硬化及其致命并发症,如心肌梗死或中风,是当今世界最常见的发病或死亡原因。动脉粥样硬化发生过程中伴随着过量的ros。在生理条件下,细胞内h
+
的积累以及细胞膜在产生ros的过程中发生去极化,使ros产生过程受到限制,从而避免氧化应激。然而,动脉粥样硬化过程中ros的持续产生表明,生理上自我限制的ros生成过程被打乱,可能存在一种未知的机制支持ros持续生成。hv1通道能快速从去极化的细胞质中去除质子并维持膜电位,可能在动脉粥样硬化过程中发挥关键作用。有研究指出hv1通道介导的氧化应激促进了过多ros的产生和泡沫细胞的形成,从而导致动脉粥样硬化(zheng z,zhang z,wang m.hv1 proton channel possibly promotes atherosclerosis by regulating reactive oxygen species production.medhypotheses.2020;141:109724.)。在脑缺血性小鼠模型及多发性硬化症(multiple sclerosis,ms)小鼠模型中,降低脑内hv1的表达可以使得小胶质细胞导致的氧化应激损伤和炎症效应降低,从而对小鼠的大脑起到一定保护作用(wu lj.microglial voltage-gatedproton channel hv1 in ischemic stroke.transl stroke res.2014;5:99-108.)。
5.帕金森病(parkinson’s disease,pd)是世界范围内影响2%-3%老年人的第2个常见的多因素神经退行性疾病(kaur r,mehan s,singh s.understanding multifactorial architecture of parkinson's disease:pathophysiology to management.j neurol sci.2019,40:13-23)。pd具体的发病原因目前并不明确,普遍的观点认为氧化应激及脑内炎症效应是pd发生的主要原因,因此减缓脑内氧化应激及炎症效应
为帕金森病的治疗提供了新的思路。小胶质细胞在大脑中发挥免疫功能,调控着炎症效应(perry vh,nicoll ja,holmes c.microglia in neurodegenerative disease.nat rev neurol.2010,6(4):193
–
201.),而在小胶质细胞中高表达的hv1通道能促进氧化应激,因此抑制hv1通道可能是治疗pd疾病的一种策略。
6.炎症和炎性痛与ros高度相关。尽管hv1通道可控制ros过载,ros的过载会导致炎性疼和神经病理痛,但是hv1通道与炎性痛和神经病理痛之间的关系还研究较少,目前还没有证据显示hv1通道是治疗炎性疼和神经病理痛的新靶点。因此开发选择性的hv1通道抑制剂作为药理学工具来阐明hv1通道在体内和体外的生理和病理作用不仅能为治疗脑卒中、动脉粥样硬化、帕金森症等疾病提供新策略,也可以揭示hv1通道能否用作预防和治疗炎性痛和神经病理痛的新靶点。
技术实现要素:
7.为了解决现有技术存在的不足,本发明的目的在于提供一种可以治疗疼痛及炎症的新靶点,即,该靶点为电压门控质子通道(voltage-gatedproton channel,hv1);通过研究提供hv1通道新的药物结合位点并发现新的可用于抑制hv1通道的化合物(抑制剂)。本发明借助所获得的抑制剂为探针,评估抑制hv1在预防/治疗疼痛、炎症以及阻断阿片类药物镇痛耐受和改善阿片类药物所导致的疼痛超敏方面的应用,发现所发明的hv1通道抑制剂可以治疗和/或缓解这些类疾病,同时也用于治疗脑卒中、动脉粥样硬化和帕金森症等疾病。
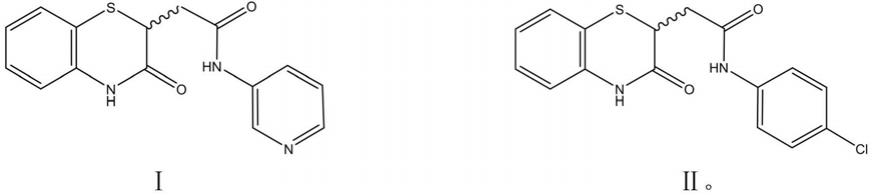
8.本发明提供了一种如式(i)所示的化合物(yhv98-1)或其药学上可接受的盐或如式(ⅱ)所示的化合物(yhv98-4)或其药学上可接受的盐在制备预防和/或治疗疼痛的药物组合物或制剂中的用途,所述化合物或其药学上可接受的盐具有hv1通道的抑制活性,所述化合物的结构如下所示:
[0009][0010]
本发明还提供了一种如式(i)所示的化合物(yhv98-1)或其药学上可接受的盐或如式(ⅱ)所示的化合物(yhv98-4)或其药学上可接受的盐在制备预防和/或治疗炎症的药物组合物或制剂中的用途,所述化合物或其药学上可接受的盐具有hv1通道的抑制活性,所述化合物的结构如下所示:
[0011][0012]
本发明还提供了一种如式(i)所示的化合物(yhv98-1)或其药学上可接受的盐或
如式(ⅱ)所示的化合物(yhv98-4)或其药学上可接受的盐在制备预防和/或治疗阿片类药物镇痛耐受和超敏的药物组合物或制剂中的用途,所述化合物或其药学上可接受的盐具有hv1通道的抑制活性,所述化合物的结构如下所示:
[0013][0014]
本发明还提供了一种如式(i)所示的化合物(yhv98-1)或其药学上可接受的盐或如式(ⅱ)所示的化合物(yhv98-4)或其药学上可接受的盐在制备预防和/或治疗脑卒中、帕金森症、动脉粥样硬化的药物组合物或制剂中的用途,所述化合物或其药学上可接受的盐具有hv1通道的抑制活性,所述化合物的结构如下所示:
[0015][0016]
在另一优选例中,所述hv1通道是人或者小鼠的hv1通道。
[0017]
在另一优选例中,所述hv1通道是指由hvcn1基因表达的蛋白。
[0018]
在另一优选例中,所述hv1通道作为预防和/或治疗疼痛及预防和/或治疗炎症的分子或者药物作用靶点。
[0019]
在另一优选例中,所述药物包含以hv1通道作为分子靶点或者药物作用靶点开发的植物提取物、化学结构明晰的化合物、肽类物质、核酸类物质、多糖类物质、病毒载体、脂质体载体或者纳米颗粒载体。
[0020]
在另一优选例中,所述的式(i)化合物为化合物yhv98-1,二者为同一化合物。
[0021]
在另一优选例中,所述的式(ⅱ)化合物为化合物yhv98-4,二者为同一化合物。
[0022]
在另一优选例中,所述的式(i)化合物和/或式(ii)化合物为抑制hv1通道活性的化合物。
[0023]
在另一优选例中,所述的疼痛包括慢性疼痛、急性疼痛、癌症疼痛;其中,所述的慢性疼痛包括肌肉及软组织疼痛、骨关节疼痛、头痛、内脏痛、病理性神经痛。
[0024]
在另一优选例中,所述的肌肉及软组织疼痛包括肌筋膜炎、腱鞘炎、肩周炎、肌肉劳损性疼痛、纤维肌痛、冷痛、烧伤疼痛、牙痛中的一种或几种。
[0025]
在另一优选例中,所述的骨关节疼痛包括膝关节疼痛、踝关节疼痛、腕关节疼痛、肘关节疼痛、肩关节疼痛、髌骨关节疼痛、髋骨关节疼痛、股骨关节疼痛、强制性脊柱炎、骶髂关节炎、风湿性关节炎、类风湿性关节炎、痛风性关节炎、椎间盘突出症、颈椎疼痛、腰椎疼痛中的一种或几种。
[0026]
在另一优选例中,所述的头痛包括原发性头痛、继发性头痛、脑神经痛、中枢和原发性颜面痛及其他头痛。
[0027]
在另一优选例中,所述的原发性头痛包括无先兆偏头痛、有先兆偏头痛、偏瘫型偏头痛、慢性偏头痛、偏头痛并发症、与偏头痛有关的发作性综合征、紧张型头痛、三叉自主神经性头痛及其它的原发性头痛中的一种或几种。
[0028]
在另一优选例中,所述的继发性头痛包括缘于头颈部外伤的头痛,缘于非血管性颅内疾病的头痛,缘于物质或物质戒断的头痛,缘于头颈部血管疾病的头痛,缘于内环境紊乱的头痛,缘于精神疾病的头痛,缘于头、颈、眼、耳、鼻、鼻窦、牙、口或其他头面部结构病变的头面痛中的一种或几种。
[0029]
在另一优选例中,所述的脑神经痛、中枢和原发性颜面痛及其他头痛包括三叉神经痛、舌咽神经痛、中间神经痛、枕神经痛、视神经炎中的一种或几种。
[0030]
在另一优选例中,所述的内脏痛包括来自内脏器官的疼痛,所述内脏器官包括呼吸道、胃肠道、胰腺、尿道、肾脏、胆囊、膀胱和生殖器。
[0031]
在另一优选例中,所述的病理性神经痛包括疱疹后神经痛、糖尿病性神经痛、痛性hiv相关性感觉神经病、灼伤综合征、截肢术后疼痛、幻痛、痛性神经瘤、创伤性神经瘤、神经挤压损伤、脊管狭窄、腕管综合征、神经根痛、坐骨神经痛、神经撕脱伤、臂丛撕脱伤、复杂性区域疼痛综合征、药物疗法引起的神经痛、癌症化学疗法引起的神经痛、脊髓损伤后疼痛、原发性小纤维神经病、原发性感觉神经病、三叉自主神经性头痛中的一种或几种。
[0032]
在另一优选例中,所述的急性疼痛包括急性创伤性疼痛、术后疼痛、分娩痛、内脏痛毒热痛、瘙痒、手术后疼痛中的一种或几种。
[0033]
在另一优选例中,所述的癌症疼痛中的癌症包括腺组织中的腺癌、器官胚胎组织中的胚细胞瘤、上皮组织中的癌、形成血细胞的组织中的白血病、淋巴组织中的淋巴瘤、骨髓中的骨髓瘤、结缔组织或支持组织中的肉瘤、肾上腺癌、aids相关淋巴瘤、膀胱癌、骨癌、脑癌、乳腺癌、类癌瘤、宫颈癌、结肠癌、子宫内膜癌、食管癌、胃癌、头癌、颈癌、肝胆癌、白血病、肝癌、肺癌、淋巴瘤、霍奇金氏病、非霍奇金氏病、神经系统肿瘤、口腔癌、卵巢癌、胰腺癌、前列腺癌、直肠癌、皮肤癌、胃癌、睾丸癌、甲状腺癌、尿道癌、骨髓癌、多发性骨髓瘤、转移到骨的肿瘤、浸润神经和空腔脏器的肿瘤、神经结构附近的肿瘤中的一种或几种。
[0034]
在另一优选例中,所述的炎症指感染性炎症和非感染性炎症,包括细菌、病毒、寄生虫生物病原体引起的炎症,高温、低温、放射性物质及紫外线和机械损伤引起的炎症,强酸、强碱及松节油、芥子气以及内源性毒性物质及体内的代谢产物引起的炎症,金属、木材碎屑、尘埃颗粒、及手术缝线引起的炎症,坏死组织引起的组织坏死导致的炎症,过敏性鼻炎、荨麻疹、肾小球肾炎、淋巴细胞性甲状腺炎、溃疡性结肠炎引起的炎症、强制性脊柱炎、骶髂关节炎、风湿性关节炎、类风湿性关节炎、痛风性关节炎、肌筋膜炎、腱鞘炎、肩周炎等。
[0035]
在另一优选例中,所述hv1通道作为预防和/或治疗阿片类药物镇痛耐受和超敏的分子或者药物作用靶点。
[0036]
在另一优选例中,所述阿片类药物包括吗啡、海洛因等。
[0037]
在另一优选例中,所述式(i)化合物和/或式(ii)化合物的施用剂量为0.1-50mg/kg;优选地,为1-5mg/kg。
[0038]
在另一优选例中,所述式(i)化合物和/或式(ii)化合物的施用剂量≤50mg/kg时,无不良反应。
[0039]
本发明还提供了一种药物组合物,所述药物组合物包含如式(i)所示的化合物或
其药学上可接受的盐或如式(ii)所示的化合物或其药学上可接受的盐,其中所述化合物的结构如下所示:
[0040][0041]
在另一优选例中,所述的药物组合物中还含有药学上可接受的载体。
[0042]
在另一优选例中,所述的式(i)化合物和/或式(ii)化合物或其药学上可接受的盐的总含量为组合物的0.001-99wt%;优选地,为0.1-90wt%;进一步优选地,为1-80wt%。
[0043]
在另一优选例中,所述的药物组合物用于预防和/或治疗疼痛。
[0044]
在另一优选例中,所述的疼痛包括慢性疼痛、急性疼痛、癌症疼痛;其中,所述慢性疼痛包括肌肉及软组织疼痛、骨关节疼痛、头痛、内脏痛、病理性神经痛。
[0045]
在另一优选例中,所述的肌肉及软组织疼痛包括肌筋膜炎、腱鞘炎、肩周炎、肌肉劳损性疼痛、纤维肌痛、冷痛、烧伤疼痛、牙痛中的一种或几种。
[0046]
在另一优选例中,所述的骨关节疼痛包括膝关节疼痛、踝关节疼痛、腕关节疼痛、肘关节疼痛、肩关节疼痛、髌骨关节疼痛、髋骨关节疼痛、股骨关节疼痛、强制性脊柱炎、骶髂关节炎、风湿性关节炎、类风湿性关节炎、痛风性关节炎、椎间盘突出症、颈椎疼痛、腰椎疼痛中的一种或几种。
[0047]
在另一优选例中,所述的头痛包括原发性头痛、继发性头痛、脑神经痛、中枢和原发性颜面痛及其他头痛。
[0048]
在另一优选例中,所述的原发性头痛包括无先兆偏头痛、有先兆偏头痛、偏瘫型偏头痛、慢性偏头痛、偏头痛并发症、与偏头痛有关的发作性综合征、紧张型头痛、三叉自主神经性头痛及其它的原发性头痛中的一种或几种。
[0049]
在另一优选例中,所述的继发性头痛包括缘于头颈部外伤的头痛,缘于非血管性颅内疾病的头痛,缘于物质或物质戒断的头痛,缘于头颈部血管疾病的头痛,缘于内环境紊乱的头痛,缘于精神疾病的头痛,缘于头、颈、眼、耳、鼻、鼻窦、牙、口或其他头面部结构病变的头面痛中的一种或几种。
[0050]
在另一优选例中,所述的脑神经痛、中枢和原发性颜面痛及其他头痛包括三叉神经痛、舌咽神经痛、中间神经痛、枕神经痛、视神经炎中的一种或几种。
[0051]
在另一优选例中,所述的内脏痛包括来自内脏器官的疼痛,所述内脏器官包括呼吸道、胃肠道、胰腺、尿道、肾脏、胆囊、膀胱和生殖器。
[0052]
在另一优选例中,所述的病理性神经痛包括疱疹后神经痛、糖尿病性神经痛、痛性hiv相关性感觉神经病、灼伤综合征、截肢术后疼痛、幻痛、痛性神经瘤、创伤性神经瘤、神经挤压损伤、脊管狭窄、腕管综合征、神经根痛、坐骨神经痛、神经撕脱伤、臂丛撕脱伤、复杂性区域疼痛综合征、药物疗法引起的神经痛、癌症化学疗法引起的神经痛、脊髓损伤后疼痛、原发性小纤维神经病、原发性感觉神经病、三叉自主神经性头痛中的一种或几种。
[0053]
在另一优选例中,所述的急性疼痛包括急性创伤性疼痛、术后疼痛、分娩痛、内脏
痛毒热痛、瘙痒、手术后疼痛中的一种或几种。
[0054]
在另一优选例中,所述的癌症疼痛中的癌症包括腺组织中的腺癌、器官胚胎组织中的胚细胞瘤、上皮组织中的癌、形成血细胞的组织中的白血病、淋巴组织中的淋巴瘤、骨髓中的骨髓瘤、结缔组织或支持组织中的肉瘤、肾上腺癌、aids相关淋巴瘤、膀胱癌、骨癌、脑癌、乳腺癌、类癌瘤、宫颈癌、结肠癌、子宫内膜癌、食管癌、头癌、颈癌、肝胆癌、肾癌、白血病、肝癌、肺癌、淋巴瘤、霍奇金氏病、非霍奇金氏病、神经系统肿瘤、口腔癌、卵巢癌、胰腺癌、前列腺癌、直肠癌、皮肤癌、胃癌、睾丸癌、甲状腺癌、尿道癌、骨髓癌、多发性骨髓瘤、转移到骨的肿瘤、浸润神经和空腔脏器的肿瘤、神经结构附近的肿瘤中的一种或几种。
[0055]
在另一优选例中,所述的药物组合物用于预防和/或治疗炎症。
[0056]
在另一优选例中,所述的炎症指感染性炎症和非感染性炎症,包括细菌、病毒、寄生虫生物病原体引起的炎症,高温、低温、放射性物质及紫外线和机械损伤引起的炎症,强酸、强碱及松节油、芥子气以及内源性毒性物质及体内的代谢产物引起的炎症,金属、木材碎屑、尘埃颗粒、及手术缝线引起的炎症,坏死组织引起的组织坏死导致的炎症,过敏性鼻炎、荨麻疹、肾小球肾炎、淋巴细胞性甲状腺炎、溃疡性结肠炎引起的炎症、强制性脊柱炎、骶髂关节炎、风湿性关节炎、类风湿性关节炎、痛风性关节炎、肌筋膜炎、腱鞘炎、肩周炎等。
[0057]
在另一优选例中,所述的药物组合物用于预防和/或治疗阿片类药物镇痛耐受和超敏。
[0058]
在另一优选例中,所述的药物组合物用于预防和/或治疗脑卒中、帕金森症、动脉粥样硬化。
[0059]
在另一优选例中,所述的药物组合物还可以与其他药物联合使用。
[0060]
在另一优选例中,所述的其他药物包括但不限于阿片类镇痛药,例如吗啡、海洛因等;非阿片类止痛剂包括但不限于,扑热息痛、乙酰水杨酸、布洛芬、依托立林、芬布芬、非诺洛芬、酮咯酸、氟比洛芬、吲哚美辛、酮洛芬、萘普生,以及它们药学上可接受的盐、光学活性消旋体和混合物。
[0061]
在另一优选例中,所述的药物组合物可以被制成口服剂型或注射剂型。
[0062]
在另一优选例中,所述的口服剂型包括片剂、胶囊剂、膜剂、颗粒剂等。
[0063]
在另一优选例中,所述的药物组合物可通过口服、注射、雾化吸入等方式施用于所需的对象(如人和非人哺乳动物)。
[0064]
本发明还提供了一种预防和/或治疗相关疾病的方法,所述方法包括:给需要的对象施用如上所述的式(i)化合物或式(ii)化合物或其药学上可接受的盐或药物组合物。
[0065]
在另一优选例中,所述的对象包括人和非人哺乳动物(如啮齿动物和灵长动物)。
[0066]
在另一优选例中,所述的对象为人,式(i)化合物和/或式(ii)化合物的施用剂量为1~20mg/kg;优选地,为5mg/kg。
[0067]
在另一优选例中,所述施用的频率为1-4次/天;优选地,为1次/天。
[0068]
在另一优选例中,所述施用的时间为2周-5年;优选地,为2月~1年。
[0069]
在另一优选例中,所述施用的方式为口服、注射、雾化吸入等;给药方式按照实际需要选用。
[0070]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在
此不再一一累述。
[0071]
本发明的有益效果包括:
[0072]
(a)为疼痛疾病治疗提供了一个新的靶点,有良好的应用前景。
[0073]
(b)发现了hv1通道中一个新的小分子或者药物分子结合口袋,提高了hv1通道活性分子发现效率。
[0074]
(c)发现了化合物ynv98-1和/或化合物ynv98-4具有显著的抑制hv1通道的作用。
[0075]
(d)发现了化合物ynv98-1和/或化合物ynv98-4具有显著的抗炎症的作用。
[0076]
(e)发现了化合物ynv98-1和/或化合物ynv98-4具有显著的抗病理痛的作用。
[0077]
(f)发现了化合物ynv98-1和/或化合物ynv98-4具有显著的降低吗啡导致的疼痛耐受和超敏。
附图说明
[0078]
图1为hv1通道中新的药物分子结合口袋,以及该口袋中yhv98-1,yhv98-4分别与hv1通道的结合模型。其中图1a显示了hv1通道中存在一个可成药的口袋;图1b显示了虚拟筛选中yhv98-1分子在hv1通道中结合模型;图1c显示了虚拟筛选中yhv98-4分子在hv1通道中结合模型。
[0079]
图2为yhv98-1对hv1通道的抑制能力。其中图2a为10μm yhv98-1抑制表达了hv1通道的hek-293t细胞的代表性电流曲线,图2b为yhv98-1抑制hv1通道的浓度依赖性曲线。
[0080]
图3为yhv98-4对hv1通道的抑制能力。其中图3a为10μm yhv98-4抑制表达了hv1通道的hek-293t细胞的代表性电流曲线,图3b为yhv98-4抑制hv1通道的浓度依赖性曲线。
[0081]
图4为hv1通道基因敲除小鼠和对照小鼠对疼痛的响应能力的比较图。wt代表野生型小鼠组;hv1 ko代表hv1通道敲除小鼠组。**表示p《0.01;***表示p《0.001,代表两组之间比较有显著差异。
[0082]
图5为保留神经损伤(sni)7天后小鼠von frey丝实验中yhv98-4具有缓解疼痛的作用的折线图。腹腔代表给药方式为腹腔给药。*表示p《0.05;**表示p《0.01,代表两组之间比较有显著差异。
[0083]
图6为小鼠cfa注射48小时后成炎性疼痛模型von frey丝实验中yhv98-4具有缓解疼痛的作用的折线图。腹腔代表给药方式为腹腔给药。*表示p《0.05;**表示p《0.01,代表两组之间比较有显著差异。
[0084]
图7为保留神经损伤(sni)7天后小鼠热辐射测定实验中yhv98-4具有缓解疼痛的作用的折线图。腹腔代表给药方式为腹腔给药。*表示p《0.05;**表示p《0.01,代表两组之间比较有显著差异。
[0085]
图8为小鼠cfa注射48小时后成炎性疼痛模型热辐射测定实验中yhv98-4具有缓解疼痛的作用。腹腔代表给药方式为腹腔给药。**表示p《0.01,代表两组之间比较有显著差异。
[0086]
图9为小鼠cfa注射48小时后成炎性痛模型炎症因子含量测定中yhv98-4具有降低体内炎症因子水平的作用的条形图。组代表注射生理盐水组;vehicle组代表注射溶剂组,yhv98-4代表注射药物组。*表示p《0.05;**表示p《0.01;***表示p《0.001,代表两组之间比较有显著差异。
[0087]
图10为yhv98-4化合物改善了吗啡疼痛超敏和耐受的结果图。(a)显示了yhv98-4化合物伴随吗啡同时给药的von frey丝实验中,yhv98-4能显著降低吗啡用药后导致的痛疼超敏现象;(b)显示吗啡耐受实验结果,yhv98-4改善了小鼠对吗啡耐受的剂量关系。腹腔代表给药方式为腹腔给药。*表示p《0.05;**表示p《0.01;***表示p《0.001,代表两组之间比较有显著差异,n.s.表示两组数据之间没有显著差异。
具体实施方式
[0088]
结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
[0089]
本发明人经过广泛而深入地研究,通过基因敲除hv1通道技术,发现相应小鼠的疼痛阈值明显提高,提示hv1通道可以作为治疗疼痛的靶标。通过计算机辅助药物设计与电生理相结合,首次发现hv1通道中存在一个小分子或者药物分子结合位点,并以该位点发现一种hv1抑制活性化合物。实验表明,本发明的化合物作为hv1通道的抑制剂,具有显著的镇痛效果,并降低相应的炎症因子含量,进一步的动物行为学实验还表明化合物能够显著的降低吗啡导致的疼痛耐受和超敏,可以用于预防和/或治疗疼痛、预防和/或治疗炎症、阻断吗啡导致的疼痛耐受和超敏。在此基础上,完成了本发明。
[0090]
具体地,本发明建立了hv1通道基因敲除小鼠模型,通过疼痛行为学实验发现,基因敲除小鼠对疼痛的阈值明显提高。
[0091]
本发明利用可成药口袋预测,发现在hv1通道胞内侧由s0和s1-s4的底端构成了一个可用于结合小分子或者药物分子的口袋,基于该口袋进行药物设计,并通过全细胞电生理检测进行了活性测试,发现化合物yhv98-1和yhv98-4具有显著的抑制hv1通道的作用,因此可作为hv1通道抑制剂的应用。
[0092]
本发明选用c57小鼠,进行了抗疼痛的行为学药效实验,经腹腔内注射yhv98-1和/或yhv98-4,结果发现式(i)化合物yhv98-1和/或式(ⅱ)化合物yhv98-4具有明显的镇痛效果和降低炎性因子作用,因此可作为制备治疗疼痛和抗炎药物的应用。
[0093]
本发明以不同组别c57小鼠每天腹腔内注射不同剂量的吗啡和yhv98-1、yhv98-4,进行了抗疼痛的行为学药效实验,结果发现式(i)化合物yhv98-1和式(ⅱ)化合物yhv98-4具有明显的阻断吗啡镇痛耐受以及改善吗啡所导致的疼痛超敏的作用,因此可作为制备治疗吗啡镇痛耐受和超敏药物的应用。
[0094]
如本发明所用,术语“本发明化合物”、“式(i)化合物”“化合物yhv98-1”、或“yhv98-1”可互换使用,指式(i)所示的化合物、或其药学上可接受的盐。
[0095]
如本发明所用,术语“本发明化合物”、“式(ⅱ)化合物”“化合物yhv98-4”、或“yhv98-4”可互换使用,指式(ⅱ)所示的化合物、或其药学上可接受的盐。
[0096]
在本发明中,还包括式(i)化合物和/或式(ⅱ)化合物以及上述两个化合物的药学上可接受的盐。术语“药学上可接受的盐”指本发明化合物与酸或碱所形成的适合用作药物的盐。药学上可接受的盐包括无机盐和有机盐。
[0097]
一类优选的药学上可接受的盐是本发明化合物与酸形成的盐。适合形成盐的酸包括但并不限于:盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸等无机酸;甲酸、乙酸、丙酸、草酸、丙
egta,用hcl调ph至6.0,细胞外液包含:180mm hepes,75mm nmdg,1mm mgcl2,1mm cacl2,用hcl调ph至7.2。测试时细胞在-60mv下钳制200ms,之后电压回到测试电压-80mv,时间为2s,然后再回到钳制电压-60mv,时间持续2s。整个4.2s的过程只有中间2s的测试电压是变化的,以每10mv的间隔递增至+80mv后结束循环。每个循环间隔为10s。采取全细胞膜片钳记录模式用epc10(heka)放大器来记录电流,采集到的数据用clampfit 10.4(molecular devices)来分析。数值越低,说明抑制活性越好。如图2所示,化合物yhv98-1对hv1通道具有显著的抑制能力,是hv1通道的抑制剂。如图3所示,化合物yhv98-4对thv1通道具有显著的抑制能力,是hv1通道的抑制剂。
[0110][0111]
实施例3敲除hvcn1基因对小鼠疼痛敏感度影响
[0112]
实验用小鼠:hvcn1基因敲除小鼠以c57b6为背景,由赛业生物(中国)公司使用crispr-cas9技术制备并提供。应用与hvcn1基因敲除小鼠具有相同遗传背景的野生型(wt)小鼠作为对照。全部动物实验均经华东师范大学伦理委员会批准。
[0113]
数据分析:所有数据分析采用spss 22(for mac)数据处理软件完成。统计比较采用使用单因素方差分析或双因素方差分析,采用lsd法多重比较校验结果。数据用mean
±
sem表示。p《0.05时标记一个星号;p《0.01时标记两个星号。
[0114]
小鼠von frey丝实验:von frey丝实验用于评价小鼠对触发性机械痛的耐受反应。采用von frey丝套件(可供0.008g-300g的刺激力),根据实际情况选定粗细得当的尼龙丝,调节适当的伸出长度,垂直地刺激皮肤,可通过调节伸长、更换尼龙丝调整刺激力大小,直到尼龙丝弯曲。小鼠受到机械刺激,它们会缩回反射,记录抬爪时所使用的刺激力强度,连续测量3次取平均值,该数值用于评估小鼠触发性机械痛的敏感程度。如图4所示,hv1通道基因敲除小鼠对触发性机械痛的敏感程度显著减低,提示hv1通道是治疗疼痛疾病的新靶点。
[0115]
实施例4动物药理药效实验
[0116]
本发明实施例中所用的受试药物包括:
[0117]
yhv98-4采用常规方法合成,盐酸吗啡注射液(10mg/ml)由东北制药集团沈阳制药有限公司生产,sfda批准文号:h21022436(辽宁,中国)。
[0118]
yhv98-4在本发明实施例中设一个剂量,为10mg/kg。给药方式为腹腔注射,10ml/kg。
[0119]
化合物的溶解:
[0120]
yhv98-4按照如下步骤溶解:(1)注射体积10%的dmso全部溶解;(2)加入注射体积的10%聚山梨酯80,混合均匀;(3)以注射体积80%的磺丁基醚倍它环糊精(20%)氯化钠盐溶液稀释至终体积。按该操作顺序,每一步斡旋30s,随后超声1min,当天配置使用。
[0121]
溶剂对照组:dmso:聚山梨酯80:磺丁基醚倍它环糊精(20%)氯化钠盐溶液=1:1:4。
[0122]
数据分析:所有数据分析采用spss 22(for mac)数据处理软件完成。统计比较采用使用单因素方差分析或双因素方差分析,采用lsd法多重比较校验结果。数据用mean
±
sem表示。p《0.05时标记一个星号;p《0.01时标记两个星号;p《0.001时标记三个星号。
[0123]
实验动物:8-10周龄balb/c或c57bl/6j雄性小鼠,近交系(inbred mice),是国际通用的实验鼠,购自上海灵畅实验动物有限公司。
[0124]
实施例4.1小鼠von frey丝实验
[0125]
von frey丝实验用于评价小鼠对触发性机械痛的耐受反应。采用von frey丝套件(可供0.008g-300g的刺激力),根据实际情况选定粗细得当的尼龙丝,调节适当的伸出长度,垂直地刺激皮肤,可通过调节伸长、更换尼龙丝调整刺激力大小,直到尼龙丝弯曲。小鼠受到机械刺激,它们会缩回反射,记录抬爪时所使用的刺激力强度,连续测量3次取平均值,该数值用于评估小鼠触发性机械痛的敏感程度。如图5所示,小鼠神经病理痛模型(保留神经损伤(spared nerve injury,sni)模型)造模7-14天后行von frey丝实验,腹腔注射yhv98-4(10mg/kg)后,小鼠触发性机械痛的敏感程度显著减低,提示yhv98-4能有效缓解小鼠的触发性机械痛敏。如图6所示,balb/c小鼠左侧跖底注射cfa(20μl)48-72小时后成炎性痛模型,腹腔注射yhv98-4(10mg/kg)能够显著降低小鼠触发性机械痛的敏感程度,提示yhv98-4能有效缓解炎性疼痛下小鼠的触发性机械痛敏。
[0126]
实施例4.2小鼠热辐射实验
[0127]
热辐射实验(hargreaves test)用于评价小鼠对恶意性热刺激的耐受反应。(1)将小鼠置于测试房间,适应环境1h
×
3d;(2)在树脂玻璃的格箱中适应30min;(3)调整辐射热源能量,使刺激强度基础值稳定于8-11s;(4)为避免损伤,截断值设定为20s;(5)记录抬爪的潜伏时间,连续测量3次,取平均值,两次连续测试的时间间隔为5min。如图7所示,小鼠sni造模7-14天后进行hargreaves test实验,腹腔注射yhv98-4(10mg/kg)后,小鼠热辐射刺激的缩爪反应时间显著延长,提示yhv98-4能有效缓解小鼠的热敏痛。如图8所示,balb/c小鼠左侧跖底注射cfa(20μl)48-72h后成炎性痛模型,腹腔注射yhv98-4(10mg/kg)能够显著延长热辐射刺激的缩爪反应时间,提示yhv98-4能显著缓解炎性疼痛下的热敏痛。
[0128]
实施例4.3小鼠体内抗炎症因子检测实验
[0129]
小鼠左后爪足底皮下注射20μl的cfa,初始对照组不注射。采用腹腔注射方式,每24小时给予2次的yhv98-4(10mg/kg)或对照溶剂注射。在注射cfa 24-48h后取小鼠后足部皮肤进行蛋白提取。蛋白提取使用procartaplex细胞裂解提取液(thermofisher scientific)。采用bca蛋白测定试剂盒(beyotime)来测定蛋白浓度。小鼠细胞因子和趋化因子含量检测采用鼠源细胞因子/趋化因子26-plex试剂盒完成(thermofisher scientific),细胞培养上清液中cxcl1含量检测采用小鼠cxcl1 elisa试剂盒(ek10019)。试剂盒检验按照制造商提供的说明书进行测定。如图9所示,和未造模的对照组比较,cfa模型小鼠中炎症因子cxcl1、il-1β、il-9和mip-1β含量明显升高,而注射yhv98-4又显著降低了这些炎症因子含量,提示yhv98-4能显著降低炎性疼痛下的炎症因子含量。
[0130]
实施例4.4小鼠对吗啡疼痛超敏和耐受影响的实验
[0131]
c57bl/6j小鼠随机分成空白对照组、模型组和模型给药组,每组8只,给药前进行
von frey试验检测小鼠基础痛阈,随后空白对照组:生理盐水,每天1次,连续注射9天;模型组小鼠(吗啡耐受模型):腹腔注射吗啡(10mg/kg),连续6天,每天1次,第7,8,9天分别注射不同剂量吗啡(1mg/kg,5mg/kg,10mg/kg);模型给药组(吗啡耐受+yhv98-4):在每天注射吗啡(10mg/kg)前15分钟腹腔注射yhv98-4(10mg/kg),连续注射6天,第7,8,9天分别注射不同剂量吗啡(1mg/kg,5mg/kg,10mg/kg)。从第6天开始(6-9天),每天进行von frey试验检测小鼠痛阈。在吗啡给药前30min(基线)和给药后15min进行von frey试验。最大镇痛百分率(%mpe)=(给药后痛阈-给药前痛阈)/(终止阈值-给药前痛阈)
×
100%。如图10a所示,von frey试验结果显示,模型组小鼠对机械痛触诱发痛更为敏感,而模型给药组小鼠的机械痛触诱发痛阈值更高,并能够形成显著性差异,表明腹腔注射yhv98-4可以改善吗啡用药产生的痛敏。yhv98-4能够显著降低吗啡用药后导致的疼痛过敏和耐受现象。如图10b所示,模型组小鼠的最大镇痛百分率显著低于模型给药组和空白对照组,表示吗啡疼痛耐受。而模型给药组小鼠的最大镇痛百分率和空白对照组没有显著差异,且显著高于模型组,表明腹腔注射yhv98-4能够改善吗啡耐受。
[0132]
应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。上述实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
[0133]
综上所述,hv1通道可以作为预防和/或治疗疼痛、预防和/或治疗炎症、阻断吗啡导致的疼痛耐受和超敏的新靶标,hv1通道抑制剂分子化合物能够在慢性炎性疼痛,神经病理性疼痛相关症状,包括机械痛和热敏痛等模型上减轻疼痛反应,并能够显著降低慢性炎性疼痛模型小鼠中炎症因子含量,显示hv1通道抑制剂分子化合物具有显著的抗多种疼痛和抗炎症的效果。在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
[0134]
本发明的保护内容不局限于以上实施例。在不背离本发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1