用于吸持生物组织的亲水界面制造方法及系统与流程
本发明涉及手术器械亲水界面的制造领域,尤其涉及用于吸持生物组织的亲水界面制造方法及系统。
背景技术:
与开放手术和传统腔镜手术不同,手术机器人通过机械装置映射动作完成手术操作,手术医师无法直接接触组织,无法通过肢体感受器实时反馈手术中组织亲水界面承受的力载荷,仅通过视觉反馈及手术医师的操作经验判断组织受力情况,存在力反馈缺失,无法及时、准确调控力载荷输出,容易导致组织撕裂、出血等不可逆损伤发生。因此,如何消除力反馈缺失条件下器械-组织亲水界面异常力学接触,避免组织损伤与滑脱,充分体现机器人手术微创治疗优势,成为临床工作中亟待解决的现实问题。
技术实现要素:
本发明提供了用于吸持生物组织的亲水界面制造方法及系统,用于解决现有的手术器械在夹持生物组织时,易造成组织损伤与滑脱的技术问题。
为解决上述技术问题,本发明提出的技术方案为:
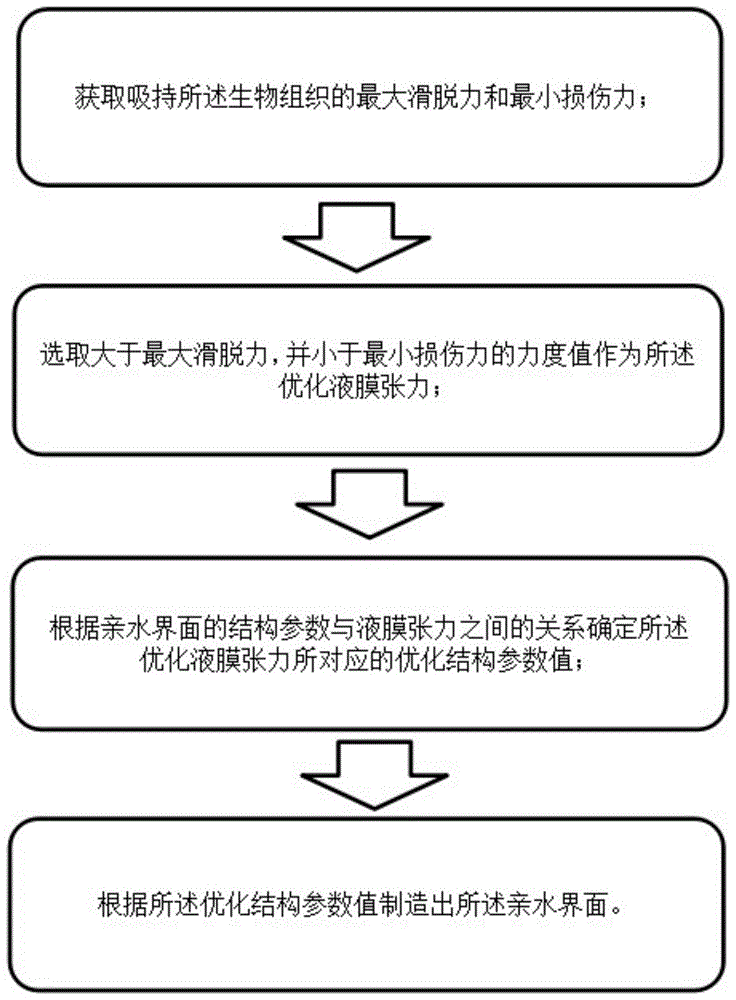
一种用于吸持生物组织的亲水界面制造方法,包括以下步骤:
获取吸持所述生物组织的最大滑脱力和最小损伤力;选取大于最大滑脱力,并小于最小损伤力的力度值作为所述优化液膜张力;根据亲水界面的结构参数与液膜张力之间的关系确定所述优化液膜张力所对应的优化结构参数值,根据所述优化结构参数值制造出所述亲水界面。
优选的,获取吸持所述生物组织的最大滑脱力和最小损伤力,具体包括以下步骤:
使用大小不同的力度对所述生物组织进行夹持试验,选取力度最小,且能夹持住所述生物组织的力度值作为最大滑脱力;选取力度最小,且对所述生物组织造成损伤的力度值作为最小损伤力。
优选的,根据亲水界面的结构参数与液膜张力之间的关系确定所述优化液膜张力所对应的优化结构参数值,具体包括以下步骤:
确定制备所述亲水界面所使用的纳米粒子的形状,根据所述纳米粒子的形状构建亲水界面的结构参数与液膜张力之间的目标函数模型;所述目标函数模型以所述结构参数为自变量,以所述液膜张力为因变量;
将所述优化液膜张力带入到所述目标函数模型中,求解出所述目标函数模型的最优解所对应的结构参数。
优选的,所述纳米粒子的形状为正六边形,所述结构参数包括所述纳米粒子的外接圆半径和相邻纳米粒子之间的间隙宽度。
优选的,所述目标函数模型为:
其中,r为所述纳米粒子的外接圆半径,h为液膜厚度,γ为液膜表面张力,w为相邻纳米粒子之间的间隙宽度,fl为液膜张力,s为所述亲水界面的表面积,所述表面积用于产生所述液膜张力,以吸持所述生物组织。
一种计算机系统,包括存储器、处理器以及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现上述任一所述方法的步骤。
本发明具有以下有益效果:
1、本发明中的用于吸持生物组织的亲水界面制造方法及系统,通过预先获取生物组织的最大滑脱力和最小损伤力,选取大于最大滑脱力,并小于最小损伤力的力度值作为所述优化液膜张力;根据亲水界面的结构参数与液膜张力之间的关系确定所述优化液膜张力所对应的优化结构参数值,根据所述优化结构参数值制造出所述亲水界面,从而实现对亲水界面的结构参数进行精准设计,将制造出的亲水界面的液膜张力精准的控制在最大滑脱力和最小损伤力之间,使亲水界面产生的液膜张力实现界面与人体组织稳定、无损伤的夹持和牵拉,避免现有的手术器械在夹持生物组织时,易造成组织损伤与滑脱的技术问题。
除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。下面将参照附图,对本发明作进一步详细的说明。
附图说明
构成本申请的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明中的用于吸持生物组织的亲水界面制造方法的流程图;
图2是本发明中优选实施例中的亲水界面的局部结构图;
图3是本发明优化实施例中的亲水界面的第一种结构图;
图4是本发明优化实施例中的亲水界面的第二种结构图。
具体实施方式
以下结合附图对本发明的实施例进行详细说明,但是本发明可以由权利要求限定和覆盖的多种不同方式实施。
实施例一:
在本发明中,最大滑脱力定义为沿组织表面的垂直方向能夹持住所述生物组织,防止组织从钳子滑脱的最小夹持力,最小损伤力定义为沿组织表面的垂直方向能夹持住所述生物组织,并引起组织损伤的最小夹持力;鉴于最大滑脱力、最小损伤力均与夹持力大小有关,因此将夹持力大小定义为将组织水平拉起或展开的力度。
亲水界面的吸持力来源为液膜张力、粘性依赖的流体动压力及分子间作用力(范德华力),其中,液膜张力起主要作用,而液膜张力又受亲水界面的结构影响,因此,可以通过调节亲水界面的结构参数,使制备出来的亲水界面的液膜张力处于生物组织的最大滑脱力和最小损伤力之间,制造出可稳定夹持,且不会到生物组织造成损伤的亲水界面。
因此,在本发明中,针对手术机器人手术力反馈缺失导致手术操作中组织容易出现损伤的临床问题,参考蝾螈、树蛙脚掌微结构,基于边界液膜调控机制、边界强摩擦力机理、方向性摩擦机理,采用光刻-覆膜技术,溅射-刻蚀技术,在器械界面低损伤形貌基础上,对夹持器械微表面进行多维度润湿性改造,构建界面亲水性微纳结构,形成亲水界面,增加器械界面边界液膜张力,边界摩擦力。
如图1所示,本发明公开了一种用于吸持生物组织的亲水界面制造方法,包括以下步骤:
获取吸持所述生物组织的最大滑脱力和最小损伤力;选取大于最大滑脱力,并小于最小损伤力的力度值作为所述优化液膜张力;根据亲水界面的结构参数与液膜张力之间的关系确定所述优化液膜张力所对应的优化结构参数值,根据所述优化结构参数值制造出所述亲水界面。
此外,在本实施例中,还公开了一种计算机系统,包括存储器、处理器以及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现上述任一所述方法的步骤。
本发明中的用于吸持生物组织的亲水界面制造方法及系统,通过预先获取生物组织的最大滑脱力和最小损伤力,选取大于最大滑脱力,并小于最小损伤力的力度值作为所述优化液膜张力;根据亲水界面的结构参数与液膜张力之间的关系确定所述优化液膜张力所对应的优化结构参数值,根据所述优化结构参数值制造出所述亲水界面,从而实现对亲水界面的结构参数进行精准设计,将制造出的亲水界面的液膜张力精准的控制在最大滑脱力和最小损伤力之间,使亲水界面产生的液膜张力实现界面与人体组织稳定、无损伤的夹持和牵拉,避免现有的手术器械在夹持生物组织时,易造成组织损伤与滑脱的技术问题。
实施例二:
实施例二是实施例的拓展实施例,其与实施例一的不同之处在于,对用于吸持生物组织的亲水界面制造方法进行了细化,具体包括以下步骤:
(1)获取吸持所述生物组织的最大滑脱力和最小损伤力:
步骤1:使用钳头沿生物组织表面的垂直方向用初始力度的夹持力(如1n)夹持所述生物组织,观测该力度下的钳头是否能夹持住生物组织;
1a:若不能夹持住所述生物组织(即钳头与组织间发生肉眼可见的移动时),则在初始力度的基础上逐步增加fα(如0.5n),并用每次增加fα后的夹持力夹持所述生物组织,直至增加fα后的夹持力夹持住所述生物组织,在当前夹持力的基础上逐步减少fμ(如0.1n),并用每次减少fμ后的夹持力夹持所述生物组织,直至减少fμ后的夹持力夹持不住所述生物组织,则当前夹持力+fμ即为所述最大滑脱力;
1b:若能夹持住所述生物组织(即钳头与组织间发生肉眼可见的移动时),则在初始力度的基础上逐步减少fα,并用每次减少fα后的夹持力夹持所述生物组织,直至减少fα后的夹持力夹持不住所述生物组织,在当前力度的基础上逐步增加fμ,并用每次增加fμ后的夹持力夹持所述生物组织,直至增加后的fμ的夹持力能夹持住所述生物组织,则该当前力度即为所述最大滑脱力;
步骤2:在最大滑脱力的基础上逐步增加fα,并用每次增加fα后的夹持力夹持所述生物组织,直至增加fα后的夹持力夹持所述生物组织时,造成肉眼可见的损伤,在当前力度的基础上逐步减少fμ,并用每次减少fμ后的夹持力夹持所述生物组织,直至减少fμ后的夹持力夹持住所述生物组织,且不会造成肉眼可见的损伤,则当前力度+fμ即为所述最大损伤力。
(2)选取大于最大滑脱力,并小于最小损伤力的力度值作为所述优化液膜张力:
由于在实际试验时,最大滑脱力和最小损伤力的测定中会存在一定的误差,因此,优选最大滑脱力与最小损伤力二值的中间值作为优化液膜张力。
(3)根据亲水界面的结构参数与液膜张力之间的关系确定所述优化液膜张力所对应的优化结构参数值:
确定制备所述亲水界面所使用的纳米粒子的形状,根据所述纳米粒子的形状构建亲水界面的结构参数与液膜张力之间的目标函数模型;所述目标函数模型以所述结构参数为自变量,以所述液膜张力为因变量;
将所述优化液膜张力带入到所述目标函数模型中,求解出所述目标函数模型的最优解所对应的结构参数。
在本实施例中,所述纳米粒子的形状为正六边形,所述结构参数包括所述纳米粒子的外接圆半径和相邻纳米粒子之间的间隙宽度,为达到“夹而不滑,持而不伤”的目的,必须使微纳结构参数:纳米粒子的外接圆半径和相邻纳米粒子之间的间隙宽度保持在一定的范围内,才能使液膜张力处于生物组织的安全域范围内,安全域范围为[最大滑脱力,最小损伤力)。
如图2所示,纳米粒子可产生液膜张力,相邻纳米粒子之间的间隙部分无液膜张力。因此对于整个亲水界面而言,其平均液膜张力相当于上图三个蓝色区域产生的液膜张力平均分布于边长为l的三角形组成的区域内,即1/2个六边形产生的液膜张力均匀分布于三角形区域内,因此,采用如下目标函数模型计算液膜张力:
其中,r为所述纳米粒子的外接圆半径,h为液膜厚度,γ为液膜的表面张力,w为相邻纳米粒子之间的间隙宽度,fl为液膜张力,s为所述亲水界面的表面积,所述表面积用于产生所述液膜张力,以吸持所述生物组织,根据应用的器械的夹持装置大小设定。
其中,在本实施例中,液膜的表面张力γ可以用harkins(哈根斯)的经验公式:γ=75.796-0.145t-0.00024t2,t为摄氏温度,γ单位为mn/m,该经验公式的适用温度为10-60℃,且35度时,γ为70.427mn/m。
其中,根据实际经验,当液膜厚度小于200nm时,纳米粒子的表面的液膜变形与生物组织粘黏接触,达到纳米粒子吸附生物组织的作用,当液膜厚度进一步减小时,液膜的表面张力γ难以进一步维持变形,从而纳米粒子表面快速脱离生物组织,并在之间留下残余液体。因此,将液膜厚度暂定为200nm。
其中,由于界面实际应用于手术机器人的夹持装置上,根据夹持装置与生物组织的接触面的大小,在本实施例中,亲水界面的尺寸定义为长20mm,宽5mm,即亲水界面的表面积为100×106um2。
在确定液膜厚度、亲水界面的表面积以及液膜的表面张力以及优化液膜张力后,将所述液膜厚度、亲水界面的表面积以及液膜的表面张力以及优化液膜张力代入到所述目标函数模型中,并以选用的纳米粒子的外接圆半径阈值以及间隙宽度阈值作为约束条件,即0<r<50nm,求解出所述目标函数模型的最优解,其中,所述纳米粒子的外接圆半径阈值及间隙宽度阈值选取的纳米粒子的种类以及选用的制备工艺、设备确定。
其中,根据纳米粒子最优解所对应的纳米粒子的外接圆半径以及间隙宽度制造出所述亲水界面可通过光刻-覆膜法,3d打印法制备。
其中,构建出的第一种亲水界面如图3所示,图3的左图为本发明中的第一种清水界面的宏观俯视图,在图3中黑色部分表示微纳结构,白色部分为沟槽部;图3中的中图为左图部分界面的放大,图3中图的上部分为左图黑色部分的放大,左图的黑色部分(即微纳结构)是由沟槽相间的灰色六边形部分组成,灰色区域为与组织的接触部分,黑色部分为小沟槽,白色部分为大沟槽。图3右图为整个界面的宏观侧视图:灰色柱子代表中图的六边形,两灰色柱间的白色区域代表中图的小沟槽;两黑色柱间的白色区域代表中图的大沟槽。
在图3中,该界面的宏观结构为白色的沟槽部分和黑色的接触区域,从宏观角度看是通过组织的咬合形变达到夹持的目的,进一步放大后可见黑色接触区域有大量的六边形仿生结构,该结构可通过产生的液膜张力对组织进行夹持,图3中的亲水界面即保留了传统组织钳的特征,又整合了新型仿生组织钳的优势。
其中,构建出的第二种亲水界面如图4所示,图4的左图为第二种界面的宏观俯视图,其中,黑色部分表示微纳结构,白色部分为沟槽部;图4的中图为左图部分界面的放大图,其中,上部分为左图黑色部分的放大,可见图4的左图的黑色部分(即微纳结构)是由沟槽相间的六边形部分组成,其中,六边形是由更为微小的灰色点的圆柱组成。其中灰色区域为与组织的接触部分,黑色部分为小沟槽,白色部分为大沟槽。图4的右图为整个界面的宏观侧视图:灰色柱子代表中图的圆柱,两灰色圆柱间的白色区域代表中图的小沟槽;两黑色柱间的白色区域代表中图的大沟槽。图4中的第二种亲水界面的六边形结构较图3更为微小,可视为在图3结构上增加了二级结构,此界面有六边形结构,并且在六边形结构上具有更为精细的二级结构,更符合树蛙、蝾螈脚掌微纳结构。
在本实施例中,所述生物组织既可以是人体组织也可以是动物组织,其中生物组织可以为胃、小肠、结肠、直肠、肝、胆、血管、网膜等。
本实施例中制造出来的界面既可以用于手术机器人的夹持装置上,也可以用于其他医疗器械上,如腹腔镜、外科用钳、外科镊夹等,亦可用于其他生物医疗器械上。
本发明中的用于吸持生物组织的亲水界面制造方法,具体可应用于构建手术机器人器械亲水性微纳结构界面,并对亲水性微纳结构的结构参数进行精准设计,到达增加界面边界液膜张力,边界摩擦力,仅通过器械界面边界液膜张力产生的边界摩擦力实现界面与人体组织稳定夹持、牵拉,无组织形变损伤。同时根据不同人体组织(如胃、小肠、结肠、直肠、肝、胆、血管、网膜等)损伤力载荷范围,明确与之相对应的亲水性界面的微结构参数,设计界面最大液膜张力<最小损伤力,可在组织即将发生损伤时,实现界面与组织脱离。研究、制造适用于人体不同组织的无损伤机器人器械界面。
其中,依据上述步骤,实验计算得到以下各种生物组织的优选亲水界面:
小肠:本团队既往对家兔小肠的安全域测量结果为:最小损伤力为5.6-8.56n(光面钳头),鉴于此,我们将人体肠道组织的安全域估计为7-12n左右。同时,由于受到制备工艺的限制,所能制备出的微纳结构最小形貌为16um。因此,针对小肠组织,我们可制备出间隙宽度为16um,纳米粒子外接圆直径为25-70um的六边形仿生界面;或者间隙宽度为30um,纳米粒子外接圆直径为50-130um,亦或间隙宽度为50um,纳米粒子外接圆直径为80-220um,依次类推。
结肠:采用16mm*8mm大小的平面钳,在5n拉力下,猪盲肠的安全域值为22-37n。考虑到人体手术中牵拉力小于5n,因此人体结肠的安全域估计值为10-18n。因此,针对小肠组织,我们可制备出间隙宽度为16um,纳米粒子外接圆直径为40-200um的六边形仿生界面;或者间隙宽度为30um,纳米粒子外接圆直径为75-200um,亦或间隙宽度为50um,纳米粒子外接圆直径为120-330um;
肝脏:在无拉力条件下采用24.0mm2的齿形钳对新鲜猪肝进行夹持,组织损伤力为5n。因此人体肝组织的安全域估计值为6-10n。因此,针对小肠组织,我们可制备出间隙宽度为20um,纳米粒子外接圆直径为16-50um的六边形仿生界面;或者间隙宽度为30um,纳米粒子外接圆直径为25-80um,亦或间隙宽度为50um,纳米粒子外接圆直径为40-120um。
胃:考虑到胃壁组织较厚,肌肉层及粘膜下层丰富,抗压能力较强,将胃组织安全域值估计为12-20n。因此,针对小肠组织,我们可制备出沟槽宽度为16um,六边形直径为50-550um的六边形仿生界面;或者沟槽宽度为30um,六边形直径为100-1000um,亦或沟槽宽度为50um,六边形直径为170-1800um,依次类推
血管:血管壁中含有丰富的弹性纤维,但血管内膜较脆弱,容易受力而破坏,血管安全域值估计为9-15n。因此,针对小肠组织,我们可制备出沟槽宽度为16um,六边形直径为35-100um的六边形仿生界面;或者沟槽宽度为30um,六边形直径为60-180um,亦或沟槽宽度为50um,六边形直径为100-300um。
综上所述,本发明中的用于吸持生物组织的亲水界面制造方法及系统,研究不同人体组织(如胃、小肠、结肠、直肠、肝、胆、血管、网膜等)损伤力载荷范围(即,在垂直方向上最小损伤力和最大滑脱力差值组成的安全域)、不同人体组织生理解剖特征和不同类型亲水性界面的微纳结构参数之间的相互关系,探索不同组织的损伤力载荷范围,及不同亲水性微纳结构产生最大边界摩擦力;通过对界面微纳结构参数的精准控制,实现界面最大液膜张力<组织最小损伤力,在组织损伤前,界面与组织自动脱离,避免器械-组织力学损伤,此功能为现有腹腔镜手术器械、现有进口手术机器人器械所不具备。
以上所述仅为本发明的优化实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!