KLK8基因的用途及相关产品
klk8基因的用途及相关产品
技术领域
1.本发明涉及医药技术领域,特别是涉及klk8基因的用途及相关产品。
背景技术:
2.糖尿病是由胰岛素分泌异常或作用缺陷引起、以长期高血糖为主要特征,全身多器官系统病变的代谢紊乱综合征。糖尿病如果不能够得到及时的控制和治疗,将会引发多种并发症,包括糖尿病心肌病、糖尿病视网膜膜病变、糖尿病足病、糖尿病肾病等。作为一类特殊心脏疾病,糖尿病心肌病的发病不依赖于冠状动脉疾病和高血压等心脏危险因素,以心脏重塑和心脏功能紊乱为主要特征,是导致糖尿病患者慢性心力衰竭和心源性死亡的重要原因。而心肌间质纤维化作为糖尿病心脏重塑的主要病理学特征,其发生要早于心脏功能紊乱,最早表现为左心室舒张期僵直,进而可能导致舒张期充盈功能障碍;随着病情发展,糖尿病患者逐渐发展为左心室收缩功能障碍。而糖尿病心肌病心肌间质纤维化在细胞水平上的表现主要为成纤维细胞增殖活化以及间质胶原沉积的增加。因此,揭示糖尿病心肌病心肌间质纤维化发生的机制,并借此找到可以抑制或逆转糖尿病心肌病心肌间质纤维化发展的具体疗法,对于提高糖尿病心肌病的防治水平具有重要的理论和临床价值。
3.组织激肽释放酶相关肽酶8(kallikrein-8,klk8)又称neuropsin,是组织激肽释放酶相关的丝氨酸蛋白酶,主要在皮肤和大脑的海马区域表达,可通过突触重塑来调节记忆的形成。我们的研究发现糖尿病小鼠心脏中klk8表达显著升高,并且可导致内皮细胞发生间充质转化(endothelial-to-mesenchymal transition,endmt),且klk8缺失可逆转糖尿病心脏endmt,这提示klk8可作为糖尿病心肌病心脏损伤发生发展过程中的分子标志物,并可作为治疗糖尿病心肌病心脏损伤的靶点。
技术实现要素:
4.鉴于以上所述现有技术的缺点,本发明的目的在于提供klk8基因的用途及相关产品,用于解决现有技术中的问题。
5.为实现上述目的及其他相关目的,本发明采用如下技术方案:
6.本发明的第一方面,klk8作为靶标在制备糖尿病心肌病心脏损伤治疗药物或者制备糖尿病心肌病心脏损伤诊断药物的用途。
7.本发明的第二方面,提供klk8抑制剂在制备至少具备以下功效之一的产品的用途:
8.抑制klk8基因表达;
9.抑制klk8活性;
10.治疗糖尿病心脏冠状动脉内皮细胞向充质细胞形态转化;
11.治疗糖尿病心肌病心脏内皮细胞向充质细胞形态转化;
12.治疗糖尿病心肌病心脏内皮功能紊乱;
13.治疗糖尿病心脏组织纤维化。
14.本发明的第三方面,提供一种降低心脏内皮细胞中klk8基因表达的核酸分子,所述核酸分子包含:双链rna或shrna,所述双链rna中含有能够与klk8基因杂交的核苷酸序列,所述shrna中含有能够与klk8基因杂交的核苷酸序列。
15.其中,所述双链rna包含第一链和第二链,所述第一链和所述第二链互补共同形成rna二聚体,并且所述第一链的序列与klk8基因中的靶序列基本相同;所述shrna包括正义链片段和反义链片段,以及连接所述正义链片段和反义链片段的茎环结构,所述正义链片段和所述反义链片段的序列互补,并且所述正义链片段的序列与klk8基因中的靶序列基本相同。
16.本发明的第四方面,提供一种klk8基因干扰核酸构建体,含有编码第一方面所述核酸分子中的shrna的基因片段,能表达所述shrna。
17.本发明的第五方面,提供一种klk8基因干扰慢病毒,由第四方面所述干扰核酸构建体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装而成。
18.本发明的第六方面,提供第三方面所述核酸分子,或第四方面所述klk8基因干扰核酸构建体,或第五方面所述的klk8基因干扰慢病毒的用途,为:用于制备预防或治疗糖尿病心肌病心脏损伤的药物,或用于制备检测心脏内皮细胞中klk8基因表达的试剂盒。
19.本发明第七方面,提供一种用于预防或治疗糖尿病心肌病心脏损伤的组合物,其有效物质含有:第三方面所述的核酸分子;和/或,第四方面所述klk8基因干扰核酸构建体;和/或,第五方面所述的klk8基因干扰慢病毒,以及药学上可接受的载体、稀释剂或赋形剂。
20.如上所述,本发明的具有以下有益效果:
21.klk8基因表达可减轻1型糖尿病小鼠心脏功能紊乱,可以减轻糖尿病心肌病心脏组织endmt,用于糖尿病心肌病心脏损伤的治疗靶点。
附图说明
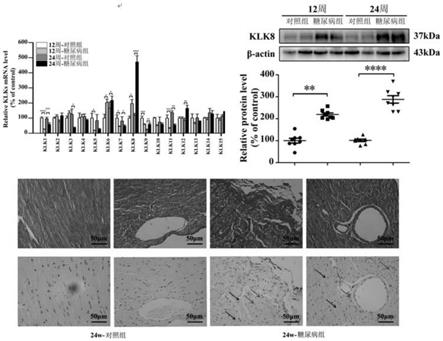
22.图1为糖尿病小鼠心脏klk8表达显著增加的表征图。
23.图2为klk8缺失可逆转糖尿病心脏纤维化的表征图。
24.图3为klk8过表达可导致冠状动脉内皮损伤、内皮细胞间质转化表征图。
25.图4为klk8缺失可逆转糖尿病心脏内皮损伤和endmt表征图。
26.图5为klk8敲低可减轻高糖导致的冠状动脉内皮细胞功能紊乱和和endmt表征图。
具体实施方式
27.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
28.本发明确认糖尿病小鼠心脏中klk8表达显著升高,并且可导致心脏内皮细胞发生间充质转化(endothelial-to-mesenchymal transition,endmt),且klk8缺失可逆转糖尿病心脏endmt,这提示klk8可作为糖尿病心肌病心脏损伤发生发展过程中的分子标志物,并可作为治疗糖尿病心肌病心脏损伤的靶点。
29.本发明的第一方面,klk8作为靶标在制备糖尿病心肌病心脏损伤治疗药物或者制
备糖尿病心肌病心脏损伤诊断药物的用途。
30.所述人klk8基因作为靶标在制备糖尿病心肌病心脏损伤药物具体是指:将klk8基因作为作用对象,对药物或制剂进行筛选,以找到可以抑制人klk8基因表达的药物作为糖尿病心肌病心脏损伤治疗备选药物。如本发明所述的klk8基因小分子干扰rna(sirna)即是以人klk8基因为作用对象筛选获得的,可用作具有抑制糖尿病心脏纤维化作用的药物,具体地,可抑制糖尿病心脏内皮细胞间质转化。除此之外,诸如抗体药物,小分子药物等也可将klk8基因作为作用对象。
31.所述将人klk8基因作为靶标用于制备糖尿病心肌病心脏损伤诊断药物具体是指:将klk8基因表达产物作为一项糖尿病心脏内皮细胞纤维化诊断指标应用于糖尿病心肌病心脏损伤诊断药物的制备。
32.实验发现糖尿病小鼠心脏中klk8表达显著升高,并且导致心脏内皮细胞中发生间充质转化(endothelial-to-mesenchymal transition,endmt),且klk8缺失可逆转糖尿病心脏endmt,证明klk8可作为糖尿病心肌病心脏损伤发生发展过程中的分子标志物,并可作为治疗糖尿病心肌病心脏损伤的靶点。
33.所述糖尿病心肌病心脏损伤治疗药物为能够特异性抑制klk8基因的转录,从而降低心脏内皮细胞中klk8基因的表达水平,抑制糖尿病心脏内皮细胞向间质细胞转化,实现治疗心脏纤维化的目的。
34.所述通过klk8基因制备获得的心脏纤维化治疗药物或者心脏纤维化诊断药物包括但不限于:核酸分子、碳水化合物、脂类、小分子化学药、抗体药、多肽、蛋白或干扰慢病毒。
35.所述核酸包括但不限于:反义寡核苷酸、双链rna(dsrna)、核酶、核糖核酸内切酶iii制备的小干扰rna或者短发夹rna(shrna)。
36.所述纤维化治疗药物的施用量为足够降低人klk8基因的转录的剂量。以使人klk8基因的表达至少被降低50%、80%、90%、95%或99%。
37.采用前述心脏纤维化治疗药物治疗心脏纤维化的方法,主要是通过降低人klk8基因的表达水平抑制糖尿病心脏内皮细胞发生间质化达到治疗的目的。具体的,治疗时,将能有效降低人klk8基因表达水平的物质给药于患者。
38.在一种实施方式中,所述klk8基因的靶标序列如seq id no:1所示。具体为:
[0039]3’-
tggaggaccacaaccatgatctgat-5’[0040]
本发明第二方面,提供klk8抑制剂在制备至少具备以下功效之一的产品中的用途:
[0041]
抑制klk8基因表达;
[0042]
抑制klk8活性;
[0043]
治疗糖尿病心脏冠状动脉内皮细胞向充质细胞形态转化;
[0044]
治疗糖尿病心肌病心脏内皮细胞向充质细胞形态转化;
[0045]
治疗糖尿病心肌病心脏内皮功能紊乱;
[0046]
治疗糖尿病心脏组织纤维化。
[0047]
klk8抑制剂是指对于klk8具有抑制效果的分子。对于klk8具有抑制效果包括但不限于:抑制klk8的表达或活性。
[0048]
抑制klk8活性是指使klk8活力下降。优选地,相比抑制前,klk8活力下降至少10%,较佳的降低至少30%,再佳的降低至少50%,更佳的降低至少70%,最佳的降低至少90%。
[0049]
抑制klk8表达具体的可以是抑制klk8基因的转录或翻译,具体的,可以是指:使klk8的基因不转录,或降低klk8的基因的转录活性,或者使klk8的基因不翻译,或降低klk8的基因的翻译水平。
[0050]
本领域技术人员可以使用常规方法对klk8的基因表达进行调节,如基因敲除、同源重组,干扰rna等。
[0051]
klk8的基因表达的抑制可以通过pcr及western blot检测表达量验证。
[0052]
优选地,与野生型相比,klk8基因表达降低至少10%,较佳的降低至少30%,再佳的降低至少50%,更佳的降低至少70%,又佳的降低至少90%,最佳地klk8基因完全没有表达。
[0053]
所述产品必然包括klk8抑制剂,并以klk8抑制剂作为前述功效的有效成分。
[0054]
所述产品中,发挥前述功用的有效成分不仅为klk8抑制剂,亦可包含其他可起到前述功用的分子。
[0055]
亦即,klk8抑制剂为所述产品的唯一有效成分或有效成分之一。
[0056]
所述产品可以为单成分物质,亦可为多成分物质。
[0057]
所述产品的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
[0058]
所述产品主要针对的对象为哺乳动物。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或人。
[0059]
所述产品包括但不限于药物、保健品、食品等。
[0060]
所述klk8抑制剂可以为核酸分子、抗体、小分子化合物。
[0061]
如本发明实施例列举的,所述klk8抑制剂可以为降低心脏内皮细胞中klk8基因表达的核酸分子。具体的,可以是双链rna或shrna。
[0062]
本发明第三方面,提供一种降低心脏内皮细胞中klk8基因表达的核酸分子,所述核酸分子包含:双链rna或shrna。所述双链rna中含有能够与klk8基因杂交的核苷酸序列,所述shrna中含有能够与klk8基因杂交的核苷酸序列。
[0063]
所述双链rna包含第一链和第二链,所述第一链和所述第二链互补共同形成rna二聚体,并且所述第一链的序列与klk8基因中的靶序列基本相同。
[0064]
在一实施例中,所述klk8基因中的靶序列即为核酸分子用于特异性沉默klk8基因表达时,被所述核酸分子识别并沉默的mrna片段所对应的klk8基因中的片段。
[0065]
优选地,所述双链rna的靶序列如seq id no:1所示。具体为:3
’-
tggaggaccacaaccatgatctgat-5’。
[0066]
更优选地,所述双链rna第一链的序列如seq id no:2所示,具体为5
’-
uggaggaccacaaccaugaucugau-3’。所述双链rna第二链的序列如seq id no:3所示,具体为5
’-
accuccugguguugguacuagacua-3’。
[0067]
进一步的,所述双链rna为小干扰rna(sirna)。
[0068]
seq id no:2为以seq id no:1所示的序列为rna干扰靶序列设计的、针对人klk8
基因的小干扰rna的一条链,另一条链即第二链的序列与第一链序列互补,该sirna可以起到特异性沉默心脏内皮细胞klk8基因表达的作用,具体地,异性沉默心脏冠状动脉内皮细胞的klk8基因表达。
[0069]
所述shrna包括正义链片段和反义链片段,以及连接所述正义链片段和反义链片段的茎环结构,所述正义链片段和所述反义链片段的序列互补,并且所述正义链片段的序列与klk8基因中的靶序列基本相同。
[0070]
优选地,所述sh rna的靶序列如seq id no:1所示。所述shrna经酶切加工后可成为小干扰rna(sirna)进而起到特异性沉默心脏内皮细胞中内源klk8基因表达的作用。
[0071]
优选地,所述shrna的茎环结构的序列可选自以下任一:uucaagaga、aug、ccc、uucg、ccacc、ctcgag、aagcuu和ccacacc。
[0072]
更优选地,所述shrna的序列如seq id no:4所示。具体为5'-caccggaggaccacaaccaugaucuuucaagagaagaucaugguugugguccucc-3'。
[0073]
优选地,所述klk8基因来源于人。
[0074]
本发明第四方面,提供一种klk8基因干扰核酸构建体,含有编码第一方面所述核酸分子中的shrna的基因片段,能表达所述shrna。
[0075]
所述的klk8基因干扰核酸构建体可以是将编码前述人klk8基因shrna的基因片段克隆入已知载体获得。
[0076]
进一步的,所述klk8基因干扰核酸构建体为klk8基因干扰慢病毒载体。
[0077]
本发明公开的klk8基因干扰慢病毒载体是将编码前述klk8基因shrna的dna片段克隆入已知载体获得,所述已知载体多为慢病毒载体,所述klk8基因干扰慢病毒载体经过病毒包装成为有感染力的病毒颗粒后,感染糖尿病心肌病心肌细胞,进而转录出本发明所述shrna,通过酶切加工等步骤,最终获得所述sirna,用于特异性沉默klk8基因的表达。
[0078]
进一步的,所述klk8基因干扰慢病毒载体还含有启动子序列和/或编码心脏冠状动脉内皮细胞中可被检测的标记物的核苷酸序列;较优的,所述可被检测的标记物如绿色荧光蛋白(gfp)。
[0079]
进一步的,所述慢病毒载体可以选自:plko.1-puro、plko.1-cmv-tgfp、plko.1-puro-cmv-tgfp、plko.1-cmv-neo、plko.1-neo、plko.1-neo-cmv-tgfp、plko.1-puro-cmv-tagcfp、plko.1-puro-cmv-tagyfp、plko.1-puro-cmv-tagrfp、plko.1-puro-cmv-tagfp635、plko.1-puro-ubc-turbogfp、plko.1-puro-ubc-tagfp635、plko-puro-iptg-1xlaco、plko-puro-iptg-3xlaco、plp1、plp2、plp/vsv-g、pentr/u6、plenti6/block-it-dest、plenti6-gw/u6-laminshrna、pcdna1.2/v5-gw/lacz、plenti6.2/n-lumio/v5-dest、pgcsil-gfp或plenti6.2/n-lumio/v5-gw/lacz中的任一。
[0080]
本发明实施例具体列举了以pgcsil-gfp为载体构建的人klk8基因干扰慢病毒载体,命名为pgcsil-gfp-klk8-shrna。
[0081]
本发明的klk8基因sirna可用于抑制klk8基因表达,抑制klk8活性,进一步地可以用作治疗糖尿病心肌病心脏内皮功能紊乱、治疗糖尿病心肌病心脏内皮细胞向充质细胞形态转化和治疗糖尿病心脏组织纤维化的药物或制剂。klk8基因干扰慢病毒载体则可用于制备所述klk8基因sirna。当用作治疗糖尿病心肌病心脏内皮功能紊乱、治疗糖尿病心肌病心脏内皮细胞向充质细胞形态转化和治疗糖尿病心脏组织纤维化的药物或制剂时,是将安全
有效量的所述核酸分子施用于哺乳动物。具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0082]
本发明第五方面,提供一种klk8基因干扰慢病毒,由第四方面所述干扰核酸构建体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装而成。
[0083]
该慢病毒可感染心脏内皮细胞并产生针对klk8基因的小分子干扰rna,从而抑制心脏冠状动脉内皮细胞向间质细胞形态转化。该klk8基因干扰慢病毒可用于制备预防或治疗糖尿病心肌病心脏损伤的药物。
[0084]
本发明第六方面,提供第三方面所述的核酸分子,或第四方面所述klk8基因干扰核酸构建体,或第五方面所述的klk8基因干扰慢病毒的用途,为:用于制备预防或治疗糖尿病心肌病心脏损伤的药物,或用于制备检测糖尿病心脏内皮细胞中klk8基因表达的试剂盒。
[0085]
所述预防或治疗糖尿病心肌病心脏损伤的药物的应用为糖尿病心肌细胞纤维化的治疗提供了一种方法,具体为一种预防或治疗对象体内糖尿病心肌细胞纤维化的方法,包括将有效剂量的所述的药物施用于对象中。
[0086]
进一步的,所述药物用于预防或治疗对象体内糖尿病心脏内皮细胞中时,需要将有效剂量的所述的药物施用于对象中。采用该方法,所述糖尿病心脏内皮细胞抑制klk8基因表达。进一步的,所述糖尿病心脏内皮细胞中klk8基因表达的10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%被抑制。
[0087]
所述方法的对象可以为人。
[0088]
本发明第七方面,提供一种用于预防或治疗糖尿病心肌病心脏损伤的组合物,其有效物质含有:第三方面所述的核酸分子;和/或,第四方面所述klk8基因干扰核酸构建体;和/或,第五方面所述的klk8基因干扰慢病毒,以及药学上可接受的载体、稀释剂或赋形剂所述组合物可以为药物组合物。
[0089]
当所述组合物用于预防或治疗对象体内糖尿病心脏内皮细胞时,需要将有效剂量的所述的组合物施用于对象中。采用该方法,抑制所述糖尿病心脏内皮细胞的klk8基因表达。进一步的,所述糖尿病心脏内皮细胞中klk8基因表达的10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%被抑制。
[0090]
所述组合物的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
[0091]
所述组合物主要针对的对象为哺乳动物。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或人。
[0092]
综上所述,本发明设计了针对人klk8基因的rnai靶点序列,构建相应的klk8 rnai载体,其中rnai载体(klk8-sirna)能够显著下调klk8基因的表达。
[0093]
此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范
围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
[0094]
实施例1
[0095]
实验动物为清洁级c57小鼠。通过腹腔注射stz构建1型糖尿病小鼠。将实验小鼠随机分为以下4组(每组7只),12周或24周后取材检测相关指标,stz为链脲佐菌素。
[0096]
野生型对照组:小鼠禁食10小时后连续两天腹腔注射100mg/kg生理盐水。
[0097]
野生型糖尿病组:小鼠禁食10小时后连续两天腹腔注射100mg/kgstz,1周后尾静脉取血检测血糖浓度,高于16.7mmol/dl即为1型糖尿病模型。
[0098]
klk8敲除组:小鼠禁食10小时后连续两天腹腔注射100mg/kg生理盐水。
[0099]
klk8敲除糖尿病组:小鼠禁食10小时后连续两天腹腔注射100mg/kgstz,1周后尾静脉取血检测血糖浓度,高于16.7mmol/dl即为1型糖尿病模型。
[0100]
12周或24周后,麻醉小鼠,超声心动图检测小鼠心脏功能,之后进行心脏组织取材。心脏组织用液氮冷冻后,部分组织检测klks家族成员基因表达水平;另一部分进行免疫印迹,检测klk8等蛋白水平表达。
[0101]
(一)小鼠心脏组织klks mrna表达
[0102]
1.1.rna提取
[0103]
(1)取心室肌组织30mg并放于2ml ep管(无rna酶),加入高温处理的磁珠,60hz/20s匀浆以充分粉碎;
[0104]
(2)400ul/孔加入三氯甲烷后votex充分混匀后5min静置处理;
[0105]
(3)4℃、12000rpm/min、20min取500ul上清于1.5ml ep管后加等量500ul异丙醇,颠倒15-20次以充分混匀混合液,-20℃过夜;
[0106]
(4)4℃、12000rpm/民,20min后离心管底可见rna白色沉淀,去除上清后depc水配制的75%乙醇,充分洗涤后去除残留液体,当白色rna斑块转为透明后加12-13ul depc水(去rna酶)。
[0107]
1.2.逆转录
[0108]
将rna反转录为cdna,以下为20ul体系:
[0109][0110]
程序:25℃/10min
→
42℃/1h
→
72℃/10min。
[0111]
1.3.实时定量pcr
[0112]
反应体系:
[0113][0114]
反应程序:95℃/5min,95℃/30s
→
退化温度/30秒
→
72℃/30s
→
95℃
……→
72℃、30秒
→
4℃,循环数40。
[0115]
1.4.半定量计算心肌组织klks基因表达。
[0116]
(二)小鼠心脏组织klk8蛋白表达
[0117]
心肌组织蛋白提取
[0118]
(1)取心室肌组织30mg并于2ml ep管,按照1ml/管加ripa(含磷酸酶抑制剂与pmsf);
[0119]
(2)加入高温处理的磁珠,60hz/20s进行匀浆以充分粉碎组织;
[0120]
(3)离心:4℃、12000rpm/min、5分钟;
[0121]
(4)bca方法测定蛋白浓度;
[0122]
(5)应用5*蛋白上样缓冲液,99℃/10min进行蛋白变性;
[0123]
蛋白印迹杂交
[0124]
(1)配胶方案:
[0125][0126]
(2)按20ul/lane上样;
[0127]
(3)电泳:80v/30min—120v/60min;
[0128]
(4)转膜:运用天能转膜系统将蛋白从胶转移至pvdf膜,转膜条件100v/90min;
[0129]
(5)抗体孵育;
[0130]
(6)显影;
[0131]
(7)半定量分析心肌组织klk8表达;
[0132]
(三)小鼠心脏组织masson染色
[0133]
(1)动物心脏灌注处理:动物进行麻醉处理后四肢固定后开胸暴露心脏,剪开右心耳,将吸有1*pbs的针管刺入左心室,持续缓慢注入心脏,待心脏逐渐转呈灰白色,拔出吸有
1*pbs的针管后将吸有4%多聚甲醛固定液针管插入左心室同意进针处,以100ml固定液持续缓慢灌注,灌流后小心取下心脏放入含有4%多聚甲醛固定液的离心管。
[0134]
(2)组织包埋、切片、脱蜡:将组织置于石蜡做成组织蜡块,并切成5μm石蜡切片后进行脱蜡处理;
[0135]
(3)染色:用regaud苏木精染液染核5-10分钟后充分水洗,masson丽春红酸性复红液染色5-10分钟,2%冰醋酸水溶液稍稍浸洗后1%磷钼酸水溶液分化3-5min;
[0136]
(4)染色:苯胺蓝染色5分钟后以2%冰醋酸水溶液稍稍浸洗;
[0137]
(5)封片:95%酒精、无水酒精、二甲苯透明、中性树胶封片。
[0138]
(四)小鼠心脏组织免疫组织化学染色
[0139]
(6)石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ15min-二甲苯ⅱ15min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-85%酒精5min-75%酒精5min-蒸馏水洗;
[0140]
(7)抗原修复:组织切片置于盛满edta抗原修复缓冲液(ph9.0)的修复盒中于微波炉内进行抗原修复,中火8min至沸,停火8min保温再转中低火7min,此过程中应防止缓冲液过度蒸发,切勿干片。自然冷却后将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min;
[0141]
(8)阻断内源性过氧化物酶:切片放入3%过氧化氢溶液(双氧水:纯水=1:9),室温避光孵育25min,将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min;
[0142]
(9)bsa或者血清封闭:切片稍甩干后用组化笔在组织周围画圈,在圈内滴加用3%bsa或者10%正常兔血清均匀覆盖组织,室温封闭30min;
[0143]
(10)加一抗:轻轻甩掉封闭液,在切片上滴加pbs按一定比例配好的一抗,切片平放于湿盒内4℃孵育过夜;
[0144]
(11)加二抗:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加与一抗相应种属的二抗(hrp标记)覆盖组织,室温孵育50min;
[0145]
(12)dab显色:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加新鲜配制的dab显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色;
[0146]
(13)复染细胞核:harris苏木素复染3min左右,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,氨水返蓝,流水冲洗;
[0147]
(14)脱水封片:将切片依次放入75%酒精6min-85%酒精6min
--
无水乙醇ⅰ6min-无水乙醇ⅱ6min-二甲苯ⅰ5min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片;显微镜镜检,图像采集分析。
[0148]
如图1所示:基因检测结果显示,1型糖尿病小鼠心脏组织klk8表达显著增加,并且是表达变化最为明显成员,此外糖尿病小鼠心脏组织klk8蛋白表达较对照组同样显著增加,并且随着年龄增加,上调更为明显,免疫组化结果显示klk8在糖尿病小鼠心脏心肌细胞和心脏内皮细胞均表达增加。
[0149]
实施例2
[0150]
(一)小鼠心脏组织masson染色步骤与上述实施例相同
[0151]
(二)小鼠心脏组织1型胶原(collagen-1)、羟脯氨酸(hydroxyproline)、转化生长因子β1表达(tgf-β1)
[0152]
(1)取10mg心室肌组织置于预冷的pbs(含磷酸酶抑制剂与pmsf);
[0153]
(2)加入高温处理的磁珠,60hz/20s进行匀浆以充分粉碎组织;
[0154]
(3)离心:4℃、2000rpm/min、20分钟;
[0155]
(4)bca方法测定蛋白浓度;
[0156]
(5)加样:加10倍稀释的待检样品0.1ml于已包被之反应孔中,置37℃孵育1小时;
[0157]
(6)加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体,37℃孵育0.5~1小时,洗涤;
[0158]
(7)加底物液显色:于各反应孔中加入临时配制的tmb底物溶液0.1ml,37℃10~30分钟;
[0159]
(8)终止反应:于各反应孔中加入2m硫酸0.05ml;
[0160]
(9)结果测定:检测450nm吸光度;
[0161]
(10)定量分析。
[0162]
(三)小鼠心脏超声心动图检测
[0163]
动物脱毛与麻醉:将脱毛膏涂抹于位于动物心脏体表区域,涂抹均匀两分钟后擦拭干净,将动物置于麻醉剂动物储存装置内,待动物处于麻醉状态后进行超声检测;利用15-mhz超声探头检测室间隔厚度(ivs)、左心室收缩末期内径(lvedd)、左心室舒张末期内径(lvesd)、左心室舒张末期后壁厚度(lvpwd)、收缩分数(fs)、射血分数(ef)
[0164]
表1:链脲佐菌素诱导的糖尿病小鼠的超声心动图结果
[0165][0166]
数据表现为means
±
sem(n=7).*p《0.05,.**p《0.01,***p《0.001,****p《0.0001
[0167]
如图2所示,马松染色结果显示klk8敲除可逆转糖尿病引起的心肌组织纤维化,酶联免疫吸附测定结果显示klk8缺失可逆转糖尿病心脏组织纤维化指标1型胶原、羟脯氨酸和转化生长因子β1表达升高,超声心动图结果显示,24周龄1型糖尿病小鼠心脏问能出现损伤,表现为lvedd(左心室舒张末期内径),lvesd(左心室收缩末期内径)升高,fs(收缩分数)和ef(射血分数)降低,而klk8敲除可逆转糖尿病引起的心脏功损伤。
[0168]
实施例3
[0169]
(一)人冠状动脉内皮细胞klk8表达步骤与上述实施例相同。
[0170]
(二)人冠状动脉内皮细胞培养上清可溶性血栓调节蛋白(thrombomodulin)、血管性血友病因子(von willebrand factor)、内皮素(e-selectin)表达检测与上述实施例相同。
[0171]
(三)细胞活力检测
[0172]
(1)人冠状动脉内皮细胞接种培养于48孔细胞培养板中,klk8腺病毒转染完成后去除细胞培养液,每孔加入37℃预热、200ul以dmem培养液十倍稀释的mtt溶液;
[0173]
(2)37℃、避光孵育2-4小时;
[0174]
(3)小心吸除mtt溶液,每孔加入200ul dmso,避光、摇床摇晃混匀20分钟
[0175]
(4)将48孔细胞培养板中的溶于dmso的甲瓒转移到白色透明的96孔细胞培养板,酶标仪490nm检测吸光值。
[0176]
klk8腺病毒的构建可参考文献:大鼠组织激肽释放酶8重组腺病毒载体的构建及鉴定。
[0177]
(四)内皮细胞通透性(fitc-dextran)检测
[0178]
(5)将24孔transwell置于完全培养基中预处理半小时后hcaecs按照(3-5)*10^5密度接种,每孔200ul;
[0179]
(6)24小时后加药处理,加入fitc标记的右旋糖苷,37℃、避光孵育1小时后取培养板内培养基进行检测,检测波长参数为494/521激发波长/发射波长。
[0180]
如图3所示,数据表现为means
±
sem(n=4).*p《0.05,**p《0.01,****p《0.0001;##p《0.01,####p《0.0001versus ad-vector day 3;$$$$p《0.0001versus ad-vector day 5。klk8过表达可导致人冠状动脉内皮细胞功能紊乱,细胞活力降低,通透性增加,发生间质转化。
[0181]
实施例4
[0182]
(一)小鼠血清可溶性血栓调节蛋白(thrombomodulin)、血管性血友病因子(von willebrand factor)、内皮素(e-selectin)表达检测实验步骤与上述实施例相同。
[0183]
(二)小鼠心脏组织ve-cadherin、cd31、vimenitn、αsma蛋白表达实验步骤与上述实施例相同。
[0184]
(三)小鼠心肌组织免疫荧光检测
[0185]
(1)石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ15min-二甲苯ⅱ15min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-85%酒精5min-75%酒精5min-蒸馏水洗;
[0186]
(2)抗原修复:组织切片置于盛满edta抗原修复缓冲液(ph=9.0)的修复盒中于微波炉内进行抗原修复。中火至沸后断电间隔10min中低火至沸,此过程中应防止缓冲液过度蒸发,切勿干片。自然冷却后将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min;
[0187]
(3)bsa封闭:切片稍甩干后用组化笔在组织周围画圈(防止抗体流走),在圈内滴加用3%bsa均匀覆盖组织,室温封闭30min;
[0188]
(4)加一抗:轻轻甩掉封闭液,在切片上滴加pbs按一定比例配好的一抗,切片平放于湿盒内4℃孵育过夜;
[0189]
(5)加二抗:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加与一抗相应种属的二抗覆盖组织,避光室温孵育50min;
[0190]
(6)dapi复染细胞核:玻片置于pbs(ph=7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加dapi染液,避光室温孵育10min;
[0191]
(7)封片:玻片置于pbs(ph=7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍
甩干后用抗荧光淬灭封片剂封片;
[0192]
(8)镜检拍照:切片于尼康倒置荧光显微镜下观察并采集图像。(紫外激发波长330-380nm,发射波长420nm;fitc绿光激发波长465-495nm,发射波长515-555nm;cy3红光激发波长510-560,发射波长590nm)。
[0193]
如图4所示,klk8缺失可逆转糖尿病小鼠内皮功能紊乱,并可逆转糖尿病心脏组织内皮间质转化,免疫荧光双染方法检测结果显示klk8缺失可逆转糖尿病小鼠心肌组织cd31表达降低以及αsma与fsp-1增加。免疫印记结果显示,高糖可导致糖尿病小鼠心脏endmt,即内皮细胞标志物ve-cadherin与cd31显著降低,而间质细胞标志物vimentin和αsma显著增加,而klk8缺失可逆转高糖导致的endmt。
[0194]
在本实施例中,klk8缺失是指小鼠klk8基因整体敲除,具体参考实施例1中的klk8敲除组。
[0195]
实施例5
[0196]
(一)人冠状动脉内皮细胞转染klk8-sirna以六孔板为例:
[0197]
(1)转染前准备:内皮细胞转染当天细胞融合度约在60-80%,以无菌双蒸水将klk8-sirna稀释成20um。
[0198]
(2)转染溶液配制:漩涡混匀x-fect,分别以x-fect,buffer配制成a液,以klk8-sirna与buffer配制成b液,配置比例如下
[0199][0200]
a/b液分别漩涡混匀后再将a、b液混合,再次漩涡混匀后室温孵育10分钟,形成x-fect/干扰片段复合物;
[0201]
(3)将400ul x-fect干扰片段复合物逐滴、逐孔加入到细胞培养板中,轻柔地前后摇晃混匀;
[0202]
(4)37℃孵育细胞培养板;
[0203]
(5)24小时后更换培养基并对心肌细胞进行进一步的实验干预;
[0204]
(二)细胞培养上清可溶性血栓调节蛋白(thrombomodulin)、血管性血友病因子(von willebrand factor)、内皮素(e-selectin)、转化生长因子β1(tgf-β1)表达检测实验步骤与上述实施例相同。
[0205]
(三)细胞活力检测实验步骤与上述实施例相同。
[0206]
(四)人冠状动脉内皮细胞ve-cadherin、cd31、vimenitn、αsma蛋白表达实验步骤与上述实施例相同。
[0207]
如图5所示,klk8敲低可减轻高糖导致的冠状动脉内皮细胞功能紊乱和endmt。人冠状动脉内皮细胞转染klk8 sirna24h后,给与25mm葡萄糖处理5天,应用elisa检测细胞培养上清内皮损伤标志物vwf,stm以及e-selectin生成,mtt检测内皮细胞活力,elisa检测细胞培养上清tgf-β1生成,wb检测内皮细胞标志物ve-cadherin/cd31,间质细胞标志物vimentin/αsma以及klk8的蛋白表达;数据表现为means
±
sem(n=4).**p《0.01,***p《
0.001;****p《0.0001。
[0208]
在本实施例中,klk8敲低是指在细胞水平上用sirna降低klk8表达。
[0209]
在以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1