一种盐酸米托蒽醌液体制剂及其制备方法与流程
1.本发明属于药物制剂技术领域,特别是涉及一种盐酸米托蒽醌液体制剂及其制备方法。
背景技术:
2.盐酸米托蒽醌,是化学名称为1,4-二羟基-5,8-二[[2-[(2-羟基乙基)氨基]乙基]氨基]蒽醌盐酸盐的蒽醌衍生物,实验式:c
22h28
n4o6·
2hcl,具有抗肿瘤、抗病毒、抗原生动物、和免疫调节特性,主要用于治疗恶性淋巴瘤、乳腺癌和急性白血病,对肺癌、黑色素瘤、软组织肉瘤、多发性骨髓瘤、肝癌、大肠癌、肾癌、前列腺癌、子宫内膜癌、睾丸肿瘤、卵巢癌和头颈部癌也有一定疗效。
[0003]
目前,盐酸米托蒽醌的制剂主要为注射液,但米托蒽醌在水溶液中不稳定,易氧化分解,需要通过加入抗氧化剂、螯合剂等,才可保证盐酸米托蒽醌注射液的的稳定性。如,ep-b-0236822中公开了一种盐酸米托蒽醌注射液,通过加入抗氧化剂偏亚硫酸氢钠以及螯合剂乙二胺四乙酸二钠和甘氨酸来抑制溶液中米托蒽醌的分解,但使用含有常规浓度的亚硫酸盐的制剂时,可能会在人体中产生过敏反应,在有些情况下还会产生严重的副作用,对于患有亚硫酸盐敏感性的哮喘患者,可能会导致危及生命的并发症。不仅如此,使用了至少两种离子螯合剂又向制剂中补充了其它组分,增加了副作用的风险。
[0004]
us006143795a公开了一种稳定的米托蒽醌溶液,发现通过添加质量分数为0.004%的乙二胺四乙酸钠就足以使米托蒽醌在水溶液中保持稳定,该溶液中虽然未使用亚硫酸盐化合物,但仍然需要添加额外的螯合剂才能保证米托蒽醌的稳定,仍然会带来副作用的风险。
技术实现要素:
[0005]
本发明主要解决的技术问题是提供一种盐酸米托蒽醌液体制剂,组分少,杂质含量低,安全性更高。
[0006]
目前,市售的盐酸米托蒽醌注射液中,辅料为焦亚硫酸钠、醋酸和醋酸钠,主药通过焦亚硫酸钠以抑制米托蒽醌的氧化分解,但焦亚硫酸钠会与盐酸米托蒽醌生成特定的杂质化合物,增加制剂中的杂质含量,且焦亚硫酸钠仍属于亚硫酸盐,仍然可能导致人体的过敏反应和其它副作用。因此,市售产品仍然存在较高的安全风险。
[0007]
经过不断地研究,本发明发明人意外地发现,若使用含氧量<0.1ppm的低氧水,即使不添加抗氧化剂、螯合剂,产品仍然具有良好的稳定性,组分少,可减少产品的副作用,且可避免杂质的生成,产品质量更好。
[0008]
为了解决上述问题,本发明提供一种盐酸米托蒽醌液体制剂,溶剂为低氧水,且不使用螯合剂和抗氧化剂;所述低氧水中溶解氧含量<0.1ppm。
[0009]
注射液中常用的抗氧化剂为亚硫酸盐类抗氧化剂,它主要包括亚硫酸氢钠、焦亚硫酸钠(偏重亚硫酸钠)、亚硫酸钠、甲醛合次硫酸氢钠、连二亚硫酸钠、硫代硫酸钠等。
[0010]
注射液中常用的螯合剂剂为依地酸二钠、依地酸钙钠等。
[0011]
本发明具体实施方式中使用的低氧水是采用解析除氧装置制备,解析除氧装置除氧效率高(达99%),除氧后水中溶解氧含量可降至0.01~0.1mg/l。采用其它除氧方式制备得到的低氧水,只要溶解氧含量<0.1ppm,均可适用于本发明。
[0012]
进一步地,每50ml液体制剂中包括:盐酸米托蒽醌50~65mg、醋酸钠1~5mg、醋酸15~30mg,余量为低氧水。
[0013]
进一步地,所述液体制剂为注射液。
[0014]
在本发明的具体实施方式中,本发明盐酸米托蒽醌液体制剂通过ph调节剂调节ph值为3.6~4.0。
[0015]
在本发明的具体实施方式中,每50ml液体制剂中醋酸钠的用量为2~3mg,优选2.5mg。
[0016]
在本发明的具体实施方式中,每50ml液体制剂中醋酸的用量为20~25mg,优选23mg。
[0017]
在本发明的具体实施方式中,每50ml液体制剂中盐酸米托蒽醌的用量为55~60mg,优选58.2mg。
[0018]
在本发明的具体实施方式中,所述ph调节剂选自盐酸或氢氧化钠。
[0019]
本发明还提供了上述盐酸米托蒽醌液体制剂的制备方法,包括如下内容:
①
将原料混合;
②
通过ph调节剂调节ph值为3.6~4.0;
③
除菌过滤。
[0020]
将原料混合的混合形式不限,可以是直接将所有原辅料一起混合,也可以是将各组分单独用部分低氧水溶解后再混合、定容,也可以是将部分原料用些许低氧水溶解,另一部分原料也用些许低氧水溶解后,再合并、定容,等等。
[0021]
调节ph的次数和与步骤顺序不限,可以是在原料混合的任意环节,只要使最终制剂溶液的ph满足3.6~4.0,在制剂配制完成前的任意环节调节均可,比如:将所有辅料和主药以及部分(如总用量的70%、75%、80%、85%等)低氧水混合后,调节ph,再添加低氧水至终体积;也可以是将主药以及绝大部分(如总用量的97%、98%、99%等)低氧水混合后,再滴加ph调节剂调节ph,再加入少量的低氧水定容;还可以是将所有用量的原料混合后,最后滴加ph调节剂调节ph等。
[0022]
在本发明的具体实施方式中,均是采用:将辅料如醋酸钠、醋酸用部分低氧水溶解,将盐酸米托蒽醌也用部分低氧水溶解,再将盐酸米托蒽醌溶液与具有所述辅料的溶液混合,调节ph至3.6~4.0,并用低氧水调至终体积。
[0023]
在本发明的具体实施方式中,溶解醋酸钠、醋酸的低氧水用量为40%总用量,溶解盐酸米托蒽醌的低氧水用量为40%总用量;但这仅仅是记载了多种可行方案中的一种,对于此类溶液的配制,本领域技术人员能够判断,两次溶解步骤中使用的低氧水的量增加或减少都不会影响最终配制的溶液产品的性能,只要控制总量一致,都可以实现本发明制剂的配制。
[0024]
进一步地,所述除菌过滤为先后通过0.45μm、0.22μm的滤膜过滤。
[0025]
进一步地,除菌过滤后进行灌装、充入保护气体、密封;所述保护气体选自氮气和/或惰性气体;
[0026]
进一步地,密封后产品内顶空残氧范围为≤2.0%。
[0027]
进一步地,密封后于110~130℃灭菌5~15min,优选为在121℃灭菌8min。
[0028]
本发明的有益效果是:
[0029]
(1)本发明盐酸米托蒽醌液体制剂,采用含氧量<0.1ppm的低氧水配制,未加入亚硫酸盐类抗氧剂和螯合剂,产品的稳定性仍然优异,组分简单,可以消除焦亚硫酸同盐酸米托蒽醌生成的有关物质,能有效保证液体制剂的杂质水平处于较低水平,也避免了亚硫酸盐、螯合剂的制剂带给人体的过敏反应和副作用,提高了产品质量和安全性。
[0030]
(2)本发明制剂能耐受高温灭菌工艺,提高本品的无菌保障水平,制备工艺简单,可保证盐酸米托蒽醌注射剂的长期稳定,操作方便,可实现大规模化工业生产。
附图说明
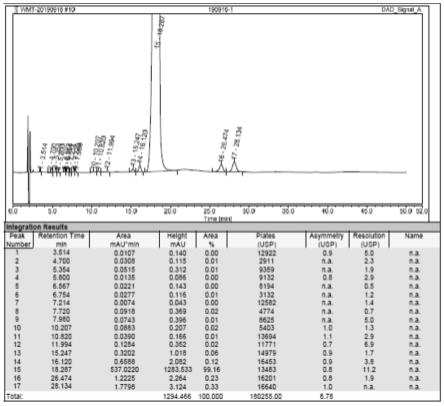
[0031]
图1为处方1制得的制剂0天有关杂质图谱检测结果,处方1中不含焦亚硫酸钠,从图中可以看出,生产的制剂中不含有rrt5.5~7杂质;
[0032]
图2为处方4制得的制剂0天有关杂质图谱检测结果,处方4中焦亚硫酸钠的添加量为1mg/ml,从图中可以看出,生产的制剂中含有rrt5.5~7杂质。
具体实施方式
[0033]
下面对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0034]
实施例1
[0035]
通过提供锅炉给水系统的解析除氧装置制备得到低氧水。
[0036]
采用常规充氮气的方法制备得到低氧水。
[0037]
分别测定解析除氧装置得到的低氧水和采用常规充氮气除氧的低氧水中溶解氧的含量,分别重复三次试验,结果见表1。
[0038]
表1不同控氧方式的低氧水中溶解氧含量数据对比
[0039]
序号低氧水(充氮气)低氧水(解析除氧)11.5ppm0.05ppm21.1ppm0.07ppm31.3ppm0.05ppm
[0040]
对比可知,解析除氧的低氧水平控制效果远远优于常规药品生产采用的惰性气体的单独填充。
[0041]
实施例2
[0042]
将辅料焦亚硫酸钠、醋酸钠、醋酸加到20ml低氧水(充氮气)中并溶解完全后,将盐酸米托蒽醌溶解于20ml低氧水(充氮气)中,再将盐酸米托蒽醌溶液加到具有辅料的溶液中,用氢氧化钠或盐酸调节ph至3.6~4.0后,用低氧水(充氮气)调至终体积,将药液过0.45μm和0.22μm的滤膜,过滤后的药液灌装在棕色安瓿中,充氮、控制残氧≤2.0%,熔封。在121℃对本品进行热压灭菌处理8min。送样,检测相关指标。
[0043]
处方1~4见表2,处方1~4的0天及影响因素有关物质检测结果见表3。
[0044]
表2
[0045] 处方1处方2处方3处方4盐酸米托蒽醌58.2mg58.2mg58.2mg58.2mg焦亚硫酸钠0mg5mg15mg50mg无水醋酸钠2.5mg2.5mg2.5mg2.5mg冰醋酸23mg23mg23mg23mg低氧水加至50ml50ml50ml50ml
[0046]
表3
[0047][0048][0049]
根据表2、表3的数据,rrt5.5~7杂质是焦亚硫酸钠与盐酸米托蒽醌反应生成的杂质,处方1未使用焦亚硫酸钠,rrt5.5~7杂质未生成,处方2~4中随着焦亚硫酸钠的处方用量增加,rrt5.5~7有关物质显著增加。rrt26.0~26.8和rrt28.0~28.5为米托蒽醌的两个氧化杂质,在高温条件下,氧化杂质随焦亚硫酸钠的处方用量增加而显著减少。
[0050]
可以看出,盐酸米托蒽醌注射液中总有关物质水平受这两种杂质共同影响,直接
去掉抗氧化剂焦亚硫酸钠(处方1)虽然可避免生成rrt5.5~7杂质,但米托蒽醌稳定性显著变差,其氧化杂质含量显著增加;增加焦亚硫酸钠用量虽然可减少总杂含量,但rrt5.5~7杂质含量显著增加;盐酸米托蒽醌注射液处方有待进一步改进。
[0051]
实施例3
[0052]
采用实施例1中通过锅炉给水系统的解析除氧装置制备得到的溶解氧含量<0.1ppm的低氧水制备液体制剂:
[0053]
处方5的制备:将辅料醋酸钠、醋酸加到20ml低氧水(解析除氧)中并溶解完全后,将盐酸米托蒽醌溶解于20ml低氧水(解析除氧)中,再将盐酸米托蒽醌溶液加到具有辅料的溶液中,用氢氧化钠或盐酸调节ph至3.6~4.0后,用低氧水(解析除氧)调至终体积,将药液过0.45μm和0.22μm的滤膜,过滤后的药液灌装在棕色安瓿中,充氮、控制残氧≤2.0%,熔封。在121℃对本品进行热压灭菌处理8min。送样,检测相关指标。
[0054]
处方6的制备:将辅料焦亚硫酸钠、醋酸钠、醋酸加到20ml低氧水(解析除氧)中并溶解完全后,将盐酸米托蒽醌溶解于20ml低氧水(解析除氧)中,再将盐酸米托蒽醌溶液加到具有辅料的溶液中,用氢氧化钠或盐酸调节ph至3.6~4.0后,用低氧水(解析除氧)调至终体积,将药液过0.45μm和0.22μm的滤膜,过滤后的药液灌装在棕色安瓿中,充氮、控制残氧≤2.0%,熔封。在121℃对本品进行热压灭菌处理8min。送样,检测相关指标。
[0055]
处方5、6见表4,处方5、6的0天及影响因素有关物质检测结果见表5、表6。
[0056]
表4
[0057] 处方5处方6盐酸米托蒽醌58.2mg58.2mg焦亚硫酸钠0mg15mg无水醋酸钠2.5mg2.5mg冰醋酸23mg23mg盐酸0q.s氢氧化钠0q.s低氧水(解析除氧)加至50ml50ml
[0058]
表5
[0059][0060]
表6处方5影响因素放样检测结果
[0061][0062]
对比表5数据可知,在本发明注射液体系中,采用溶氧量<0.1ppm的低氧水配制后,不加入任何抗氧剂或螯合剂也可保证体系的稳定性,从杂质含量来看,处方6加入抗氧剂还会增加rrt5.5~7杂质的生成,且其余杂质的含量也高于或至少等于处方5,总杂含量更高,说明在使用溶氧量<0.1ppm的低氧水做溶剂后,不加抗氧化剂的效果是优于添加抗氧化剂的,能有效的提高产品安全性。
[0063]
通过表6数据可知,经过长时间的放置,本发明盐酸米托蒽醌注射液中,各单杂、总杂的含量仍然很低,稳定性良好。市售产品各组分的用量同处方6,区别仅在于未使用低氧水(溶氧量<0.1ppm),对比可以看出本发明盐酸米托蒽醌注射液中的杂质水平低于市场上销售的产品,本品也没有产生rrt5.5~7杂质,各单杂和总杂水平也低于现有上市的产品,杂质水平低,能明显提高产品的质量,保证产品在临床使用上的安全性。
[0064]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1