无创口内颏舌肌肌电活性评估方法及系统与流程
本发明涉及一种无创口内颏舌肌肌电活性评估方法,同时涉及用于实现上述无创口内颏舌肌肌电活性评估方法的系统。
背景技术:
阻塞性睡眠呼吸暂停(obstructivesleepapnea,osa)是一种常见的睡眠呼吸障碍性疾病,可造成夜间低氧、高碳酸血症、胸腔内压力显著波动、睡眠结构紊乱等一系列病理生理改变。已有多项研究证实osa是高血压、冠心病、脑血管疾病、糖尿病等多种慢性疾病的独立危险因素。不仅如此,osa作为一个交通事故的高危诱发因素,严重威胁着机动车驾驶员的生命安全。目前针对osa仍缺乏简单有效的治疗方法。美国睡眠学会曾对目前临床常用的治疗手段如下评价:持续气道正压通气(cpap)的治愈率为90%,但受试者长期佩戴依从性欠佳;悬雍垂腭咽成形术(uppp)的治愈率仅为50%~60%;口腔矫治器的治愈率仅为50%~60%。其疗效受限的根本原因是对osa的病理生理机制缺乏深入的认识以及疗效评估体系的不健全。
目前,越来越多的研究已证实osa是多病因相关的疾病。除上气道解剖狭窄机制外,神经-上气道扩张肌调节相关的功能性因素也起着不容忽视的作用。其中,颏舌肌作为主要的上气道扩张肌,作为接受呼吸-神经调控输出信号的效应器,具有直接对抗上气道阻力以维持上气道通畅性的作用。研究表明,颏舌肌的功能活性在osa受试者之间存在个体差异,宏观表现为受吸气负压刺激后可呈现出不同程度的活性失调表现。有学者提出,osa受试者疾病的严重程度有2/3可能与神经-上气道扩张肌调节功能相关,有1/3和气道解剖结构负荷相关。然而,目前临床上对于神经-上气道扩张肌调节相关的功能性因素的评估应用甚少,这可能是导致目前osa疗效受限的原因之一。尤其对于像外科手术这一类的有创治疗手段,对osa受试者进行神经-上气道扩张肌方面的术前评估,有利于排除不适宜手术的非解剖因素主导的受试者,从而提高疗效。
技术实现要素:
本发明所要解决的首要技术问题在于提供一种无创口内颏舌肌肌电活性评估方法。
本发明所要解决的另一技术问题在于提供一种无创口内颏舌肌肌电活性评估系统。
为了实现上述技术目的,本发明采用下述技术方案:
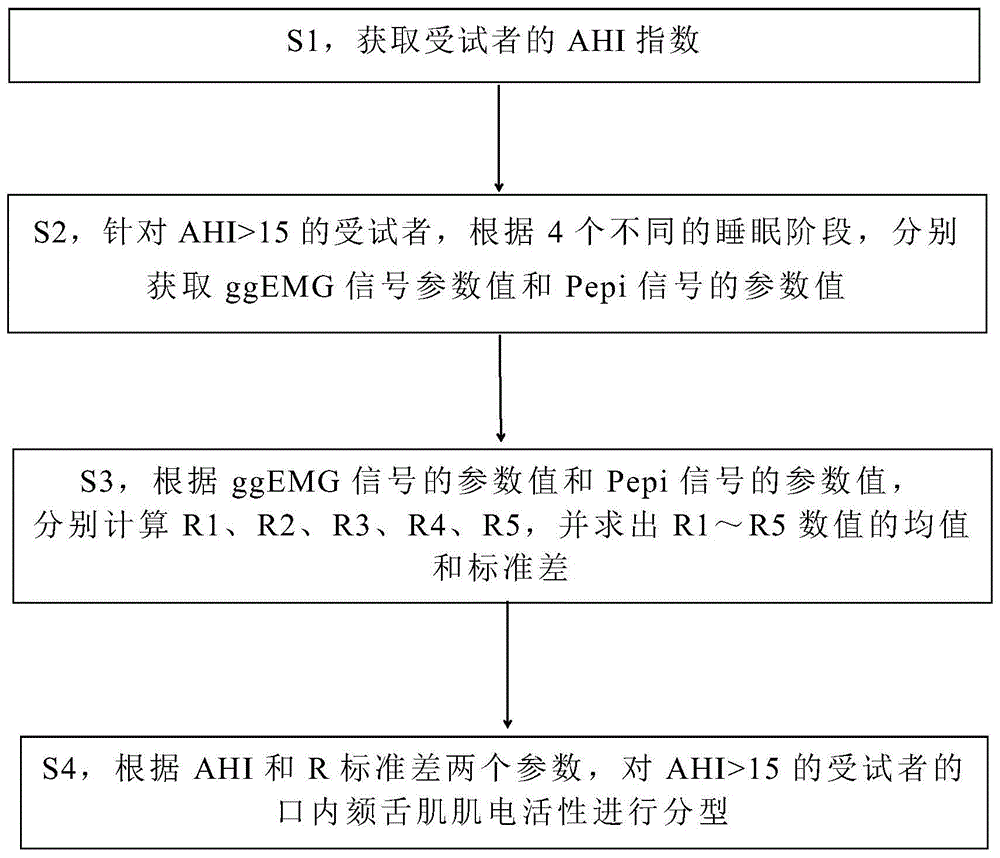
根据本发明实施例的第一方面,提供一种无创口内颏舌肌肌电活性评估方法,包括如下步骤:
s1,根据整夜多导睡眠监测数据,计算出受试者ahi指数;
s2,针对ahi>15的受试者,口内表面肌电同步腔内负压监测下进行如下参数获取;根据清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸4个阶段,分别获取颏舌肌肌电(ggemg)信号参数值和会厌水平气道咽腔压力(pepi)信号的参数值;
s3,根据ggemg信号的参数值和pepi信号的参数值,分别计算清醒期单位压力肌电值r1、入睡初期单位压力肌电值r2、n2期呼吸暂停最小单位压力肌电值r3、n2期呼吸暂停最大单位压力肌电值r4、n2期鼻咽通气道置入后单位压力肌电值r5,并求出r1~r5数值的均值和r标准差;
s4,根据ahi指数和r标准差两个参数,对ahi>15的受试者的口内颏舌肌肌电活性进行分型。
其中较优地,在所述步骤s4中,当ahi>15且r标准差≥10,判断受试者符合中-重度osa诊断,颏舌肌功能活性尚可,患病因素以解剖狭窄为主;当ahi>15,r标准差<10时,判断受试者符合中-重度osa诊断,颏舌肌功能活性较差,舌后区易塌陷,患病因素较综合。
其中较优地,在所述步骤s2中,获取的颏舌肌肌电信号的参数值包括:最大肌电值、峰值肌电值、呼吸暂停最小肌电值和呼吸暂停最大肌电值。
其中较优地,在所述步骤s1中,所有肌电原始振幅信号换算为均方根值(rms)以衡量肌电的活化程度。
其中较优地,在所述步骤s2中,获取的会厌水平气道咽腔压力信号的参数值包括:平静呼吸pepi值、呼吸暂停pepi最小值、呼吸暂停pepi最大值。
其中较优地,在所述步骤s3中,清醒期单位压力肌电值r1=清醒期峰值肌电值/清醒平静呼吸pepi值;入睡初期单位压力肌电值r2=入睡初期峰值肌电值/入睡初期平静呼吸pepi值;n2期呼吸暂停最小单位压力肌电值r3=呼吸暂停最小肌电值/呼吸暂停pepi最小值;n2期呼吸暂停最大单位压力肌电值r4=呼吸暂停最大肌电值/呼吸暂停pepi最大值;n2期鼻咽通气道置入后单位压力肌电值r5=n2期鼻咽通气道置入后峰值肌电值/n2期鼻咽通气道置入后平静呼吸pepi值。
根据本发明实施例的第二方面,提供一种无创口内颏舌肌肌电活性评估系统,用于实现上述无创口内颏舌肌肌电活性评估方法,包括ahi指数采集模块、ggemg信号采集模块、pepi信号采集模块和数据处理模块;
所述ahi指数采集模块用于从整夜多导睡眠监测数据中获取所述受试者的ahi指数;
所述ggemg信号采集模块用于获得受试者清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸4个阶段的ggemg信号参数值;
所pepi述信号采集模块用于获得受试者清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸4个阶段的pepi信号参数值;
所述数据处理模块,用于根据ggemg信号的参数值和pepi信号的参数值,分别计算清醒期单位压力肌电值r1、入睡初期单位压力肌电值r2、n2期呼吸暂停最小单位压力肌电值r3、n2期呼吸暂停最大单位压力肌电值r4、n2期鼻咽通气道置入后单位压力肌电值r5,并求出r1~r5数值的均值和r标准差,然后,根据ahi指数和r标准差两个参数,对ahi>15的受试者的口内颏舌肌肌电活性进行分型。
其中较优地,所述ggemg信号采集模块通过无创口内表面肌电信号采集设备采集ggemg信号;
所述pepi信号采集模块通过食道压力测定仪采集pepi信号;
所述无创口内表面肌电信号采集设备和所述食道压力测定仪均与多导睡眠监测设备连接。
其中较优地,所述无创口内表面肌电信号采集设备包括根据受试者口底及下颌牙体系制作的下颌下齿透明保持器和两个氯化银球状电极,用自凝塑料将两个氯化银球状电极包埋在下颌下齿透明保持器的内侧面,定位于双侧尖牙与前磨牙舌侧之间。
其中较优地,所述多导睡眠监测设备同时用于采集脑电信号、鼻气流信号、胸腹呼吸运动信号和血氧饱和度信号。
本发明所提供的无创口内颏舌肌肌电活性评估方法,借以诱导睡眠下的口内表面肌电同步腔内负压监测技术,建立了基于呼吸暂停低通气指数(apnea-hypopneaindex,ahi)和单位压力肌电值(ratioofpeakphasicggemgtopepi,rggemg)的osa受试者的无创口内颏舌肌肌电活性评估体系,可以对ahi>15的osa中-重度受试者进行分型,从而有针对性的对ahi>15的osa中-重度受试者颏舌肌相关的功能性因素进行客观评价,有利于为对因治疗提供客观依据。
附图说明
图1是无创口内颏舌肌肌电活性分型评估方法的流程图;
图2是平静呼吸时ggemg、pepi参数定义图解;
图3是呼吸暂停时ggemg、pepi参数定义图解;
图4是诱导睡眠期间测压管探头位置示意图;
图5是无创口内颏舌肌肌电活性分型评估体系的技术路线图;
图6a是峰值ggemg的变化趋势折线图;
图6b是pepi的变化趋势折线图;
图7是无创口内颏舌肌肌电活性分型评估系统的组成框图。
具体实施方式
下面结合附图和具体的实施例对本发明的技术方案进行进一步地详细描述。
本申请提供了一种无创口内颏舌肌肌电活性评估方法,借助于无创口内颏舌肌肌电监测技术,可有针对性的分析归纳不同osa受试者颏舌肌肌电(genioglossuselectromyography,ggemg)活性的个体化差异,完成不同osa受试者的颏舌肌活性评估分型。
如图1所示,本发明提供的一种无创口内颏舌肌肌电活性评估方法,包括如下步骤:
s1,从睡眠监测数据中,获取受试者呼吸暂停低通气指数(apnea-hypopneaindex,ahi);
s2,针对ahi>15的受试者,口内表面肌电同步腔内负压监测下进行如下参数获取;针对清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸4个阶段,分别获取颏舌肌肌电(ggemg)信号参数值和会厌水平气道咽腔压力(pepi)信号的参数值;
s3,根据ggemg信号的参数值和pepi信号的参数值,分别计算清醒期单位压力肌电值r1、入睡初期单位压力肌电值r2、n2期呼吸暂停最小单位压力肌电值r3、n2期呼吸暂停最大单位压力肌电值r4、n2期鼻咽通气道置入后单位压力肌电值r5,并求出r1~r5数值的均值和r标准差;
s4,根据ahi和r标准差两个参数,对ahi>15的受试者的口内颏舌肌肌电活性进行分型。
下面对无创口内颏舌肌肌电活性评估方法的具体步骤进行介绍。
s1、根据整夜多导睡眠监测数据,计算受试者ahi指数;
受试者进行整夜的常规多导睡眠监测(polysomnography,psg)及同步的口内ggemg监测。从整夜多导睡眠监测数据中计算出受试者的ahi参数,属于常规技术,在此不再赘述。
根据现行诊断标准,按照整夜psg监测数据可初步确定受试者的osm等级,其中,ahi<5次/小时,不符合osa诊断;5≤ahi<15次/小时,符合轻度osa诊断;15≤ahi<30次/小时,符合中度osa诊断;ahi≥30次/小时,符合重度osa。
osa受试者长期慢性打鼾,使上气道组织易于由对抗气道关闭而产生的咽部负压振荡和强烈的肌肉收缩而导致机械损伤,可引起神经和肌肉纤维结构破坏和咽部组织的炎症反应,从而造成上气道扩张肌收缩功能失调和肌肉无力,尤其可体现在颏舌肌肌肉。颏舌肌的神经肌肉损伤可直接影响上气道的反射扩张能力,进一步导致上气道塌陷性增加,形成恶性循环。因此osa受试者颏舌肌损伤的严重程度与受试者病程的长短有关,也与受试者疾病的严重程度有关。
虽然目前常用ahi来划分osa疾病的严重程度,但是对于osa受试者上气道扩张肌的评估分级不能够完全依赖以ahi为程度划分。申请人对于不同ggemg-pepi变异度的osa受试者ahi的相关性分析发现,它们在ahi的相关性分析上具有很大的差异。ggemg-pepi变异度较小的受试者呼吸事件的发生主要与解剖及清醒-入睡的肌电活性变化值量有关。而ggemg-pepi变异度较大的受试者呼吸事件的发生主要与功能性因素相关。二者之间的手术方式的选择以及治疗效果均可能不同。
因此,本发明所提供的无创口内颏舌肌肌电活性评估方法,对筛选出的中-重度osa受试者(ahi≥15)进行诱导睡眠纤维喉镜检查(drug-inducedsleependoscopy,dise)检查,并同步进行ggemg监测和上气道腔内压力监测,根据所得参数进行口内ggemg活性评级,具有高安全性和适用性。能够无创地、准确地划分不同osa受试者上气道扩张肌活性情况,有利于细化osa疾病的表型分型,从而为不同类型的osa受试者制定个体化治疗方案。
s2、针对ahi>15的受试者,口内表面肌电同步腔内负压的监测下的参数获取方法:
应用的无创口内表面肌电信号采集设备(参见中国实用新型专利zl201520088053.3中的记载)可稳定采集以颏舌肌肌电(ggemg)为主的信号。食道压力测定仪(英国gaeltec公司)用于采集会厌水平气道咽腔压力(pepi)。无创口内表面肌电信号采集设备和食道压力测定仪均可连接于任意多导睡眠监测设备上,与脑电信号、鼻气流信号、胸腹呼吸运动信号和血氧饱和度信号等进行同步记录和分析。所采集的肌电和压力原始信号可导入分析软件(英国ced公司spike2软件)进行信号处理和测量。
(1)ggemg信号的参数值获取:
所有肌电原始振幅信号均需换算为均方根值(rms)以衡量肌电的活化程度,均方根振幅值(rms)换算公式如下:
诱导睡眠下,每例监测对象肌电参数值的测量需包括以下4个时段:清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸。平静呼吸期间(包括清醒期、入睡初期和放置鼻咽通气道后的n2睡眠期)的信号的测量至少要选取5个连续的呼吸循环进行分析后取平均值作为最终数据记录。n2睡眠期阻塞性呼吸暂停时间期间的信号的测量至少要选取5次对应事件进行分析后取平均值作为最终数据记录。
需纳入计算的ggemg参数值包括:
①最大肌电值(maximalggemg,ggemgmax):受试者用力伸舌或舌抵住上颌前切牙舌面时的最大rms振幅值,之后所有参数值均除以该值进行校对;
②峰值肌电值(peakphasicggemg):平静呼吸期间,吸气相rms振幅的最大值除以ggemgmax,数值单位定义为%max,可反映受试者平静呼吸期间颏舌肌受自身吸气负压刺激下肌电的活化程度。
③呼吸暂停最小肌电值(minimumggemgduringapnea):n2睡眠期阻塞性呼吸暂停事件前1/2段的rms振幅的最小值除以ggemgmax,数值单位定义为%max,可反映受试者呼吸暂停初期颏舌肌肌电的活化程度。
④呼吸暂停最大肌电值(peakggemgafterapnea):n2睡眠期阻塞性呼吸暂停事件结束后第一个呼吸循环期间所对应的rms振幅的最大值除以ggemgmax,数值单位定义为%max,可反映受试者呼吸暂停末期颏舌肌肌电的活化程度。
(2)pepi信号的参数值获取:
每例监测对象在电子喉镜引导下将压力传感器的探头固定于会厌缘水平(诱导睡眠期间测压管探头位置参见图4所示),嘱受试者平静呼吸,在呼气末进行调零。
pepi参数值选取时段需与ggemg同步且对应,需纳入计算的参数值包括:
①平静呼吸pepi值:对应平静呼吸期间吸气末负压最大值的绝对值,数值单位mmhg,可反映受试者平静呼吸期间自身产生的最大吸气负压水平。
②呼吸暂停pepi最小值(n2apneaminimumpepi):对应阻塞性呼吸暂停事件前1/2段最小吸气末负压值的绝对值,数值单位mmhg,可反映受试者呼吸暂停初期的腔内负压水平。
③呼吸暂停pepi最大值(n2apneamaximalpepi):对应阻塞性呼吸暂停事件结束后第一个呼吸循环期间的最大吸气末负压值的绝对值,数值单位mmhg,可反映受试者呼吸暂停末期的腔内负压水平。
图2示出了平静呼吸时ggemg、pepi参数定义图解,其中,np=鼻气流压力;tho=胸部运动;pepi=会厌水平腔内压力;emgraw=原始口内颏舌肌肌电信号;rms=emgraw振幅的均方根信号。
图3示出了呼吸暂停时ggemg、pepi参数定义图解,其中,np=鼻气流压力;tho=胸部运动;pepi=会厌水平腔内压力;emgraw=原始口内颏舌肌肌电信号;rms=emgraw振幅的均方根信号。
s3、根据ggemg信号的参数值和pepi信号的参数值,单位压力肌电值(rggemg)的计算方法如下:
单位压力肌电值(rggemg)客观反映了个体在单位腔内压力下其颏舌肌对抗负压的功能活性,rggemg值越高说明其颏舌肌对抗压力变化的能力越强,颏舌肌维持气道通畅性的调节能力越强。单位压力肌电值(rggemg)=峰值ggemg/pepi,定义数值单位为%max。
针对上述4个时段(清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸)分别进行所对应的rggemg的计算,所得值分别记为r1(清醒期rggemg)、r2(入睡初期rggemg)、r3(n2期呼吸暂停最小值rggemg)、r4(n2期呼吸暂停最大值rggemg)和r5(n2期鼻咽通气道置入后rggemg)(汇总见表1)。
之后对每例受试者求出r1~r5数值的均值,并计算标准差,即r标准差。r标准差这一指标能客观反映出受试者从清醒、入睡至发生呼吸事件以及消除呼吸事件整个过程中颏舌肌功能活性数据的离散程度,全面评估了不同状态下颏舌肌的综合活性。
经大量osa受试者数据分析后已证实,r标准差与多导睡眠监测结果中的呼吸暂停低通气指数(ahi)和最低血氧饱和度等密切相关,不仅具有反映受试者患病严重程度的效力,并且有针对性的对osa受试者颏舌肌相关的功能性因素进行了客观评价。r标准差越小的osa受试者颏舌肌活性功能越差,舌后气道的塌陷倾向越明显,患病程度也较重。对于这一类受试者,应尤为重视颏舌肌活性功能性的评估,积极地对因治疗,以避免因治疗方案选择不当所造成的疗效受限。
表1.不同状态rggemg参数汇总
s4、无创口内颏舌肌肌电活性分型评估体系的建立
参考正常人和osa受试者肌电的特点以及临床应用的可行性,本分型评估体系的建立主要参考ahi和r标准差两个参数,主要用于客观评估受试者颏舌肌的功能活性,指导治疗方案的选择(见表2)。
表2无创口内颏舌肌肌电活性分型评估标准
注:osa:阻塞性睡眠呼吸暂停;ahi:呼吸暂停低通气指数;rem:快动眼睡眠期;nrem:非快动眼睡眠期;ggemg:颏舌肌肌电值;pepi:会厌水平咽腔内压力
通过步骤s3计算出的r标准差结合步骤s1计算出的ahi指数,可以对中-重度osa受试者进一步细化。当ahi>15且r标准差≥10,判断受试者符合中-重度osa诊断,颏舌肌功能活性尚可,患病因素以解剖狭窄为主;当ahi>15,r标准差<10时,判断受试者符合中-重度osa诊断,颏舌肌功能活性较差,舌后区易塌陷,患病因素较综合。根据上述判断结果,可以设计出不同的治疗方案。
为了更好的解释本发明所提供的无创口内颏舌肌肌电活性评估方法,下面结合图5所示的技术路线图,对本发明作详细描述。
首先,依照2018年国内颁布的《成人阻塞性睡眠呼吸暂停多学科诊疗指南》的诊断标准,对初诊以“睡眠打鼾和日间困乏”为主要主诉的受试者进行睡眠监测检查,后根据ahi筛选出中度以上osa受试者。之后参考受试者治疗意愿,尤其对倾向于腭咽部手术治疗的受试者,建议进一步完善药物诱导睡眠纤维喉镜检查(drug-inducedsleependoscopy,dise),在检查过程中同期进行口内表面肌电同步腔内负压监测,获取颏舌肌肌电功能相关的数据。
具体流程如下:每例受试者应检查前佩戴好睡眠监测设备(导联至少要包括脑电、鼻气流、胸腹运动、血氧饱和度)以及口内表面肌电监测设备。嘱受试者保持仰卧位,用力伸舌抵住上颌前切牙舌面持续约10秒钟,连续重复3次所取得的最大肌电值。之后,对受试者双侧鼻腔进行1%丁卡因溶液表面麻醉后,在电子喉镜的引导下将测压管自鼻腔置入咽腔,当压力探头达会厌上缘水平时固定测压管位置。嘱受试者平静呼吸,观察测定仪表上的压力数值波动情况,在呼气末进行调零。由麻醉师给予盐酸右美托咪啶诱导睡眠状态。观察时机是主观上见到受试者入睡,口头刺激没有反应,而疼痛等刺激可以唤醒,直至脑电波出现纺锤波等典型的n2期睡眠波形,证明诱导睡眠成功。dise下需保证稳定n2睡眠的时间至少10分钟,全面观察呼吸事件期间气道塌陷形态的变化,并保证肌电和腔内压力数据采集充分。在dise下完成10分钟以上n2期睡眠的监测之后,自受试者鼻腔置入鼻咽通气道,以解除受试者上气道的阻塞状态,并在此状态下继续记录10分钟以上n2期睡眠下数据。之后依据上文中的算法,得出r标准差数值。依据r标准差<10和≥10进一步划分,最终完成该受试者术前的颏舌肌功能活性评估。最终根据分型结果,指导临床医生选择适宜的治疗方案。
最后,对本发明所提供的无创口内颏舌肌肌电活性评估方法中所使用的如表2所示的无创口内颏舌肌肌电活性评估体系的建立过程进行补充介绍。
首先,所有受试者进行整夜的常规多导睡眠监测(polysomnography,psg)及同步的口内ggemg监测。之后根据诊断标准,按照整夜psg监测数据中的睡眠呼吸暂停低通气指数(apnea-hypopneaindex,ahi指数,是指整夜睡眠中每小时发生呼吸暂停及低通气事件的次数),可明确区分对照组(ahi<5次/小时)、轻度组(5≤ahi<15次/小时)、中度组(15≤ahi<30次/小时)以及重度组(ahi≥30次/小时)。对筛选出的中-重度osa受试者(ahi≥15)进行诱导睡眠纤维喉镜检查(drug-inducedsleependoscopy,dise)检查,并同步进行ggemg监测和上气道腔内压力监测,根据所得参数进行口内ggemg活性评级。
(一)诱导睡眠纤维喉镜检查流程
测量清醒期气道结构之后,由麻醉师给予盐酸右美托咪啶诱导睡眠状态。盐酸右美托咪啶在既往的报道中证实能引起近似n2期睡眠的脑电波活动,并对呼吸中枢影响很小,目前已普遍应用于模拟睡眠的检查项目。盐酸右美托咪啶用法为0.8mg/kg,给药10分钟,观察受试者入睡后调整为0.6mg/kg维持给药。观察时机是主观上见到受试者入睡,口头刺激没有反应,而疼痛等刺激可以唤醒,客观上观察到脑电波出现纺锤波等典型的n2期睡眠波形。受试者佩戴口内表面电极进行同步ggemg信号的记录。dise下需保证稳定n2睡眠的时间至少15分钟,全面观察呼吸事件期间气道塌陷形态的变化,并保证ggemg数据采集充分。在dise下完成15分钟以上n2期睡眠的监测之后,自受试者鼻腔置入鼻咽通气道,以解除受试者上气道的阻塞状态,并在此状态下继续记录15分钟以上n2期睡眠下ggemg、腔内压力以及气道形态的变化情况。
(二)ggemg参数的获取
应用的无创表面肌电采集设备已获批实用新型专利(zl201520088053.3),本装置可同步连接于多导睡眠监测上,可通过根据不同的呼吸状态的提取出肌电的活性数据。本装置根据受试者口底及下颌牙体系制作下颌下齿透明保持器。用自凝塑料将两个直径3mm的氯化银球状电极(natus公司,美国)包埋在制作的下颌下齿透明保持器的内侧面,定位于双侧尖牙与前磨牙舌侧之间,并确保球电极与口底颏舌肌隆起处相接触,且受试者努力伸舌不受限制。两球电极的间距为10-15mm,与颏舌肌隆起处相接触。双侧球电极采集的ggemg信号通过放电、滤过处理,频率设定为10hz-100hz之间。
根据呼吸运动来提取ggemg参数取值,通过英国ced公司spike2软件将ggemg原始信号振幅换算为均方根值(rms)以衡量肌电的活化程度。进行整夜监测前,首先嘱受试者保持仰卧位,用力伸舌抵住上颌前切牙舌面持续约10秒钟,连续重复3次所取得的最大肌电值定义为最大ggemg值(maximalggemg)。所有对象原始肌电值均除以其最大ggemg值,所得百分比作为最终校正值进行统计学分析。纳入分析的肌电参数值如下:(1)呼气相ggemg振幅最小值定义为张力性肌电值(tonicggemg);(2)吸气相ggemg振幅最大值定义为峰值肌电值(peakggemg);(3)将完整呼吸循环中的ggemg振幅平均值定义为平均肌电值(averageggemg)。
根据同步psg监测数据所判读的不同皮层状态下的ggemg各参数值,不同皮层状态下的ggemg测量的取值区间判定如下:(1)清醒期取值:为仰卧位5分钟内平静呼吸状态下的ggemg各参数值;(2)睡眠初期取值:受试者入睡后最初的连续3个呼吸运动时段下的ggemg各参数值;(3)稳定nrem睡眠期取值:受试者进入稳定n2期5分钟后仰卧位下的ggemg各参数值;(4)稳定rem睡眠期取值:受试者进入稳定rem期后仰卧位下的ggemg各参数值;(5)阻塞性睡眠呼吸暂停事件期间取值:受试者(主要是osa受试者)在nrem或rem睡眠期的仰卧位时,根据psg判读的阻塞性呼吸暂停事件,选取鼻导管气流消失至气流恢复期间进行ggemg的数据测量,测量ggemg参数包括:事件初期肌电最小值、事件末期肌电值最大值、呼吸暂停期间平均肌电值。
不同皮层状态转换后ggemg的变化值计算方法如下:
(1)清醒-入睡ggemg变化值(%)=(清醒期ggemg参数值-入睡初期ggemg参数值-)/清醒期ggemg参数值
(2)入睡-nrem期ggemg变化值(%)=(入睡初期ggemg参数值-n2期ggemg参数值-)/入睡初期ggemg参数值
(3)nrem-remggemg变化值(%)=(n2期ggemg参数值-rem期ggemg参数值)/n2期ggemg参数值
(三)上气道腔内压力与ggemg协同性的计算
我们使用了英国gaeltec公司的食道压力测定仪来测定上气道咽腔压力,在行dise之前,对受试者双侧鼻腔进行1%丁卡因溶液表面麻醉后,在电子喉镜的引导下将测压管自鼻腔置入咽腔,当压力探头达会厌上缘水平时固定测压管位置。嘱受试者平静呼吸,观察测定仪表上的压力数值波动情况,在呼气末进行调零。dise监测结束后予测压管取出。
在生理情况下,为了维持睡眠期的气道通畅性,ggemg活性不仅应与腔内负压值成正比,而且腔内负压的变化趋势应该与受负压刺激后反应的ggemg变化趋势协同,这样才能形成对稳定气道有效的颏舌肌负压反射性活动。那么,即使腔内负压和ggemg活性都在增加,而二者的增加程度不匹配,同样可视为是ggemg活性异常的表现。这种无法提供足够反射性活动的颏舌肌可视为存在失代偿表现,及存在颏舌肌功能障碍。已有研究证明,在osa受试者中存在不同程度的颏舌肌功能异常,且峰值ggemg是主要反应颏舌肌活性随腔内负压变化的肌电成分。为了评价ggemg随压力变化的协同性,本研究借以dise下的ggemg同步pepi评估手段,可以将①入睡初期、②n2期阻塞性呼吸暂停初期(pepi最小值点)、③n2期阻塞性呼吸暂停末期(pepi最大值点)、④n2期解除气道塌陷(防止鼻咽通气道后)以上这4个状态来整合受试者睡眠期整体的pepi和峰值ggemg的变化趋势。
峰值ggemg-pepi变异度的计算方法如表3所示,将所有受试者的峰值ggemg-pepi变异度升序排列后,参考所有受试者峰值ggemg的变化趋势折线图(参见图6a)和pepi的变化趋势折线图(参见图6b),将ggemg-pepi变异度=6作为分界点,并将所有受试者分为变异度较小组(ggemg-pepi变异度≤6)和变异度较小组较大组(ggemg-pepi变异度>6)。
表3峰值ggemg-pepi变异度计算
(四)分型评估体系
通过大量研究数据分析并比较正常人与不同严重程度的osa受试者整夜颏舌肌ggemg活性特点汇总如下:
1、在清醒和睡眠初期,轻度osa受试者清醒期ggemg活性显高于健康对照组。在非快速动眼(non-rapideyemovement,nrem)睡眠期睡眠平静呼吸阶段,轻度osa受试者的ggemg活性较对照组较高,而快动眼睡眠(rapideyemovement,rem)期的所有ggemg值以及变化值均无明显统计学差异,由此推测,轻度osa受试者自nrem转变为rem睡眠期时,皮层状态对于ggemg活性的调控转变与正常人类似。
2、中-重度osa组在各个阶段的ggemg活性均为较高水平,并且在入睡初期峰值ggemg显著高于轻度osa受试者,可见ggemg活性有随疾病严重程度升高而增强的趋势,以对抗气道的狭窄。在睡眠期发生阻塞性呼吸暂停时,无论是nrem期还是rem期,虽然事件初期的最小ggemg无明显差异,但中-重度osa受试者的ggemg活性变化幅度均明显高于轻度受试者。可见中-重度osa受试者在入睡初期可能需要更大的ggemg活性以维持气道稳定。
3、根据计算峰值ggemg-pepi变异度的方法,对中-重度osa受试者进行重新分型发现,ggemg-pepi变异度较小组清醒期的ggemg具有较好的代偿能力。在nrem期呼吸事件中,二组的压力变化量相同而ggemg-pepi变异度较小组的最小峰值肌电较大,且ggemg变化范围较小,由此可见变异度较小组发生呼吸事件时ggemg活性的衰减量更小,而变异度较大组的ggemg对抗呼吸事件时幅度较大,且ggemg数值衰减过快,推测ggemg-pepi变异度较大组的颏舌肌更易出现疲劳、压力反射失调等失代偿状态。
依托于上述研究结果,汇总无创口内颏舌肌肌电活性分型标准如表2所示。
如图7所示,本发明同时提供了用于实现上述无创口内颏舌肌肌电活性评估方法的系统,包括:ahi指数采集模块、ggemg信号采集模块、pepi信号采集模块和数据处理模块;其中,ahi指数采集模块用于从整夜多导睡眠监测数据中获取受试者的ahi指数;ggemg信号采集模块用于获得受试者清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸4个阶段的ggemg信号参数值;pepi信号采集模块用于获得受试者清醒期平静呼吸、入睡初期平静呼吸、n2睡眠期阻塞性呼吸暂停时间期间、n2睡眠期放置鼻咽通气道后平静呼吸4个阶段的pepi信号参数值;数据处理模块,用于根据ggemg信号的参数值和pepi信号的参数值,分别计算清醒期单位压力肌电值r1、入睡初期单位压力肌电值r2、n2期呼吸暂停最小单位压力肌电值r3、n2期呼吸暂停最大单位压力肌电值r4、n2期鼻咽通气道置入后单位压力肌电值r5,并求出r1~r5数值的均值和r标准差,然后,根据ahi指数和r标准差两个参数,对ahi>15的受试者的口内颏舌肌肌电活性进行分型。
具体来说,ggemg信号采集模块通过无创口内表面肌电信号采集设备采集ggemg信号;pepi信号采集模块通过食道压力测定仪采集pepi信号;无创口内表面肌电信号采集设备和食道压力测定仪均与多导睡眠监测设备连接,多导睡眠监测设备同时用于采集脑电信号、鼻气流信号、胸腹呼吸运动信号和血氧饱和度信号。
在上述无创口内颏舌肌肌电活性评估系统中,所使用的无创口内表面肌电信号采集设备包括根据受试者口底及下颌牙体系制作下颌下齿透明保持器和两个球状电极,用自凝塑料将两个直径3mm的氯化银球状电极(natus公司,美国)包埋在制作的下颌下齿透明保持器的内侧面,定位于双侧尖牙与前磨牙舌侧之间,并确保球电极与口底颏舌肌隆起处相接触。
综上所述,本发明所提供的无创口内颏舌肌肌电活性评估方法,借以诱导睡眠下的口内表面肌电同步腔内负压监测技术,建立了基于ahi指数和rggemg的osa受试者的无创口内颏舌肌肌电活性评估体系,可以对ahi>15的osa中-重度受试者进行分型,从而有针对性的对ahi>15的osa中-重度受试者颏舌肌相关的功能性因素进行客观评价,有利于为对因治疗提供客观依据。
在颏舌肌相关的功能性致病因素方面提供了临床可应用的客观评估指标。在以ahi为基础的经典osa疾病严重程度的划分标准上,增加r标准差<10和≥10的划分,细化中、重度受试者的致病因素的评估和临床表型的分型。本发明的无创口内颏舌肌肌电活性评估系统具有高安全性和适用性。能够无创地、准确地划分不同osa受试者颏舌肌功能活性情况,从而为不同类型的osa受试者制定个体化治疗方案,提高治疗效果。
以上对本发明所提供的一种无创口内颏舌肌肌电活性评估方法及系统进行了详细的说明。对本领域的一般技术人员而言,在不背离本发明实质内容的前提下对它所做的任何显而易见的改动,都将构成对本发明专利权的侵犯,将承担相应的法律责任。
- 还没有人留言评论。精彩留言会获得点赞!