一种双价人乳头瘤病毒疫苗的制作方法
1.本发明涉及疫苗领域,尤其是涉及一种双价人乳头瘤病毒疫苗,及其制备方法。
背景技术:
2.宫颈癌是世界上最常见的恶性肿瘤之一,在全世界女性癌症死亡率中,仅次于乳腺癌,并且呈现出发病年龄年轻化的趋势。人乳头瘤病毒(human papillomavirus,hpv)的持续性感染是导致宫颈癌及许多生殖器瘤样病变的主要原因。人乳头瘤病毒是一类双链dna病毒,能感染人的表皮及黏膜上皮,诱导上皮组织的疣状增生乃至良恶性肿瘤。目前已分离鉴定出170多种不同的hpv型别,根据hpv的致病力或致癌危险性的大小,将hpv分为高危型和低危型。高危型包括16、18、31、33、35、39、45、51、52、56、58等15个型别,主要引起宫颈癌等的恶性病变,流行病学研究显示,90%以上宫颈癌病例中可以检出上述高危型别dna,其中以16和18型最常见,检出率高达70%以上,16型主要导致鳞状细胞癌,18型则导致腺癌;低危型主要型别有6、11、34、40、42、43和44型等,其中90%以上的生殖器疣与hpv6和hpv11感染相关。根据2012年who统计数据显示,全球由hpv感染导致的癌症病例达到527,624例,病死率为50.3%;据统计约86%的病例发生在发展中国家,我国每年宫颈癌新发病例约6万人,死亡约2万人。
3.接种疫苗是预防hpv感染并进一步预防宫颈癌的最经济有效的手段。天然的hpv呈现t=7的正二十面体对称结构,其结构简单,衣壳蛋白由主要衣壳蛋白l1和次要衣壳蛋白l2组成,l1蛋白占病毒衣壳蛋白总量的80%~90%。l1蛋白可在体外多种表达系统中表达,例如,酵母菌、昆虫细胞、哺乳动物细胞或细菌等,并能自组装成与天然hpv病毒高度相似的病毒样颗粒(virus like particle,vlp,综述参见schiller和roden,papillomavirus reviews:current research on papillomaviruses;lacey,ed.leeds,uk:leeds medical information,pp 101-12(1996))。动物实验和人类实验表明vlps具有较高的免疫原性,能够诱导机体产生高滴度的中和抗体(breitburd等,j virol.69(6):3959-63(1995);suzich等,proc.natl.acad.sci.usa 92(25):11553-57(1995);koutsky等,n.engl.j.med.347:1645-51(2002);schiller和hidesheim,j clin.virol.19:67-74(2000))。hpv l1蛋白在病毒感染细胞初期具有重要作用,参与细胞表面受体的相互作用。l2约占衣壳蛋白总量的10%~20%,研究发现l2蛋白中存在许多广谱中和表位,具有发展为hpv广谱疫苗的潜力;l2蛋白在病毒感染过程中发挥重要作用,其参与病毒感染的整个过程,包括吸附、内吞入胞、囊泡运输、入核和病毒复制。目前已上市的疫苗均是基于l1vlp研制的,包括默克公司的gardasil和葛兰素史克公司的cervarix。默克公司的gardasil为铝佐剂疫苗,有四价(16、18、6、11)hpv疫苗与九价(6、11、16、18、31、33、45、52、58)hpv疫苗,葛兰素史克公司的cervarix为二价(16、18)hpv疫苗,使用as04佐剂系统,含氢氧化铝与单磷酰酯a。而临床研究结果显示接种cervarix产生的针对hpv16、hpv18的抗体要高于四价gardasil,尽管目前对这种免疫效果的临床意义尚不明确,至少提示复合佐剂诱导的免疫反应优于单纯的铝佐剂。鉴于国内hpv疫苗研发仅使用铝佐剂,有必要进行国产复合佐剂hpv疫苗的研究。
技术实现要素:
4.本发明提供一种双价人乳头瘤病毒疫苗组合物,其包含人乳头瘤病毒16型l1蛋白的vlp、人乳头瘤病毒18型l1蛋白的vlp、bcg-cpg-dna和铝佐剂。
5.根据本发明,铝佐剂可以选自al(oh)3,或alpo4。在本发明中,如无特殊说明,所述铝佐剂的含量或浓度均以al
3+
的含量或浓度计或表示。
6.在本发明的具体实施方式中,所用铝佐剂为al(oh)3。
7.根据本发明,以单位剂量疫苗组合物来讲,人乳头瘤病毒16型l1蛋白的vlp、人乳头瘤病毒18型l1蛋白的vlp的含量相同,均为10-30μg。在本发明的一个具体实施方式中两者均为20μg。
8.以单位剂量疫苗组合物来讲,bcg-cpg-dna的含量为50-150μg,优选为75-125μg。在本发明的具体实施方式中为75μg、100μg或125μg。
9.以单位剂量疫苗组合物来讲,铝佐剂的含量以al
3+
含量计为200-600μg,优选为220-300μg。在本发明的一个具体实施方式中为250μg。
10.根据本发明,所述双价人乳头瘤病毒疫苗组合物,进一步包含载体溶液。所述载体溶液提供液体形式的疫苗组合物所需的等渗条件,因此宜选用能提供等渗条件的溶液体系,包括但不限于:磷酸盐缓冲液、醋酸盐缓冲液、组胺缓冲液等,优选为pbs溶液,例如,含有0.01-0.05m po
43-,0.3-1.0m nacl,ph 5.5-6.5的pbs缓冲液,或者,含有0.018-0.022m po
43-,0.5-0.7m nacl,ph 5.8-6.2的pbs缓冲液。在本发明的一个实施方式中,所用载体溶液是含有0.02m po
43-,0.6m nacl,ph 6.0的pbs缓冲液。
11.根据本发明,所述双价人乳头瘤病毒疫苗组合物为液体形式时,人乳头瘤病毒16型l1蛋白的vlp和人乳头瘤病毒18型l1蛋白的vlp的浓度均为20-60μg/ml,优选均为40μg/ml;bcg-cpg-dna的浓度为100-300μg/ml,优选为150-250μg/ml;铝佐剂的浓度以al
3+
浓度计为400-1200μg/ml,优选为440-600μg/ml。
12.根据本发明,所述双价人乳头瘤病毒疫苗组合物,作为疫苗使用时,通常以一人份疫苗剂量(即,单位剂量)的方式提供,所述一人份疫苗剂量的体积优选为0.5ml。
13.在本发明的一个具体实施方式中,所述一人份疫苗剂量为0.5ml,含有人乳头瘤病毒16型l1蛋白的vlp和人乳头瘤病毒18型l1蛋白的vlp均为20μg,bcg-cpg-dna 100μg,铝佐剂的量以al
3+
计为250μg。
14.在本发明的一个具体实施方式中,所述一人份疫苗剂量为0.5ml,含有人乳头瘤病毒16型l1蛋白的vlp和人乳头瘤病毒18型l1蛋白的vlp均为20μg,bcg-cpg-dna 75μg,铝佐剂的量以al
3+
计为250μg。
15.在本发明的一个具体实施方式中,所述一人份疫苗剂量为0.5ml,含有人乳头瘤病毒16型l1蛋白的vlp和人乳头瘤病毒18型l1蛋白的vlp均为20μg,bcg-cpg-dna 125μg,铝佐剂的量以al
3+
计为250μg。
16.本发明进一步提供所述双价人乳头瘤病毒疫苗组合物的制备方法。
17.根据本发明,所述制备方法的一种方式包括:在载体溶液中,将人乳头瘤病毒16型l1蛋白的vlp、人乳头瘤病毒18型l1蛋白的vlp、bcg-cpg-dna和铝佐剂直接混合配制。
18.根据本发明,所述制备方法的另一种方式包括:先制备人乳头瘤病毒16型l1蛋白的vlp和铝佐剂的预吸附原液、人乳头瘤病毒18型l1蛋白的vlp和铝佐剂的预吸附原液、
bcg-cpg-dna和铝佐剂的预吸附原液,再将上述三种预吸附原液混合。
19.根据本发明,无论哪种制备方法,都优选在10-30℃,例如20-26℃下,进行预吸附或混合。
20.根据本发明,优选预吸附在50-200转/分钟,例如80-110转/分钟的条件下进行。
21.本发明的一个具体实施方式中,所述制备方法为:
22.制备hpv-16l1的vlp预吸附原液:在含有0.01-0.05m po
43-,0.3-1.0m nacl,ph 5.5-6.5的pbs缓冲液,例如,含有0.018-0.022m po
43-,0.5-0.7m nacl,ph 5.8-6.2的pbs缓冲液中,加入hpv-16l1的vlp与铝佐剂。优选预吸附原液中,hpv-16l1的vlp浓度为100-300μg/ml,铝佐剂浓度(以al
3+
计)为0.1~3mg/ml。优选预吸附条件为:温度24~26℃,转速为88-95rpm,吸附时间为1-2h。优选铝佐剂为al(oh)3佐剂。
23.制备hpv-18l1的vlp预吸附原液:在含有0.01-0.05m po
43-,0.3-1.0m nacl,ph 5.5-6.5的pbs缓冲液,例如,含有0.018-0.022m po
43-,0.5-0.7m nacl,ph 5.8-6.2的pbs缓冲液中,加入hpv-18l1的vlp与铝佐剂。优选预吸附原液中,hpv-18l1的vlp浓度为100-300μg/ml,铝佐剂浓度(以al
3+
计)为0.1-3mg/ml。优选预吸附条件为:温度24~26℃,转速为88-95rpm,吸附时间为1-2h。优选铝佐剂为al(oh)3佐剂。
24.制备复合佐剂预吸附原液:在含有0.01-0.05m po
43-,0.3-1.0m nacl,ph 5.5-6.5的pbs缓冲液,例如,含有0.018-0.022m po
43-,0.5-0.7m nacl,ph 5.8-6.2的pbs缓冲液中,加入bcg-cpg-dna与铝佐剂。优选预吸附原液中,bcg-cpg-dna的浓度为150-1000μg/ml,铝佐剂浓度(以al
3+
计)为0.5-3mg/ml。优选预吸条件为:温度24~26℃,转速为88-95rpm,吸附时间为2-4h。优选铝佐剂为al(oh)3佐剂。
25.制备疫苗组合物:在一定体积的含有0.01-0.05m po
43-,0.3-1.0m nacl,ph 5.5-6.5的pbs缓冲液,例如,含有0.018-0.022m po
43-,0.5-0.7m nacl,ph 5.8-6.2的pbs溶液中,依次加入上述的hpv-16l1 vlp预吸附原液、hpv-18l1 vlp预吸附原液和复合佐剂预吸附原液,必要时可以补足铝佐剂,使疫苗组合物中,hpv-16l1 vlp蛋白浓度为20-60μg/ml、hpv-18l1vlp蛋白浓度为20-60μg/ml、bcg-cpg-dna浓度为100-300μg/ml,铝佐剂(以al
3+
计)浓度为400-1200μg/ml。
26.根据本发明,所述双价人乳头瘤病毒疫苗组合物,优选采用预吸附的制备方法。虽然直接混合法制备的疫苗和预吸附法制备的疫苗,在实验的时长范围内免疫效果基本一致,但预吸附法制备的疫苗抗原吸附率高,更能满足铝佐剂疫苗的质量控制要求。
27.根据本发明,所述制备方法中人乳头瘤病毒16型l1蛋白的vlp、人乳头瘤病毒18型l1蛋白的vlp和bcg-cpg-dna可以固体形式或浓溶液形式加入载体溶液中或用于制备预吸附的原液。所述各浓溶液的溶剂体系可以选用本领域常用的缓冲液体系,优选为pbs溶液。在本发明的一些实施方式中,所述bcg-cpg-dna的浓溶液为用含有0.1-0.2m氯化钠的0.04m-0.1m,ph7.2-7.6的pbs缓冲液,例如含有0.14-0.17m氯化钠的0.06m-0.07m,ph7.2-7.6的pbs缓冲液,配置的bcg-cpg-dna浓度为0.1-10mg/ml的溶液,例如bcg-cpg-dna浓度为0.8-2mg/ml。在本发明的一些实施方式中,所述人乳头瘤病毒16型l1蛋白的vlp的浓溶液为用含有10-50mm his,0.3-1.0m nacl,0.01-0.05%tween80,ph 5.0-6.5的缓冲液,例如含有18-22mm his,0.5-0.7m nacl,0.018-0.022%tween80,ph 5.7-6.3的缓冲液,配置的蛋白浓度为0.5-50mg/ml的溶液,例如蛋白浓度为1-5mg/ml。在本发明的一些实施方式中,所
述人乳头瘤病毒18型l1蛋白的vlp的浓溶液为用含有10-50mm his,0.3-1.0m nacl,0.01-0.05%tween80,ph 5.0-6.5的缓冲液,例如含有18-22mm his,0.5-0.7m nacl,0.018-0.022%tween80,ph 5.7-6.3的缓冲液,配置的蛋白浓度为0.5-50mg/ml的溶液,例如蛋白浓度为1-5mg/ml。
28.铝佐剂一般商业上销售的就是溶液形式,可以直接加入本发明的载体溶液中。
29.本发明进一步提供由上述方法制备得到的双价人乳头瘤病毒疫苗组合物。
30.根据本发明,所述双价人乳头瘤病毒疫苗组合物包含:人乳头瘤病毒16型l1蛋白的vlp、人乳头瘤病毒18型l1蛋白的vlp、bcg-cpg-dna和铝佐剂。以单位剂量疫苗组合物来讲,人乳头瘤病毒16型l1蛋白的vlp、人乳头瘤病毒18型l1蛋白的vlp的含量相同,均为10-30μg,优选均为20μg;bcg-cpg-dna的含量为50-150μg,优选为75-125μg;铝佐剂的含量为200-600μg,优选为220-300μg。
31.本发明进一步提供所述双价人乳头瘤病毒疫苗组合物在制备预防hpv感染和/或预防宫颈癌的疫苗中的应用。
32.根据本发明,所述疫苗是注射剂型。在本发明的一个实施方式中,所述注射剂型是注射液。
33.根据本发明,所述疫苗采用肌肉内注射给药的方式。
34.本发明进一步提供一种预防hpv感染和/或预防宫颈癌的方法。
35.根据本发明,所述方法包括给予有需要的受试者预防有效量的所述双价人乳头瘤病毒疫苗组合物。
36.人乳头瘤病毒16型l1蛋白病毒样颗粒,和,人乳头瘤病毒18型l1蛋白病毒样颗粒,可以通过如下方式进行重组表达:将l1的dna分子克隆到包括合适启动子及其它合适转录调控要素的表达载体中,并转移到原核生物或真核宿主细胞中,产生重组蛋白。这种操作技术是分子生物学的成熟操作(例如,molecular cloning:a laboratory manual;cold spring harbor laboratory,cold spring harbor,new york,(1989)所记载)。当l1蛋白在宿主细胞中重组表达时,vlps可以自我组装。
37.本发明的hpv 16型和hpv 18型的l1蛋白可以是所述两种亚型hpv的全长l1蛋白序列,或任何突变或截断的l1蛋白。通过从一或多种包含所选择hpv类型的临床样品中分离dna、测定hpv l1 dna序列的排序并使用遗传密码将dna序列转译到氨基酸序列,可以测定用于本发明的l1蛋白序列。适合用于本发明中的许多示范性的l1序列可以在文献中找到,例如,美国专利5,820,870、7,250,170、7,276,243等。用于本发明疫苗组合物的l1蛋白的生物学活性片段和/或突变株,包括但不一定局限于:氨基酸取代、消除、加入、氨基末端缺失和羧基端部缺失,以使这些突变提供能够形成vlp的l1蛋白或蛋白片段,并且可引起免疫应答,用于hpv vlp疫苗开发。
38.表达重组体hpv l1并且随后自组装vlps的合适的宿主细胞包括但不局限于酵母细胞、昆虫细胞、哺乳动物细胞或细菌。在本发明的示范性实施方案中,vlps是在大肠杆菌中产生的。
39.另外,本领域技术人员可以认识到,用于自我组装vlps的l1可以通过全长野生型hpv l1多核苷酸进行编码,或可以通过已知的野生型序列的片段或突变株进行编码。编码可表达hpv l1蛋白的mrna的野生型多核苷酸序列在本领域是可获得的。任何突变株多核苷
酸可以编码蛋白或蛋白片段,任何这种多核苷酸包括但不局限于:核苷酸取代、缺失、插入等。
40.在本发明的一种实施方式中,人乳头瘤病毒16型l1蛋白是由大肠杆菌表达的非感染性的人乳头瘤病毒16型l1蛋白的病毒样颗粒(vlps)。所述vlp可以商购;也可以采用本领域已知的基因工程技术制备,例如,将编码重组的hpv16型l1蛋白的基因转染到大肠杆菌,由大肠杆菌翻译表达hpv16 l1融合蛋白、五聚体和由该五聚体组成vlp,再经纯化处理后获得hpv16 l1vlp蛋白质。在本发明的一个具体实施方式中,是采用中国专利申请cn105039359a中记载的方法制备的hpv 16l1 vlp。在本发明中将cn105039359a全文引入。
41.在本发明的一种实施方式中,人乳头瘤病毒18型l1蛋白是由大肠杆菌表达的非感染性的人乳头瘤病毒18型l1蛋白的病毒样颗粒(vlps)。所述vlp可以商购;也可以采用本领域已知的基因工程技术制备,例如,将编码重组的hpv18型l1蛋白的基因转染到大肠杆菌,由大肠杆菌翻译表达hpv18 l1融合蛋白、五聚体和由该五聚体组成vlp,再经纯化处理后获得hpv18 l1vlp蛋白质。在本发明的一个具体实施方式中,是采用中国专利申请cn105177025a中记载的方法制备的hpv 18l1 vlp。在本发明中将cn105177025a全文引入。
42.本发明所指的bcg-cpg-dna是从卡介菌(bcg)中提取的dna片段,其含有大量未甲基化的cpg基序,因此简称为“bcg-cpg-dna”。bcg-cpg-dna本身具有免疫刺激作用,在信号通路水平上调nf-κb、mapks信号通路中关键蛋白分子的磷酸化水平;在转录水平促进tnf-α和mcp-1转录;在细胞因子分泌水平促进tnf-α、mcp-1、ifn-γ、il-6及il-17等细胞因子分泌;在细胞功能水平促进apc细胞增殖,上调mhc-ii分子和其他共刺激分子cd40,cd80和cd86的表达、促进吞噬抗原能力。其对固有免疫细胞刺激作用主要依赖于tlr-9受体的存在,是有效的tlr-9受体激动剂。
43.bcg-cpg-dna可采用中国发明专利zl200410033878.1中记载的制备方法:将菌种接种于适合卡介菌生长的培养基中培养至对数期时收集菌体;菌体经破碎后离心收集上清液;上清液经ctab的沉淀物用nacl溶液溶解后用有机溶剂抽提收集无蛋白层,该无蛋白层再次抽提后的上清液用乙醇处理收集沉淀,对该沉淀进行后处理。
44.bcg-cpg-dna也可以采用中国发明专利zl201310586057.x中记载的制备方法:将卡介菌接种于适合卡介菌生长的培养基中培养至对数期时收集菌体;菌体以去离子水或上样缓冲液经匀浆后获得菌体裂解液,任选对菌体裂解液进行澄清处理后,利用q sepharose hp离子交换柱,在te缓冲液或磷酸钠缓冲液中进行bcg-cpg-dna的分离。
45.由这些示例性的方法获得的bcg-cpg-dna都能用于本发明的疫苗,产生良好的免疫佐剂效果。从制备方法的简便性和获得大分子量的bcg-cpg-dna角度出发,优选采用中国发明专利zl201310586057.x中记载的制备方法。在此全文引用zl200410033878.1和zl201310586057.x作为参考。
46.本发明中bcg-cpg-dna的cpg含量可以通过高效液相检测而获得,例如可以采用zl200410033878.1中记载的通过反相-高效液相法(rp-hplc),采用特异甲基化酶sssi修饰cpg二核苷酸的胞嘧啶(dc)为5-甲基胞嘧啶(m5-dc),利用核酸酶p1和细菌碱性磷酸酶(bap)将dna水解为单个脱氧核苷,利用反相-高效液相法(rp-hplc)对修饰和未修饰的dna水解样品中m5-dc检出量的差别而对cpg进行定量。
47.本发明的有益效果:
48.1.佐剂中增加使用bcg-cpg-dna后,能明显降低达到同样免疫原性所需的铝佐剂用量,从而提高了疫苗的安全性。
49.2.bcg-cpg-dna和铝佐剂产生了协同作用,使得复合佐剂疫苗比单纯铝佐剂疫苗诱导了更多的th1型细胞因子(ifn-γ、il-2)产生,以及更高水平的中和抗体。
附图说明
50.图1:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍后免疫小鼠,测定hpv-16、hpv-18抗原特异性ifn-γ与il-2的记忆细胞数量的结果。
51.图2:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍后免疫小鼠,测定血清中和抗体水平的结果。
52.图3:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍免疫小鼠3周后,测定hpv-16、hpv-18抗原特异性ifn-γ与il-2的记忆细胞数量的结果。
53.图4-1和图4-2:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍免疫小鼠5周、8周和12周后,测定hpv-16、hpv-18抗原特异性ifn-γ与il-2的记忆细胞数量的结果。
54.图5:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍免疫小鼠后,hpv-16、hpv-18抗原特异性ifn-γ与il-2的记忆细胞数量的时间累计统计图。
55.图6:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍免疫小鼠后,hpv-16型中和抗体滴度在3周、5周、8周和12周的结果,其中*表示与tc1组比较差异有显著性,p《0.05;
▲
表示与tc2组比较差异有显著性,p《0.05。
56.图7:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍免疫小鼠后,hpv-18型中和抗体滴度在3周、5周、8周和12周的结果,其中*表示与tc1组比较差异有显著性,p《0.05;
▲
表示与tc2组比较差异有显著性,p《0.05。
57.图8:2μg hpv16 l1蛋白vlp和2μg hpv18 l1蛋白vlp与不同剂量的bcg-cpg-dna和铝佐剂配伍免疫小鼠后,两种抗原型中和抗体滴度的时间累计统计图。
58.图9:预吸附法制备的疫苗和直接法制备的疫苗,分别免疫小鼠后,hpv-16型中和抗体水平的统计图,图中a代表预吸附组,z代表直接配制组。
59.图10:预吸附法制备的疫苗和直接法制备的疫苗,分别免疫小鼠后,hpv-18型中和抗体水平的统计图,图中a代表预吸附组,z代表直接配制组。
60.图11:预吸附法制备的疫苗和直接法制备的疫苗,分别免疫小鼠后,ifnγ的记忆细胞数量的统计图,图中a代表预吸附组,z代表直接配制组。
61.图12:预吸附法制备的疫苗和直接法制备的疫苗,分别免疫小鼠后,il-2的记忆细胞数量的统计图,图中a代表预吸附组,z代表直接配制组。
具体实施方式
62.以下结合实施例对本发明做进一步描述。需要说明的是,实施例不能作为对本发
明保护范围的限制,本领域的技术人员理解,任何在本发明基础上所作的改进和变化都在本发明的保护范围之内。
63.以下实施例所用的常规化学试剂均可商购获得。
64.具体实施方式中的试剂如下:
65.0.067m pbs:浓度0.067mol/l,ph为7.4,hyclone,批号:abc212871。其配置方法:氯化钠9.0g,磷酸二氢钾0.144g,磷酸氢钠0.795g,加蒸馏水至1000ml,调节ph 7.2-7.6。
66.bcg-cpg-dna佐剂:浓度1mg/ml,批号:m20160702;制备方法如下:将卡介菌菌种接种于马铃薯苏通培养基,37℃培养15天后转种于改良的液体苏通培养基,37℃下培养14-20天。待菌体生长至对数期时,收集菌膜,加入适量去离子蒸馏水洗涤,压干后称重。将收集的菌体以去离子蒸馏水按1g/ml混匀,以组织捣碎匀浆机获得菌体裂解液。将破碎的菌体裂解液以去离子蒸馏水稀释到200mg/ml的浓度,高速冷冻离心机4℃、12000rpm/min离心,离心两次,每次15分钟,收集上清,将上清用洗脱缓冲液稀释1倍后,过1.0-1.2μm的滤器过滤。采用q sepharose hp离子交换柱进行上清中bcg-cpg-dna的分离:上样缓冲液(0.5m氯化钠、50mm磷酸钠缓冲液,ph 7.5),洗脱缓冲液(1m氯化钠、50mm磷酸钠缓冲液,ph 7.5),上样速度2ml/min,梯度洗脱,洗脱速度2ml/min,用50%的洗脱缓冲液洗脱用量7cv,之后用100%的洗脱缓冲液洗脱用量2cv,经电导和紫外检测稳定,收集100%洗脱缓冲液的洗脱峰,是为分离的bcg-cpg-dna,经浓缩后用0.067m pbs缓冲液稀释为1mg/ml的浓度,经检定合格后,为bcg-cpg-dna佐剂,用于以下试验中的疫苗制备。
67.hpv16型l1 vlp溶液:批号:c0216170602,蛋白浓度:3.59mg/ml,缓冲液:20mm his,600mm nacl,0.02%tween80,ph 5.8。由北京康乐卫士生物技术股份有限公司提供(按照cn105039359a的方法制备)。
68.hpv18型l1 vlp溶液:批号:c0218170402,蛋白浓度:1.65mg/ml,缓冲液:20mm his,600mm nacl,0.02%tween80,ph 6.2。由北京康乐卫士生物技术股份有限公司提供(按照cn105177025a的方法制备)。
69.al(oh)3佐剂(丹麦)(批号:5240):al
3+
浓度10mg/ml,以al(oh)3计浓度为28.9mg/ml;
70.pbs:0.02m po
43-,0.6m nacl,ph 6.0的缓冲液,配置方法为:称取nah2po
4 1.2g、nacl 17.53g,加ddh2o 490ml,用naoh调ph到6.0,加ddh2o至500ml,用0.22μm滤器无菌过滤。
71.疫苗的配制方法为:
72.hpv-16l1 vlp预吸附原液制备:在0.02m po
43-,0.6m nacl,ph 6.0的pbs缓冲液中,加入hpv-16l1 vlp溶液与al(oh)3佐剂,使蛋白与铝佐剂(以al
3+
计)质量含量比为1:5~1:10进行预吸附配制,即,吸附体系中,蛋白浓度为200μg/ml,铝佐剂浓度(以al
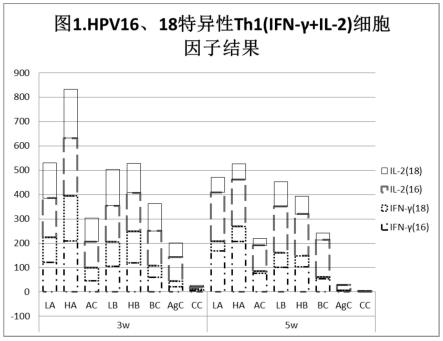
3+
计)在1mg/ml~2mg/ml,预吸附条件为:温度24~26℃,转速为88~95rpm,时间为1.5h,吸附完成后转移至4-8℃保存。经检测,蛋白吸附率不低于90%。通过实验,选择蛋白与铝佐剂(以al
3+
计)质量含量比为1:7.5配制的预吸附原液。
73.hpv-18l1 vlp预吸附原液制备:在0.02m po
43-,0.6m nacl,ph 6.0的pbs缓冲液中,加入hpv-18l1 vlp溶液与al(oh)3佐剂,使蛋白与铝佐剂(以al
3+
计)质量含量比为1:1进行预吸附配制,即,吸附体系中,蛋白浓度为200μg/ml,铝佐剂浓度(以al
3+
计)也为200μg/ml,预吸附条件为:温度24~26℃,转速为8895rpm,时间为1.5h,吸附完成后转移至4-8℃保
存。经检测,蛋白吸附率不低于85%。
74.复合佐剂预吸附原液制备:在0.02m po
43-,0.6m nacl,ph 6.0的pbs缓冲液中,加入bcg-cpg-dna与al(oh)3佐剂,使bcg-cpg-dna与铝佐剂(以al
3+
计)质量含量比分别为1:0.8,1:1.07,1:3,1:4,即,吸附体系中,bcg-cpg-dna浓度分别为800μg/ml、750μg/ml、500μg/ml,铝佐剂浓度(以al
3+
计)对应分别为640μg/ml、800μg/ml、1.5mg/ml。复合佐剂预吸附制剂在24~26℃,转速为88-95rpm的摇床吸附3h后转移至4~8℃冰箱静置过夜。
75.预吸附疫苗制备:在一定体积的pbs溶液(0.02m po
43-,0.6m nacl,ph6.0)中依次加入hpv-16l1 vlp预吸附原液、hpv-18l1 vlp预吸附原液和复合佐剂预吸附原液,使hpv-16l1 vlp蛋白浓度为20μg/0.5ml、hpv-18l1vlp蛋白浓度为20μg/0.5ml、bcg-cpg-dna浓度和铝佐剂(以al
3+
计)浓度为相应的实验浓度。
76.采用相同方式制备不含bcg-cpg-dna的单纯铝佐剂疫苗,区别仅在于不含有复合佐剂预吸附原液,而采用铝佐剂。
77.在以下实施例中,为描述方便,将bcg-cpg-dna和al(oh)3的复合佐剂简称为“bc复合佐剂”或“bc佐剂”。
78.蛋白吸附率的测定方法:供试品于6500g离心5分钟取上清,检测上清中蛋白含量,与对照未吸附相同浓度蛋白溶液进行比较,吸附率=(1-供试品上清蛋白浓度/对照蛋白浓度)
×
100%。
79.elispot法检测ifn-γ、il-2细胞斑点数:无菌分离免疫动物的脾淋巴细胞,并稀释成所需细胞浓度,细胞悬液100μl/孔(保证每孔细胞个数为:2.5
×
105),分别以hpv16型l1蛋白、hpv18型l1蛋白作为体外刺激物(50μl/孔),随后37℃,5%co2的培养箱中培养24-48h后显色。
80.采用假病毒中和实验检测动物血清中和抗体水平的实验方法:预先铺293ft细胞于96孔板,37℃,5%co2孵箱培养;将hpv假病毒按照固定的接种量,进行稀释;将待测血清按照1:40进行稀释;将假病毒稀释液以及待测血清稀释液等体积混合,4℃放至1h;取稀释的假病毒血清混合物贴壁缓缓加入预先已铺好的细胞培养板的对应孔中,轻拍培养板四周混匀,37℃,5%co2孵箱中培养72h。取孵育72小时样品,采用化学发光检测的方法,检测发光值(rlu)。计算感染抑制率,其公式为:感染抑制率(%)=100
×
(l-血清组的rlu/阴性对照组的rlu);根据不同血清稀释度下的感染抑制率,利用reed-muench法计算血清抗体滴度ic
50
。
81.实施例1预吸附疫苗与直接配制疫苗免疫原性比较
82.实验用样品:
83.1、预吸附法疫苗配制:按照前述制备方法,制备蛋白预吸附原液、复合佐剂预吸附原液、再混合为疫苗,使各成分含量为每毫升中:40μg hpv16l1-vlp、40μg hpv18 l1-vlp、500μg al
3+
、200μg dna。
84.2.直接法配制疫苗:在pbs溶液中(0.02m po
43-,0.6m nacl,ph 6.0),直接加入蛋白和佐剂,使各成分含量为每毫升中:40μg hpv16 l1-vlp、40μg hpv18 l1-vlp、500μg al
3+
、200μg dna。
85.对两种疫苗的蛋白吸附率进行测定:直接法配制疫苗在配制后即刻以及配制后2w,其蛋白吸附率分别为85%、84%,比预吸附法制备疫苗88%的吸附率略低。
86.一人份剂量为0.5ml,按照1/10人用剂量免疫动物。将spf级balb/c小鼠随机分为2组,每组15只。免疫程序为0w、2w、4w。分别在首次免疫后3w、5w、8w,每组取5只动物按照前述方法进行免疫学检测。
87.结果见图9-12:
88.1.hpv-16型中和抗体水平在免疫后3w、5w、8w,预吸附组与直接配制组结果基本一致,均无统计学差异。
89.2.hpv-18型中和抗体水平在免疫后3w、5w、8w,预吸附组与直接配制组结果基本一致,均无统计学差异。
90.3.分泌hpv-16、hpv-18两型抗原特异性ifn-γ因子产生细胞数量方面,在免疫后3w、5w、8w,两种方法配制疫苗间也无统计学差异。
91.4.分泌hpv-16、hpv-18两型抗原特异性il-2因子产生细胞数量方面,在免疫后3w、5w、8w,两种方法配制疫苗间也无统计学差异。
92.实施例2配制双价人乳头瘤病毒疫苗及其蛋白吸附率的测定
93.采用前述预吸附疫苗配制方法,配制如下组成的疫苗。
[0094][0095]
上述疫苗的总蛋白吸附率(%)测定结果如下表:
[0096][0097]
预吸附的hpv-16l1 vlp和hpv-18l1 vlp的原液中,蛋白吸附率(%)结果如下表:
[0098]
蛋白预吸附原液蛋白:al
3+
配制后18h配制后90h配制后99天hpv16 l1vlp-al
3+
1:7.593.494.395.0hpv18l1vlp-al
3+
1:189.790.991.0
[0099]
实施例3制备的双价人乳头瘤病毒疫苗诱导小鼠免疫应答的研究
[0100]
将spf级balb/c小鼠随机分为8组,每组15只,按表2剂量肌肉注射实施例2中配制的疫苗,同时设置仅含抗原(hpv 16型l1蛋白vlp、hpv18型l1蛋白vlp)对照组(ag-c)、稀释剂(pbs:0.02m po
43-,0.6m nacl,ph 6.0的缓冲液)试剂对照组(cc)。免疫程序为0w、2w、4w。分别在首次免疫后3w、5w、8w,每组取5只动物进行免疫学检测。
[0101]
动物实验概况见表2。根据疫苗动物实验的给药量规则,以下实施例中,免疫动物的抗原量、佐剂量都是相应人用量的十分之一。
[0102]
表2动物免疫剂量、免疫时间和检测时间
[0103][0104]
分泌抗原特异性th1型细胞因子细胞数量检测
[0105]
采用酶联免疫斑点法(elispot)于免疫后3w、5w检测分泌hpv-16、hpv-18抗原特异性ifn-γ与il-2细胞数量水平。结果见图1。
[0106]
由结果可见,由单纯铝佐剂制备的疫苗与复合佐剂制备的疫苗均比单纯抗原能诱导较高水平的ifn-γ与il-2水平,但复合佐剂制备的疫苗诱导的th1型细胞因子的水平更高。说明复合佐剂疫苗诱导细胞免疫水平优于单纯铝佐剂疫苗。
[0107]
另外显示,在复合佐剂的剂量配伍方面,低、高剂量的bcg-cpg-dna与al
3+
配伍后,配制的疫苗诱导的细胞免疫反应均优于单纯铝佐剂疫苗,同时高剂量的bcg-cpg-dna与低剂量al
3+
的配伍效果最佳,不但优于单纯铝佐剂低剂量组疫苗效果,也优于单纯铝佐剂高剂量组疫苗效果。说明bcg-cpg-dna与al
3+
配伍能降低铝佐剂的用量,并能诱导更强的细胞免疫反应,尤其在诱导抗原特异性ifn-γ水平方面,差异显著。
[0108]
血清中和抗体检测
[0109]
采用假病毒中和实验检测动物血清中和抗体水平,结果见图2。
[0110]
由结果可见,免后3周,所有试验组均诱导产生一定水平的hpv-16、hpv-18中和抗体,各组差异不明显。免疫后5周,各组间抗体水平出现差异,单纯铝佐剂疫苗组抗体水平低于对应的复合佐剂疫苗组的抗体水平,并且低、高剂量的bcg-cpg-dna与铝佐剂配伍后,配制的疫苗诱导的体液免疫反应均优于单纯铝佐剂疫苗,同时抗体水平随配伍的bcg-cpg-dna的剂量有升高的趋势,并且低剂量铝佐剂配伍bcg-cpg-dna后,诱导的抗体水平优于单纯铝佐剂的高剂量疫苗组。随着时间延长,免疫后8周,各组抗体水平反应趋势不一致。但高
剂量的bcg-cpg-dna与低剂量铝佐剂的配伍效果仍然是最佳的,不但优于单纯铝佐剂低剂量组疫苗效果,也优于单纯铝佐剂高剂量组疫苗效果。
[0111]
实施例4复合佐剂剂量配伍优化与疫苗诱导免疫反应特点评价
[0112]
根据实施例3免疫原性评价结果,明确以低剂量al
3+
(250μg)复合佐剂制备二价hpv疫苗,进行复合佐剂剂量配伍优化与疫苗诱导免疫反应特点评价。同时与市售疫苗(葛兰素史克公司的cervarix)比较诱导免疫反应的特点。
[0113]
研究方案:按1/10人份拟人用剂量免疫动物,spf级balb/c小鼠。
[0114]
1)动物分组及免疫:120只(20只/组,共6组),动物标记,免疫方式大腿内侧肌肉注射;免疫体积为100μl,具体免疫剂量及试验分组见试验设计表3。
[0115]
2)免疫程序:分别于0天、2周、4周免疫相应疫苗。
[0116]
3)免疫评价:首次免疫后3w、5w、8w,12w进行体液与细胞免疫相关指标评价。
[0117]
表3试验设计表
[0118][0119][0120]
实验结果:
[0121]
在细胞免疫方面:
[0122]
1、bc复合佐剂能在免疫早期诱生抗原特异性的免疫记忆细胞。
[0123]
于第二次免疫后一周,即免后3周,采集脾单个核细胞,经体外hpv抗原刺激后,elispot法检测受抗原刺激后,分泌抗原特异性ifn-γ与il-2的记忆细胞数量。
[0124]
结果见图3。
[0125]
由图3可见,免疫后3周,致敏细胞针对外来抗原的刺激,含bc复合佐剂各疫苗组产生的hpv-16型抗原特异性ifn-γ的水平均显著高于单纯铝佐剂疫苗组,差异有显著性(p lc vs tc1
=0.027,p mc vs tc1
=0.001,p hc vs tc1
=0.002)。
[0126]
含bc复合佐剂各疫苗组产生的hpv-18型抗原特异性ifn-γ的水平均显著高于单纯铝佐剂疫苗组,差异有显著性(p lc vs tc1
=0.005,p mc vs tc1
≤0.0001,p hc vs tc1
=0.001)。
[0127]
含bc复合佐剂各疫苗组产生的hpv-16型抗原特异性il-2的水平均高于单纯铝佐剂疫苗组,其中,mc组、hc组与tc1相比差异有显著性(p mc vs tc1
=0.0003,p hc vs tc1
=0.006)。
[0128]
含bc复合佐剂各疫苗组产生的hpv-18型抗原特异性il-2的水平均高于单纯铝佐剂疫苗组,其中mc组与tc1的差异有显著性(p mc vs tc1
=0.003);
[0129]
该结果显示,bc复合佐剂疫苗组能产生高于单纯铝佐剂疫苗的抗原特异性ifn-γ与il-2。il-2的功能是能促进ifn-γ产生,ifn-γ与杀伤性t细胞的产生有关,这些对于病毒感染的控制起重要作用。说明bc复合佐剂能促进本发明双价人乳头瘤病毒疫苗在免疫早期诱生免疫记忆细胞,当接触外来抗原刺激时,能免疫产生高水的ifn-γ与il-2。
[0130]
本实验中同质对照疫苗为上市的葛兰素史克公司的cervarix(as佐剂hpv二价疫苗),在诱生抗原特异性细胞因子方面,中、高剂量bc复合佐剂疫苗组相对于该上市疫苗,能产生更高水平的ifn-γ与il-2,尤其在分泌ifn-γ方面,分泌hpv-18型抗原特异性ifn-γ与hpv-16型抗原特异性ifn-γ的致敏细胞数量,中剂量bc复合佐剂疫苗(mc)组与tc2组差异有显著性(p mc vs tc2
(16)=0.029,p mc vs tc2
(18)=0.004)。说明bc复合佐剂较同质对照疫苗佐剂能更早促进抗原记忆细胞的产生。
[0131]
2、bc复合佐剂诱生疫苗产生更强的th1型免疫反应。
[0132]
继续于第三次免疫后1周、4周、8周,即免后5w、8w、12w,采集脾单核细胞,经体外hpv抗原刺激后,elispot法检测受抗原刺激后,分泌抗原特异性ifn-γ与il-2的细胞数量。
[0133]
结果见图4-1和图4-2。
[0134]
由图4-1和图4-2可见,免后5w、8w、12w,含bc复合佐剂疫苗组产生的抗原特异性细胞因子ifn-γ与il-2的致敏细胞数量均高于单纯铝佐剂对照组。ifn-γ与il-2是th1型细胞因子,说明相对于单纯的铝佐剂疫苗,bc复合佐剂诱生疫苗产生更强的th1型免疫反应。
[0135]
经统计,5w时,hpv-16型ifn-γ因子产生细胞数量方面,中剂量bc复合佐剂疫苗组(mc)显著高于铝佐剂疫苗(tc1)组(p mc vs tc1
(16)《0.0001);高剂量bc复合佐剂疫苗组(hc)显著高于铝佐剂疫苗(tc1)组(p hc vs tc1
(16)=0.001);hpv-18型ifn-γ因子产生细胞数量方面,中剂量bc复合佐剂疫苗组(mc)显著高于铝佐剂疫苗(tc1)组(p mc vs tc1
(18)=0.006);hpv-16型il-2因子产生细胞数量方面,高剂量bc复合佐剂疫苗组(hc)显著高于铝佐剂疫苗(tc1)组(p hc vs tc1
(16)=0.02);hpv-18型il-2因子产生细胞数量方面,高剂量bc复合佐剂疫苗组(hc)显著高于铝佐剂疫苗(tc1)组(p hc vs tc1
(18)=0.0014);其他组与铝佐剂组无统计学差异。
[0136]
8w时,hpv-16型ifn-γ因子产生细胞数量方面,中剂量bc复合佐剂疫苗组(mc)显著高于铝佐剂疫苗(tc1)组(p mc vs tc1
(16)=0.0029),高剂量bc复合佐剂疫苗组(hc)显著高于铝佐剂疫苗(tc1)组(p hc vs tc1
(16)=0.0066);hpv-16型il-2因子产生细胞数量方面,中剂量bc复合佐剂疫苗组(mc)显著高于铝佐剂疫苗(tc1)组(p mc vs tc1
(18)=0.04);高剂量bc复合佐剂疫苗组(hc)显著高于铝佐剂疫苗(tc1)组(p hc vs tc1
(16)=0.01);其他组与铝佐剂组无统计学差异。
[0137]
12w时,bc复合佐剂疫苗组各指标与铝佐剂疫苗(tc1)组均无统计学差异,但总体还是bc复合佐剂的中、高剂量组水平偏高。
[0138]
3、bc复合佐剂诱生疫苗产生细胞因子效应与剂量相关
[0139]
由图5细胞因子动态结果可见,bc复合佐剂的bcg-cpg-dna剂量不同,诱生的细胞因子水平有一定的差异,总体呈现bcg-cpg-dna剂量高,诱生的细胞因子水平高的现象。
[0140]
其中低剂量bc复合佐剂相对诱生抗原特异性细胞因子的数量低于中、高剂量组,
中、高剂量组各细胞因子水平基本相当。
[0141]
经统计,3w时,hpv-16型il-2因子产生细胞数量方面,低剂量bc复合佐剂疫苗组(lc)显著低于mc组(p mc vs lc
(16)=0.023),hpv-18型il-2因子及两个抗原型别的ifn-γ方面,三个bc复合佐剂疫苗组间无统计学差异。
[0142]
5w时,hpv-16型ifn-γ因子产生细胞数量方面,低剂量bc复合佐剂疫苗组(lc)显著低于mc组(p mc vs lc
(16)=0.003);hpv-16型il-2因子产生细胞数量方面,低剂量bc复合佐剂疫苗组(lc)显著低于hc组(p hc vs lc
(16)=0.02);其他指标在三个组间无统计学差异。
[0143]
8w时,hpv-16型ifn-γ因子产生细胞数量方面,低剂量bc复合佐剂疫苗组(lc)显著低于hc组(p hc vs lc
(16)=0.02);其他指标三个组间无统计学差异。
[0144]
12w时,受抗原体外刺激,能产生抗原特异性ifn-γ与il-2的细胞数量均呈下降趋势,各指标三个组间无统计学差异,但总体还是bc复合佐剂的中、高剂量组水平偏高。
[0145]
从细胞因子结果可见,在免疫后3w、5w,中剂量bc复合佐剂组(mc)诱导高水平的抗原记忆细胞,后期虽有下降,但和高剂量及tc2组并无差异,均远高于单纯铝佐剂疫苗组(tc1),可见在诱导细胞免疫方面,中剂量bc与抗原配伍效果最佳。
[0146]
在体液免疫方面:
[0147]
1、bc复合佐剂提高hpv-16型中和抗体滴度
[0148]
由图6可见,免疫后3w、5w、8w、12w,hpv-16型50%抑制率中和抗体滴度(ic50)水平,含bc复合佐剂的各疫苗组均高于单纯铝佐剂疫苗组,但并无统计学差异,说明bc复合佐剂可以提高hpv-16型中和抗体滴度。
[0149]
2、bc复合佐剂提高hpv-18型中和抗体滴度
[0150]
由图7可见,免疫后3w、5w、8w、12w,hpv-18型50%抑制率中和抗体滴度(ic50)水平,含bc复合佐剂各疫苗组均高于单纯铝佐剂疫苗组,但并无统计学差异,说明bc复合佐剂可提高hpv-18型中和抗体滴度。
[0151]
3、bc复合佐剂诱导抗体产生的特点
[0152]
由图8可见,在免疫8w时,含bc复合佐剂疫苗组诱导抗体水平呈现一个上升的趋势,12w时,lc与hc组抗体水平较8w时结果呈现一个下降趋势,而mc组继续降低不明显,反而呈现上升的趋势。
[0153]
bc复合佐剂诱导的中和抗体水平与剂量相关,剂量高则抗体水平相对较高。抗体水平在8w时提高明显,与单纯铝佐剂组差异增大。到12w,mc组抗体水平与tc2组相当。
[0154]
从中和抗体水平结果可见,bc复合佐剂能在一定程度上提高中和抗体水平,均高于单纯铝佐剂疫苗组(tc1),抗体水平的总趋势为:免疫后8w抗体水平最高,随后有所下降;总体而言,bc复合佐剂中、高剂量组(mc、hc)诱导抗体水平高较高,尤其在12w时,mc与tc2水平基本一致。可见在诱导体液免疫方面,中剂量bc、高剂量bc与抗原配伍效果最佳。
[0155]
通过本发明的实验研究证明:bc复合佐剂应用于二价hpv抗原,组成hpv疫苗,能促进免疫记忆细胞产生、诱生抗原特异性ifn-γ与il-2、提高病毒中和抗体水平,诱导th1型细胞免疫反应。
[0156]
与单纯铝佐剂相比,bc复合佐剂早期即能诱导细胞免疫,随后诱导体液免疫反应,无论在细胞因子和中和抗体方面都有明显优势。与上市二价疫苗相比,bc复合佐剂诱导的
细胞免疫反应更明显。
相关技术
网友询问留言
已有1条留言
-
 0151958... 来自[中国] 2023年12月14日 20:21非常好
0151958... 来自[中国] 2023年12月14日 20:21非常好
1