柠檬发酵物的制备方法及其不易形成体脂肪的用途与流程
1.本发明是有关一种柠檬发酵物,尤其是一种柠檬发酵物的制备方法 及其不易形成体脂肪的用途。
背景技术:
2.近年来,经济成长与生活型态的变化已改变饮食习惯。现代人体重 过重及肥胖比例的增加,其主要原因在于过多摄取高热量食品(如快餐品)以及缺 乏运动。
3.体重过重与肥胖会提高血压与胆固醇浓度,并引发或恶化各种不同 疾病,如:心血管疾病、糖尿病与关节炎,亦成为儿童或青少年,及成年人的 动脉粥样硬化、高血压、高血脂或心血管疾病发生率上升的主因。
4.然而,肥胖却很难治疗,因为肥胖涉及了食欲调节与能量代谢的复 杂机转。过去虽有开发出药物:利莫那班(rimonabant)(sanofi-aventis)、诺美婷 (sibutramin)(abbott)、康特弗(contrave)(takeda)与罗氏鲜(orlistat)(roche)
…
等药 物。
5.但,目前用于减肥或减重的合成药物仍存在程度不一的安全性疑虑 (如致癌及心血管的风险),且其效果见仁见智,无法保证能达到减肥或减重的效 果。
6.再者,肥胖是由脂肪细胞数量的增加(hyperplasia)及脂肪细胞的肥 大(hypertrophy)所导致(jo et al.,2009)。当脂肪细胞数量及脂肪细胞内的tg 含量增加,便会促使体内脂肪的累积,进而造成肥胖的发生。因此,防止脂肪 细胞增生及三酸甘油酯的累积为预防肥胖的重要关键(junghyo et al.,2009)。
7.为此,如何藉由原始、天然食物的萃取来减少人体体脂肪的增生, 为本技术领域人员所欲解决的问题。
技术实现要素:
8.本发明的主要目的,在于提供一种柠檬发酵物的制备方法及其不易 形成体脂肪的用途,藉由柠檬发酵物来使体脂肪不易增生并进一步预防肥胖的 发生。
9.本发明揭示了一种柠檬发酵物的制备方法,其步骤包含:取一柠檬 进行一全果压榨制程,产生一柠檬液;以及取该柠檬物与一乳酸菌进行一发酵 制程,形成一柠檬发酵物。
10.又,本发明提供一实施例,其内容在于柠檬发酵物的制备方法,其 中于形成一柠檬发酵物的步骤前,进一步包含步骤:于该发酵制程后,加热至 80℃并持续1分钟。
11.为了达到上述的目的,本发明揭示了一种柠檬发酵物的不易形成体 脂肪的用途,其用于抑制一脂肪细胞的增生,其中该柠檬发酵物由一柠檬液经 添加一乳酸菌制备而成,其中该柠檬液由一柠檬压榨制成。
12.又,本发明揭示了一种柠檬发酵物的不易形成体脂肪的用途,其用 于抑制一脂肪细胞的一脂质及一三酸甘油酯的累积,其中该柠檬发酵物由一柠 檬液经添加一乳酸菌制备而成,其中该柠檬液由一柠檬压榨制成。
13.又,本发明揭示了一种柠檬发酵物的不易形成体脂肪的用途,其用 于抑制一脂肪
细胞的一基因的表现,该基因选自由一pparγ基因及一fas基因所 组成的群组的其中之一,其中该柠檬发酵物由一柠檬液经添加一乳酸菌制备而 成,其中该柠檬液由一柠檬压榨制成。
14.本发明揭示了一种柠檬发酵物的不易形成体脂肪的用途,其用于抑 制一大鼠的一生理数据的影响,其中该柠檬发酵物由一柠檬液经添加一乳酸菌 制备而成,其中该柠檬液由一柠檬压榨制成。
15.又,本发明揭示了一种柠檬发酵物的不易形成体脂肪的用途,其用 于抑制一大鼠肝脏的一三酸甘油酯及一总胆固醇的累积,其中该柠檬发酵物由 一柠檬液经添加一乳酸菌制备而成,其中该柠檬液由一柠檬压榨制成。
16.又,本发明揭示了一种柠檬发酵物的不易形成体脂肪的用途,其用 于抑制一大鼠的一基因的表现,该基因选自由一pparγ基因、一c/ebpα基因、 一srebp-1c基因、一hmg-coa-r基因及一acat基因所组成的群组的其中之 一,其中该柠檬发酵物由一柠檬液经添加一乳酸菌制备而成,其中该柠檬液由 一柠檬压榨制成。
17.又,本发明揭示了一种柠檬发酵物的不易形成体脂肪的用途,其用 于提升一大鼠的一基因的表现,该基因选自由一hsl基因、一atgl基因、一 ampk基因及一lcat基因所组成的群组的其中之一,其中该柠檬发酵物由一柠 檬液经添加一乳酸菌制备而成,其中该柠檬液由一柠檬压榨制成。
附图说明
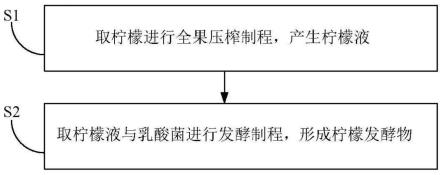
18.第1图:其为本发明的实施例的步骤流程图;第2a图:其为本发明的实施例的脂肪细胞增生的实验结果图;第2b图:其为本发明的实施例的脂肪细胞存活率的实验结果图;第2c图:其为本发明的实施例的脂肪细胞的脂质含量的实验结果图;第2d图:其为本发明的实施例的脂肪细胞的三酸甘油酯含量的实验结果 图;第2e图:其为本发明的实施例的脂肪细胞的pparγ基因及fas基因的表现 量的实验结果图;第2f图:其为本发明的实施例的大鼠肝脏的三酸甘油酯及总胆固醇的含量 的实验结果图;第2g图:其为本发明的实施例的大鼠的pparγ基因、c/ebpα基因及 srebp-1c基因的表现量的实验结果图;第2h图:其为本发明的实施例的大鼠的hsl基因、atgl基因及ampk基因 的表现量的实验结果图;以及第2i图:其为本发明的实施例的大鼠的hmg-coa-r基因、acat基因及 lcat基因的表现量的实验结果图。【图号对照说明】s1-s3 步骤流程
具体实施方式
19.为了使本发明的结构特征及所达成的功效有更进一步的了解与认 识,特用较佳
的实施例及配合详细的说明,说明如下:
20.有鉴于现代人常因摄取高热量食品(如快餐品)以及缺乏运动,而造 成体重过重及肥胖的人口比例遽增,据此,本发明遂提出一种柠檬发酵物的制 备方法及其不易形成体脂肪的用途,以解决习知技术所造成的问题。
21.以下,将进一步说明本发明所包含的特性、所搭配的结构及其方法:
22.请参阅第1图,其为本发明的实施例的步骤流程图。如第1图所示, 而本发明的柠檬发酵物的制备方法,其步骤包含:
23.s1:取柠檬进行全果压榨制程,产生柠檬液;以及
24.s2:取柠檬液与乳酸菌进行发酵制程,形成柠檬发酵物。
26.如步骤s1所示,取一柠檬(本发明选用绿柠檬(citrus limon(l.) burm))进行一全果压榨制程,产生一柠檬液后,接续如步骤s2所示,取该柠檬 液与0.1%的一乳酸菌(本发明选用(lactobacillus opc1))进行一发酵制程,于该发 酵制程后,加热至80℃并持续1分钟终止该发酵制程,并形成一柠檬发酵物(于本 发明中该柠檬发酵物代称为lfp(lemon fermented products))。
27.接续,请参阅第2a-2i图,为本发明使用该柠檬发酵物(lfp)所做的 各个实验的结果,用以验证柠檬发酵物的不易形成体脂肪的用途。
28.首先,为第2a、2b图,其分别为本发明的实施例的脂肪细胞的增 生的实验结果图及本发明的实施例的脂肪细胞的存活率的实验结果图。其该柠 檬发酵物用于抑制一脂肪细胞的增生,其中该柠檬发酵物由该柠檬液经添加该 乳酸菌制备而成,其中该柠檬液由该柠檬压榨制成。
29.于本发明中脂肪细胞选用小鼠的脂肪细胞株3t3-l1(后续代称 3t3-l1),并培养于含有1%青霉素/链霉素(100u/ml)、10%胎牛血清及3.7g/l 碳酸氢钠的dmem培养基(dulbecco's modified eagle's medium)中,置于37℃含 5%co2的恒温培养箱中进行培养。
30.并进行该脂肪细胞(3t3-l1)的增生实验,实验步骤为:细胞株以每 毫升1
×
105个细胞种植于3.5公分培养皿中,培养24小时至细胞贴盘(此时间点定 义为0小时),分别给予0.1、0.5、0.75或1mg/ml的该柠檬发酵物(lfp),培养24、48及72小时后,以pbs清洗二次,并加入100μl trypsin后置于37℃含5%co2的 恒温培养箱中作用3分钟,接着以1ml dmem培养基将细胞收集于1.5ml微量离 心管中,进行201
×
g、25℃离心3分钟,去除上清液,加入4℃ pbs混合均匀, 取19μl的细胞液于1.5ml微量离心管中并加入1μl solution(含286μm dapi 及80μm acridine orange)(denmark)混匀,装入slide-a8,利用多光源微量细胞 自动分析仪(nc-3000image cytometry),进行细胞增生分析。
31.其分析结果如第2a图所示,该柠檬发酵物(lfp)在0.1、0.5、0.75、 1mg/ml处理该脂肪细胞(3t3-l1)48与72小时后,其细胞增生能力显著低于控制 组(control,为未经处理的该脂肪细胞),表示该柠檬发酵物(lfp)在0.1、0.5、0.75、 1mg/ml可以抑制该脂肪细胞(3t3-l1)的增生。
32.并进一步进行该脂肪细胞(3t3-l1)的存活率实验,本发明采用mtt [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide]试验,作为测定该 脂肪细胞(3t3-l1)的存活率的方法。首先,该脂肪细胞(3t3-l1)经样品处理后以 pbs清洗两次,并
加入含有0.1mg/ml mtt的dmem置于37℃且含5%co2的恒 温培养箱中培养3小时,去除培养液,加入1ml异丙醇将formazan溶出,经15分 钟震荡摇匀后移入1.5ml微量離心管中,以4℃、9,560
×
g离心10分钟,取上 清液,后续并以波长570nm测定其吸光值。
[0033]
其分析结果如第2b图所示,该柠檬发酵物(lfp)以0.75、1mg/ml处 理该脂肪细胞(3t3-l1)10天后与控制组(control,为未经处理的该脂肪细胞)相 比,不会影响其细胞存活率,表示该柠檬发酵物(lfp)不会对该脂肪细胞(3t3-l1) 造成细胞毒性。
[0034]
由第2a-2b图可知,本发明的该柠檬发酵物(lfp)可以在不会对该脂 肪细胞(3t3-l1)造成细胞毒性的情况下,进一步抑制该脂肪细胞(3t3-l1)的增 生。
[0035]
再者,为第2c-2d图,其分别为本发明的实施例的脂肪细胞的脂质 含量的实验结果图及本发明的实施例的脂肪细胞的三酸甘油酯含量的实验结果 图。其该柠檬发酵物用于抑制该脂肪细胞的一脂质及一三酸甘油酯的累积,其 中该柠檬发酵物由该柠檬液经添加该乳酸菌制备而成,其中该柠檬液由该柠檬 压榨制成。
[0036]
本发明的该脂质及该三酸甘油酯的累积实验依旧选用该脂肪细胞 (3t3-l1)。该脂质的累积实验利用油红染色实验来进行该脂肪细胞(3t3-l1)内该 脂质含量的分析,油红(oil red o)是一种亲油性高的染料,可以将成熟脂肪细 胞中的油滴染成红色。实验步骤:该脂肪细胞(3t3-l1)经样品处理后,以pbs清 洗两次,每盘加入1ml 10%formaldehyde于室温下静置30分钟固定后,再以灭 菌水清洗并加入1ml油红染剂,染色15分钟,去除染色液后以无菌水润洗两次, 再加入1ml无菌水移至显微镜下观察,即可看出分化后该脂肪细胞(3t3-l1)有明 显红色脂滴(park et al.,2011)。染色后拍照存档并进行染剂定量。
[0037]
拍照完的该脂肪细胞(3t3-l1)加入1ml的异丙醇,经15分钟震荡 摇匀,使油红染剂溶出,以波长510nm测定其吸光值。计算实验组(诱导组(为 加入诱导培养基(induce,为10μg/ml胰岛素(insulin)、0.5mm 3-异丁基-1-甲基 黄嘌呤(ibmx)以及1μm地塞米松(dexamethasone))、0.75mg/ml组(为加入诱 导培养基(induce)及0.75mg/ml的该柠檬发酵物(lfp))、1mg/ml组(为加入诱导 培养基(induce)及1mg/ml的该柠檬发酵物(lfp)))与控制组的吸光比值,以得知 相对脂质累积量的变化(ram
í
rez-zacar
í
as et al.,1992)。相对脂质累积量计算公 式如下:相对脂质累积量(%)=样品组的吸光值/控制组的吸光值
×
100%。
[0038]
其分析结果如第2c图所示,该柠檬发酵物(lfp)在0.75、1mg/ml处 理该脂肪细胞(3t3-l1)6、8及10天后,其油红含量(相较于对照组(control))显著 低于诱导组。显示其该脂肪细胞(3t3-l1)中的该脂质含量有被抑制。
[0039]
本发明的该三酸甘油酯的累积实验利用市售试剂组(tr213,uk) 进行。取分化至第八天的该脂肪细胞(3t3-l1)以pbs清洗两次,加入70μl含 0.5%triton x-100的pbs静置5分钟,以刮勺轻轻刮下后收集至1.5ml微量离心 管内,并以细胞破碎机进行破碎30秒,即完成样品前处理。将市售试剂组内的 三酸甘油酯标准品200mg/dl稀释成100、50、25、12.5与6.25mg/ml。将三酸 甘油酯各浓度的标准液及样品液各取5μl至96孔盘中,分别加入200μl酵素混 合液,于室温下震荡摇匀5分钟,以波长500nm测定吸光值。经标准品比对,计 算可得三酸甘油酯浓度。
[0040]
本发明的实验组为:诱导组(为加入诱导培养基(induce,为10μg/ml 胰岛素(insulin)、0.5mm 3-异丁基-1-甲基黄嘌呤(ibmx)以及1μm地塞米松 (dexamethasone)))、
0.75mg/ml组(为加入诱导培养基(induce)及0.75mg/ml的该柠 檬发酵物(lfp))、1mg/ml组(为加入诱导培养基(induce)及1mg/ml的该柠檬发酵 物(lfp))。
[0041]
其分析结果如第2d图所示,该柠檬发酵物(lfp)在0.75、1mg/ml处 理该脂肪细胞(3t3-l1)4、6、8及10天后,其该三酸甘油酯含量(单位:mg该三酸 甘油酯/mg蛋白)显著低于诱导组。显示其该脂肪细胞(3t3-l1)中的该三酸甘油 酯含量有被抑制。
[0042]
接续,为第2e图,其为本发明的实施例的脂肪细胞的pparγ基因及 fas基因的表现量的实验结果图。该柠檬发酵物用于抑制该脂肪细胞的一基因的 表现,该基因选自由一pparγ基因及一fas基因所组成的群组的其中之一,其中 该柠檬发酵物由该柠檬液经添加该乳酸菌制备而成,其中该柠檬液由该柠檬压 榨制成。
[0043]
本发明的该基因(该pparγ基因及该fas基因)的表现量分析如下: 先进行总核糖核酸萃取,取分化至第八天的该脂肪细胞(3t3-l1)以pbs清洗两 次,加入trizol reagent 1ml并充分混合,再加入200μl chloroform轻摇混合均 匀,冰浴5分钟,于4℃、16200
×
g离心15分钟,取上清液到新的微量离心管里 并加入等体积的异丙醇,剧烈震荡混匀,冰浴5分钟沉淀rna,再以4℃、16200
ꢀ×
g离心15分钟,去除上清液,留下底部沉淀物,加入1ml 75%酒精,再以4℃、 16200
×
g离心10分钟,留下沉淀物,再以4℃、16200
×
g离心1分钟,将残存酒 精去除,之后rna沉淀物于室温下自然风干,最后以depc-h2o回溶中,定量后 保存于-80℃保存。
[0044]
后续再进行总核糖核酸定量,并接续反转录形成互补脱氧核醣核 酸,以便进行实时聚合酶连锁反应(real-time pcr)来进行定量,由于相对定量时 需选用小鼠具有的恒定表现特性基因作为正常化的必要计算值,因此本发明的 实验方法选用小鼠肌动蛋白(β-actin)来进行比对。
[0045]
本发明的该pparγ基因的表现量的分组如下:对照组(未加入诱导培 养基(induce,为10μg/ml胰岛素(insulin)、0.5mm 3-异丁基-1-甲基黄嘌呤 (ibmx)以及1μm地塞米松(dexamethasone))及未加入该柠檬发酵液(lfp))。其 余实验组为:诱导组(为加入诱导培养基(induce))、0.75mg/ml组(为加入诱导培 养基(induce)及0.75mg/ml的该柠檬发酵物(lfp))、1mg/ml组(为加入诱导培养基 (induce)及1mg/ml的该柠檬发酵物(lfp))。
[0046]
由第2e图可知,lfp在0.75、1mg/ml时,其该pparγ基因的表现量 显著低于诱导组。表示lfp可抑制分化中该脂肪细胞(3t3-l1)中该pparγ基因的 表现。
[0047]
再者,本发明的该fas基因的表现量的分组如下:对照组(未加入诱 导培养基(induce,为10μg/ml胰岛素(insulin)、0.5mm 3-异丁基-1-甲基黄嘌呤 (ibmx)以及1μm地塞米松(dexamethasone))及未加入该柠檬发酵物(lfp))。其 余实验组为:诱导组(为加入诱导培养基(induce))、0.75mg/ml组(为加入诱导培 养基(induce)及0.75mg/ml的该柠檬发酵物(lfp))、1mg/ml组(为加入诱导培养基 (induce)及1mg/ml的该柠檬发酵物(lfp))。
[0048]
由第2e图可知,lfp在0.75、1mg/ml时,其该fas基因的表现量显 著低于诱导组。表示lfp可抑制分化中该脂肪细胞(3t3-l1)中该fas基因的表现。
[0049]
接续,除了细胞实验外,本发明亦选用一大鼠,平均体重为250
±
20 g(6周龄的雄性wistar大鼠,乃购自乐斯科生物科技股份有限公司(台北))来进行 抑制体脂肪增生的实验。
[0050]
该大鼠入室驯养一周后,随机分成5组,分别为正常饮食组(normaldiet,nd)、高
热量饮食组(使用标准饲料5001作为高热量饲料的基底,添加台糖 二号砂糖(高雄)与大豆色拉油(高雄),配制成醣类、脂肪及蛋白质占总热量百 分比为45%、45%及10%的高热量饲料,high calories diet,hd)、低剂量lfp 合并高热量饮食组(high calories diet with low lfp,hd+llfp;577.5mg/kgbw)、中剂量lfp合并高热量饮食组(high calories diet with medium lfp,hd+mlfp;1732.5mg/kg bw)及高剂量lfp合并高热量饮食组(high caloriesdiet with high lfp,hd+hlfp;2887.5mg/kg bw)。
[0051]
本发明用于该大鼠的该柠檬发酵液的实验浓度,为参考本发明上述 细胞实验其结果,进行推算而得。实验共进行9周,实验期间记录体重变化、饲 料摄取量、脏器相对重量、血清生化指标及肝脏脂质,并分析副睪脂肪组织及 肝脏中脂质代谢相关指标(该pparγ基因、一c/ebpα基因、一srebp-1c基因、 一hsl基因、一atgl基因及一ampk基因)的测定、胆固醇代谢相关基因(一 hmg-coa-r基因、一acat基因及一lcat基因)以及肝脏中一总胆固醇(tc)及 该三酸甘油酯(tg)的含量测定。
[0052]
本发明的该大鼠的喂食模式为:正常饮食组的该大鼠在第0至9周期 间,每周管喂4次磷酸盐缓冲生理盐水(phosphate buffered saline,pbs);高热量 饮食组(hd)的该大鼠在第0至9周期间给予高热量饮食,每周管喂4次pbs;低剂 量lfp合并高热量饮食组(hd+llfp)的该大鼠在第0至9周期间除了给予高热量 饮食,还会以管喂方式每周给予4次低剂量的该柠檬发酵物(lfp);中剂量lfp 合并高热量饮食组(hd+mlfp)的该大鼠在第0至9周期间除了给予高热量饮食, 还会以管喂方式每周给予4次中剂量的该柠檬发酵物(lfp);高剂量lfp合并高 热量饮食组(hd+hlfp)的该大鼠在第0至9周期间除了给予高热量饮食,还会以 管喂方式每周给予4次高剂量的该柠檬发酵物(lfp)。
[0053]
并于牺牲前禁食36小时后,以二氧化碳进行窒息牺牲,利用心脏采 血收集血液,取出各部位脏器后进行秤重,并取部份肝脏、副睪脂肪组织及小 肠置于10%福尔马林中,作为组织染色切片使用,剩余部分与其他组织置于液态 氮急速冷冻,储存保存在-80℃冰箱中待后续分析。
[0054]
其牺牲后,优先测量该大鼠的一生理数据,其该大鼠的该生理各数 据如下表1、2所示:表1、生理数据表1
[0055]
其中,表1中的增加体重(%)的计算方式为:[(最终体重-初始体重)/ 最终体重]
×
100。又,饲料转换率(g/bw)的计算方式为:[(最终体重-初始体重)/ 食物摄入量]
×
100。又,其各器官(心、肝脏、脾脏、肾脏、脂肪组织)的相关重 量计算方式为:(器官重量/最终体重)
×
100。表2、生理数据表2
[0056]
接者,如第2f图,其分别为本发明的实施例的大鼠肝脏的三酸甘油 酯及总胆固醇的含量的实验结果图。该柠檬发酵物用于抑制该大鼠的该总胆固 醇及该三酸甘油酯的累积,其中该柠檬发酵物由该柠檬液经添加该乳酸菌制备 而成,其中该柠檬液由该柠檬压榨制成。
[0057]
本发明的该大鼠的该三酸甘油酯(tg)的累积含量分析方法同上述 本发明的该脂肪细胞(3t3-l1)的该三酸甘油酯(tg)的实验分析方法(利用市售 试剂组(tr213,uk))。
[0058]
其结果如第2f图所示,hd组的tg含量显著高于nd组。再者,不 同剂量的该柠檬发酵物(lfp)的tg含量皆显著低于hd组,表示给予不同剂量的 该柠檬发酵物(lfp)可以减少并抑制藉由高热量饮食诱导下的该大鼠的肝脏中 tg含量的累积。
[0059]
而本发明的该总胆固醇(tc)的累积含量分析利用市售试剂组 (ch7945,uk)进行。取8μl的肝脏脂质萃取液或标准品,加入200μl反应酵 素于室温下反应15分钟,检测波长500nm的吸光值。经与标准品的吸光值比 对计算,可得血清中的该总胆固醇的含量。
[0060]
其结果如第2f图所示,hd组的tc含量显著高于nd组,再者不同 剂量的该柠檬发酵物(lfp)的tc含量皆显著低于hd组,表示给予不同剂量的该 柠檬发酵物(lfp)可以减少并抑制藉由高热量饮食诱导下的该大鼠的肝脏中tc 含量的累积。
[0061]
再者,如第2g图,其分别为本发明的实施例的大鼠的pparγ基因、 c/ebpα基因及srebp-1c基因的表现量的实验结果图。该柠檬发酵物用于抑制该 大鼠的一基因的表现,该基因选自由该pparγ基因、该c/ebpα基因、该srebp-1c 基因所组成的群组的其中之一,其中该柠檬发酵物由该柠檬液经添加该乳酸菌 制备而成,其中该柠檬液由该柠檬压榨制成。
[0062]
本发明的该大鼠的副睪脂肪组织的该pparγ基因、该c/ebpα基因及 该srebp-1c基因的各表现量分析方法同上述该脂肪细胞(3t3-l1)的该基因的表 现量的实验分析方法(先进行总核糖核酸萃取,接续再进行总核糖核酸定量,并 接续反转录形成互补脱氧核醣核酸,以便进行实时聚合酶连锁反应(real-timepcr)来进行定量,由于相对定量时需选用
大鼠具有的恒定表现特性基因作为正 常化的必要计算值,因此本发明的实验方法选用大鼠肌动蛋白(β-actin)来进行 比对)。
[0063]
其中,该大鼠的副睪脂肪组织的该pparγ基因的表现量如第2g图所 示,hd组的该pparγ基因的表现量显著高于nd组,且不同剂量的该柠檬发酵物 (lfp)的该pparγ基因的表现量显著低于hd组,显示给予不同剂量的该柠檬发酵 物(lfp)皆可以抑制高热量饮食诱导该大鼠的副睪脂肪组织中的该pparγ基因的 表现,又以中剂量lfp合并高热量饮食组及高剂量lfp合并高热量饮食组效果较 佳。
[0064]
又,该大鼠的副睪脂肪组织的该c/ebpα基因的表现量如第2g图所 示,hd组的该c/ebpα基因的表现量显著高于nd组,且不同剂量的该柠檬发酵 物(lfp)的该c/ebpα基因的表现量显著低于hd组,显示给予不同剂量的该柠檬 发酵物(lfp)皆可以抑制高热量饮食诱导该大鼠的副睪脂肪组织中的该c/ebpα 基因的表现,又以中剂量lfp合并高热量饮食组及高剂量lfp合并高热量饮食组 效果较佳。
[0065]
再者,该大鼠的副睪脂肪组织的该srebp-1c基因的表现量如第2g 图所示,hd组的该srebp-1c基因的表现量显著高于nd组,且不同剂量的该柠 檬发酵物(lfp)的该srebp-1c基因的表现量显著低于hd组,显示给予不同剂量 的该柠檬发酵物(lfp)皆可以抑制高热量饮食诱导该大鼠的副睪脂肪组织中的该 srebp-1c基因的表现,又以中剂量lfp合并高热量饮食组及高剂量lfp合并高热 量饮食组效果较佳。
[0066]
再者,如第2h图,其分别为本发明的实施例的大鼠的hsl基因、 atgl基因及ampk基因的表现量的实验结果图。该柠檬发酵物用于提高该大鼠 的该基因的表现,该基因选自由该hsl基因、该atgl基因、该ampk基因所组 成的群组的其中之一,其中该柠檬发酵物由该柠檬液经添加该乳酸菌制备而成, 其中该柠檬液由该柠檬压榨制成。
[0067]
本发明的该大鼠的副睪脂肪组织的该hsl基因、该atgl基因及该 大鼠的肝脏组织的该ampk基因的各表现量分析方法同上述该脂肪细胞 (3t3-l1)的该基因的表现量的实验分析方法(先进行总核糖核酸萃取,接续再进 行总核糖核酸定量,并接续反转录形成互补脱氧核醣核酸,以便进行实时聚合 酶连锁反应(real-time pcr)来进行定量,由于相对定量时需选用大鼠具有的恒定 表现特性基因作为正常化的必要计算值,因此本发明的实验方法选用大鼠肌动 蛋白(β-actin)来进行比对)。
[0068]
其中,该大鼠的副睪脂肪组织的该hsl基因的表现量如第2h图所 示,hd组的该hsl基因的表现量显著低于nd组,而有加入不同剂量的该柠檬发 酵物(lfp)的该hsl基因的表现量则显著高于hd组,且由图可知具有剂量依赖 性,表示给予不同剂量的该柠檬发酵物(lfp)可以增加该大鼠(有高热量饮食)的 副睪脂肪组织中该hsl基因的表现,其中又以高剂量lfp合并高热量饮食组效果 较佳。
[0069]
又,该大鼠的副睪脂肪组织的该atgl基因的表现量如第2h图所 示,hd组的该atgl基因的表现量显著低于nd组,且中、高剂量的该柠檬发酵 物(lfp)的该atgl基因的表现显著高于hd组。由实验结果表示,给予中、高剂 量的该柠檬发酵物(lfp)可以增加该大鼠(有高热量饮食)的副睪脂肪组织中该 atgl基因的表现。
[0070]
再者,该大鼠的肝脏组织的该ampk基因的表现量如第2h图所示, hd组的该ampk基因的表现量显著低于nd组,且不同剂量的该柠檬发酵物 (lfp)的该ampk基因的表现显著高于hd组,表示给予不同剂量的该柠檬发酵物 (lfp)皆可以该大鼠(有高热量饮食)的肝脏组
织中该ampk基因的表现,其中以 中剂量lfp合并高热量饮食组及高剂量lfp合并高热量饮食组效果较佳。
[0071]
最后,如第2i图,其分别为本发明的实施例的大鼠的hmg-coa-r 基因、acat基因及lcat基因的表现量的实验结果图。该柠檬发酵物用于提高 该大鼠的该lcat基因的表现以及该柠檬发酵物用于抑制该大鼠的该 hmg-coa-r基因及acat基因的表现,其中该柠檬发酵物由该柠檬液经添加该 乳酸菌制备而成,其中该柠檬液由该柠檬压榨制成。
[0072]
本发明的该大鼠的该hmg-coa-r基因、该acat基因及该lcat基 因(皆与胆固醇代谢有关)的各表现量分析方法同上述该脂肪细胞(3t3-l1)的该基 因的表现量的实验分析方法(先进行总核糖核酸萃取,接续再进行总核糖核酸定 量,并接续反转录形成互补脱氧核醣核酸,以便进行实时聚合酶连锁反应 (real-time pcr)来进行定量,由于相对定量时需选用大鼠具有的恒定表现特性基 因作为正常化的必要计算值,因此本发明的实验方法选用大鼠肌动蛋白 (β-actin)来进行比对)。
[0073]
又,该大鼠的该hmg-coa-r基因及该acat基因的表现量如第2i 图所示,hd组的该hmg-coa-r基因及该acat基因的表现量显著高于nd组, 而有加入不同剂量的该柠檬发酵物(lfp)的该hmg-coa-r基因及该acat基因 的表现量则显著低于hd组,且由图可知具有剂量依赖性,表示给予不同剂量的 该柠檬发酵物(lfp)可以抑制该大鼠(有高热量饮食)的该hmg-coa-r基因及该 acat基因的表现,其中又以高剂量lfp合并高热量饮食组效果较佳。
[0074]
又,该大鼠的该lcat基因的表现量如第2i图所示,hd组的该lcat 基因的表现量显著低于nd组,而有加入不同剂量的该柠檬发酵物(lfp)的该 lcat基因的表现量则显著高于hd组,且由图可知具有剂量依赖性,表示给予 不同剂量的该柠檬发酵物(lfp)可以提升该大鼠(有高热量饮食)的该lcat基因 的表现,其中又以高剂量lfp合并高热量饮食组效果较佳。
[0075]
上文仅为本发明的较佳实施例而已,并非用来限定本发明实施的范 围,凡依本发明权利要求范围所述的形状、构造、特征及精神所为的均等变化 与修饰,均应包括于本发明的权利要求范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1